人羊膜间充质干细胞旁分泌对成骨细胞的影响
王贵玲,洪 滔,淦 岷,仇丽鸿
肿瘤或炎症等骨破坏性疾病可能引起牙槽骨较大面积骨缺损,往往需要外界干预。缺损区成骨细胞对微环境的改变很敏感,又是直接调节骨形成的重要细胞,所以它的生物活性在骨组织修复中具有重要作用[1]。如何充分调动缺损区成骨细胞生物活性对骨缺损的修复再生具有重要意义。
间充质干细胞(mesenchymal stem cells,MSCs)是具有高度自我更新能力和多向分化潜能的多能干细胞,在骨缺损修复治疗中疗效显著[2-3]。早期人们认为MSCs主要作为组织修复中的种子细胞,利用其成骨分化能力发挥作用,但近年来研究结果显示MSCs并非直接参与组织修复的主要细胞,而是主要通过分泌相关生物活性因子,改变机体局部微环境,即通过旁分泌机制诱导机体自身细胞归巢并调节细胞增殖分化,进而发挥对骨组织的修复作用[4-5]。人羊膜间充质干细胞(human amniotic mesenchymal stem cells, hAMSCs)因取材方便,且无伦理限制,成为MSCs理想的细胞来源[6-7]。本研究通过收集人羊膜间充质干细胞条件培养基(condition medium,hAMSCs-CM)并作用于人成骨样细胞系MG63,进而研究hAMSCs对成骨细胞的旁分泌作用,为hAMSCs在牙槽骨再生修复中的进一步应用提供研究基础。
1 材料与方法
1.1 主要试剂
DMEM/F12培养基(Gibco,美国),低糖DMEM培养基、胎牛血清(FBS)(Hyclone,美国),胶原蛋白酶Ⅳ、pNPP试剂盒(Sigma,美国),胰蛋白酶(Sangon,中国),MTT试剂盒(Invitrogen,美国),CD29、CD105、CD44、CD45、CD31、CD49d、SSEA3、SSEA4、CD34、HLADR抗体(BD Pharmingen,美国),BCA试剂盒(碧云天,中国)。
1.2 细胞培养
人成骨样细胞系MG63细胞(购自中国科学院细胞库),用含10% FBS的低糖DMEM培养基于37 ℃、5% CO2、饱和湿度条件下培养。细胞融合度达90%后按4×104个/cm2传代。
1.3 hAMSCs原代提取
羊膜样本由中国医科大学附属第一医院产科提供,产前检测无传染性疾病,并经产妇知情同意。在胎盘娩出10 min内,从胎盘上钝性分离羊膜,用磷酸盐缓冲液(PBS)反复漂洗后,浸泡于含1 000 U/mL庆大霉素和2.5 μg/mL 二性霉素B的PBS中,冰盒2 h内运至实验室。剪取面积约5 cm×5 cm大小羊膜,刮净表面的绒毛膜及残留血块,放入离心管中,加入约20 mL的0.25%胰蛋白酶,37 ℃水浴消化20 min两次,后剪碎放入离心管中,加入10 mL 1 g/L的胶原蛋白酶Ⅳ,37 ℃水浴约60 mim,200目不锈钢网过滤,1 000 r/min离心5 min,可观察到细胞沉淀即为hAMSCs。用含10% FBS的DMEM/F12培养液将细胞沉淀重悬并接种,第二天可观察细胞贴附情况,1~2 d后换液,长满后传代,之后换用含10% FBS的低糖DMEM培养。取生长状态良好的第3~5代hAMSCs进行后续实验。
1.4 流式鉴定原代hAMSCs细胞表面标记物表达
取第4代hAMSCs,消化离心后冷PBS清洗2次,加100 μL冷PBS重悬细胞,细胞数不少于5×105个/管,每管各加5 μL细胞表面标记物抗体,分别为CD29、CD105、CD44、CD49d、SSEA3、SSEA4、CD34、HLADR,另设空白对照,冰上避光孵育30 min,洗涤2次后300 μL PBS重悬细胞沉淀,换用流式管,流式检测仪检测。
1.5 收取hAMSC-CM
取第3~5代hAMSCs,待其细胞融合度达90%左右时,换用新鲜培养液,24 h后收取培养上清,1 500 r/min离心5 min去沉淀后分装,-20 ℃保存备用,与新鲜培养液1∶1混合后作为hAMSC-CM用于后续实验,并以新鲜培养液作为阴性对照组。
1.6 MTT检测hAMSC-CM对MG63增殖的影响
MG63按2×103个/孔接种于96孔板中,第2天换用hAMSC-CM,之后1~4 d内每隔24 h MTT法检测细胞增殖活力。按试剂说明书操作,1.5 h后酶标仪490 nm波长下检测光密度(OD值)。
1.7 Transwell检测hAMSC-CM对MG63迁移的影响
MG63消化离心后按1×106个/mL重悬于不含血清培养基中,选用24孔板Transwell小室,下室加入600 μL hAMSC-CM,取100 μL细胞悬液(约1×105个)置于上室,观察无气泡后放回细胞培养箱。2.5 h后甲醇固定1 min,苏木精-伊红染色,棉花棒擦去小室上层细胞,晾干后显微镜下随机取7个视野拍照并计数穿膜细胞数。
1.8 pNPP法检测细胞内ALP表达活性
MG63融合度达90%后,换用hAMSC-CM,5 d后,pNPP法检测细胞内ALP表达[8]。每孔加40 μL RIPA(加蛋白酶抑制剂PMSF)裂解细胞提取细胞质蛋白。取10 μL蛋白裂解液于96孔微板中,另加90 μL pNPP溶液,迅速酶标仪405 nm波长下检测各孔OD值作为Ainitial。37 ℃温箱中孵育tx=30 min后再次检测405 nm波长下OD值作为Afinal。按公式计算ALP活性:ALP 活性=10×((Afinal-Ainitial)/tx) ×R/18.45(其中10代表稀释倍数;R为路径长度,在96孔板、100 μL反应体系中约为0.31 cm;18.45代表消光系数)。
同时取1 μL蛋白裂解液,按BCA试剂盒说明书检测蛋白浓度(mg/mL),最后将计算得到的ALP活性除以蛋白量后得到标准化的ALP活性(U/g)。
1.9 统计学分析
实验重复三次,数据均以均值±标准差表示,SPSS 13.0软件进行统计分析,数据采用独立样本t检验分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 hAMSCs表面标志物鉴定
hAMSCs呈典型的成纤维样细胞形态,漩涡状生长(图1A)。流式结果(图1B)显示,人羊膜间充质干细胞阳性表达CD29、CD105、CD49d、CD44;阴性表达CD34、CD45、CD31和HLADR,表明hAMSCs具有间充质干细胞一般特性。

A:hAMSCs形态观察( ×100);B: 流式细胞仪检测hAMSCs表面标志物表达图1 hAMSCs细胞鉴定Fig.1 Identification of hAMSCs
2.2 hAMSC-CM对MG63增殖能力的影响
hAMSC-CM作用于MG63后,与阴性对照组相比,连续3 d均可显著促进细胞增殖(P<0.05),第4天时,细胞增殖增加无显著统计学差异(图2)。
2.3 hAMSC-CM对MG63迁移能力的影响
Transwell迁移模型2.5 h后,hAMSC-CM组MG63迁移细胞计数为117.60±14.54,显著高于对照组的20.20±10.38,表明hAMSC-CM可显著增强MG63迁移能力(P<0.05)(图3)。
2.4 hAMSCs-CM对MG63细胞ALP活性的影响
hAMSCs-CM连续培养MG63细胞5 d后,细胞内ALP表达明显强于对照组(P<0.05)(图4),提示hAMSCs-CM可显著促进MG63细胞成骨分化。
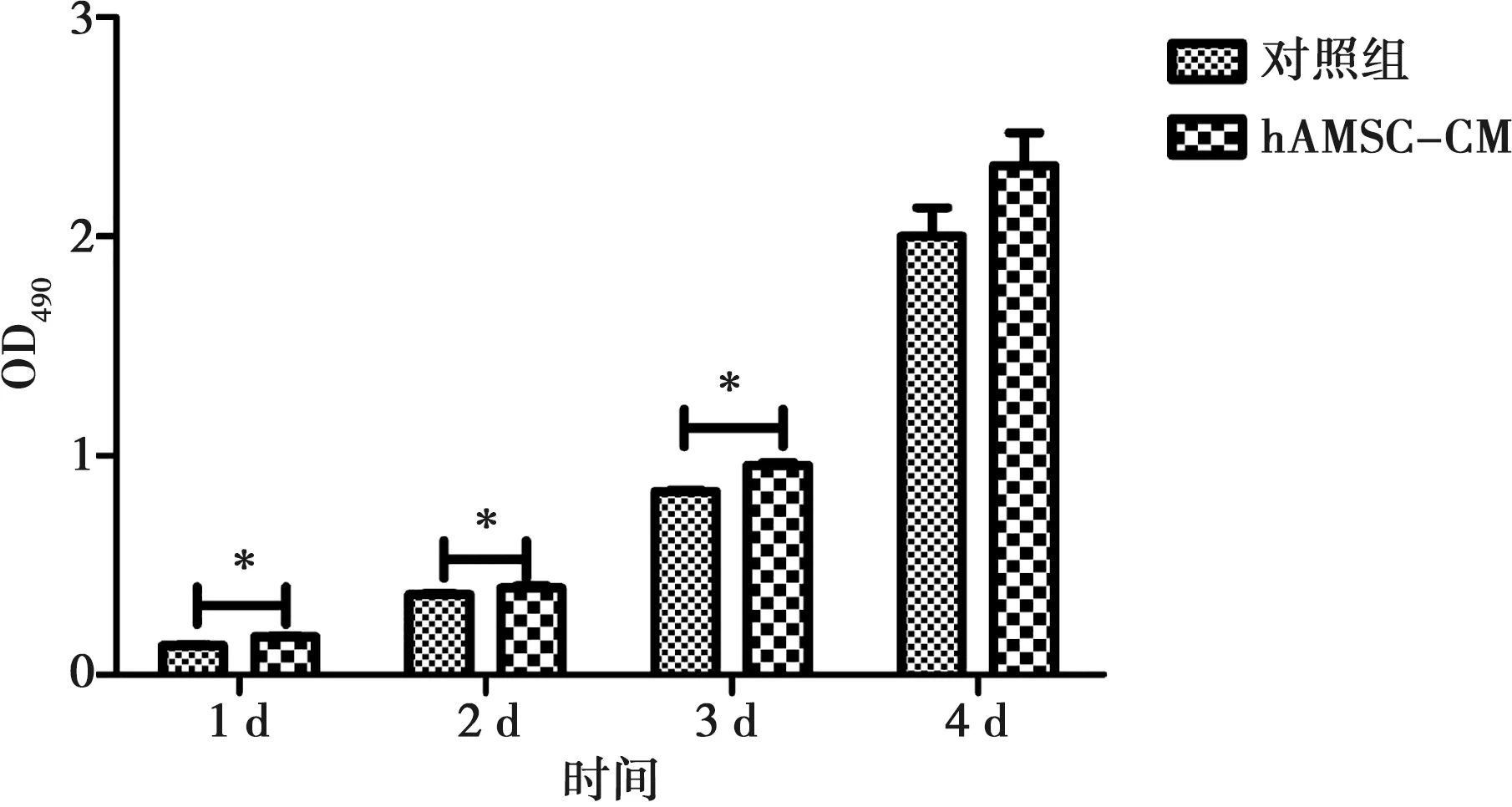
与对照组比较,*:P<0.05图2 hAMSC-CM对MG63增殖能力的影响Fig.2 Effect of hAMSC-CM on MG63 cell proliferation

A:对照组MG63迁移细胞情况;B:hAMSC-CM细胞迁移情况( ×100);C:不同组迁移细胞数比较,与CON组比较,*:P<0.05图3 hAMSC-CM对MG63迁移能力的影响Fig.3 Effect of hAMSC-CM on MG63 cell migration

与CON组比较,*:P<0.05图4 hAMSCs-CM对MG63中ALP活性的影响Fig.4 Effect of hAMSC-CM on ALP activity in MG63
3 讨 论
MSCs广泛存在于全身多种组织中,最早是由骨髓中提取出来[9]。然而骨髓间充质干细胞来源有限,且提取方法具有侵入性,而羊膜取材方便,无伦理限制,且hAMSCs增殖及成骨分化能力比BMSCs更强[6-7,10]。本研究及既往研究均表明,hAMSCs不表达免疫因子HLA-DR、CD14,也不表达协同刺激分子CD80、CD83、CD86、CD40L等,具有低免疫原性和免疫调节作用[11-12],可以作为间充质干细胞临床应用的理想细胞来源。
近年来人们研究证实,在骨组织工程中植入的MSCs主要通过旁分泌作用促进骨组织修复再生,且MSC-CM与MSCs具有相似的骨诱导作用[13-14],这为MSC-CM在临床应用提供了理论基础。研究表明,MSCs可通过分泌血小板生长因子、转化生长因子beta、血管内皮生长因子等可溶性生长因子,或通过胞外囊泡携带并传递遗传信息等多种可能的途径改变组织细胞所处的微环境,发挥旁分泌作用[15-17]。
本研究通过提取hAMSC-CM作用于人成骨样细胞系MG63,检测其对成骨细胞增殖、迁移及分化功能的影响。本研究证实hAMSC-CM对成骨细胞增殖和迁移具有显著促进作用,ALP是成骨细胞分化早期的标志物,本研究通过pNPP法检测hAMSC-CM培养5 d后成骨细胞内ALP活性,在蛋白水平上验证了hAMSC-CM对成骨细胞分化的显著促进作用。由此提示hAMSCs可通过旁分泌作用增强成骨细胞生物活性,但具体作用的生长因子及其相关机制尚需进一步研究。
目前对于hAMSCs的研究主要把它作为骨组织工程的种子细胞,研究其自身成骨分化或对骨髓间充质干细胞成骨分化的影响[18-19]。有研究提示hAMSCs与成骨细胞共培养后,可促进成骨细胞分化指标表达,但文中并未明确标明实验所用成骨细胞系的种类,且仅涉及hAMSCs对成骨细胞分化功能的影响[20],同时培养两种细胞的实验操作难度大。有体内研究发现植入的MSCs在体内存活时间短、分化活性差[13-14],且MSCs在储存、培养和应用操作中相对复杂,而MSC-CM可更方便临床应用,且不用担心体内成瘤的风险[21],所以在组织修复的体内应用中,MSC-CM有其独特的优势。
综上所述,本研究通过提取并鉴定hAMSCs,收取hAMSC-CM作用于成骨细胞,可显著增强成骨细胞生物活性,为hAMSCs在骨组织修复领域的进一步研究提供了理论基础。

