DZIP1通过影响Wnt/β-catenin信号通路促进口腔鳞状细胞癌增殖、迁移和侵袭
库都斯·克依木,卡米力江·买买提明,徐 前
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部区域最常见的癌症。它是人类10种最常见的癌症之一,全球每年约诊断出30万例新病例[1]。OSCC晚期诊断预后差,病死率高,尽管在放疗和外科治疗方面取得了一些进展,但晚期OSCC患者仍有转移和复发风险[2]。因此,仍需努力开发更为有效的OSCC靶向疗法。
Wnt/β-catenin信号通路在细胞信号传导中起关键作用[3]。有研究表明,β-catenin可以与TCF/LEF转录因子作用以激活下游靶基因,从而促进细胞增殖、迁移和侵袭[4]。Wnt/β-catenin信号通路促进乳腺癌、大肠癌、胆管癌等癌症细胞的增殖、迁移和侵袭[5-7]。
DAZ相互作用蛋白1(DAZ interacting protein 1,DZIP1)是一种最初在斑马鱼中鉴定出的锌指蛋白,主要在人类胚胎干细胞和生殖细胞中表达[8-9]。DZIP1是Hedgehog信号通路重要组成部分[10]。肠上皮中的Hedgehog信号抑制Wnt信号通路,从而抑制Wnt靶基因在干细胞或祖细胞中的表达[11]。Shi等[12]证明DZIP1是膀胱癌组织中差异化表达的基因之一,并且可能对Wnt信号通路具有调控作用。最新研究证明,DZIP1是OSCC癌组织中差异化表达基因之一,与预后呈负相关[13]。综上所述,本研究旨在探究DZIP1是否通过Wnt/β-catenin信号通路对口腔鳞状细胞癌增殖、迁移和侵袭产生影响,以期为OSCC治疗靶点的发现提供科学依据。
1 材料与方法
1.1 实验材料
人口腔角质形成细胞(HOK)和人OSCC细胞系TSCCA、Tca8113和SCC25购自美国典型培养物保藏中心(ATCC);DMEM培养基、胎牛血清(FBS)和Lipofectamine 2000购自Invitrogen公司;0.25%胰蛋白酶溶液购自Gibco公司;PrimeScript RT Master Mix、SYBRR Premix Ex TaqTMⅡ试剂盒购自Takara公司;siRNA-DZIP1(si-DZIP1-1、si-DZIP1-2)和NC(negitive control)序列由上海吉玛制药技术有限公司合成;Transwell小室、24孔细胞培养板购自Corning公司;Matrigel购自BD公司;结晶紫染液、ECL化学发光法检测试剂盒购自Solarbio公司;RIPA裂解液购自Beyotime公司;兔抗DZIP1抗体购自GeneTex公司;鼠抗β-catenin、Cyclin D1、c-Myc、GAPDH抗体购自圣克鲁斯生物技术公司;BCA蛋白定量试剂盒购自北京全式金生物;CCK-8购自东仁化学科技(上海)有限公司;LiCl(Wnt/β-catenin信号通路激活剂)购自Sigma公司。
1.2 实验方法
1.2.1 细胞培养 用含有10%FBS的DMEM培养基重悬冻存的HOK、TSCCA、Tca8113和SCC25细胞系,随后将各细胞系转移至细胞培养瓶中,37 ℃、5%CO2条件下继续培养,待细胞密度达到80%~90%时,0.25%胰蛋白酶消化液消化传代。
1.2.2 细胞转染 转染前一天,接种SCC25细胞于6孔板中,密度为4×105个/mL,每孔2 mL。按照分组:NC组(阴性对照组)、si-DZIP1组(si-DZIP1-1、si-DZIP1-2)、LiCl组和si-DZIP1+LiCl组,配制反应混合液。溶液A:240 μL Opti-MEMI减血清培养基+10 μL Lipofectamine 2000,室温孵育5 min;B:Opti-MEM与待转染物混合(NC、si-DZIP1-1、si-DZIP1-2终浓度为50 nmol/L,LiCl终浓度为10 mmol/L[14]),总体积为250 μL,室温孵育5 min。将A液和B液混合,室温孵育20 min。将混合液加入6孔板内,轻轻混匀,37 ℃、5%CO2培养箱培养48 h后,进行后续实验。转染序列见表1。

表1 转染序列Tab.1 Transfection sequences
1.2.3 实时荧光定量PCR Trizol法提取HOK、TSCCA、Tca8113和SCC25细胞总RNA,并使用PrimeScript RT Master Mix将2 μg RNA反转录成cDNA。按照SYBRR Premix Ex TaqTMⅡ试剂盒说明书进行实时荧光定量PCR检测。PCR反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95℃ 15 s;60℃ 30 s;95℃ 15 s。其中GAPDH为内参。实验所需引物见表2。

表2 实时荧光定量PCR所需引物Tab.2 Primers required for real-time PCR
1.2.4 Western blot 收集HOK、TSCCA、Tca8113和SCC25细胞(或转染后的SCC25细胞),RIPA裂解液(含蛋白酶抑制剂)冰上裂解细胞,4 ℃,12 000 r/min离心20 min,取上清液。BCA蛋白定量试剂盒测定蛋白浓度。取30 μg蛋白进行SDS-PAGE分离。将目的蛋白转印至PVDF膜上。5%脱脂奶粉室温封闭3 h,加入一抗DZIP1(1∶1 000)、β-catenin(1∶5 000)、Cyclin D1(1∶2 000)、c-Myc(1∶2 000)、GAPDH(1∶5 000),4 ℃过夜孵育,二抗(1∶2 000)室温孵育1 h。ECL发光试剂盒显影、曝光。
1.2.5 克隆形成实验 0.25%胰蛋白酶消化液消化SCC25细胞,含10%FBS的DMEM培养基重悬细胞,将SCC25细胞接种于6孔板中(1×103个/孔),37 ℃、5%CO2条件下连续培养2周。PBS清洗细胞,4%多聚甲醛固定30 min,1%结晶紫染色10 min。PBS洗涤细胞,晾干,拍照并计数。
1.2.6 CCK-8实验 待SCC25细胞生长至80%~90%融合时,0.25%胰酶消化液消化细胞,制成密度为5×104个/mL的细胞悬液,96孔板中每孔加入100 μL细胞悬液。37 ℃、5%CO2条件下继续培养。在细胞培养24 h、48 h、72 h和96 h后,向孔内加入10 μL CCK-8溶液,37 ℃、 5%CO2条件下孵育2 h。酶标仪测定各孔在450 nm处的光密度(OD)值。
1.2.7 Transwell实验 迁移实验:取100 μL SCC25细胞悬液(5×104个细胞)加入上腔室中,下腔室加入500 μL含20% FBS的DMEM培养基,37 ℃、5%CO2条件下培养24 h。5%戊二醛4 ℃条件下固定,0.1%结晶紫室温染色30 min,显微镜下观察。
侵袭实验:用无血清DMEM培养基稀释Matrigel(稀释比例5∶1)。取Matrigel稀释液加入各上腔室中,每室各100 μL,37 ℃孵育直至变为固态。取100 μL SCC25细胞悬液(5×104个细胞)加入上腔室中,下腔室加入500 μL含20% FBS的DMEM培养基,37 ℃、5%CO2条件下培养24 h。5%戊二醛4 ℃条件下固定,0.1%结晶紫室温染色30 min,显微镜下观察。
1.3 统计学分析

2 结 果
2.1 HOK、TSCCA、Tca8113和SCC25细胞系中DZIP1的差异性表达
实时荧光定量PCR和Western blot检测HOK、TSCCA、Tca8113和SCC25细胞中DZIP1的表达,结果显示,与HOK组相比,人OSCC细胞系TSCCA,Tca8113和SCC25中DZIP1的mRNA表达和蛋白表达均显著升高(图1A、B,P<0.05),其中SCC25细胞系中DZIP1表达的升高最为明显,因此,选择SCC25细胞系进行后续实验。

A:实时荧光定量PCR检测HOK、TSCCA、Tca8113和SCC25细胞系DZIP1 mRNA表达;B:Western blot检测HOK、TSCCA、Tca8113和SCC25细胞系DZIP1 蛋白表达。a:P<0.05 vs. HOK组图1 HOK、TSCCA、Tca8113和SCC25细胞系DZIP1的差异性表达Fig.1 Differential expression of DZIP1 in HOK, TSCCA, Tca8113, and SCC25 cell lines
2.2 si-DZIP1干扰效率筛选
SCC25细胞分别转染si-DZIP1-1、si-DZIP1-2和NC序列,实时荧光定量PCR和Western blot检测DZIP1 mRNA和蛋白表达,结果显示,与空白对照组相比,NC组DZIP1 mRNA和蛋白表达均无明显变化(图2A、B,P>0.05);与NC组相比,si-DZIP1-1、si-DZIP1-2组DZIP1 mRNA和蛋白表达均显著降低(图2A、B,P<0.05),其中si-DZIP1-2敲低效果更为明显,因此,选取si-DZIP1-2进行后续实验,简称为si-DZIP1。
2.3 DZIP1促进SCC25细胞Wnt/β-catenin信号通路活化
实时荧光定量PCR和Western blot检测Wnt/β-catenin信号通路相关基因的mRNA和蛋白表达,结果显示,与NC组相比,si-DZIP1组β-catenin、Cyclin D1和c-Myc mRNA和蛋白表达均显著降低(图3A、B,P<0.05),LiCl组SCC25细胞中β-catenin、Cyclin D1和c-Myc mRNA和蛋白表达均显著升高(图3A、B,P<0.05);与si-DZIP1组相比,si-DZIP1+LiCl组细胞β-catenin、Cyclin D1和c-Myc mRNA和蛋白表达均显著升高(图3 A、B,P<0.05)。
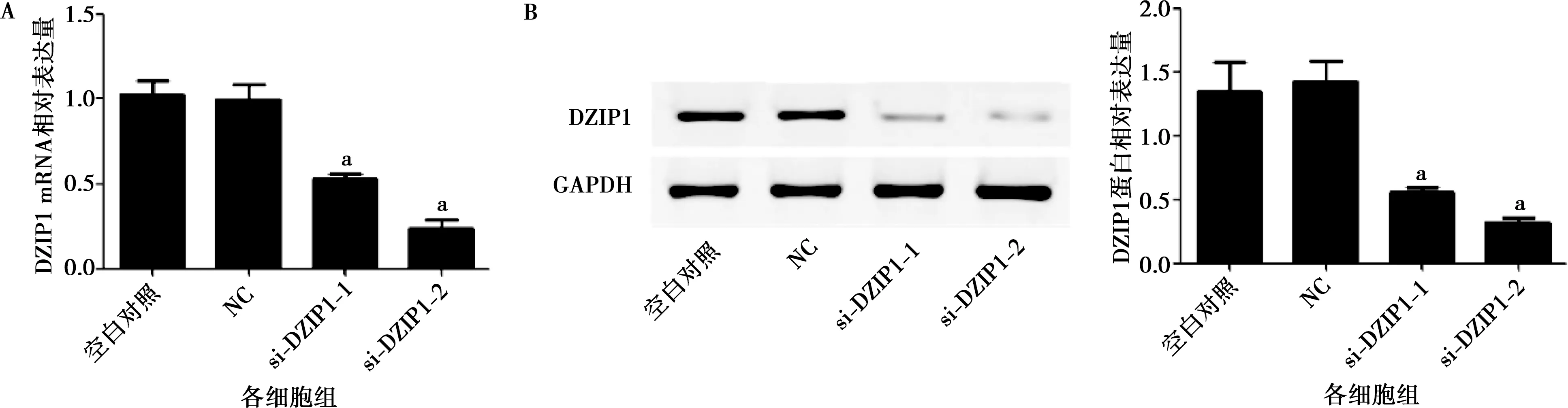
A:实时荧光定量PCR检测SCC25细胞中DZIP1 mRNA表达;B:Western blot检测SCC25细胞中DZIP1 蛋白表达。a: P<0.05,vs. NC组图2 si-DZIP1干扰效率筛选Fig.2 si-DZIP1 interference efficiency screening

A:实时荧光定量PCR检测Wnt/β-catenin信号通路相关基因的mRNA表达;B:Western blot检测Wnt/β-catenin信号通路相关基因的蛋白表达。a: P<0.05, vs. NC组;b: P<0.05, vs. si-DZIP1组图3 实时荧光定量PCR和Western blot检测Wnt/β-catenin信号通路相关基因的mRNA和蛋白表达Fig.3 Detection of mRNA and protein expression of genes related to the Wnt/β-catenin signaling pathway by real-time quantitative PCR and Western blot
2.4 DZIP1通过Wnt/β-catenin信号通路促进SCC25细胞增殖
CCK-8实验检测SCC25细胞活力,克隆形成实验检测SCC25细胞增殖能力,结果显示,与NC组相比,si-DZIP1组细胞活力显著降低(图4A,P<0.05),细胞增殖能力显著降低(图4B,P<0.05),LiCl组细胞活力显著升高(图4A,P<0.05),细胞增殖能力显著升高(图4B,P<0.05);与si-DZIP1组相比,si-DZIP1+LiCl组细胞活力显著升高(图4A,P<0.05),细胞增殖能力显著升高(图4B,P<0.05)。
2.5 DZIP1通过Wnt/β-catenin信号通路促进SCC25细胞迁移和侵袭
Transwell实验检测SCC25细胞迁移和侵袭能力,结果显示,与NC组相比,si-DZIP1组细胞迁移能力显著降低(图5A,P<0.05),细胞侵袭能力也显著降低(图5B,P<0.05),LiCl组细胞迁移能力显著升高(图5A,P<0.05),细胞侵袭能力也显著升高(图5B,P<0.05);与si-DZIP1组相比,si-DZIP1+LiCl组细胞迁移能力显著升高(图5A,P<0.05),细胞侵袭能力也显著升高(图5B,P<0.05)。
3 讨 论
OSCC是全球10种最常见的癌症之一,占头颈部癌症的80%~90%,具有免疫抑制性[15]。OSCC的特征是角蛋白生成、鳞状分化、生长和转移[16]。目前的治疗方法是通过外科手术辅助化疗和放疗。但许多患者经治疗后,仍有转移和复发的风险[17-19]。Wnt/β-catenin信号传导途径可调节多种癌症进展,与肿瘤发生相关[20-22]。有研究对TCGA数据库中519例OSCC肿瘤和44例正常组织中DZIP1的表达进行分析,发现DZIP1是OSCC组织中失调的基因之一[13]。有研究者对膀胱癌转移相关基因进行筛选和分类,结果显示,DZIP1是Wnt信号通路的可能调控基因[12]。本研究旨在探究DZIP1是否通过Wnt/β-catenin信号通路对口腔鳞状细胞癌的增殖、迁移和侵袭产生影响,以期为寻找OSCC治疗靶点提供科学资料。
研究表明,DZIP1在OSCC癌组织和人OSCC细胞系中上调,与预后呈负相关[13]。本研究选取多种细胞系:人口腔角质形成细胞HOK和OSCC细胞系TSCCA、Tca8113和SCC25,应用实时荧光定量PCR和Western blot检测各细胞系中DZIP1的mRNA表达和蛋白表达,结果显示,与HOK组相比,TSCCA组、Tca8113组和SCC25组中DZIP1的mRNA表达和蛋白表达均显著升高,其中SCC25组变化最明显。

A:CCK-8检测SCC25细胞活力;B:克隆形成实验检测SCC25细胞增殖能力;a: P<0.05, vs. NC组;b: P<0.05, vs. si-DZIP1组图4 DZIP1通过Wnt/β-catenin信号通路促进SCC25细胞增殖Fig.4 DZIP1 promotes SCC25 cell proliferation through the Wnt/β-catenin signaling pathway

A:Transwell实验检测SCC25细胞迁移能力;B:Transwell实验检测SCC25细胞侵袭能力;a: P<0.05, vs. NC组;b: P<0.05, vs. si-DZIP1组图5 DZIP1通过Wnt/β-catenin信号通路促进SCC25细胞迁移和侵袭Fig.5 DZIP1 promoting migration and invasion of SCC25 cells through the Wnt/β-catenin signaling pathway
DZIP1是Hedgehog信号通路重要组成部分[10]。肠上皮中的Hedgehog信号抑制Wnt信号通路,从而抑制Wnt靶基因在干细胞或祖细胞中的表达[11]。Shi等[12]证明DZIP1是Wnt信号通路的可能调控基因。本研究应用实时荧光定量PCR和Western blot检测SCC25细胞中Wnt/β-catenin信号通路相关基因的mRNA表达和蛋白表达,结果显示,敲低DZIP1会抑制Wnt/β-catenin信号通路相关基因的mRNA表达和蛋白表达,该抑制现象可被Wnt/β-catenin信号通路激活剂LiCl逆转,说明DZIP1介导Wnt/β-catenin信号通路活化。
当Wnt/β-catenin信号通路被激活时,β-catenin聚集在细胞核中,以促进细胞上皮表型的丧失。这个过程与肿瘤的生长和转移密切相关[23]。研究表明,Wnt/β-catenin信号传导可加速鼻咽癌和食道鳞癌的肿瘤进展[24]。此外,FOXD2-AS1的过表达通过Wnt/β-catenin信号通路促进非小细胞肺癌的细胞增殖、迁移和侵袭[25]。R-spondin 2-LGR4系统通过Wnt/β-catenin信号调节舌鳞状细胞癌的生长、迁移和侵袭,上皮-间质转化和茎样特性[26]。本研究应用CCK-8实验检测SCC25细胞活力,克隆形成实验检测SCC25细胞增殖能力,Transwell实验检测SCC25细胞迁移和侵袭能力,结果显示,敲低DZIP1能显著降低SCC25细胞活力,抑制细胞增殖,降低细胞迁移和侵袭能力,以上抑制现象均可被LiCl逆转,说明DZIP1通过Wnt/β-catenin信号通路促进细胞增殖、迁移和侵袭。
综上所述,DZIP1通过影响Wnt/β-catenin信号通路促进口腔鳞状细胞癌增殖、迁移和侵袭。而有关DZIP1是否通过影响其它信号通路发挥对口腔鳞状细胞癌增殖、迁移和侵袭的影响,尚需进一步研究。

