DC-CIK细胞免疫联合干扰素治疗肾细胞癌的临床疗效评价
李勋钢,张文圣,颜小平
(九江市第一人民医院(南昌大学附属九江医院)泌尿外科,江西 九江 332000)
肾癌又称为肾细胞癌,是最常见的实质性恶性肿瘤,肾细胞癌占成人恶性肿瘤的2%~3%,肾脏原发性恶性肿瘤的85%~90%。在泌尿系统恶性肿瘤中,仅次于膀胱癌,发病率呈逐年上升趋势[1]。目前,根治性肾癌切除术是最有效、最常用的治疗方法,放射、化学和激素等治疗可提高患者的临床疗效,但总体效果不佳,近年来研究表明细胞免疫治疗已成为一种重要且有效的抗癌的治疗方法[2-3]。本研究选取80例行腹腔镜肾癌手术的肾细胞癌患者进行DC-CIK细胞免疫联合干扰素治疗,评价其临床疗效及安全性,现报道如下。
1 资料与方法
1.1 临床资料 选取2016年3月至2018年3月于本院行腹腔镜肾癌手术的肾细胞癌患者80 例作为研究对象,随机分为治疗组和对照组,每组40例。其中男47例,女33例;年龄43.5~78.3 岁,平均年龄(65.7±12.3)岁。术后病理肾透明细胞癌65 例,嫌色细胞癌6 例,其他9 例。治疗前均取得患者及家属同意并签署知情同意书,本研究通过本院伦理委员会审核批准。纳入标准:参照美国癌症联合委员会(AJCC)分期标准,TNM 分期为T3~T4 期病理确诊断的肾癌患者;治疗前Karnofsky 评分(KPS)>60 分;预计生存时间>6 个月。排除标准:有生物制品过敏患者;术后复发及非原发性肾癌患者;心、肝、肺等重要器官功能不全或衰竭患者;妊娠或哺乳期妇女;患有严重的自身免疫性疾病患者;严重凝血功能异常患者。
1.2 方法 对照组采用干扰素治疗。患者术后第2周开始使用α-干扰素,每次5×106U,隔天1 次,肌内注射,1 个疗程8~12周,并给予对症治疗。定期行肝肾功能、血清钙,胸部、腹部CT或MRI及全身骨扫描。
治疗组采取DC-CIK细胞免疫联合干扰素治疗。DC-CIK细胞免疫治疗方法:抽取患者外周血,采用血细胞分离机分离患者外周血单核细胞,体积为0.3倍血容量。采用Ficoll淋巴细胞分离液从单个核细胞分离淋巴细胞,用培养液洗涤2 次BIN,无血清培养基混悬于培养瓶中并置于37 ℃5%CO2孵育箱中,2 h后将悬浮细胞移出,加入IL-4 500 U/LGM-CSF 1 000 U/mL 继续培养 2~3 d,换液 1 次,第 6 天加入 TNF-α 500 U/mL。LCIK细胞培养、分离后加入重组人IFN 1 000 U/mL和10% AB 型人血清的RPMI 1 640 培养液,24 h 后更换成含100 ng/mL小鼠抗人CD3单克隆抗体1 000 U/mL。IL-1和IL-2的RPMI 1 640完全培养液继续培养2 d后更换为含IL-2的完全培养液,隔日换液维持培养DC-CIK细胞培养。采集第7天的 DC 和 CIK 细胞按 1∶5 混合培养,3 d 后开始应用。控制标准:CD3+CD56+NKT≥50%,CD3+CD8+≥30%,细胞存活率≥95%,不含细菌和内毒素。DC-CIK 细胞回输:静脉输注DC-CIK 细胞,6次为1 个疗程,每例患者至少治疗2 个疗程,最多治疗6 个疗程。
1.3 观察指标 比较两组临床疗效、治疗前后免疫功能、生活质量及不良反应情况。临床疗效评价根据RECIST实体瘤疗效评价标准[4],分为完全缓解(completeremission,CR):病变完全消失并维持4 周以上;部分缓解(partialremission,PR):肿瘤病灶最大垂直两径乘积缩小≥50%,并维持4周以上;病情稳定(stabledisease,SD):肿瘤缩小或增大<25%,疾病进展(progressiondisease,PD):肿瘤增大≥25%或出现新病灶。以CR 和PR 为有效,疾病控制率(diseasecontrolrate,DCR)=(CR+PR+SD)/总例数×100%。客观缓解率(objectiveresponserate,ORR)=(CR+PR)/总例数×100%。随访总体中位时间为32个月,第1次随访为术后第4周,每3个月随访1 次,观察患者疾病进展及生存情况;采用生活质量KPS评分比较患者治疗前后生活质量情况,KPS>80分,患者生活自理,50~79 分,患者生活半自理,评分越高表示生活质量越好;采用流式细胞仪分析患者治疗前后T细胞亚群及NK等细胞变化,并对患者免疫功能进行评价。
1.4 统计学方法 采用SPSS 17.0统计软件进行数据分析,计量资料以“”表示,比较采用t检验,计数资料用[n(%)]表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较 治疗组疾病控制率为82.5%,客观缓解率为52.5%;对照组疾病控制率为62.5%,客观缓解率为22.5%,差异有统计学意义(P<0.05),见表1。
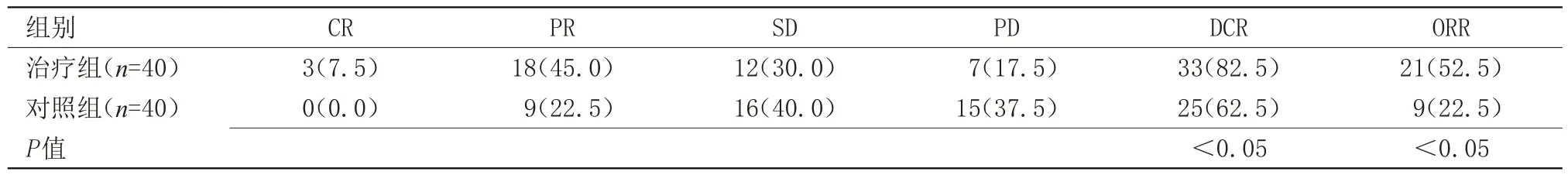
表1 两组临床疗效比较[n(%)]Table 1 Comparison of clinical efficacy between the two groups[n(%)]
2.2 两组免疫功能与生活质量评分比较 治疗后,治疗组免疫功能、KPS评分明显高于对照组(P<0.05),且与治疗前比较明显好转(P<0.05),见表2。
表2 两组治疗前后免疫功能及生活质量比较()Table 2 The comparing of the immune function and quality of life between two groups before and after treatment()
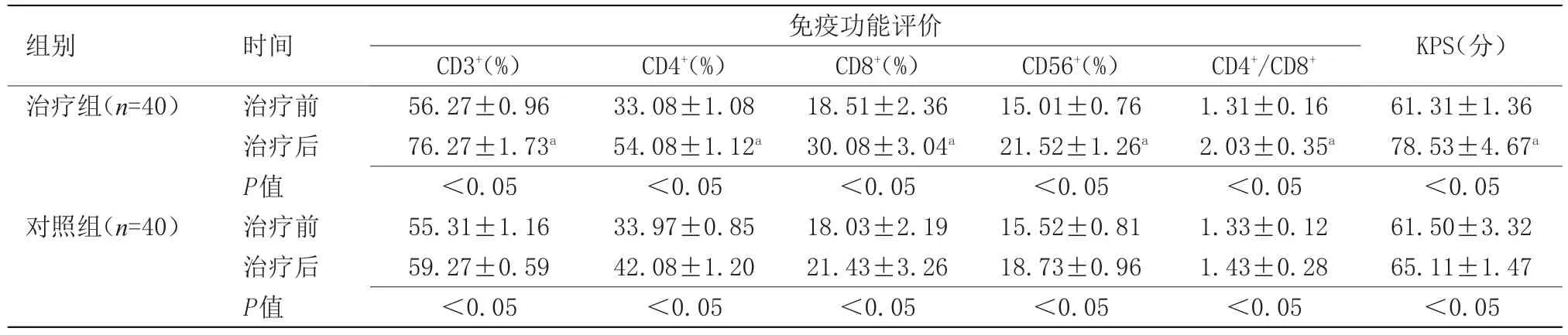
表2 两组治疗前后免疫功能及生活质量比较()Table 2 The comparing of the immune function and quality of life between two groups before and after treatment()
注:与对照组治疗后比较,aP<0.05
组别治疗组(n=40)时间治疗前治疗后P值治疗前治疗后P值KPS(分)61.31±1.36 78.53±4.67a<0.05 61.50±3.32 65.11±1.47<0.05免疫功能评价对照组(n=40)CD3+(%)56.27±0.96 76.27±1.73a<0.05 55.31±1.16 59.27±0.59<0.05 CD4+(%)33.08±1.08 54.08±1.12a<0.05 33.97±0.85 42.08±1.20<0.05 CD8+(%)18.51±2.36 30.08±3.04a<0.05 18.03±2.19 21.43±3.26<0.05 CD56+(%)15.01±0.76 21.52±1.26a<0.05 15.52±0.81 18.73±0.96<0.05 CD4+/CD8+1.31±0.16 2.03±0.35a<0.05 1.33±0.12 1.43±0.28<0.05
2.3 两组平均生存期比较 治疗组平均生存期为(41.6±3.1)个月,明显长于对照组的(39.3±2.9)个月(t=3.427,P<0.05)。
2.4 两组不良反应发生率比较 两组均未出现严重不良反应,部分患者出现轻微的不良反应。其中治疗组轻度乏力3例,恶心呕吐2例,发热1例,不良反应发生率为15.0%;对照组发热3例,较严重的血细胞减少等骨髓抑制1例,恶心、呕吐及纳差1例,不良反应发生率为12.5%,均停药或对症治疗后好转,两组不良反应比较差异无统计学意义(χ2=1.105)。
3 讨论
目前肾细胞癌的治疗仍以手术治疗为主,但临床诊断肾癌时,发现约25%~33%的患者已有转移病灶,术后20%~40%的患者可能出现转移,在部分转移患者中其中位生存期仅8~12 个月,且5 年生存率不足10%。术后的化学治疗及放射治疗效果不满意,不能降低肿瘤复发率和转移。目前,生物免疫治疗广泛应用于肾细胞癌术后辅助治疗[2]
α-干扰素(INF-α)是目前研究较多的生物免疫治疗制剂,1983年开始应用于临床,是首个用于临床的基因重组细胞因子。有文献[5]报道,单独应用IFN-α治疗转移肾癌的有效率为10%~15%,α-干扰素主要由白细胞、成纤维细胞等在细菌、DNA 或RNA 病毒、多核苷酸等刺激物诱导下产生,具有抗病毒、抑制某些细胞生长、免疫调节、抑制和杀伤肿瘤细胞等多种作用。其中,抗肿瘤作用主要通过抗细胞增殖作用、直接细胞毒性作用等多种机制[6-7]。其抗肿瘤活性包括3个方面:①直接或间接抑制肿瘤细胞生长;②调控宿主抗肿瘤免疫反应;③改变宿主和肿瘤之间的关系。通过抑制肿瘤血管形成、分解营养因子等抑制肿瘤发展。但应用干扰素治疗会产生发热、寒战、头痛、乏力等不良反应,多次给药后患者多可耐受。大剂量应用可出现消化道反应、骨髓抑制、神经系统和心血管系统症状,且IFN-α 的最佳方案目前尚无定论。本研究对照组1例出现较严重的血细胞减少等骨髓抑制,1例出现恶心、呕吐及纳差等严重消化道不良反应。
目前,以DC-CIK 细胞生物免疫治疗方法为主的细胞过继免疫治疗越来越受到关注[8]。树突状细胞(dendriticcells,DC)是Steinman 等[9]首次在小鼠脾脏中发现,其抗瘤机制为:①分泌IL-12、IL-10、Ⅰ型干扰素、TGF-p、IL-lp 等细胞因子;②诱导产生大量效应T细胞;③保持效应T细胞在肿瘤部位的长期存在;④启动效应T 细胞迁移至肿瘤部位;⑤抑制肿瘤血管的生成[10]。细胞因子诱导的杀伤细胞(cytokineinducedkillcells,CIK)是一非主要组织相容复合体(majorhistocompatibilitycomplex,MHC)限制性的细胞毒性T淋巴细胞(主要包括CD3+CD56+)。CIK抗瘤作用主要有以下3个方面:①产生分泌大量的炎性细胞因子(IFN、TNF、IL-2 等),通过调节机体免疫系统反应性或抑制肿瘤细胞而杀伤肿瘤细胞;②通过释放大量能穿透肿瘤细胞膜的细胞毒性颗粒,使肿瘤细胞破坏溶解;③通过介导Fas-FasL途径致肿瘤细胞凋亡及坏死[11-12]。近年来,DC-CIK生物免疫治疗作为新的肿瘤治疗手段,已应用于肾细胞癌术后辅助治疗。Wang等[13]分别采用DC联合CIK治疗晚期肾细胞癌患者,与单独用DC联合干扰素治疗转移性肾细胞癌相比,均获得较好疗效。本研究研究显示,治疗组免疫功能和KPS评分均明显高于对照组,治疗组免疫功能较治疗前明显好转(P<0.05)。随访期间,治疗组总生存期较对照组延长(P<0.05)。两组不良反应发生率比较差异无统计学意义,均未出现严重的不良反应,安全性较高。
综上所述,DC-CIK 细胞免疫联合干扰素治疗肾细胞癌安全可行,疗效显著,不良反应发生率较低,可作为肾细胞癌的治疗选择。

