生长异质大西洋鲑转录组学分析
章 昭,聂苗苗,高 强,刘 丹,王振吉,祁得林*
(1.省部共建三江源生态与高原农牧业国家重点实验室,青海大学,青海 西宁 810016;2.青海大学农牧学院,青海 西宁 810016;3.青海省渔业环境监测站(青海省高原水生生物及生态环境重点实验室),青海 西宁 810012)
大西洋鲑(Salmosalar), 俗称三文鱼,主要分布于大西洋北部及其附近河流流域,隶属于硬骨鱼纲(Osteichthyes)、辐鳍鱼亚纲(Actinopterygii)、鲑形目(Salmoniformes)、鲑科(Salmonidae),因其营养丰富,经济价值高,成为人们最喜爱的高档水产品。根据FAO统计数据显示,2017年至2018年全球养殖大西洋鲑总产量达244.5万t,预计2020年达到260万t[1]。但由于大西洋鲑在中国没有自然分布,且对生长环境要求较高,人工育苗和养殖难度较大,所以我国利用工厂化养殖大西洋鲑的技术尚处于起步阶段。2016年4月,青海省首次从冰岛引进淡水大西洋鲑发眼卵24 000粒进行孵化,经过2年的工厂化循环水养殖实验发现,同一批次大西洋鲑最大个体体重达到4.6 kg,而最小个体体重不足0.5 kg,养殖群体表现出显著地生长异质性。目前,对鱼类个体生长异质相关的研究多集中于遗传因素[2]、养殖密度[3]、社会等级因素[4]等方面。但对相同饲养管理条件下,产生生长异质的分子机制尚不明确。
基于此,文中以大西洋鲑为研究对象,利用转录组测序技术获得生长异质大西洋鲑的基因表达差异情况,并对差异基因进行GO功能富集、KEGG通路富集分析,期望能从转录组学研究中解析大西洋鲑生长异质的原因,从而为大西洋鲑的遗传繁育提供参考依据。
1 材料和方法
1.1 试验材料
本研究以同一养殖环境下的24月龄雄性大西洋鲑作为研究对象,随机选择生长速度较慢,平均体重为0.51 kg的3尾鱼,作为慢速生长组;随机选择生长速度较快,平均体重为4.20 kg的3尾鱼,作为快速生长组(表1)。收集样品时,用MS-222麻醉大西洋鲑,解剖并分离其肌肉组织,保存于液氮中备用。
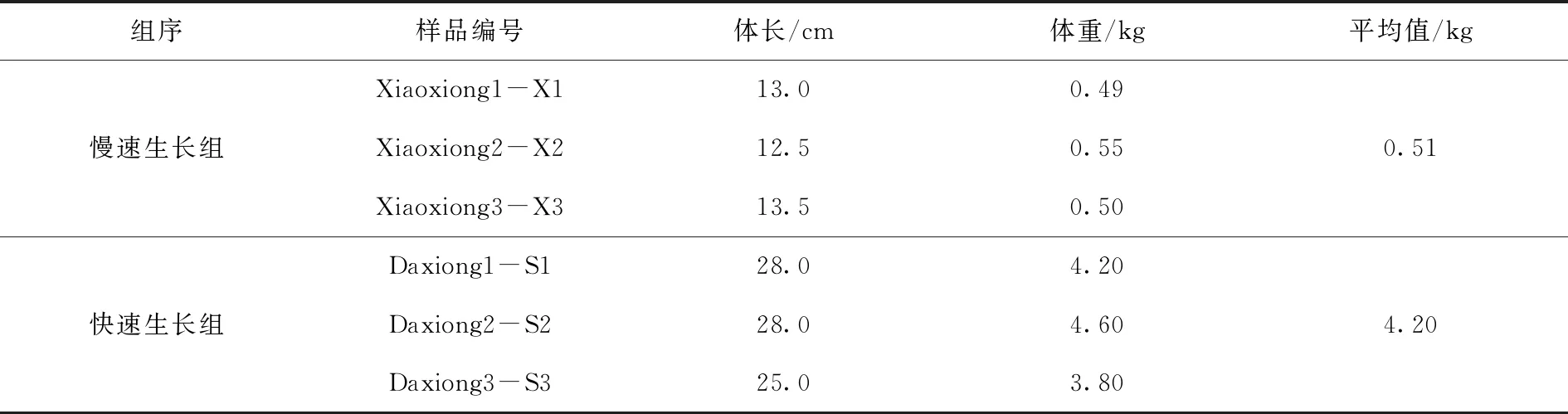
表1大西洋鲑测序样品采集表Tab.1 Collection of samples of Salmo salar sequencing
1.2 试验方法
1.2.1 总RNA提取及质量检测
取100 mg肌肉组织样品,采用 Ambion MagmaxTM-96 total RNA isolation kit (Ambion,美国)试剂盒,按照说明提取总RNA,用1%琼脂糖凝胶检测污染情况。用 Nano Photometer®(IMPLEN,USA)分光光度计检测RNA纯度,用 Qubit®RNA Assay Kit(Thermo Fisher,中国)试剂盒检测RNA浓度,最后使用安捷伦生物分析仪2100系统的 RNA Nano 6000检测试剂盒检测RNA完整性。
1.2.2 文库构建及测序
从6个组织样品中分别取3 μg RNA,使用Illumina公司的NEBNext UltraTM RNA试剂盒(NEB,USA)构建大西洋鲑测序文库。大西洋鲑转录组文库的测序由北京百迈客生物科技有限公司通过Illumina HiSeq 2500高通量测序平台完成。
1.2.3 原始数据质量控制
基于边合成边测序(Sequencing by Synthesis,SBS)技术,完成文库测序。对测序所得的原始数据进行初步处理,去除包含接头、ploy-N含量大于5%和低质量的数据,从而得到高质量数据(clean reads)并保存为 Fastq 格式[5]。利用Trinity软件[6]进行转录本组装,最终获得 Unigenes。
1.2.4 转录本注释
将筛选出的 Unigenes 注释到以下数据库中,包括Cluster of Orthologous Groups of proteins (COG)数据库、Gene Ontology(GO)数据库、Kyoto Encyclopedia of Genes and Genomes (KEGG)数据库、clusters of orthologous groups for eukaryotic complete genomes(KOG)数据库、Pfam 数据库、Swiss-prot 数据库、evolutionary genealogy of genes:non-supervised orthologous groups(eggNOG)数据库和non-redundant protein sequences(NR)数据库。
1.2.5 Unigenes差异表达分析
以 Bowtie[7]软件为基础,将转录组测序得到的 clean reads 比对到参考基因组上(https:∥www.ncbi.nlm.nih.gov/genome/term=Salmo),随后用 DESeq R包[8](依据负二项分布原理)计算基因和转录本的表达水平。比较慢速生长组和快速生长组各三个重复样品并计算其基因表达平均值。采用 Benjamini-Hochberg方法对P值(P-value)进行校正,并采用错误发现率(False Discovery Rate,FDR)作为差异表达基因筛选的关键指标,而FDR是通过对差异显著性P值校正得到的,最终将差异倍数(Fold Change)≥2且FDR<0.05作为筛选标准,并对筛选得到差异表达基因进行GO功能富集和KEGG通路富集等分析。
2 结果与分析
2.1 大西洋鲑转录组测序质量评估
由表2可知,通过 Illumina HiSeq 2500 高通量测序平台测序,6个样品共产生81.27 Gb Clean Data,每个样品的碱基量均达到12.61 Gb,去除带接头、低质量和短序列后,共获得271 841 994大西洋鲑高质量序列。样品测序的碱基错误率均低于0.05%,GC含量均在50.7%左右,Q30碱基百分比均大于92.55%,说明测序质量较高。
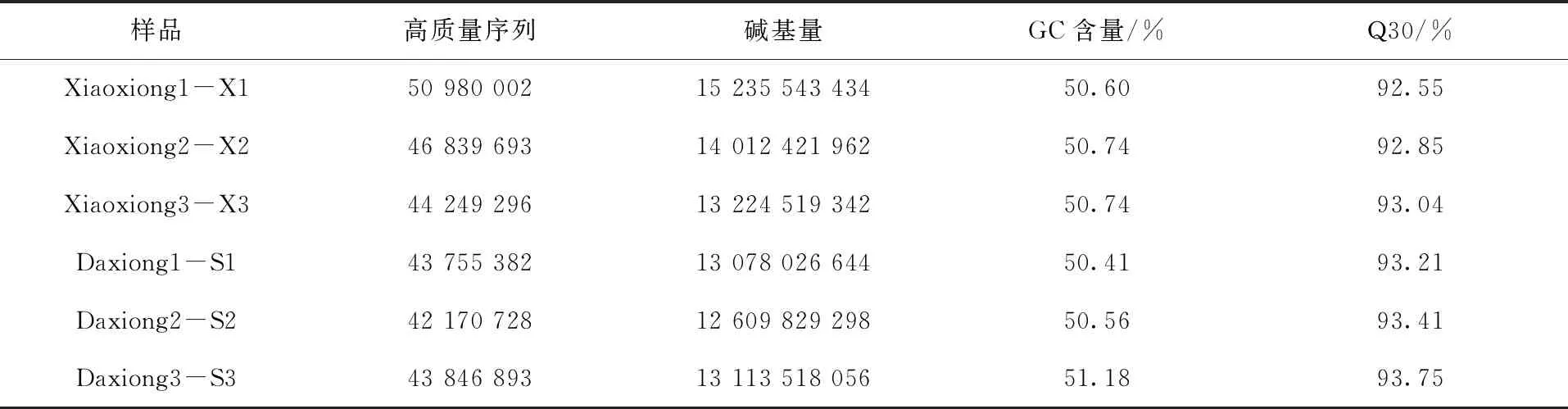
表2大西洋鲑样品转录组测序数据统计Tab.2 Data statistics of transcriptome sequencing of Salmo salar samples
2.2 基因功能注释
为获得全面的基因功能信息,将Unigenes注释到8个数据库中,其中注释基因最多的数据库是NR数据库,其次是eggNOG数据库,最少的是COG数据库(表3)。
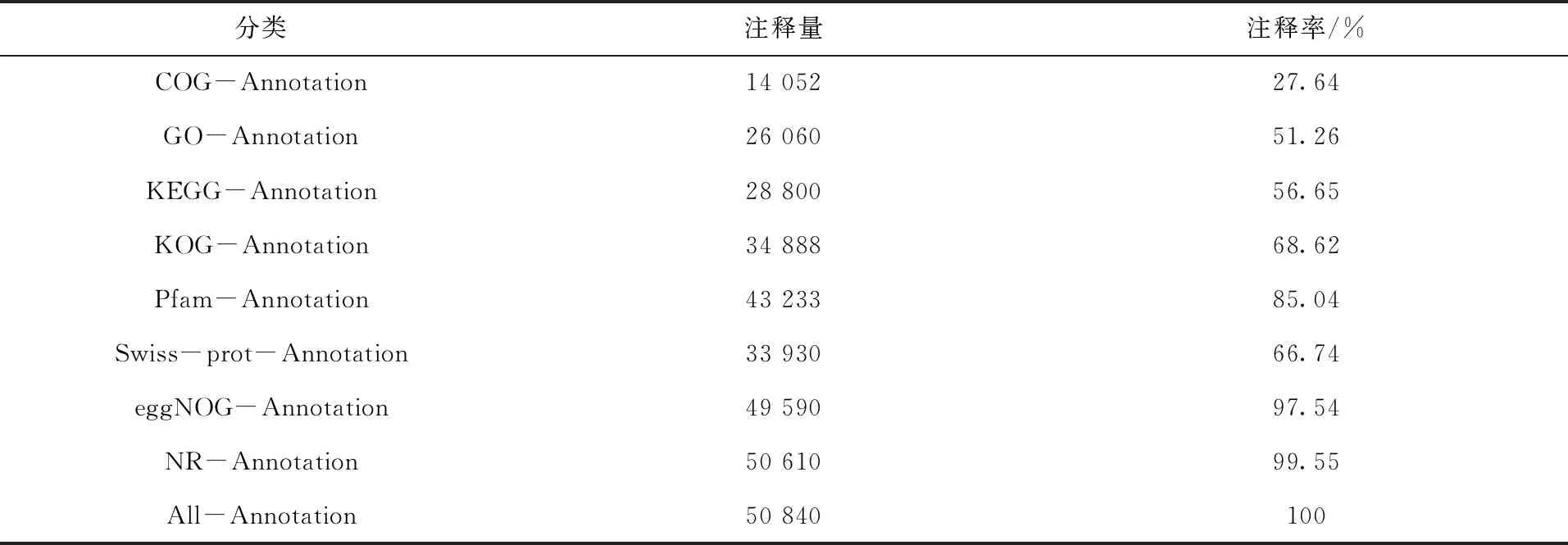
表3大西洋鲑基因功能注释结果统计Tab.3 Statistical results of gene functional annotation of Salmo salar
2.3 基因表达水平分析
使用Bowtie软件将每一个样品的clean reads比对到参考基因组,比对统计结果见表4。从比对结果来看,各样品的clean reads与参考基因组的比对效率为82.15%~87.04%。
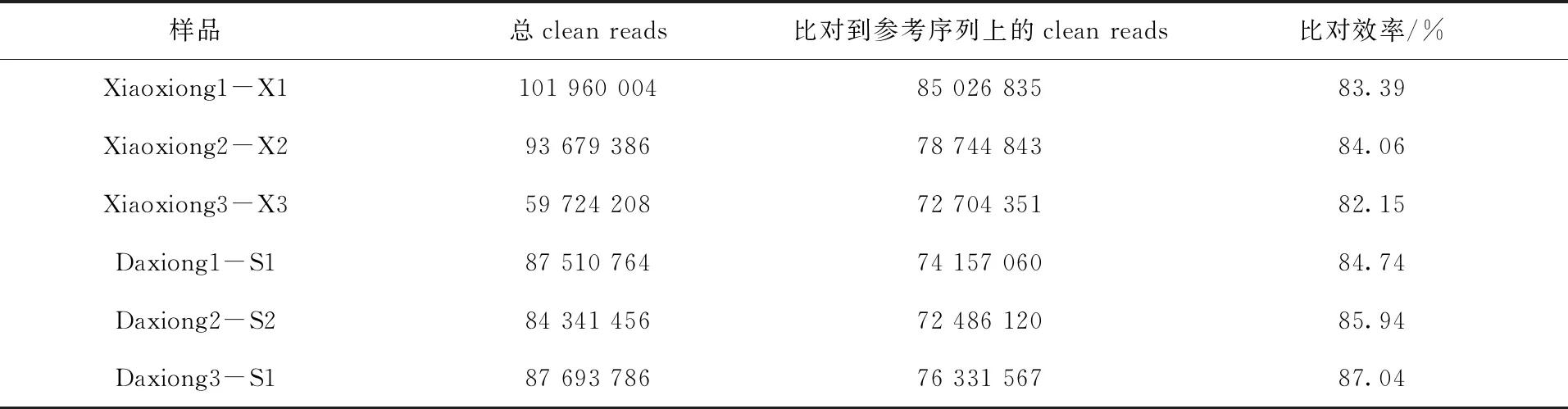
表4 clean reads与参考序列比对统计Tab.4 Clean reads and comparison of reference sequence
2.4 差异表达基因分析
通过对慢速生长组和快速生长组6个样品进行样品间相关性分析发现,Xiaoxiong3-X3和Daxiong1-S1两个样品组内相关性较低,因此后续对两组样品进行差异表达基因分析时剔除这两个样品。最终筛选出948个差异表达基因,其中包括363个上调基因,585个下调基因(快速生长组中的表达水平高于慢速生长组中的表达水平称为上调基因,反之称为下调基因),如图1所示。
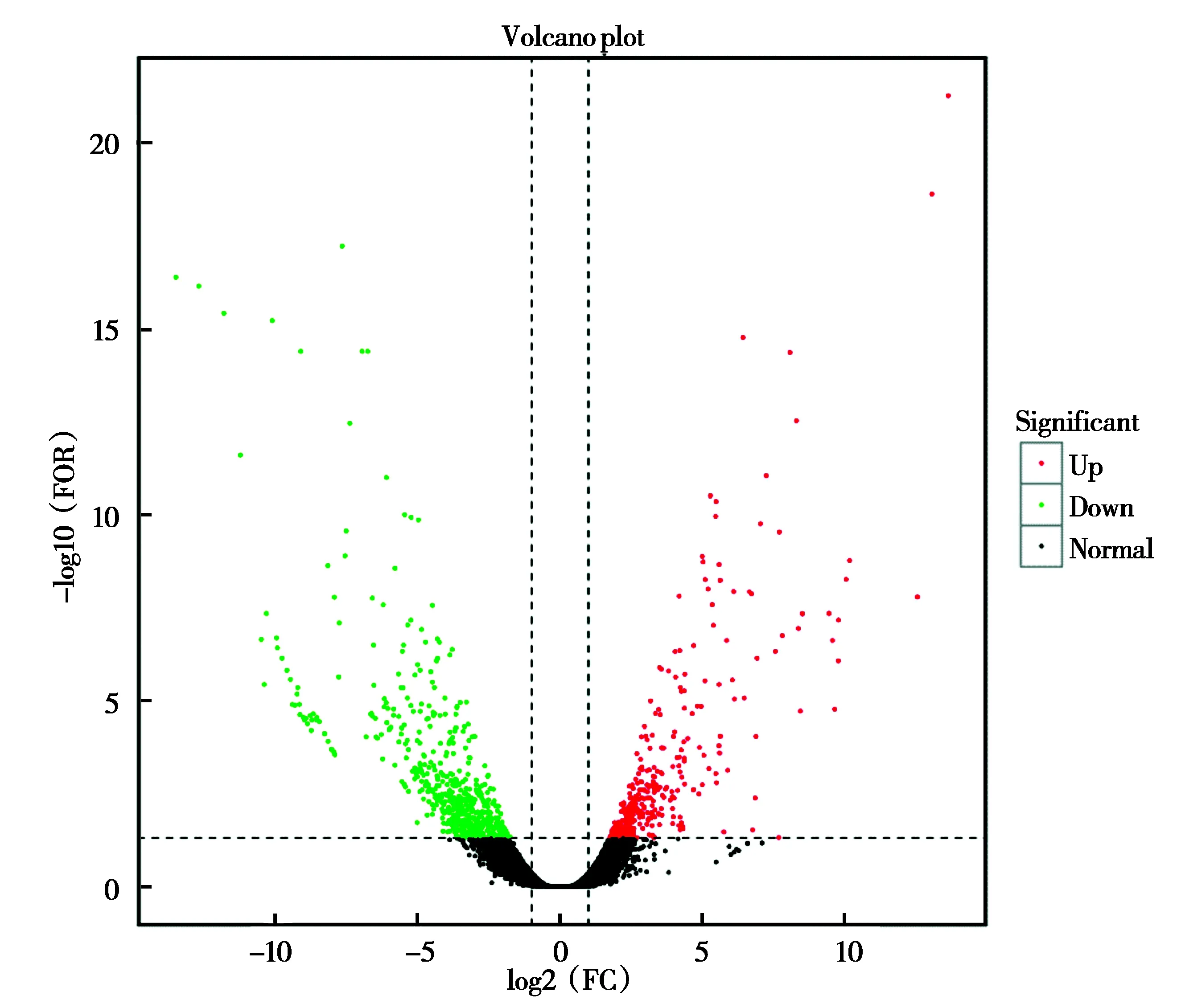
图1 差异表达基因火山图Fig.1 Volcano plot of differentially expressed genes
2.5 差异表达基因的GO富集和KEGG通路富集分析
GO功能富集分析显示,共有543个差异表达基因得到归类注释。在生物过程(biological process)、细胞组分(cellular component)、分子功能(molecular function)3大类中大部分Term都富集到了基因(图2)。KEGG通路富集分类中共有229个差异表达基因参与到了6大类50小类114个代谢通路中, KEGG通路富集分析发现,6个分支所富集的基因占比例不同:环境信息处理(environmental information processing,56.33%)、代谢(metabolism,51.53%)、细胞过程(cellular processes,33.18%)、生物体系统(organismal system,27.51%)、人类疾病(human diseases,6.11%)和遗传信息处理(genetic information processing,3.93%)。注释基因最多的3个通路依次是神经活性受体-配体交互作用信号通路(neuroactive ligand-receptor interaction pathway)、钙信号通路(calcium signaling pathway)和紧密连接信号通路(tight junction pathway)(图3)。
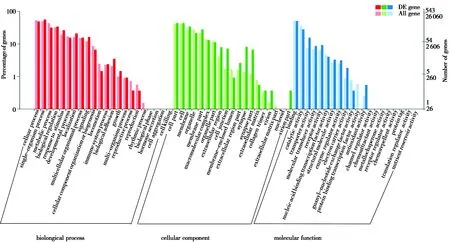
图2 差异基因的GO功能分类Fig.2 Classification of GO function of differentially expressed genes
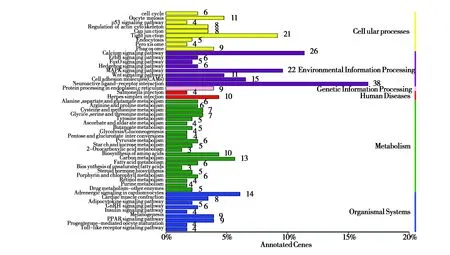
图3 KEGG注释和分类Fig.3 Annotation and classification of KEGG
3 讨论与结论
(1)本研究采用 Illumina HiSeq 2500高通量测序平台对生长异质大西洋鲑转录组文库进行高通量测序分析,经过测序质量控制,共得到81.27 Gb Clean Data,各样品Q30碱基百分比均大于92.55%,高于多个已发表的鱼类转录组组装结果,包括斑马鱼(Daniorerio)(91.93%)[9]、金钱鱼(Scatophagusargus)(91.87%)[10]等,通过与参考基因组比对,各样品的clean reads与参考基因组的比对效率为82.15%~87.04%,说明本试验测序质量较好,可进行后续分析。
(2)肌球蛋白(myosin)是一种普遍存在的真核运动蛋白,也是肌肉的主要组成蛋白质,它与肌动蛋白相互作用,参与从细胞分裂到肌肉收缩等各种细胞运动的过程[11]。本研究发现,参与紧密连接代谢通路调控的肌球蛋白重链(myosin heavy chain,MyHC)基因出现显著上调。相关的研究发现,MyHC基因的表达存在于整个鱼类的肌肉发育过程中[12]。鱼类的生长是蛋白质和脂质沉积的综合结果[13],Hevrøy发现大西洋鲑的生长速度与MyHC基因的表达量呈正相关[14],在对翘嘴鳜(Sinipercachuatsi)早期生长阶段的研究也发现MyHC在快速生长组中的表达量更高[15],这一结果与本研究的结果相一致,说明鱼类的生长速度可能与MyHC相关。
苏氨酸作为一种必须氨基酸,在幼龄动物的生长发育中具有重要的调控作用,包括参与蛋白质的合成,促进生长等[16]。在美国红鱼(Sciaenopsocellatus)和欧洲黑鲈(Dicentrarchuslabrax)的研究中发现,饲料中苏氨酸缺乏会导致生长下降和饲料系数升高[17-18]。窦秀丽等[19]对鲈鱼的研究中发现当饲料中苏氨酸含量为1.83%~1.87%时,鲈鱼的生长性能和蛋白利用效率达到最佳水平。本研究中参与苏氨酸代谢调控的基因在快速生长组中表达量显著高于慢速生长组,说明在快速生长组中,较高的苏氨酸代谢水平是大西洋鲑生长较快的原因之一。
过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)通路在脂质代谢、葡萄糖代谢和调节能量平衡过程中发挥重要作用[20]。PPARs家族包括3种同工型:PPARα,PPARβ/δ和PPARγ[21]。其中PPARα在肝脏、心脏、骨骼肌等代谢活跃的组织中高表达,主要作用于脂肪酸代谢[22]。在斑马鱼(Daniorerio)和红鲷鱼(Pagrusmajor)的研究中发现PPARs的激活是导致鱼类脂肪形成和肥胖的重要因素[23-24]。本研究中有9个基因富集到PPARs通路中,其中包括参与血脂代谢和利用的载脂蛋白AI(apolipoproteinAI,apoAI)和负责氨基酸、核苷酸、糖等吸收和运输功能的溶质载体家族27(solute carrier family 27),并且这两个基因表达水平均显著上调,这些基因主要参与PPARs转录的调控,当PPARs被激活后机体脂肪酸浓度增加[25],蛋白脂肪酶的合成增加,进而调控脂肪细胞的分化[26],这可能也是大西洋鲑个体生长速度较快的重要因素。
钙/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ,CaMKⅡ )是一种多功能蛋白激酶,可磷酸化40多种蛋白质[27]。CaMKⅡ不仅参与Ca2+的代谢,而且在维持细胞能量代谢方面也发挥重要作用[28]。本研究中,CaMKⅡ表达量出现显著下调,同时,与其调控相关的谷氨酸受体(glutamate receptor ionotropic,NMDA1和NMDA2D)基因也出现显著的下调。快速生长组中CaMKⅡ和NMDA的表达量下调说明在慢速生长组中该基因的表达量相对较高,NMDA对Ca2+具有高度通透性,并可使胞内Ca2+浓度升高,从而激活CaMKⅡ[29]。也有研究表明细胞内游离Ca2+浓度升高可能引起肌肉收缩、激素分泌等生理过程的改变[30]。而维持机体细胞内外Ca2+浓度平衡是保证机体正常生长发育的首要条件,刘亚静等[31]在不同Ca2+浓度对青海湖裸鲤(Gymnocyprisprzewalskii)幼鱼生长的研究中发现高Ca2+和低Ca2+均不同程度的减缓了青海湖裸鲤的生长速度。Laining 等[32]在对红鳍东方鲀(Takifugurubripes)幼鱼喂食高钙饵料后发现该鱼生长速度明显减慢。因此,慢速生长组中CaMKⅡ 和NMDA相对较高的表达水平引起胞内Ca2+浓度升高可能对一部分大西洋鲑的生长产生了不利的影响。
鱼类生长过程受到环境、温度、采食等多种复杂因素的影响,因此准确的阐明影响其生长异质的确切机制是十分困难的,本试验通过对生长异质大西洋鲑的转录组测序分析获得了大西洋鲑的转录组数据、基因注释结果,为后续探究大西洋鲑生长异质的主要原因提供数据支撑。同时,通过差异表达基因富集分析,对与本研究相关的钙信号通路、紧密连接通路、PPARs等通路调控机制进行分析,揭示了与生长异质相关的生物学过程和分子机制,为大西洋鲑人工养殖繁育提供科学依据。

