白背飞虱VAMP7和Vti1a蛋白的原核表达、抗体制备及应用
张潇婉 张璐 刘文文 李莉 王锡锋

摘要 :白背飞虱Sogatella furcifera的囊泡相关膜蛋白7(VAMP7)和囊泡转运蛋白(Vti1a)隶属于SNARE(soluble Nethylmaleimidesensitive factor attachment protein receptor)家族,该家族蛋白主要参与生物体中关键的膜转运过程。前期研究发现这两种蛋白分别与南方水稻黑条矮缩病毒Southern rice blackstreaked dwarf virus (SRBSDV)的主要外层衣壳蛋白P10存在显著互作,推测可能协助病毒粒体在介体白背飞虱内的转运和扩散。为了进一步利用血清学技术研究VAMP7和Vti1a在传毒过程中的功能,本研究克隆了白背飞虱编码这两种蛋白的基因,成功构建了VAMP7和Vti1a基因的原核表达载体,并将载体分别转入大肠杆菌中进行诱导表达,得到了相应的原核表达蛋白。在蛋白纯化后,将纯化蛋白注射于新西兰大白兔体内进行免疫,分别制备得到VAMP7和Vti1a的抗体。两种抗体经Western blot检测发现,均可分别与白背飞虱体内的VAMP7和Vti1a特异性结合。利用制备的抗体对白背飞虱的肠道进行免疫标记,激光共聚焦显微镜观察发现所制备抗体能够在白背飞虱中肠上皮细胞的胞质中特异性标记到VAMP7和Vti1a,表明制备的抗体能够成功用于这两种蛋白的体内外检测,为阐明这两种蛋白参与传播SRBSDV的机制研究奠定了基础。
关键词 :白背飞虱; 囊泡相关膜蛋白7; 囊泡转运蛋白; 原核表达; Western blot; 免疫荧光标记
中图分类号: S 435.112.3
文献标识码: A
DOI: 10.16688/j.zwbh.2019622
Preparation and application of the antibodies of Sogatella furcifera VAMP7 and Vti1a proteins expressed in Escherichia coli
ZHANG Xiaowan, ZHANG Lu, LIU Wenwen, LI Li*, WANG Xifeng
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant
Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract :Vesicleassociated membrane protein 7 (VAMP7) and vesicle transport through interaction with tSNAREs homolog 1a (Vti1a) of Sogatella furcifera belong to the SNARE family, participating in the vesicular transport. In our previous study, they interacted with the P10 of Southern rice blackstreaked dwarf virus (SRBSDV) respectively, and might facilitate virion transport in insects. In order to use the serological techniques to further validate their functions, the prokaryotic expression vectors of VAMP7 and Vti1a genes were constructed and then transformed into strain BL21 (DE3) of Escherichia coli and expressed by IPTG induction. Purified proteins were used to immunize rabbits for preparation of polyclonal antibodies. Western blot showed that the prepared antibodies could specifically bind to the recombinant proteins and VAMP7 and Vti1a in S.furcifera, respectively. Immunofluorescent labeling assay revealed that VAMP7 and Vti1a were located in the cytoplasm of the midgut epithelia in S.furcifera, which laid the foundation for the functional study of VAMP7 and Vti1a in SRBSDV transmission.
Key words :Sogatella furcifera; VAMP7; Vti1a; prokaryotic expression; Western blot; immunofluorescence
白背飛虱Sogatella furcifera (Horváth)属半翅目Hemiptera飞虱科Delphacidae,是重要的迁飞性害虫。以成虫和若虫群栖稻株基部刺吸汁液,使水稻生长缓慢、分蘖延迟、瘪粒增加,为害严重时,造成稻株枯死,呈“虱烧”状[1]。除了直接为害外,作为南方水稻黑条矮缩病毒Southern rice blackstreaked dwarf virus (SRBSDV)唯一的传播介体,对于该病毒病害近年在我国的暴发流行发挥了关键作用[2]。白背飞虱以持久循回增殖方式传播SRBSDV,病毒进入白背飞虱体内后,会与虫体内多种蛋白发生互作,从而克服相应的传播屏障[34]。本实验室前期以SRBSDV的主要外层衣壳蛋白P10为诱饵,筛选白背飞虱cDNA文库,得到了囊泡相关膜蛋白7(vesicleassociated membrane protein 7, VAMP7)和囊泡转运蛋白(vesicle transport through interaction with tSNAREs homolog 1a, Vti1a),进一步利用pulldown技术验证这两种蛋白分别与SRBSDVP10存在显著互作,而且在白背飞虱肠道内表达量最高,推测他们在白背飞虱高效传播SRBSDV的过程中发挥了重要作用[5]。
1.2.5 免疫荧光法检测白背飞虱肠道内的VAMP7和Vti1a的定位
在解剖镜下剖出白背飞虱的肠道,用4%的多聚甲醛固定1 h后用0.01 mol/L磷酸缓冲液(PBS)清洗3次,每次5 min;用0.2%的TritonX100渗透2 h后,
PBS清洗3次,每次10 min;用PBS
稀释牛血清白蛋白为3%的抗体稀释液,然后将其按照1∶100的比例稀释VAMP7和Vti1a的一抗,利用稀释后的一抗孵育2 h,PBS洗3次,每次10 min;然后再用稀释后的二抗 antirabbit IgGCy3(1∶200)孵育1.5 h,PBS洗3 次;在避光环境中,将清洗后的白背飞虱肠道固定于载玻片上,利用激光共聚焦显微镜(LSM TPMT, Germany)观察VAMP7和Vti1a的定位情况。
2 结果与分析
2.1 白背飞虱VAMP7和Vti1a基因的克隆
利用PCR获得VAMP7和Vti1a的目的片段(图1),其中VAMP7基因为651 bp,Vti1a基因为669 bp。PCR产物切胶回收后与载体PEASYT5进行重组,获得中间载体PEASYT5VAMP7和PEASYT5Vti1a。转化大肠杆菌,阳性克隆测序后分别通过BLAST比对分析,基因同源性均可达99%以上。
2.2 载体构建与重组蛋白表达
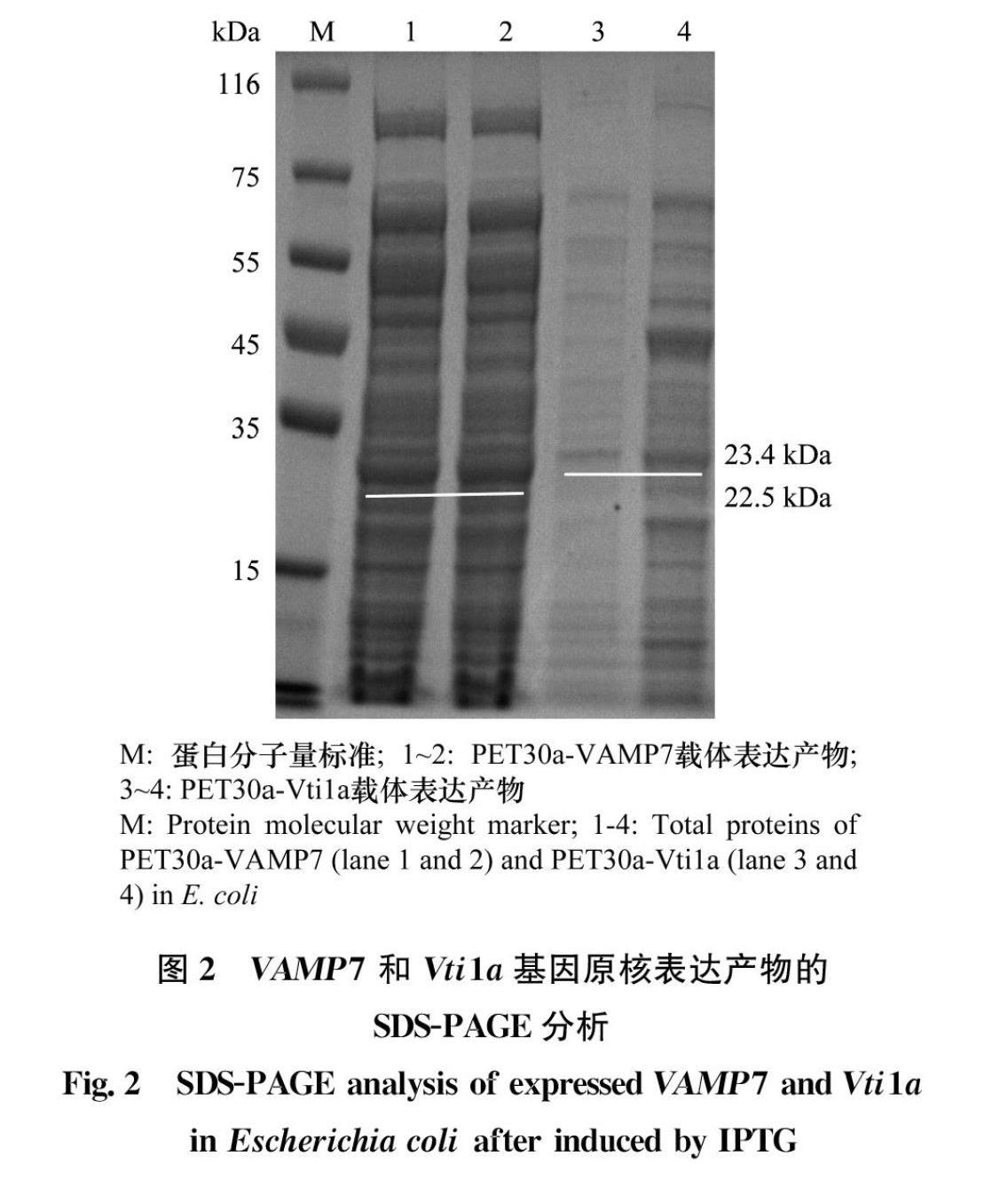
将目的载体PET30a与测序正确的中间载体进行LR重组,获得重组原核表达载体PET30aVAMP7和PET30aVti1a,然后将这两种原核表达载体分别转入大肠杆菌BL21(DE3)感受态细胞中,挑取单菌落于LB液体培养基中培养。在37℃、200 r/min条件下,IPTG诱导4 h后,利用SDSPAGE凝胶电泳检测蛋白表达情况。结果发现,目的蛋白已特异性表达,VAMP7和Vti1a蛋白大小分别为22.5 kDa和23.4 kDa,与预期的大小一致,而未诱导的菌液样品中未见目的条带(图2)。因为前期设计的VAMP7和Vti1a融合蛋白含有6×His标签序列,因此在Western blot检测中,选用6×His单克隆抗体特异性检测目的蛋白的表达情况。结果表明,抗体可分别与VAMP7和Vti1a的融合蛋白发生特异性反应(图3)。蛋白纯化中需利用可溶性的蛋白,因为外源基因在大肠杆菌中表达容易产生包涵体蛋白,因此本实验对获得的融合蛋白进行了检测,结果发现,诱导得到的融合蛋白为包涵体蛋白,需要进一步优化诱导条件,以获得可溶性蛋白。
2.3 可溶性蛋白的诱导及纯化
为获得可溶性蛋白,本试验进一步优化诱导条件:当菌液OD600为0.1时,向其中加入 IPTG 至终浓度为 0.1 mmol/L,将其置于16℃,100 r/min的条件下诱导过夜。超声波破碎诱导后的菌体,离心得上清和沉淀。利用SDSPAGE电泳分别对收集获得的上清和沉淀进行检测,结果表明,沉淀和上清中均含有目的蛋白。因沉淀中常存在包涵体蛋白,因此本研究选择回收纯化上清中的可溶性蛋白(图4),用于下一步的抗体制备。
2.4 抗体的制备及Western blot检测
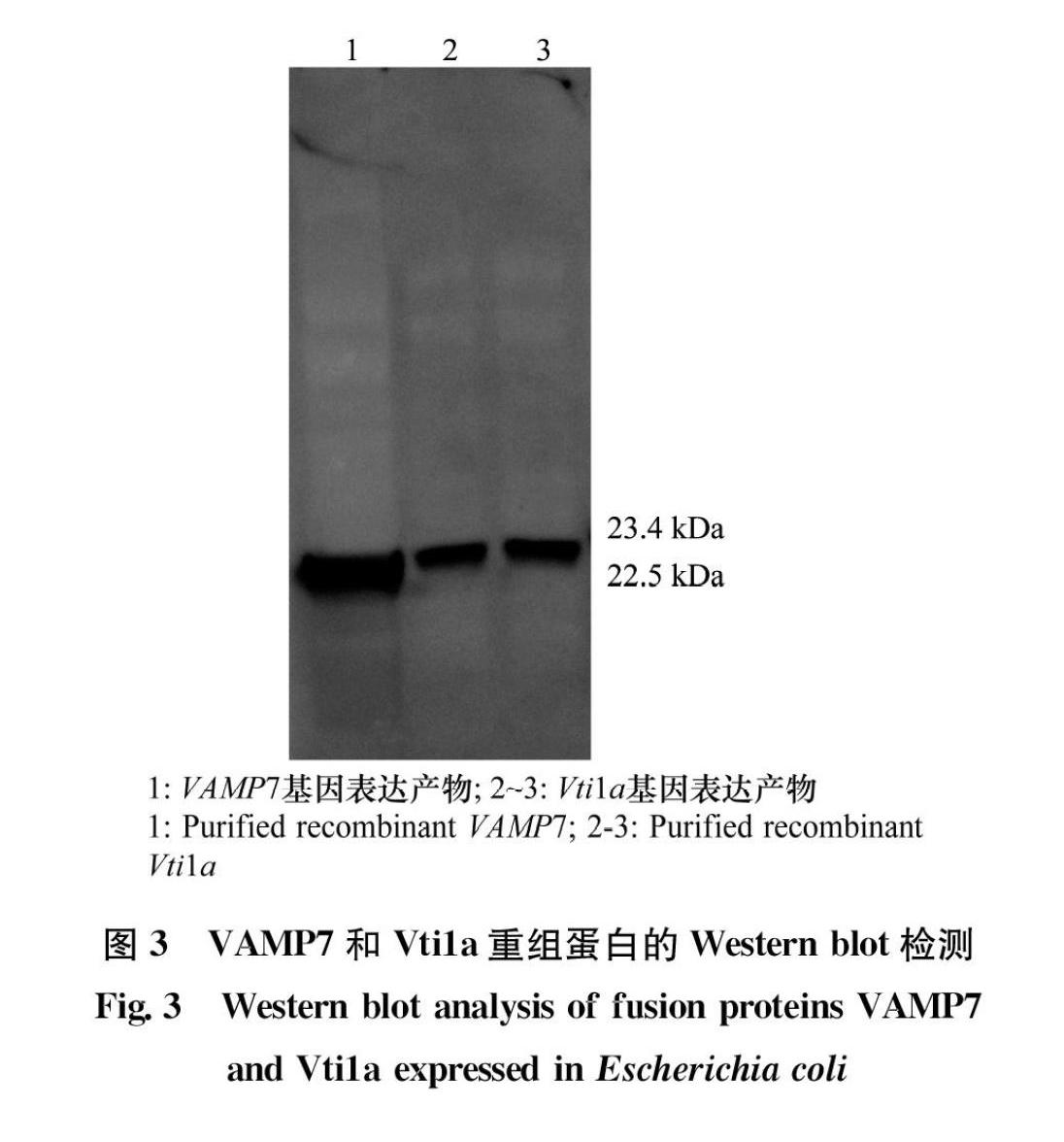
分别将纯化后的VAMP7和Vti1a多点免疫注射于新西兰公兔皮下,制备相应的抗血清。另外,提取白背飞虱的总蛋白,后将总蛋白通过SDSPAGE凝胶电泳转移至硝酸纤维素膜上,后将其置于含VAMP7和Vti1a一抗抗体(1∶4 000稀释)的抗体稀释液中孵育,以检测抗体特异性。Western blot分析结果显示,VAMP7和Vti1a的抗体分别与VAMP7和Vti1a的重组蛋白、白背飞虱总蛋白有特异性反应,产生1条22.5 kDa或23.4 kDa的条带,而与诱导的空载体未产生任何条带,说明制备的抗体具有特异性(图5)。
2.5 VAMP7与Vti1a在白背飞虱体内的分布
参照本实验室已有方法进行免疫荧光检测[12],对白背飞虱成虫肠道进行免疫荧光标记。经激光共聚焦显微镜观察发现,制备的抗体均可特异性地标记VAMP7(图6a,红色荧光标记)和Vti1a蛋白(图6b,红色荧光标记),说明制备的VAMP7和Vti1a抗体能够用于免疫荧光学分析,VAMP7和Vti1a均定位于白背飞虱的肠道上皮细胞内。
3 讨论
本研究利用重组技术将白背飞虱编码的VAMP7和Vti1a基因重组插入到原核表达载体PET30a,在大肠杆菌中成功表达了这两种蛋白。可溶性的重组蛋白经Ni2+NTA 亲和层析柱纯化后,作为抗原成功制备了具有较高特异性的多克隆抗体,为研究白背飞虱中这两种蛋白的功能奠定了基础。外源基因在大肠杆菌体内表达容易产生包涵体蛋白,这种状态的蛋白质不具有生物学活性且不易纯化回收。有研究表明,胞質内蛋白质生成速率会影响包涵体的形成,新多肽生成越快,浓度则越高,因高浓度的多肽没有充足时间进行折叠,导致形成了非结晶、无定形的蛋白质聚集体[13]。为降低蛋白质的合成速度,获得可溶性蛋白,本研究选择利用低浓度菌体,在低温和低转速条件下诱导。当菌液OD600达0.1时,加入IPTG至终浓度为0.1 mmol/L,在16℃、100 r/min的条件下继续诱导过夜,进而大大增强了大肠杆菌中VAMP7和Vti1a蛋白的可溶性表达,为最终蛋白质纯化和特异性抗体制备奠定基础。将纯化蛋白免疫于新西兰公兔,制备得到VAMP7和Vti1a抗体。经检测两种抗体特异性良好、性价比较高,为下一步研究白背飞虱VAMP7和Vti1a与SRBSDV或其他相关病毒的互作机制打下了基础。
白背飞虱是目前已知的唯一一种能够以持久增殖循回的方式传播SRBSDV的介体昆虫[23]。在白背飞虱取食过程中,病毒随汁液进入消化道,侵入肠道上皮细胞并在此复制,然后穿透基底膜后扩散入血液淋巴,继而到达唾液腺,再随唾液的分泌完成其传播过程,在整个循回过程中病毒与其昆虫介体内的多种蛋白会形成复杂多样的互作关系[14]。实验室前期发现白背飞虱的VAMP7和Vti1a分别可与SRBSDV的主要外层衣壳蛋白P10发生互作[5]。在树突结构细胞中,VAMP7定义了一种新的膜结构,并参与大多数细胞类型常见的运输途径[7],由此推测VAMP7和Vti1a可能参与到病毒在介体白背飞虱组织内的移动过程。利用VAMP7和Vti1a重组蛋白的抗体,我们发现VAMP7和Vti1a定位在介体白背飞虱肠道上皮细胞的胞质内,这也是SRBSDV复制和开始扩散的场所。有研究表明,在人体宫颈癌细胞中VAMP7和Vti1a蛋白能够组合形成一种SNARE复合体[15],VAMP7、Vti1a、syntaxin 5蛋白和 rBet1蛋白共同形成SNARE复合体,能够帮助囊泡由内质网向高尔基体转运,在这个过程中VAMP7和Vti1a蛋白能够自动恢复以备循环使用[16],我们推测,白背飞虱体内的VAMP7和Vti1a蛋白可能组成了一种SNARE复合体共同完成SRBSDV病毒粒体在介体肠道中的转运,而在此过程中SRBSDV粒体先与转运囊泡膜上的VAMP7结合,通过VAMP与靶标膜上的Vti1a蛋白特异性识别,将SRBSDV病毒粒体运输到特定的囊泡。因此,白背飞虱的这两种蛋白在其高效传播SRBSDV的过程中可能发挥重要的作用。
参考文献
[1] 沈君辉,尚金梅,刘光杰. 中国的白背飞虱研究概况[J].中国水稻科学,2003,17(增刊):722.
[2] 周国辉,温锦君,蔡德江,等. 呼肠孤病毒科斐济病毒属一新种:南方水稻黑条矮缩病毒[J]. 科学通报,2008,53(20):25002508.
[3] PU Lingling, XIE Guohua, JI Chuanyan, et al. Transmission characteristics of Southern rice blackstreaked dwarf virus by rice planthoppers [J]. Crop Protection, 2012, 41(6): 7176.
[4] LIU Wenwen, GRAY S M, HUO Yan, et al. Proteomic analysis of interaction between a plant virus and its vector insect reveals new functions of hemipteran cuticular protein [J]. Molecular & Cellular Proteomics, 2015, 14(8): 22292242.
[5] THAN W, QIN Faliang, LIU Wenwen, et al. Analysis of Sogatella furcifera proteome that interact with P10 protein of Southern rice blackstreaked dwarf virus [J/OL]. Scientific Reports, 2016, 6:32445.DOI:10.1038/srep32445.
[6] JAHN R, SCHELLER R H. SNAREsengines for membrane fusion [J]. Nature Reviews Molecular Cell Biology, 2006, 7(9): 631643.
[7] ADVANI R J, YANG Bin, PREKERIS R, et al. VAMP7 mediates vesicular transport from endosomes to lysosomes [J]. Journal of Cell Biology, 1999, 146(4): 765775.
[8] GALLI T, ZAHRAOUI A, VAIDYANATHAN V V, et al. A novel tetanus neurotoxininsensitive vesicleassociated membrane protein in SNARE complexes of the apical plasma membrane of epithelial cells [J]. Molecular Biology of the Cells, 1998, 9(6): 14371448.
[9] RAMIREZ D M O, KHVOTCHEW M, TRAUTERMAN B, et al. Vti1a identifies a vesicle pool that preferentially recycles at rest and maintains spontaneous neurotransmission [J]. Neuron, 2012, 73(1): 121134.
[10]EMPERADORMELERO J, TOONEN R F, VERHAGE M. Vti proteins: beyond endolysosomal trafficking [J]. Neuroscience, 2019, 420:3240.
[11]QIN Faliang, LIU Wenwen, WU Nan, et al. Invasion of midgut epithelial cells by a persistently transmitted virus is mediated by sugar transporter in its insect vector [J/OL]. PLoS Pathogens, 2018, 14(7): e1007201.DOI:10.1371/journal.ppat.1007201.
[12]WANG Yajiao, Mao Qianzhuo, LIU Wenwen, et al. Localization and distribution of wheat dwarf virus in its vector leafhopper, Psammotettix alienus [J]. Phytopathology, 2014, 104(8): 897904.
[13]方敏,黃华. 包涵体蛋白体外复性的研究进展 [J].生物工程学报,2001,17(6):608612.
[14]HOGENHOUT S A, AMMAR E D, WHITFIELD A E, et al. Insect vector interactions with persistently transmitted viruses [J]. Annual Review of Phytopathology, 2008, 46: 327359.
[15]FLOWERDEW S E, BURGOYNE R D. A VAMP7/Vti1a SNARE complex distinguishes a nonconventional traffic route to the cell surface used by KChIP1 and Kv4 potassium channels [J]. Biochemical Journal, 2009, 418(3): 529540.
[16]SIDDIQI S A, SIDDIQI S, MAHAN J, et al. The identification of a novel ER to Golgi SNARE complex used by the prechylomicron transport vesicle [J]. Journal of Biological Chemistry, 2006, 281(30): 2097420982.
(责任编辑:田 喆)

