利巴韦林抗酪氨酸酶活性及其在贡梨中的保鲜应用
邓维良,柴纬明,罗麟霜
(江西师范大学 生命科学学院,功能有机小分子教育部重点实验室,江西 南昌,330022)
酪氨酸酶(EC 1.14.18.1),又称为多酚氧化酶,广泛存在于植物、动物和微生物当中[1-2]。在植物当中,酪氨酸酶可催化酚类物质氧化生成醌类物质,再经过聚合作用形成引起褐变的色素物质[3-4]。在许多食品(如水果、果汁、蔬菜等)中,这一过程直接影响产品的自然外观和营养价值,进而降低产品的经济价值。因此,抑制酪氨酸酶活性,可有效减缓酶促褐变的发生,高效安全的酪氨酸酶抑制剂可以维持果蔬品质并延长其货架期。迄今为止,已有文献报道了部分酪氨酸酶抑制剂,但不论是天然的还是有机合成的化合物,安全性差、活性低、溶解性差等诸多原因限制了其在食品工业中的应用[5-6]。因此,寻找新型的酪氨酸酶抑制剂仍是当下食品领域的研究热点。
1,2,4-三唑是含有3个氮原子的五元芳香杂环化合物,其独特的富电结构使得其衍生物能够很好地与酶和生物受体相结合,从而表现出广泛的生物活性。研究表明1,2,4-三唑的衍生物能够有效地抑制酪氨酸酶活性,并且在芒果的保鲜过程中表现出良好的效果[7-9]。利巴韦林又称三氮唑核苷,化学名为1-β-D-呋喃核糖基-1H-1,2,4-三氮唑-3-羧酰胺,具有广谱的抗病毒活性,可用于治疗人的呼吸系统疾病[10]。然而,利巴韦林的抗酪氨酸酶活性及保鲜作用却从未被研究过。因此,在本研究中使用酶动力学实验、荧光淬灭实验、非辐射能量转移和分子对接等手段,探究利巴韦林对酪氨酸酶的抑制作用和抑制机理。此外,我们还对利巴韦林对贡梨的保鲜效果进行了初步研究。本论文的研究结果可为开发新型的果蔬保鲜剂提供理论依据和实践基础。
1 材料和方法
1.1 材料与仪器
蘑菇酪氨酸酶(比酶活力为6 680 U/mg)、L-3,4′-二羟基苯丙氨酸(L-3,4′-dihydroxyphenglalanine,L-DOPA),美国sigma公司;利巴韦林、人血清白蛋白(human serum albumin,HSA)、二甲基亚砜(dimethyl sulfoxide,DMSO),上海阿拉丁试剂公司;贡梨,超市;蒸馏水均为去离子重蒸水;其他试剂均为分析纯。
UD-730紫外分光光度计,美国Beckman公司;FluoroMax PLUS 荧光光谱仪,日本Horiba公司;VGT—1860Q超声波清洁仪,宁波新芝公司;NICO超纯水机,中国尼珂公司。
1.2 实验方法
1.2.1 利巴韦林对酪氨酸酶活性的抑制效果分析
以L-DOPA作为底物,研究利巴韦林对酪氨酸酶活性的抑制效果[11-12]。将利巴韦林溶解于DMSO,初始浓度为3 mmol/L,实验时分别稀释至0.15、0.2、0.25、0.3、0.35 mmol/L。在3 mL的反应体系中依次加入0.75 mL 0.1 mol/L磷酸钠缓冲液(pH 6.8)、0.3 mL 2 mmol/LL-DOPA、0.1 mL利巴韦林溶液和1.8 mL H2O,最后加入0.2 mg/L酪氨酸酶溶液,混匀后立即在475 nm波长下测定初始反应速率。以动力学曲线的初始斜率来表示酪氨酸酶的活性,按照公式(1)计算酪氨酸酶的相对活性。IC50为酶活性被抑制一半(酶的相对活性为50%)时的抑制剂浓度,IC50越低表明抑制剂对酶的抑制作用越强。

(1)
式中:Us,实验组(含有不同浓度的利巴韦林)的酶活性;Uc,对照组(不含利巴韦林)的酶活性。
1.2.2 利巴韦林对酪氨酸酶的抑制动力学分析
在以上抑酶效果测定体系中,保持底物L-DOPA的浓度不变,改变酪氨酸酶的加入量。通过酶促反应速率对酪氨酸酶质量浓度作图来判断利巴韦林对酪氨酸酶活性的抑制机制。
在同样的测定体系中维持酪氨酸酶的浓度不变,改变体系中L-DOPA的浓度,测定酶促反应速率。利用Lineweaver-Burk方程进行双倒数作图,根据直线交点的位置来判断利巴韦林对酪氨酸酶活性的抑制类型[13]。用不同直线的斜率对利巴韦林浓度进行二次作图,可求得利巴韦林对游离酶的抑制常数KI。
1.2.3 荧光淬灭实验
利巴韦林对酪氨酸酶的荧光淬灭实验参照CHAI等[14]的方法。采用Stern-Volmer方程[15]对荧光淬灭的数据进行分析,如公式(2)所示:
(2)
式中:F和F0分别是酪氨酸酶在有无利巴韦林存在时的荧光强度;Ksv,Stern-Volmer淬灭常数;Kq,生物分子淬灭速率常数;[c],利巴韦林的浓度;τ0为荧光分子的平均寿命,约为10-8s。此外,对于静态淬灭过程,结合位点的数量n和表观结合常数KA可以通过公式(3)进行计算[16]:
(3)
1.2.4 非辐射能量转移分析
参照HUANG等[17]的方法,以HSA为标准测量酪氨酸酶的荧光量子产率。利用紫外分光光度计测定利巴韦林(0.4 mol/L)在300~500 nm的紫外吸收光谱,根据利巴韦林的紫外吸收光谱和酪氨酸酶的荧光发射光谱的重叠面积,可计算出利巴韦林与酪氨酸酶作用过程中的能量转移效率E和结合距离r,按照公式(4)~(6)[18]进行计算:
(4)
R6=8.79×10-25N-4K2Jφ
(5)
(6)
式中:R0,Förster距离;F和F0分别为有无利巴韦林存在时酪氨酸酶的荧光强度,F(λ),在波长λ处的荧光强度;N,介质的平均折射率,值为1.336;K2,空间取向因子,值为2/3;ε(λ)是利巴韦林在波长λ处的摩尔吸光系数;φ,酪氨酸酶的荧光量子产率;J,酪氨酸酶的荧光光谱和利巴韦林紫外吸收光谱的重叠积分。
1.2.5 分子对接
从RCSB蛋白数据库(http://www.rcsb.org/)和Pubchem(https://pubchem.ncbi.nlm.nih gov/)中获得蘑菇酪氨酸酶(PDB entry 2Y9W)和利巴韦林(CID 37542)的晶体结构。对接前除去酪氨酸酶中的溶剂水分子和铜原子,使用 Autodock 4.2进行分子对接,选择结合能量最低的构象作为最终结果[14]。
1.2.6 利巴韦林对贡梨的保鲜效果
选择形状、颜色、大小和成熟度均相同,无任何损伤的贡梨。将其经去皮处理后,切成形状和大小相同、厚度5 mm左右的梨块,在不同浓度的利巴韦林溶液中浸泡10 min后装入聚乙烯袋中,置于15 ℃、相对湿度为80%的培养箱中贮藏[19]。每天称量梨块的质量,并按照公式(7)计算失重率:
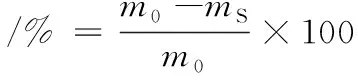
(7)
式中:m0为初始梨块质量,g;ms为每天测量的梨块质量,g。
参照LIU等[20]的方法,使用贡梨梨汁来研究利巴韦林的抗褐变效果。将贡梨去皮处理后切成质量为10 g的梨块,用不同浓度的利巴韦林溶液浸泡10 min后研磨成匀浆,4 ℃下8 000 r/min离心5 min,收集上清液3 mL。梨汁置于15 ℃、相对湿度为80%的培养箱中贮藏。用紫外分光光度计每天测量梨汁在420 nm处的吸光度值,每次测量重复3次。
1.2.7 数据统计
所有实验平行重复3次,实验数据以平均值±标准差的形式表示。使用Duncan多重比较法检验数据之间的差异显著性(P<0.05)。采用Origin 2017软件进行数据处理、绘图和曲线拟合。
2 结果与讨论
2.1 利巴韦林对酪氨酸酶的抑制效果
如图1所示,随着利巴韦林浓度的增加,酪氨酸酶的相对活性逐渐降低,其导致酪氨酸酶活力下降至一半的浓度(IC50)为(0.3±0.05)mmol/L;当利巴韦林浓度达到0.4 mmol/L时,酶的相对活力下降到26.8%。以上结果说明利巴韦林能够有效抑制酪氨酸酶的活性,与目前已经报道的酪氨酸酶抑制剂,如阿莫西林[12](IC50= 0.9 mmol/L)、熊果苷[21](IC50= 2.7 mmol/L)相比,利巴韦林是一种相对高效的酪氨酸酶抑制剂。

图1 利巴韦林对酪氨酸酶的抑制效果Fig.1 Inhibitory effect of ribavirin on tyrosinase
2.2 利巴韦林对酪氨酸酶的抑制机理分析
抑制机理分析的结果表明:在不同浓度利巴韦林存在下,酪氨酸酶活性对酶质量浓度作图得到一组过坐标原点的直线(图2)。随着利巴韦林浓度的增加,直线1~6的斜率逐渐下降,这说明利巴韦林对酪氨酸酶的抑制作用是一个可逆的过程,并没有降低酪氨酸酶的总量,而仅仅是抑制了酪氨酸酶的催化活性。
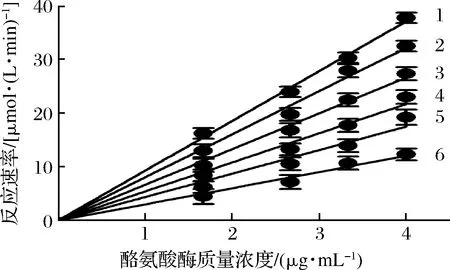
图2 利巴韦林对酪氨酸酶的抑制机制Fig.2 Inhibitory mechanism of ribavirin on tyrosinase注:直线1~6利巴韦林浓度分别为0、0.15、0.2、0.25、0.3、0.35 mmol/L
2.3 抑制类型和抑制常数分析
采用Lineweaver-Burk方程来判断利巴韦林对酪氨酸的抑制类型。以酶促反应速率倒数1/v对底物浓度倒数1/S作图,其结果如图3-a所示。随着利巴韦林浓度的增大,直线斜率逐渐增大,且所有直线均相交于纵轴,这表明利巴韦林是一种竞争型的酪氨酸酶抑制剂,可以与底物L-DOPA竞争酶的活性中心。此外,以直线斜率对利巴韦林浓度进行二次作图,得到一条具有良好线性关系的直线(图3-b),这表明利巴韦林在酪氨酸酶上只有一个或者一类结合位点,通过计算得到抑制常数KI为(0.144±0.02) mmol/L。
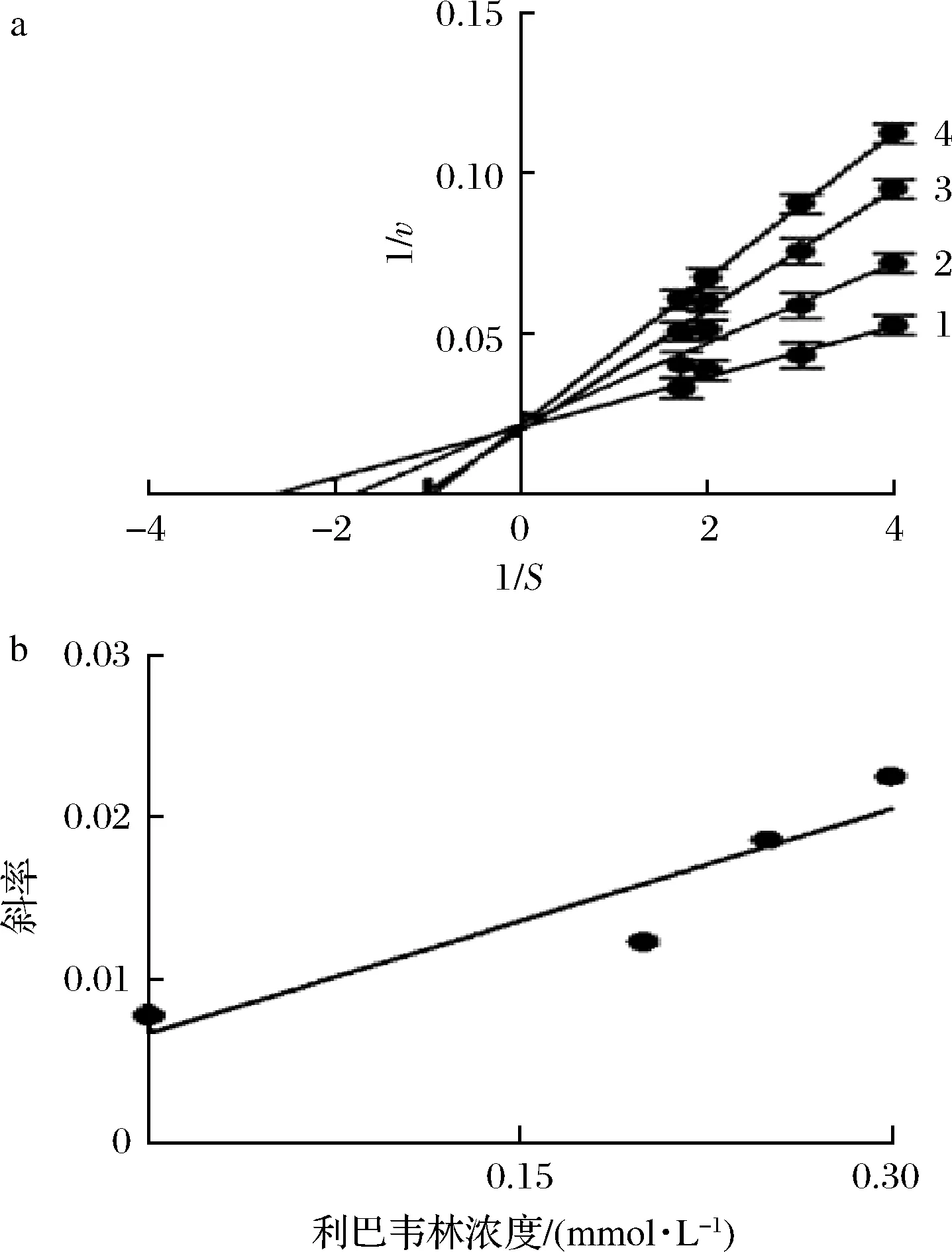
a-抑制类型;b-抑制常数图3 利巴韦林对酪氨酸酶的抑制类型和抑制常数Fig.3 Inhibitory type and inhibition constant of ribavirin on tyrosinase注:直线1~4的利巴韦林浓度分别为0、0.15、0.2、0.3 mmol/L
2.4 荧光淬灭分析
如图4-a所示,曲线7代表5 μmol/L利巴韦林的荧光发射光谱,曲线1~6对应的利巴韦林浓度分别为0、0.5、1、2、3和5 μmol/L,以及酪氨酸酶的荧光发射光谱。结果表明,随着利巴韦林浓度的增加,酪氨酸酶的荧光强度显著下降(P<0.05),当利巴韦林的浓度为5 μmol/L时,酪氨酸酶荧光发射光谱的峰值降低到59.8%(图4-b),这说明利巴韦林可有效淬灭酪氨酸酶的内源荧光。KIM等[22]的研究发现,抑制剂中的羟基是淬灭酶内源荧光的主要基团,进而推测利巴韦林主要通过其呋喃环上的羟基与酪氨酸酶发生作用从而淬灭酶的荧光。此外,随着利巴韦林浓度的增加,酪氨酸酶发射荧光光谱的峰值发生了明显的红移(由325 nm变为335 nm),这表明利巴韦林可通过与酪氨酸酶的相互作用导致酶构象的改变[23]。
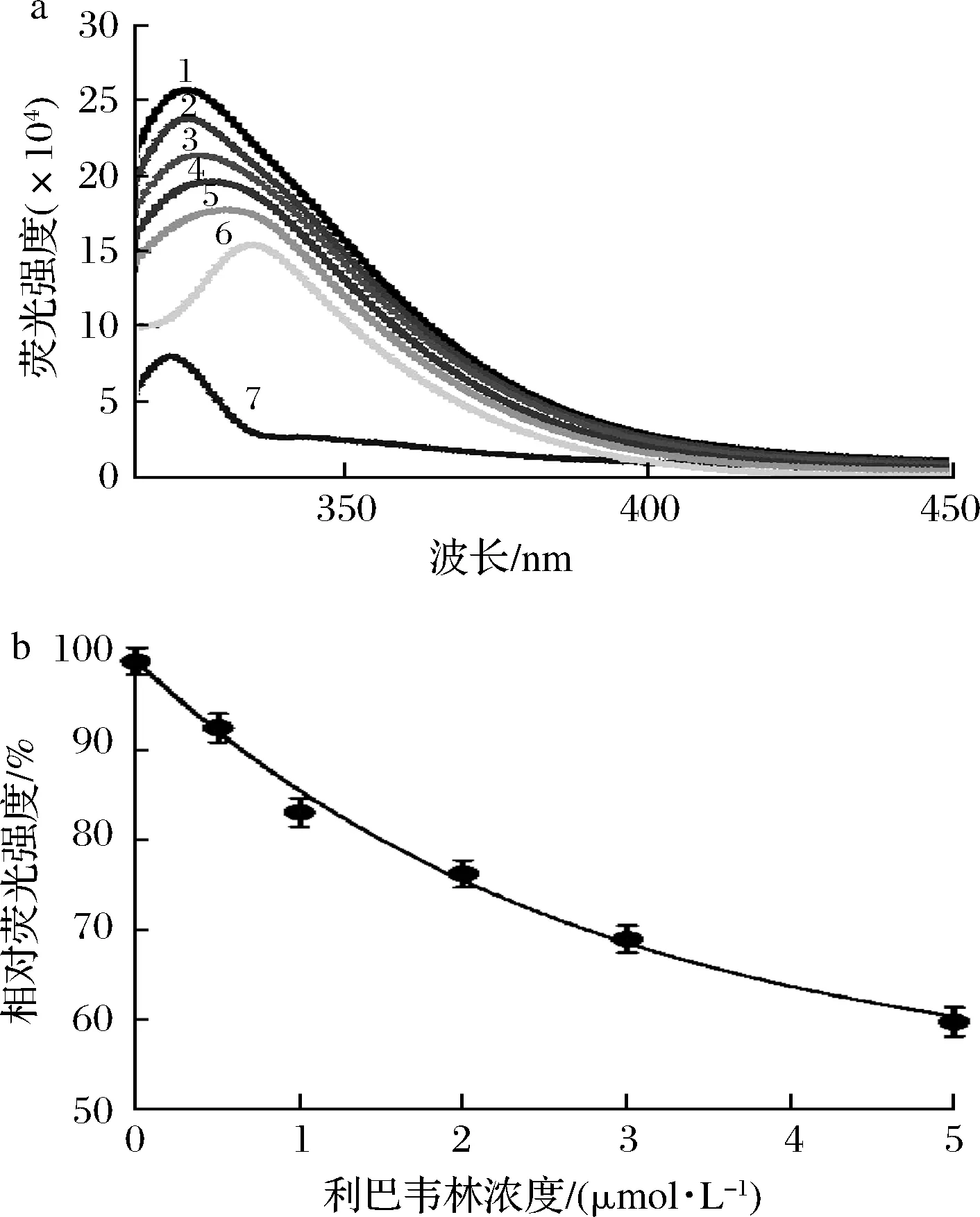
a-酪氨酸酶荧光光谱图;b-酪氨酸酶相对荧光强度变化图4 荧光淬灭实验结果Fig.4 Results of fluorescence quenching experiment注:曲线1~6的利巴韦林浓度分别为0、0.5、1、2、3、5 μmol/L,曲线7为5 μmol/L利巴韦林溶液的荧光光谱
本研究采用Stern-Volmer方程对淬灭结果进行分析,如图5-a所示,F0/F对利巴韦林浓度[c]作图得到了一条具有良好线性关系的直线,这表明利巴韦林对酪氨酸酶的淬灭机制只有1种[24]。根据公式(2)可进一步计算出淬灭速率常数Kq的值为1.27×1013L/(mol·s),这比最大散射碰撞淬灭常数2.0×1010L/(mol·s)高出3个数量级[25]。以上结果表明利巴韦林淬灭酶荧光的机制为静态淬灭。
对于静态淬灭,可根据公式(3)计算出表观结合常数KA和结合位点数n。以lg[(F0-F)/F]对lg[c]作图,根据所得直线(图5-b)的斜率和截距,计算得到KA和n分别为(16.29±0.94)×104L/mol和0.92±0.04。其中,结合位点数n约等于1,表明利巴韦林在酪氨酸酶只存在1个结合位点。
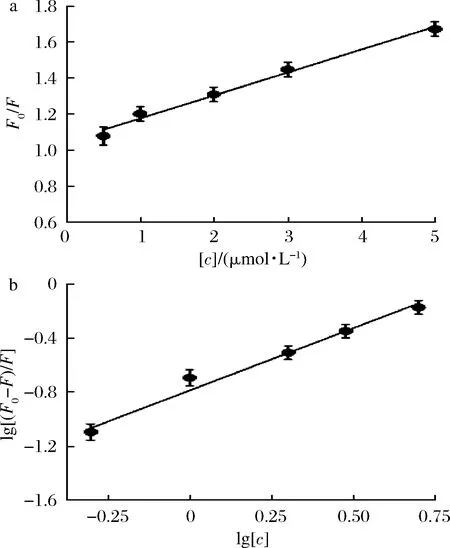
a-Stern-Volmer 方程绘图曲线;b-lg[(F0-F)/F]对lg [c]线性回归曲线图5 Stern-Volmer 方程绘图曲线和lg [(F0-F)/F] 对lg [c]线性回归曲线Fig.5 Stem-Volmer plot of fluorescence quenching and the plot of lg[(F0-F)/F] against lg [c]
2.5 非辐射能量转移分析
以HSA为对照,测得酪氨酸酶的荧光量子产率为0.06。酪氨酸酶荧光发射光谱与利巴韦林紫外吸收光谱重叠如图6所示。通过公式(6)计算出重叠积分J为4.96×10-19(cm3·L)/ mol。根据公式(4)和(5)分别计算出能量转移效率E等于0.4,结合距离r和临界距离R0分别为1.15 nm和1.08 nm,其中0.5R0 1-酪氨酸酶荧光光谱;2-利巴韦林吸收光谱图6 酪氨酸酶荧光光谱和利巴韦林吸收光谱的重叠面积Fig.6 The overlap of fluorescence spectrum of tyrosinase and the absorption spectrum of ribavirin 对接结果如图7所示,图7-a显示了利巴韦林和酪氨酸酶活性中心的结合模式,可以看出利巴韦林能够很好地嵌入到酪氨酸酶的活性口袋。进一步分析了利巴韦林与酪氨酸酶活性口袋处的氨基酸残基的结合情况,从图7-b可以看出,利巴韦林呋喃环上所连接的羟基,可与和酪氨酸酶B链上Lys379、Glu356、Gln307形成氢键,测得间距分别为0.21、0.3、0.22 nm。而连接在1,2,4-三唑杂环上的羧酰胺基,则与B链的Asp312、Val313、Asn310形成氢键,其间距分别为0.2、0.23和0.23 nm。分子对接的结果表明,利巴韦林可以强有力地结合到酪氨酸酶的活性中心,并与周围的氨基酸残基形成氢键。 a-酪氨酸酶和利巴韦林对接模型;b-利巴韦林和酪氨酸酶氨基酸残基形成氢键图7 利巴韦林(蓝色)和酪氨酸酶分子对接结果Fig.7 Molecular docking results of ribavirin and tyrosinase 不同浓度的利巴韦林对贡梨鲜切梨块和梨汁的保鲜作用如图8所示,其中曲线1~5的利巴韦林浓度依次为0、0.04、0.2、0.4和0.8 mmol/L。 a-利巴韦林对鲜切梨块失重率的影响;b-利巴韦林对梨汁褐变度的影响图8 利巴韦林对贡梨的保鲜效果Fig.8 Effect of ribavirin on the preservation of Gong pear注:曲线1~5的利巴韦林浓度为0、0.04、0.2、0.4、0.8 mmol/L 由图8可知,随着贮藏时间的延长,梨块的失重率和梨汁的褐变度均呈上升趋势。但随着利巴韦林浓度的增加,相较于空白对照组,梨块的失重率和梨汁的褐变程度均显著下降(P<0.05),当利巴韦林浓度为0.8 mmol/L时,梨块的失重率减小至对照组的44.8%。由此可知,利巴韦林在贡梨保鲜过程中能够显著降低失重率和减少褐变产物的生成。LIN等[19]的研究发现,奥美拉唑可有效抑制鲜切苹果中的多酚氧化酶活性,从而抑制褐变的发生。由此,可推测利巴韦林可抑制贡梨当中的多酚氧化酶活性,从而减缓贡梨当中酚类物质的氧化。 利巴韦林是一种高效的酪氨酸酶抑制剂,其IC50为(0.3±0.05)mmol/L,且利巴韦林抑制酪氨酸酶属于可逆、竞争性抑制。利巴韦林可与酪氨酸酶通过1个结合位点形成“利巴韦林-酶”静态复合物,从而淬灭酪氨酸酶的内源荧光,这一过程伴随着非辐射能量转移和酶构象的改变。利巴韦林可嵌入到酪氨酸酶的活性口袋并与周围的6个氨基酸残基形成氢键。利巴韦林对于贡梨具有很好的保鲜效果,能够有效地降低鲜切梨块的失重率和梨汁的褐变程度。本论文的研究结果为开发新型的果蔬保鲜剂提供了理论依据和实践基础。
2.6 分子对接分析

2.7 贡梨保鲜实验

3 结论

