中山市白纹伊蚊现场种群击倒抗性基因检测分析
杨罗菊,刘德星,陈 健,魏晓雅,李婷婷,邱德义,刘环宇
白纹伊蚊(Aedesalbopictus)在我国广泛分布,是一种极具侵袭性的蚊虫,是登革热、黄热病及基孔肯雅热等虫媒病的重要传播媒介[1-2],已严重影响到我国公共卫生安全。目前对于蚊媒传染病最有效的预防和控制措施仍是降低蚊密度,包括减少孳生地和使用杀虫剂等对蚊虫进行消杀。自上世纪80年代起,由于有机氯和有机磷农药受到禁用或限用,拟除虫菊酯类杀虫剂已开始成为我国主要使用的杀虫剂之一[3-4],由于长期大范围使用,已造成我国多地的白纹伊蚊对拟除虫菊酯类杀虫剂产生不同程度的抗药性[5-10]。
蚊虫产生抗性的机制主要有靶标抗性、代谢抗性和行为抗性3种,其中靶标抗性是近几年来的研究热点[11-12]。蚊虫神经细胞膜上电压门控钠离子通道(Voltage-gated sodium channel,VGSC)是拟除虫菊酯类和DDT类杀虫剂的作用靶点,当其编码基因突变,相应的氨基酸发生改变会降低蚊虫对这一类杀虫剂的敏感性而产生抗性,故称为靶标抗性,又称为击倒抗性(Knockdown resistance,kdr)[13-14]。自2011年Kasai在新加坡采集的白纹伊蚊现场种群中首次发现与抗性相关的kdr基因突变F1534C以来[15],随后在中国广东、海南和云南[5,16-18]等多地的白纹伊蚊中也被检测出来,但是在对广东地区的白纹伊蚊种群的抗性研究中多数集中在广州和深圳等地区[5,18],缺乏对中山市白纹伊蚊击倒抗性基因突变和抗药性现状的研究。此外,很多生物测定结果表明对于同种杀虫剂,雄蚊比雌蚊敏感[19],已有研究表明部分抗性基因在雌雄蚊之间存在差异表达[20],但造成雌雄蚊抗性差异的原因尚未完全阐明。本研究对广东省中山市雌性白纹伊蚊现场种群的kdr基因进行检测,了解当前中山市白纹伊蚊击倒抗性基因的突变情况,并将雌雄蚊的分子检测数据进行对比,了解当地白纹伊蚊种群对拟除虫菊酯类杀虫剂的抗药性现状,检验不同性别白纹伊蚊之间的kdr基因突变是否存在差异,为当地科学使用杀虫剂和虫媒病防制提供依据。
1 材料与方法
1.1材 料
1.1.1供试蚊虫 2019年8月至11月,在广东省中山市多年持续使用拟除虫菊酯类杀虫剂灭蚊的5个生境采集白纹伊蚊幼虫及蛹,实验室饲养至成蚊,经形态学鉴定,挑选羽化后3~5 d的白纹伊蚊成蚊进行击倒抗性基因检测。5个采样点及其所属的生境分别为:大尖山森林公园(DJ种群)为半原始状态公园,植被丰富,天然水容器较多,且杀虫剂使用较少;中山海关技术中心(HG种群)为办公区,广东药科大学(GY种群)为城乡结合部,2个采样点人流量较大,定期会进行蚊虫消杀;三溪村(SX种群)为城中村,生活环境较差,峰景花园小区(FJ种群)为居民区,人群较为密集,积水容器多,拟除虫菊酯类杀虫剂使用频率较高。实验室饲养条件为温度(25±1)℃,光周期14L∶10D,相对湿度60%~80%。
1.1.2主要仪器 PCR仪(美国Thermo fisher公司)、电泳仪、电泳槽、凝胶成像仪、离心机、不同量程的移液枪等。
1.1.3主要试剂 血液和组织 DNA 提取试剂盒(型号:DP304-02)购自天根生化科技有限公司,dNTP 、r-TaqDNA 聚合酶等购于大连宝生物有限公司,引物由 Invitrogen 公司合成。
1.2方 法
1.2.1白纹伊蚊基因组DNA提取 经形态学鉴定白纹伊蚊雌雄蚊,采用羽化3~5 d成虫,按照试剂盒说明书提取单只蚊虫基因组DNA。
1.2.2Kdr基因扩增和测序 以白纹伊蚊基因组DNA为模板,白纹伊蚊VGSC基因片段扩增引物序列:正向aegSCF7 5′—GAGAACTCGCCGATGAACTT—3′,反向aegSCR8 5′—TAGCTTTC-AGCGGCTTCTTC—3′[15]。PCR扩增体系:dNTP 2 μL,10×PCR Buffer 5 μL,上、下游引物(10 μL/L)各1 μL,rTaq酶0.5 μL,加ddH2O补至50 μL。PCR反应条件:94 ℃ 2 min;94℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 8 min。PCR产物经1%琼脂糖凝胶电泳检测,将出现目的条带且条带清晰明亮的样品送至上海立菲公司测序,测序引物同扩增引物。
1.2.3序列比对和统计学分析 将所得序列在NCBI数据库进行比对,用Primer Premier 5.0和MEGA6.0 软件对序列进行比对和峰图分析,分析基因突变情况。使用SPSS 19.0软件,应用χ2检验比较不同性别成蚊kdr基因突变的差异。检验水准为α=0.05。
2 结 果
2.1单蚊基因组DNA提取及扩增 将5个生境采集的雌蚊276只,雄蚊293只,共569只白纹伊蚊分别提取基因组DNA,扩增后成功获得569 个VGSC基因片段,
2.2kdr基因的等位基因和基因型 将获得的白纹伊蚊基因序列在NCBI上进行BLAST比对,与白纹伊蚊VGSC基因domainsⅢ编码区(KC152046.1)部分序列一致性达99.00%,长度约为400 bp。
对获得的276只雌性白纹伊蚊kdr基因序列进行比对分析,发现1 532位点未出现突变,1 534位点存在突变。1 532位点仅有一种等位基因类型,即野生型ATC/I(100%);一种基因型,即野生型纯合子I/I(100%)。1 534位点共有5种等位基因,即野生型TTC/F(22.46%),突变型TTG/L(55.80%)、TCC/S(14.13%)、TCG/S(7.25%)和TGC/C(0.36%);8种基因型分别为野生型纯合子F/F(1.81%),野生突变型杂合子F/L(23.55%)、F/S(17.39%)和F/C(0.36%),突变型纯合子L/L(38.05%)和S/S(6.52%),突变型杂合子L/S(11.96%)和L/C(0.36%),详见表1。
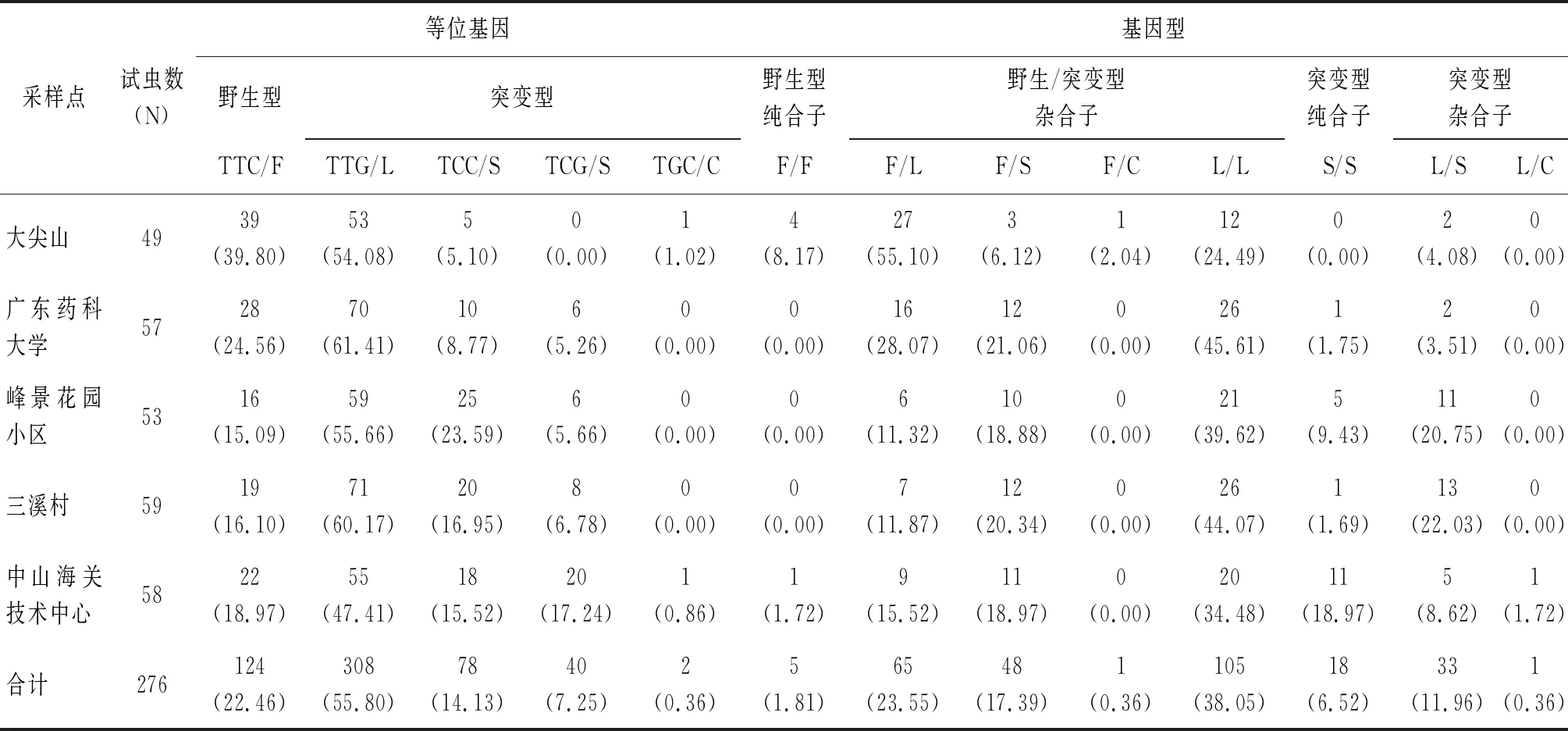
表1 中山市白纹伊蚊雌蚊现场种群kdr基因1 534位点的等位基因和基因型
2.3不同生境kdr基因的等位基因和基因型及其频率 在5个生境中发现1 532位点尚未突变,等位基因均为野生型ATC/I,基因型为I/I。1 534位点在各个生境中均出现不同程度的突变,突变类型也较多。5个白纹伊蚊现场种群雌蚊的1 534位点的突变情况见图1。5个采样点的等位基因均以突变型TTG/L为主,突变率从高到低依次为GY种群(61.41%)、SX种群(60.17%)、FJ种群(55.66%)、DJ种群(54.08%)、HG种群(47.41%);其次为野生型TTC/F,DJ种群的野生型等位基因频率最高39.80%;突变型TCC/S和TCG/S的频率较低,其中在突变型TCC/S中,以FJ种群和SX种群突变率最高,分别为23.59%和16.95%,其次HG种群和GY种群,分别为15.52%、8.77%,DJ种群最低为5.10%;HG种群的等位基因突变型TCG/S突变率最高,为17.24%,其次SX种群、FJ种群和GY种群的突变率相近,分别为6.78%、5.66%、5.26%,DJ种群未发现此种类型突变;仅在DJ种群和FJ种群发现等位基因突变型TGC/C,分别为1.02%和0.86%。
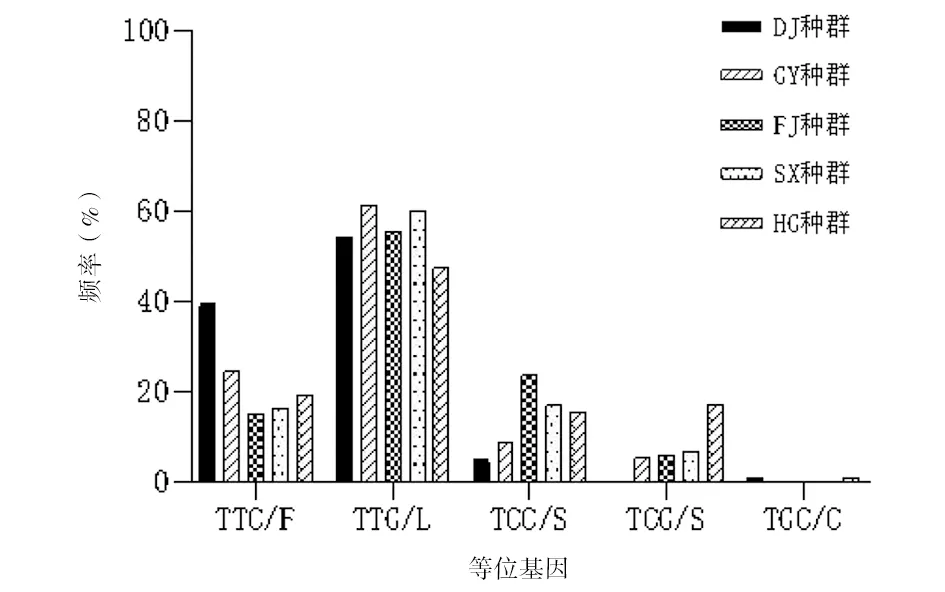
图1 中山市白纹伊蚊现场种群雌蚊kdr基因1 534位点等位基因的类型和频率
在中山市5个生境的白纹伊蚊雌蚊中,基因型的突变情况见图2。在DJ种群中,以野生型杂合子F/L(55.10%)为主,其次是突变型纯合子L/L(24.49%);在其余4个种群中,均以L/L为主,分别为45.61%、39.62%、44.07%和34.48%。野生型杂合子F/C和突变型杂合子L/C频率较少,仅在DJ种群存在F/C(2.04%),L/C只出现在采样点HG种群(1.72%)。在5个生境中,野生型纯合子只在DJ种群(8.17%)和HG种群(1.72%)存在,其余3个种群中均未发现无野生型纯合子。
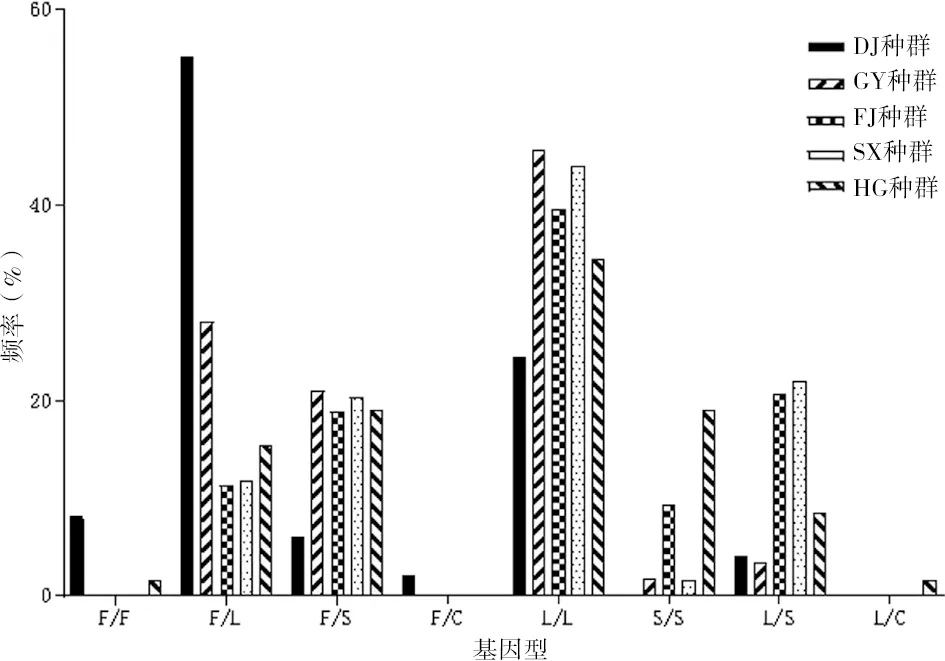
图2 中山市白纹伊蚊现场种群雌蚊kdr基因1 534位点基因型的类型和频率
2.4白纹伊蚊kdr基因突变的性别差异 本研究共测试了雌蚊276只,雄蚊293只。在雌蚊现场种群中,kdr基因1 534位点的野生型(野生纯合子)和突变型(含突变型杂合子和突变型纯合子)分别为6只和270只;在雄蚊中野生型和突变型分别为10只和283只。 采用χ2检验,对不同性别白纹伊蚊的1 534位点的kdr基因型进行比较,结果显示,雌蚊和雄蚊的kdr基因型的差异无统计学意义(χ2=0.798,P>0.05)。1 532位点不存在突变型,均为野生型纯合子。
3 讨 论
目前国内已有白纹伊蚊现场种群的kdr基因1 532位点和1 534位点突变的一些研究[5,9,16],1 532位点共有2种等位基因,即野生型 ATC/I 和突变型 ACC/T,此种突变在上海市、江苏省南京市、云南省景洪市和瑞丽市、江西省南昌市、山东省济宁市[5,17,21-23]等地的白纹伊蚊种群中均有检测到,但本研究未检测到1 532位点突变,这与赵春春2019年在广州种群的检测结果一致[5]。在本次研究检测的5个采样点的白纹伊蚊中1 534位点突变普遍存在,共5种等位基因,包括1种野生型TTC/F和4种突变型TTG/L、TCC/S、TCG/S、TGC/C。其中以等位基因TTG/L频率最高,突变频率范围为47.41%~61.41%;其次为TCC/S,突变频率范围为5.10%~32.76%;TCG/C等位基因突变频率最低,仅在DJ种群(1.02%)和HG种群(0.86%)存在。在5个采样点中,DJ种群和HG种群存在野生型纯合子F/F,且DJ种群野生型纯合子F/F含量较高(8.17%),而HG种群此种基因型频率较低(1.72%),其余采样点均已突变无该野生型存在,这可能与DJ种群的环境更接近原始状态,用药较少,其他采样点用药较为频繁有关。以上信息均提示当地白纹伊蚊对拟除虫菊酯类杀虫剂已经产生抗药性。1 534位点较1 532位点突变频率高,突变类型多样,这与2016年Xu[24]在广东深圳、广州种群检测到的结果相似。很多研究显示,我国多个地区的白纹伊蚊kdr基因1 534位点已发生突变,但各地区白纹伊蚊1 534位点的各等位基因的突变频率不尽相同,比如在云南省瑞丽市和景洪市[22-23]、海南省海口市[16]和广东省深圳市[24]等地的白纹伊蚊中,均以突变型TCC/S为主,而在本研究检测的中山种群和Xu等[24]检测的广州种群中却以TTG/L为主,这可能是由于各地区使用杀虫剂的种类、使用时间和强度不同,引起基因突变的多态性,再经选择压力和遗传,导致各地区1 534位点等位基因突变的优势类型存在差异。此外,本研究分析kdr基因突变时,使用采集的幼虫和蛹在实验室孵化成成虫并区分雌雄蚊,避免了因蚊虫发育阶段不同和雌雄不一致对测定结果产生影响,使结果更具可靠性。
许多生物测定表明,雌雄蚊的抗药性水平存在差异,对同一种类杀虫剂,雄蚊比雌蚊敏感[19]。本研究结果显示,不同性别白纹伊蚊的kdr基因1 534位点突变率无统计学差异,提示kdr基因1 534位点突变引起的蚊虫抗药性可能不是导致白纹伊蚊雌雄蚊抗性差异的主要原因。蚊虫产生抗药性的机制是多方面的,雌雄蚊的生理差异和外界环境等都会影响抗药性的产生,可能其他抗性机制在引起雌雄蚊抗性差异中贡献较大,如胡梦雪等对淡色库蚊的研究显示,与蚊抗性相关的基因乙酰葡萄糖胺水解酶蛋白基因和溶血磷脂酶基因在雌雄蚊中的表达存在两性差异[20],李士根等报道,在淡色库蚊中雌蚊乙酰胆碱酯酶活性大于雄蚊[21],但也不能排除击倒抗性机制在其中的作用。通过对白纹伊蚊抗药性的深入研究,从分子层面了解抗性机制,将有助于了解当地蚊虫的抗药性发展趋势,对制定更加完善的控蚊防疫措施具有重要意义。
利益冲突:无

