大豆GmGolS2-1基因高温胁迫诱导表达及转基因烟草鉴定
邱爽 张军 何佳琦 李铭杨 周雨明 邬长乐 袁洪淼 刘嘉仪 翟莹

摘要: 肌醇半乳糖苷合成酶(GolS)是棉籽糖系列寡糖(RFO)生物合成途径中的关键酶,在植物应对非生物胁迫过程中发挥重要作用。实时荧光定量RT-PCR结果显示,高温胁迫可以诱导GmGolS2-1在大豆幼苗中的表达。将GmGolS2-1基因构建到植物表达载体pRI101上并通过叶盘法转化烟草,经卡那霉素抗性筛选,PCR及qRT-PCR检测共获得6株阳性转基因烟草植株(OE1~OE6)。对野生型烟草植株和GmGolS2-1转基因烟草植株进行高温胁迫处理,结果显示野生型烟草的电解质渗透率和丙二醛含量均高于转基因烟草。由此推测GmGolS2-1可以提高转基因烟草的耐热性。
关键词: 大豆;肌醇半乳糖苷;GolS基因;高温胁迫;转基因烟草
中图分类号: S565.1 文献标识码: A 文章编号: 1000-4440(2021)01-0038-06
Expression of soybean GmGolS2-1 induced by heat stress and identification of GmGolS2-1 transgenic tobacco
QIU Shuang1, ZHANG Jun2, HE Jia-qi1, LI Ming-yang1, ZHOU Yu-ming3, WU Chang-le1, YUAN Hong-miao1, LIU Jia-yi1, ZHAI Ying1
(1.College of Life Science and Agro-Forestry, Qiqihar University, Qiqihar 161006, China;2.Branch of Animal Husbandry and Veterinary of Heilongjiang Academy of Agricultural Sciences, Qiqihar 161005, China;3.Jilin Zhongzhi Jiufang Consulting Co., Ltd., Changchun 130000, China)
Abstract: Galactinol synthase (GolS) is the key enzyme in the biosynthetic pathway of raffinose family oligosaccharides (RFOs), which plays an important role in the response to abiotic stresses of plants. The results of real-time fluorescence quantitative RT-PCR showed that the expression of GmGolS2-1 could be induced by high temperature stress in soybean seedlings. The GmGolS2-1 gene was constructed into expression vector pRI101 in plants and was transformed into tobacco using leaf disc method. Six positive transgenic tobacco plants (OE1-OE6) were obtained by kanamycin resistance screening, PCR and qRT-PCR. The wild-type and GmGolS2-1 transgenic tobacco plants were treated with heat stress. The results showed that the electrolyte leakage and malondialdehyde content of wild-type tobacco were both higher than that of transgenic tobacco. These data indicate that GmGolS2-1 can increase the tolerance to heat stress of transgenic tobacco.
Key words: soybean;galactinol;GolS gene;heat stress;transgenic tobacco
植物在遭受不良環境条件后,可以诱导合成大量渗透调节物质来增加植物细胞的渗透压,提高植物抵抗胁迫的能力,从而维持植物自身的代谢和生长发育。其中棉子糖系列寡糖(Raffinose family oligosaccharides, RFO)就是这些渗透调节物质的典型代表。它们是高等植物中含量仅次于蔗糖的一类可溶性糖,在逆境胁迫条件下可以维持细胞膨压,保持细胞稳定性,降低植物氧化性损伤,维持光合作用正常进行[1-3]。肌醇半乳糖苷合成酶(Galactinol synthase, GolS)是RFO生物合成途径中的关键酶,它所催化的UDP-半乳糖和肌醇合成肌醇半乳糖苷的反应既是RFO代谢通路中的第一步,也是限速步骤[4]。
GolS基因在植物中以多基因家族形式存在,不同GolS基因在抵御非生物胁迫过程中的作用也各不相同。拟南芥中含有7个GolS基因,其中AtGolS1和AtGolS2可以被干旱和高盐胁迫诱导上调表达,AtGolS3可以被低温胁迫诱导上调表达[5]。AtGolS1和AtGolS2过表达转基因植株中肌醇半乳糖苷和棉籽糖含量均增加,对氧化胁迫的耐受能力增强[6]。越来越多的研究结果显示,GolS基因在应对高温胁迫过程中同样发挥重要作用。AtGolS1是热激因子HSF3的调控靶基因,在高温胁迫下可以促进棉籽糖的合成[7]。葡萄VvGOLS1基因能够被高温处理上调表达[8]。高温和氧化胁迫可以诱导鹰嘴豆CaGolS1的表达,将其在拟南芥中过表达可以降低活性氧的积累从而提高转基因植株的耐热性[9]。
大豆作为一种重要的经济作物,其GolS基因的功能鉴定对于大豆RFO代谢途径及大豆抗逆机制的研究都具有重要意义。但到目前为止,有关大豆中GolS基因与高温胁迫反应之间的关系的研究尚未见报道。本研究对大豆GmGolS2-1基因在高温胁迫下的表达量进行检测,并将其转化烟草进行耐热性鉴定。
1 材料与方法
1.1 植物材料及高温胁迫处理
试验材料为齐齐哈尔地区广泛种植的大豆抗逆品种北豆9号。在Hoagland营养液中水培大豆幼苗,待大豆幼苗第一片三出复叶完全展开时进行高温胁迫处理:将大豆幼苗置于42 ℃培养箱中,分别在胁迫处理的0 h、1 h、2 h、5 h和10 h,剪取0.1 g第一片三出复叶并迅速置于液氮中,于-80 ℃超低温冰箱中保存,用于后续总RNA的提取。
1.2 实时荧光定量RT-PCR
使用RNAiso Plus试剂(TaKaRa公司产品)提取各样本的总RNA,通过琼脂糖凝胶电泳和OD260/OD280值检测提取RNA的质量。使用cDNA反转录试剂盒(Novoprotein公司产品)合成第一链cDNA。利用Primer 5软件设计GmGolS2-1(GenBank登录号:NM001354866)实时荧光定量RT-PCR引物。上游引物序列:5′-GCGGTGATGGATTGTTTCTG-3′;下游引物序列:5′-GTGGGCTTGGTGAGTTGGA-3′。使用大豆组成型表达基因β-Tubuin(GenBank登录号:GMU12286)作为内参基因,上游引物序列:5′-GGAAGGCT TTCTTGCATTGGTA-3′;下游引物序列:5′-AGTGGCATCCTGGTACTGC-3′)[10]。在BIO-RAD CFX96 Real-Time PCR仪设置反应程序如下:95 ℃预变性30 s;95 ℃ 5 s,58 ℃ 30 s,共循环40次。实时荧光定量RT-PCR反应体系如下:2×TB Green Premix Ex TaqⅡ(TaKaRa公司产品) 10.0 μl、cDNA 2.0 μl、上下游引物各0.8 μl,补充水至总体积20.0 μl。所有处理3次重复,采用2-△△Ct法计算基因的相对表达量。
1.3 植物表达载体的构建
使用限制性内切酶Nde I和EcoR I双酶切pMD18-T-GmGolS2-1重组质粒(本实验室前期构建)和植物表达载体pRI101,分别切胶回收酶切片段后利用Ligation kit 2.0(TaKaRa公司产品)进行连接。连接产物转化大肠杆菌DH5α,提取质粒进行双酶切验证。将验证后的重组载体质粒pRI101-GmGolS2-1转化农杆菌EHA105。
1.4 烟草遗传转化及筛选
通过农杆菌侵染叶盘法将重组载体pRI101-GmGolS2-1转化烟草NC89[11]。在含有50 mg/L卡那霉素的MS培养基上筛选烟草抗性苗。待烟草抗性苗生根后提取DNA作为模板,以pRI101-GmGolS2-1重组质粒作为阳性对照,野生型烟草叶片DNA作为阴性对照,对转基因抗性苗进行PCR检测。提取转基因及野生型烟草叶片RNA并进行反转录。使用烟草组成型表达基因α-Tubuin(GenBank登录号:AB052822)作为内参基因(上游引物序列:5′-ATGAGAGAGTGCATATCGAT-3′;下游引物序列: 5′-TTCACTGAAGAAGGTGTTGAA-3′)[10],目的基因引物同方法1.2 实时荧光定量RT-PCR中引物,对转基因烟草中的GmGolS2-1基因的表达量进行检测,实时荧光定量RT-PCR方法同1.2,每个株系3次重复。
1.5 转基因烟草耐热性检测
将营养钵中土培56 d的T1代转基因烟草植株置于42 ℃培养箱中进行高温处理。在处理48 h时进行相对电解质渗透率和丙二醛含量的检测。电解质渗透率测定:取0.1 g烟草叶片剪碎,加入5 ml去离子水浸泡1 h,测定电导率D1,之后置于沸水中10 min,冷却后测定电导率D2。相对电解质渗透率计算公式:D1/D2×100%。 丙二醛含量的测定参照Shao等[12]的方法进行。每个处理3次重复。
1.6 数据处理
數据的差异显著性分析采用Students t检验。
2 结果与分析
2.1 高温胁迫下GmGolS2-1的表达分析
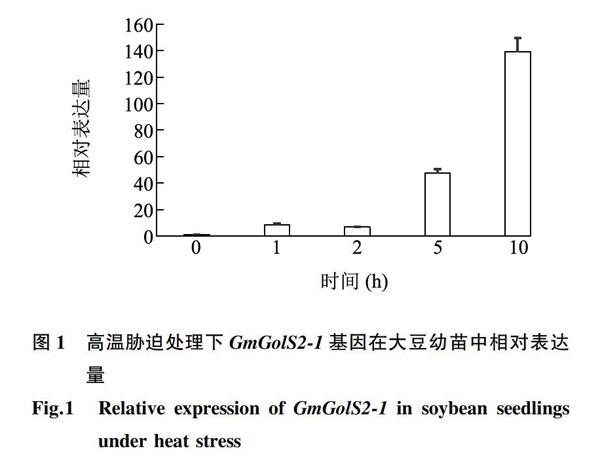
为了检测GmGolS2-1在大豆中是否能够响应高温胁迫,利用实时荧光定量RT-PCR对其高温胁迫下的表达动态进行分析。结果(图1)显示,GmGolS2-1的表达量随着高温处理时间延长逐渐升高,在处理10 h时达到最大值,是对照(0 h)的139倍。表明GmGolS2-1在大豆幼苗中能够响应高温胁迫,可能在大豆应对高温胁迫过程中发挥作用。
2.2 GmGolS2-1植物表达载体构建
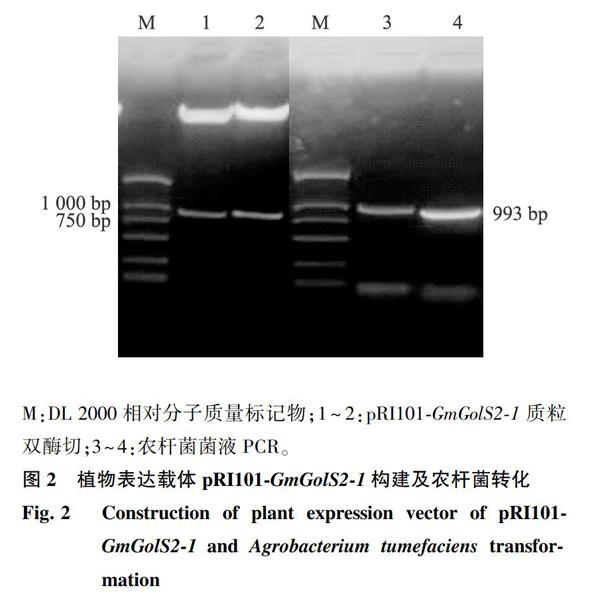
利用引物两端的限制性内切酶位点,构建GmGolS2-1植物表达载体。如图2所示,质粒双酶切鉴定结果表明GmGolS2-1已经整合进植物表达载体pRI101中。农杆菌菌液PCR鉴定结果(图2)显示已获得含有重组载体pRI101-GmGolS2-1的转基因工程菌。
2.3 GmGolS2-1转基因烟草的筛选及鉴定
烟草遗传转化如图3所示,在卡那霉素抗性培养基上筛选烟草愈伤组织(图3A),待抗性芽长至1 cm时(图3B)将其移入生根培养基中,待根系生长正常后(图3C)再移入土中正常培养。
PCR检测结果显示,共获得6株阳性转基因烟草植株,分别命名为OE1~OE6(图4A)。对转基因烟草植株中GmGolS2-1基因的表达量进行检测,野生型烟草中没有GmGolS2-1基因的表达,OE4植株中GmGolS2-1基因的表达量最高,其次是OE2植株,因此后续选择OE4和OE2植株进行耐高温胁迫鉴定(图4B)。
2.4 转基因烟草耐热性鉴定
高温胁迫处理后,OE2和OE4转基因烟草植株中的相对电解质渗透率均低于野生型烟草,且OE4达到显著程度(图5A)。丙二醛含量检测结果(图5B)显示,OE2和OE4转基因烟草植株与野生型烟草植株在未处理(0 h)时的丙二醛含量没有显著差异;高温胁迫处理48 h后,丙二醛含量均升高,但OE2和OE4转基因烟草植株中的丙二醛含量均低于野生型烟草植株,且OE4达到显著程度。以上结果表明,GmGolS2-1在烟草中的持续过表达可以减少高温胁迫对烟草细胞质膜完整性的破坏,提高转基因烟草的耐热性。
3 讨论
作物在生长发育过程中常常遭受各种逆境胁迫,其中高温可以对作物的生长发育造成不可逆转的影响,且高温常常伴随着干旱及各种病害的发生,是导致作物减产质量降低的主要因素之一。当植物遭受高温胁迫时,相关转录因子可以激活胁迫相关基因的表达。GolS是RFO生物合成起始的关键限速酶,它通过催化UDP-半乳糖和肌醇反应合成肌醇半乳糖苷,再以此为供体,在棉籽糖合成酶和水苏糖合成酶的作用下将蔗糖合成棉籽糖和水苏糖等寡糖[13]。这些可溶性糖不仅可以作为细胞中的渗透调节物质,还可以作为植物适应环境的信号物质[14]。因此,GolS基因对植物抵抗逆境胁迫意义重大。
GolS属于多基因家族,仅在拟南芥中就发现了10个编码GolS的基因[15]。我们在大豆基因组中共获得6个GolS基因碱基序列,它们对非生物胁迫的应答模式并不相同。基因表达量检测结果显示,GmGolS2-1是一个典型的高温胁迫诱导表达基因。基因的表达模式往往与基因功能密切相关,由此推测GmGolS2-1可能在大豆耐热生理中起重要作用。前人也有过类似报道,例如鹰嘴豆CaGolS1可以应答高温胁迫,将其在拟南芥中过表达可以提高转基因植株的耐热性[9]。但到目前为止,有关GolS基因与高温胁迫反应之间的关系的研究相比其与其他非生物胁迫反应还比较少,耐热机制也不甚明了。Wang等[16]认为,丹参中的3个GolS基因能够被高温胁迫诱导表达,可能是这些基因上游的启动子序列中含有HSF转录因子结合的顺式作用元件,转基因试验结果也驗证了此观点。
植物在遭受外界逆境胁迫后通常会在形态上出现一系列的变化,如叶片萎蔫、叶色褪绿、幼苗死亡等[17-18]。但是单纯的形态学观察常常会产生极大的误差,因此可以通过检测某些与抗逆相关的生理指标来鉴定不同植株的抗逆能力。高温胁迫会导致植物脱水,影响植物体内自由基产生和消除的平衡,进而导致过氧化作用,破坏细胞膜的完整性,对细胞造成伤害[19]。电解质渗透率增大是植物遭受逆境胁迫后细胞膜通透性增大的最直观体现,细胞膜通透性增大会导致细胞中物质大量流失,进而影响细胞正常的生理功能并最终影响植物的正常生长发育[20]。丙二醛是植物膜脂过氧化的产物,其含量可作为判断植物受损伤程度的一项重要生理指标[21]。因此,电解质渗透率和丙二醛含量可以在一定程度上反应植株的抗逆能力。TaGolS3转基因拟南芥和水稻在锌离子胁迫下活性氧清除相关基因的表达量升高,其电解质渗透率和丙二醛含量均低于野生型对照,由此提高了转基因植株对重金属胁迫的抗性[22]。本研究中,GmGolS2-1转基因烟草植株在高温处理下叶片电解质渗透率及丙二醛含量均低于野生型对照组,证明GmGolS2-1基因可以降低高温胁迫对烟草叶片造成的伤害,提高转基因烟草的耐热性。
参考文献:
[1] BARTELS D, SUNKAR R. Drought and salt tolerance in plants[J]. Critical Reviews in Plant Sciences, 2005, 24(1): 23-58.
[2] NISHIZAWA Y A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage[J]. Plant Physiology, 2008, 147(3): 1251-1263.
[3] KNAUPP M, MISHRA K B, NEDBAL L, et al. Evidence for a role of raffinose in stabilizing photosystem II during freeze-thaw cycles[J]. Planta, 2011, 234(3): 477-486.
[4] ELSAYED A I, RAFUDEEN M S, GOLLDACK D. Physiological aspects of raffinose family oligosaccharides in plants: protection against abiotic stress[J]. Plant Biology, 2014, 16(1): 1-8.
[5] TAJI T, OHSUMI C, IUCHI S, et al. Important roles of drought-and cold-inducible genes for galactinol synthase in stress tolerance in Arabidopsis thaliana[J]. Plant Journal, 2002, 29(4): 417-426.
[6] NISHIZAWA Y A, YABUTA Y, SHIGEOKA S. The contribution of carbohydrates including raffinose family oligosaccharides and sugar alcohols to protection of plant cells from oxidative damage[J]. Plant Signal Behavior, 2008, 3(11): 1016-1018.
[7] PANIKULANGARA T J. Galactinol synthase1. A novel heat shock factor target gene responsible for heat-induced synthesis of raffinose family oligosaccharides in Arabidopsis[J]. Plant Physiology, 2004, 136(2): 3148-3158.
[8] PILLET J, EGERT A, PIERI P, et al. VvGOLS1 and VvHsfA2 are involved in the heat stress responses in grapevine berries[J]. Plant & Cell Physiology, 2012, 53(10): 1776-1792.
[9] PRAFULL S, NITIN U K, MANOJ M. Stress-inducible galactinol synthase of chickpea (CaGolS) is implicated in heat and oxidative stress tolerance through reducing stress-induced excessive reactive oxygen species accumulation[J]. Plant Cell Physiol, 2018, 59(1): 155-166.
[10]ZHAI Y, SHAO S L, SHA W, et al. Overexpression of soybean GmERF9 enhances the tolerance to drought and cold in the transgenic tobacco[J]. Plant Cell Tissue and Organ Culture, 2017, 128(3): 607-618.
[11]HOEKEMA A, HIRSCH P R, HOOYKAASP J J, et al. A binary plant vector strategy based on separation of vir- and T-region of the Agrobacterium tumefaciens Ti-plasmid[J]. Nature, 1983, 303(5913): 179-180.
[12]SHAO H B, LIANG Z S, SHAO M A. Osmotic regulation of 10 wheat (Triticum aestivum L.) genotypes at soil water deficits[J]. Colloids and Surfaces B: Biointerfaces, 2006, 47(2), 132-139.
[13]PETERBAUER T, RICHTER A. Biochemistry and physiology of raffinose family oligosaccharides and galactosyl cyclitols in seeds[J]. Seed Science Research, 2001, 11(3), 185-197.
[14]SHEEN J, ZHOU L, JIANG J C. Sugar as signaling molecules[J]. Current Opinion in Plant Biology, 1999, 2(5): 410-418.
[15]KAPLAN F, KOPKA J, SUNG D Y, et al. Transcript and metabolite profiling during cold acclimation of Arabidopsis reveals an intricate relationship of cold-regulated gene expression with modifications in metabolite content[J]. The Plant Journal, 2007, 50(6): 967-981.
[16]WANG D H, YAO W, SONG Y, et al. Molecular characterization and expression of three galactinol synthase genes that confer stress tolerance in Salvia miltiorrhiza[J]. Journal of Plant Physiology, 2012, 169(18): 1838-1848.
[17]夏瑞祥,肖 寧,洪义欢,等. 东乡野生稻苗期耐冷性的QTL定位[J]. 中国农业科学, 2010, 43(3): 443-451.
[18]王代鑫,徐 升,程 哲,等. 吉林省中晚熟水稻品种耐冷性鉴定结果与分析[J]. 中国稻米, 2020, 26(3): 48-53.
[19]CAKMAK I, HORSTW J. Effect of aluminium on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycinemax)[J]. Physiologia Plantarum, 1991, 83(3): 463-468.
[20]周 旋,申 璐,金 媛,等. 外源水杨酸对盐胁迫下茶树生长及主要生理特性的影响[J]. 西北农林科技大学学报(自然科学版), 2015, 43(7): 161-167.
[21]高向阳,杨根平,许志强,等. 水分胁迫下钙对大豆膜脂过氧化保护酶系统的影响[J]. 华南农业大学学报, 1999,20(2): 7-12.
[22]WANG Y, LIU H, WANG S, et al. Overexpression of a common wheat gene GALACTINOL SYNTHASE3 enhances tolerance to zinc in Arabidopsis and rice through the modulation of reactive oxygen species production[J]. Plant Molecular Biology Reporter, 2016, 34: 794-806.
(责任编辑:陈海霞)
收稿日期:2020-06-29
基金项目:黑龙江省普通本科高等学校青年创新人才培养计划项目(UNPYSCT-2017153);黑龙江省省属高等学校基本科研业务费科研项目(植物性食品加工技术特色学科专项)(YSTSXK201878);黑龙江省省属高等学校基本科研业务费科研项目(135209264);齐齐哈尔大学研究生创新科研项目(YJSCX2019050)
作者简介:邱 爽(1995-),男,山东济宁人,硕士研究生,主要从事大豆分子育种研究。(E-mail)qs187143@163.com
通讯作者:翟 莹,(Tel)15845640163;(E-mail)fairy39809079@126.com

