枇杷花多酚对脂肪酶的抑制作用
黄桂丽 王毓宁 马佳佳 隋思瑶 孙灵湘


摘要: 以枇杷花为原料,提取枇杷花多酚,并通过大孔树脂AB-8纯化,得到枇杷花多酚提取物,然后从抑制率、抑制机理、抑制类型和荧光淬灭效应几个方面探究枇杷花多酚对脂肪酶的抑制作用。结果表明,枇杷花多酚对脂肪酶具有很好的抑制效果,半抑制质量浓度为(66.1±6.36) μg/ml,以可逆混合性方式抑制脂肪酶的活性。枇杷花多酚能与脂肪酶生成复合物,结合位点数为1。
关键词: 枇杷花多酚;脂肪酶;抑制作用
中图分类号: TS201.2 文献标识码: A 文章编号: 1000-4440(2021)01-0192-05
Inhibitory effect of loquat flowers polyphenolics on lipase activity
HUANG Gui-li, WANG Yu-ning, MA Jia-jia, SUI Si-yao, SUN Ling-xiang
(Suzhou Academy of Agricultural Sciences, Suzhou 215105, China)
Abstract:The total polyphenolics were extracted and purified by AB-8 macroporous resin from loquat flowers. To investigate the inhibitory kinetics and mechanism of polyphenolics from loquat flowers on lipase, the inhibitory rate, inhibitory mechanism, inhibition type and fluorescence quenhing effect were explored. The results indicated that polyphenolics from loquat flowers showed a remarkable inhibitory effect on lipase activity with half-maximal inhibitory concentration (IC50) value of (66.1±6.36) μg/ml in a mixed-type manner. Loquat flowers polyphenolics can form complex with lipase, and the number binding sites is one.
Key words: loquat flowers polyphenolics;lipase;inhibitory effect
隨着生活环境的变化和社会经济的发展,世界范围内肥胖症[体质量指数(BMI)≥30 kg/m2]患病率急剧上升。2018年世界卫生组织统计的全球成人肥胖患病率男性和女性分别为11%和15%[1]。肥胖已成为世界性的健康问题。肥胖可能导致许多慢性疾病,如心血管疾病、糖尿病、癌症和代谢性综合征[2-3]。临床肥胖患者体质量减轻5%~10%可显著降低患肥胖相关疾病的风险,改善包括血糖、血脂和血压在内的异常危险因素,甚至能改善一些早期代谢并发症[4]。肥胖产生的根本原因是膳食中脂肪被脂肪酶水解为游离脂肪酸、甘油二酯、甘油单酯和甘油,然后被小肠吸收利用[5]。在这一过程中脂肪酶起着关键的作用。因此,通过抑制脂肪酶活性来阻碍膳食脂肪的吸收被认为是一种潜在的减肥策略。目前,研究和开发脂肪酶天然抑制剂受到广泛关注。
植物多酚广泛分布于植物的各器官中,是植物的次生代谢产物,与植物的生长、代谢、繁殖、抗逆等密切相关[6-7]。近年来,随着天然活性成分研发的兴起,植物多酚的多方面开发利用成为人们关注的热点。植物多酚具有抗氧化、抗肿瘤、抗心脑血管疾病、抗病毒、抑菌等多种活性作用[8]。
枇杷[Eriobotrya japonica(Thunb.) Lindl.]为蔷薇科植物,原产于中国东南地区,主要分布在长江以南各省,是一种具有药用价值的常绿果树。作为传统的中草药,枇杷花用于治疗咳嗽化痰。现代医学研究发现,枇杷花具有抑菌、抗氧化、止咳、化痰、抗炎、抗肿瘤及免疫调节等药用价值[9]。枇杷花具有很好的药效主要源于其含有丰富的多酚类物质。在枇杷栽种过程中,为了达到枇杷果实的优质增产,大量枇杷花被疏除,这为枇杷花的利用提供了充足的原材料。目前对枇杷花的开发利用主要有枇杷花茶、枇杷花醋、枇杷花酒、枇杷花露、蜜炼枇杷膏等产品[10]。吴媛琳等[11]研究发现,枇杷花的多酚含量高于叶。然而,枇杷花多酚对脂肪酶的作用鲜有报道。鉴于此,本研究拟通过酶抑制动力学和荧光淬灭等试验研究枇杷花多酚与脂肪酶的相互作用情况,以揭示枇杷花多酚抑制脂肪酶的分子机制,为推动枇杷花多酚在食品领域的应用,以及开发新型降脂功能性产品提供科学依据。
1 材料与方法
1.1 材料与试剂
枇杷花采集于江苏省洞庭东山枇杷采摘示范园。脂肪酶(毛霉菌)、对硝基苯酚棕榈酸酯(4-NPP)和二甲基亚砜(DMSO)为美国Sigma-Aldrich公司产品,其他化学试剂均为国产分析纯。
1.2 仪器与设备
FW100高速多功能粉碎机,天津市泰斯特仪器有限公司产品;ME104E电子天平,梅特勒-托利多仪器有限公司产品;UV-800紫外分光光度计,美国贝克曼公司产品;Cary Eclipse荧光分光光度计,美国Agilent公司产品;KQ-250V型超声波清洗器,昆山超声仪器有限公司产品;TGL-16M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司产品。
1.3 方法
1.3.1 枇杷花多酚的提取、纯化及含量测定 参照我们前期的试验方法进行枇杷花多酚的提取和含量测定[12]。枇杷花烘干至恒质量,粉碎,过60目筛。称取50 g枇杷花粉末,按照料液比1 g∶50 ml加入50%乙醇溶液,在61 ℃超聲提取9 min,重复提取3次,合并滤液,旋转蒸发仪减压浓缩。过AB-8大孔树脂纯化,湿法装柱(20 mm×300 mm),枇杷花多酚粗提液以每小时1倍柱床体积的流速上样,吸附平衡后用4倍柱床体积的去离子水洗脱去除水溶性蛋白质、还原糖和多糖等杂质,再用50%的乙醇溶液以每小时1.5倍柱床体积的流速洗脱,减压浓缩,冷冻干燥得到纯化的枇杷花多酚。用福林酚法测定枇杷花多酚含量。
1.3.2 枇杷花多酚对脂肪酶活性的影响 脂肪酶活性测定参照Liu等[13]的方法,具体步骤如下:枇杷花多酚溶于DMSO,以7.5 mmol/L的4-NPP为底物,在0.05 mol/L Tris-HCl缓冲液(pH 7.8)的3 ml测定体系中,加入0.3 ml不同质量浓度的枇杷花多酚溶液,最后加入0.05 ml脂肪酶水溶液,立刻混匀,在37 ℃条件下测定波长405 nm下的脂肪酶活性。脂肪酶的终质量浓度为2 μg/ml,消光系数按ε=12 010.7 (mol/L)-1cm-1计算。以酶的相对剩余活性对枇杷花多酚浓度作图,计算脂肪酶的半抑制浓度(IC50)。
1.3.3 枇杷花多酚对脂肪酶活性的抑制试验 以7.5 mmol/L的4-NPP为底物,在0.05 mol/L Tris-HCl缓冲液(pH 7.8)的3 ml测定体系中,改变加入脂肪酶的量,测定不同质量浓度枇杷花多酚对脂肪酶催化4-NPP活性的影响。以剩余脂肪酶活性对加入的酶量作图,由此判断枇杷花多酚对脂肪酶的抑制作用机理。
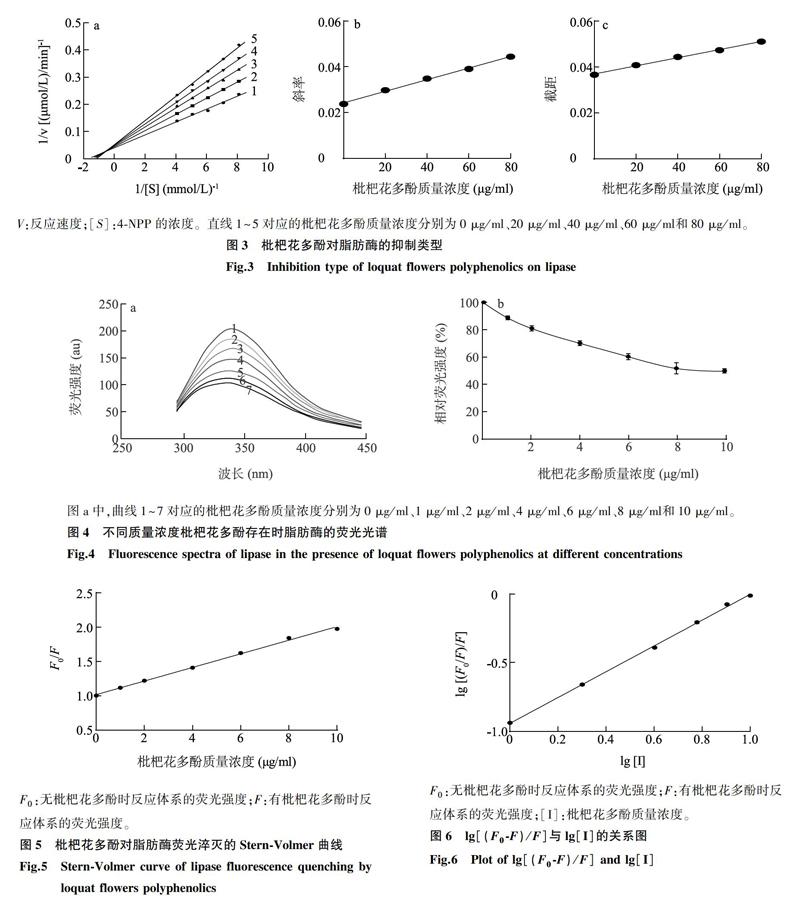
1.3.4 枇杷花多酚对脂肪酶活性的抑制作用类型试验 在脂肪酶活性测定体系中,固定脂肪酶的浓度,改变底物4-NPP浓度,测定不同质量浓度枇杷花多酚对脂肪酶活性的影响,其中4-NPP的浓度分别为0.125 mmol/L、0.140 mmol/L、0.160 mmol/L、0.200 mmol/L、0.250 mmol/L,枇杷花多酚质量浓度分别为0 μg/ml、20 μg/ml、40 μg/ml、60 μg/ml、80 μg/ml。通过Lineweaver-Burk双倒数作图,判断枇杷花多酚的抑制类型并求出酶抑制动力学常数[14]。
1.3.5 枇杷花多酚对脂肪酶作用的荧光发射光谱分析 荧光淬灭试验可以用来分析蛋白质和配体之间的相互关系[15]。参照Chai等[16]的方法进行试验。激发波长为280 nm,激发和发射波长的光带宽度为5 nm,测定290~450 nm波长处脂肪酶溶液的荧光发射光谱[17-18]。在测定体系中,枇杷花多酚的质量浓度分别为0 μg/ml、1 μg/ml、2 μg/ml、4 μg/ml、6 μg/ml、8 μg/ml、10 μg/ml。根据Stern-Volmer方程F0/F=1+Kqτ0[I]=1+Ksv[I][19],将荧光淬灭试验结果进行作图。对于静态淬灭,根据lg[(F0-F)/F]对lg[I]的线性方程lg[(F0-F)/F] = lgKA+n lg[I][20]求得结合常数(KA)和结合位点数(n)。
1.4 数据统计与分析
试验重复3次,数据以平均值±标准差表示。采用Prism 6进行试验数据处理、分析及绘图。
2 结果与分析
2.1 枇杷花多酚对脂肪酶的抑制作用
图1显示,枇杷花多酚对脂肪酶具有很好的抑制效果,并且呈质量浓度梯度依赖性。随着枇杷花多酚质量浓度的升高,脂肪酶的活性快速降低,但没有完全受到抑制。枇杷花多酚引起脂肪酶活性50%丧失的质量浓度(IC50)为(66.1±6.36) μg/ml。
2.2 枇杷花多酚对脂肪酶的抑制机理
固定底物浓度,改变反应体系中脂肪酶量,以剩余酶活性对酶量作图,得到一组通过原点的直线(图2)。由图2可知,随着枇杷花多酚质量浓度的升高,直线的斜率降低,说明枇杷花多酚对酶的抑制是可逆过程,它是通过降低脂肪酶的催化效率,导致脂肪酶活性的下降,而不是使脂肪酶变性失活[21]。
2.3 枇杷花多酚对脂肪酶的抑制类型
经Lineweaver-Burk双倒数作图,得到以反应速率的倒数(1/V)对底物浓度的倒数(1/[S])的线性回归关系(图3a)。随着抑制剂枇杷花多酚质量浓度的上升,直线的斜率上升,且这些直线相交于第二象限,表明枇杷花多酚对脂肪酶的抑制类型为混合型抑制[22]。这个结果还揭示枇杷花多酚既能与脂肪酶结合也能与脂肪酶-底物复合体结合。枇杷花多酚对脂肪酶的抑制常数(KI)可以通过以直线的斜率对枇杷花多酚质量浓度作图得到(图3b),枇杷花多酚对脂肪酶-底物复合物的抑制常数(KIS)可以通过以直线和纵轴的截距对枇杷花多酚质量浓度作图得到(图3c)。KI和KIS的值分别为95.84 μg/ml和208.63 μg/ml。枇杷花多酚对脂肪酶的KIS大于KI,说明枇杷花多酚对脂肪酶的结合能力大于对脂肪酶-底物复合物的结合能力[23]。
2.4 枇杷花多酚作用于脂肪酶的荧光光谱分析
2.4.1 荧光淬灭光谱 以荧光淬灭试验分析枇杷花多酚与脂肪酶之间的相互作用。如图4a所示,枇杷花多酚对脂肪酶有很强的抑制活性。随着枇杷花多酚质量浓度的升高,脂肪酶的荧光强度逐渐降低。当枇杷花多酚的质量浓度达到10 μg/ml时,脂肪酶的相对荧光强度降到49.58%(图4b)。
2.4.2 荧光淬灭Stern-Volmer曲线 根据枇杷花多酚对脂肪酶荧光淬灭的Stern-Volmer曲线(图5),计算得到枇杷花多酚对脂肪酶的KSV(Stern-Volmer方程的淬灭常数)为1.134×10-1μg/ml,Kq(生物分子淬灭速率常数)为1.134×107μg/(ml·s)。
2.4.3 结合常数和结合位点数 根据lg[(F0-F)/F]对lg[I]的双对数曲线(图6),计算得到枇杷花多酚与脂肪酶的结合常数(KA)为0.113 6 μg/ml,结合位点数为0.944。说明枇杷花多酚與脂肪酶之间仅有1个结合位点。
3 结论
采用超声波辅助乙醇溶液提取方法从枇杷花粉末中提取得到枇杷花多酚粗提物,然后通过大孔树脂AB-8纯化得到枇杷花多酚纯化物,用纯化的枇杷花多酚对脂肪酶进行抑制效果分析。结果表明,枇杷花多酚对脂肪酶活性具有很好的抑制作用,半抑制率(IC50)为(66.10±6.36) μg/ml,抑制类型为可逆混合型抑制。荧光淬灭分析结果表明,枇杷花多酚能与脂肪酶结合生成复合物,结合位点数为1。枇杷花多酚能抑制脂肪酶活性,从而阻碍膳食中脂肪的消化和吸收,减少脂肪的摄取,因此具有开发成天然降脂产品的应用价值。
参考文献:
[1] GERDTS E, REGITZ-ZAGROSEK V. Sex differences in cardiometabolic disorders[J]. Nature Medicine, 2019, 25(11): 1657-1666.
[2] WANG S H, DONG S, ZHANG R, et al. Effects of proanthocyanidins on porcine pancreatic lipase: conformation, activity, kinetics and thermodynamics[J]. Process Biochemistry, 2014, 49(2): 237-243.
[3] SCHERER P E. The multifaceted roles of adipose tissue-therapeutic targets for diabetes and beyond: the 2015 banting lecture[J]. Diabetes, 2016, 65(6): 1452-1461.
[4] ZHAO S, ZHU Y, SCHULTZ R D, et al. Partial leptin reduction as an insulin sensitization and weight loss strategy[J]. Cell Metabolism, 2019, 30(4): 706-719.
[5] KIM S H, KIM H. Inhibitory effect of astaxanthin on oxidative stress-induced mitochondrial dysfunction-a mini-review[J]. Nutrients, 2018, 10(9): 1137.
[6] PANIC M, RADIC S M, KRALJIC K, et al. Ready-to-use green polyphenolic extracts from food by-products[J]. Food Chemistry, 2019, 283: 628-636.
[7] DENG G F, SHEN C, XU X R, et al. Potential of fruit wastes as natural resources of bioactive compounds[J]. International Journal of Molecular Sciences, 2012, 13(7): 8308-8323.
[8] LI A N, LI S, ZHANG Y J, et al. Resources and biological activities of natural polyphenols[J]. Nutrients, 2014, 6(12): 6020-6047.
[9] LIU Y, ZHANG W, XU C, et al. Biological activities of extracts from loquat (Eriobotrya japonica Lindl): A review[J]. International Journal of Molecular Sciences, 2016, 17(12): 1983.
[10]ZHOU C H, XU C J, SUN C D, et al. Carotenoids in white- and red-fleshed loquat fruits[J]. Journal of Agricultural and Food Chemistry, 2007, 55(19): 7822-7830.
[11]吴媛琳. 枇杷不同部位主要有效成分及抗氧化活性的比较[D]. 咸阳:西北农林科技大学, 2014.
[12]HUANG G L, MA J J, SUI S Y, et al. Optimization of extraction of loquat flowers polyphenolics and its antioxidant and anti-polyphenol oxidase properties[J]. Bioengineered, 2020, 11(1): 281-290.
[13]LIU T T, HE X R, XU R X, et al. Inhibitory mechanism and molecular analysis of furoic acid and oxalic acid on lipase[J]. International Journal of Biological Macromolecules, 2018, 120(Pt B): 1925-1934.
[14]HUANG Q, CHAI W M, MA Z Y, et al. Inhibition of alpha-glucosidase activity and non-enzymatic glycation by tannic acid: Inhibitory activity and molecular mechanism[J]. International Journal of Biological Macromolecules, 2019, 141: 358-368.
[15]ANAND U, JASH C, BODDEPALLI R K, et al. Exploring the mechanism of fluorescence quenching in proteins induced by tetracycline[J]. Journal of Physical Chemistry B, 2011, 115(19): 6312-6320.
[16]CHAI W M, OU-YANG C, HUANG Q, et al. Antityrosinase and antioxidant properties of mung bean seed proanthocyanidins: Novel insights into the inhibitory mechanism[J]. Food Chemistry, 2018, 260: 27-36.
[17]WANG H R, ZHU W J, WANG X Y. Mechanism of inhibition of arginine kinase by flavonoids consistent with thermodynamics of docking simulation[J]. International Journal of Biological Macromolecules, 2011, 49(5): 985-991.
[18]张 静,米 佳,禄 璐,等. 黑果枸杞花色苷提取物对胰脂肪酶活性的影响[J]. 食品科学, 2020, 41(5): 8-14.
[19]EFTINK M R, GHIRON C A. Fluorescence quenching studies with proteins[J]. Analytical Biochemistry, 1981, 114(2): 199-227.
[20]JIA J, GAO X, HAO M, et al. Comparison of binding interaction between beta-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J]. Food Chemistry, 2017, 228: 143-151.
[21]LIN M Z, CHAI W M, OU-YANG C, et al. Antityrosinase mechanism of omeprazole and its application on the preservation of fresh-cut Fuji apple[J]. International Journal of Biological Macromolecules, 2018, 117: 538-545.
[22]CHEN X X, ZHANG J, CHAI W M, et al. Reversible and competitive inhibitory kinetics of amoxicillin on mushroom tyrosinase[J]. International Journal of Biological Macromolecules, 2013, 62: 726-733.
[23]HUANG Q, CHAI W M, MA Z Y, et al. Antityrosinase mechanism of ellagic acid in vitro and its effect on mouse melanoma cells[J]. Journal of Food Biochemistry, 2019, 43(11): e12996.
(責任编辑:张震林)
收稿日期:2020-04-30
基金项目:苏州市科技计划项目(SNG201909); 江苏省农业科技自主创新基金项目[CX(17)3029]
作者简介:黄桂丽(1986-),女,河南潢川人,博士,助理研究员,研究方向为食品保鲜与加工。(E-mail)huanggl2015@163.com
通讯作者:王毓宁, (E-mail)wyn705@163.com

