陕西泡菜中降解亚硝酸盐乳酸菌的筛选及其发酵特性与耐受性研究
熊蝶,袁岚玉,李媛媛,范鹏飞,冯武
(华中农业大学 食品科学技术学院,湖北 武汉,430070)
泡菜是中国传承数千年的传统发酵食品,因其口感酸香脆嫩、鲜香开胃而广受人们喜爱[1]。随着泡菜产业的发展,其工业化程度逐渐提高,产品质量也更加稳定,但仍然存在许多问题[2]。泡菜在制作过程中会产生亚硝酸盐,而亚硝酸盐含量超标也是泡菜常见的安全问题之一[3]。亚硝酸盐食用过量会对人体造成危害,一次食用达到中毒剂量会造成低氧血症等急性毒性危害,同时亚硝酸盐在体内与胺类物质结合生成的亚硝胺作为一种强致癌物,会增加患癌症的风险,因此控制泡菜中亚硝酸盐的产生尤为重要[4-5]。
乳酸菌是一类细菌的统称,它呈革兰氏阳性,一般被认为是安全的细菌,有许多研究表明了乳酸菌降解亚硝酸盐的性质[6]。朱军莉等[7]从自制发酵泡菜中分离出1株植物乳杆菌(Lactobacillusplantarum),其培养72 h后对125 mg/L亚硝酸盐的降解率达到95.6%。王英等[8]从自制发酵酸豆角中分离出1株植物乳杆菌,培养48 h后对200 mg/L亚硝酸盐的降解率达到91.64%。同时乳酸菌能够发酵糖产酸,在泡菜发酵的过程中占主导地位,因此将具有良好发酵性质的乳酸菌应用于泡菜发酵中,是一种便捷有效降低泡菜中亚硝酸盐含量并提升泡菜安全性的方法[9]。此外,乳酸菌还被报道有降低血清胆固醇[10]、缓解乳糖不耐受症[11]以及提高免疫[12]等益生作用,因此随泡菜一起进入人体的乳酸菌有可能在人体内发挥益生作用。
本研究主要从陕西家庭自制泡菜中筛选出高效降解亚硝酸盐的乳酸菌,并对其进行鉴定,然后对筛选出的菌株进行发酵特性与耐受特性的研究。通过研究其产酸和降解亚硝酸盐的能力,以及耐亚硝酸盐和耐NaCl特性,为开发菌株应用于泡菜生产发酵的潜力提供理论基础。
1 材料与方法
1.1 材料与试剂
陕西家庭自制泡菜。
MRS肉汤、MRS琼脂、乳酸菌成套生化鉴定管,青岛海博生物技术有限公司;硼砂、亚铁氰化钾、乙酸锌、盐酸、对氨基苯磺酸、盐酸萘乙二胺、NaCl、NaNO2,国药集团化学试剂有限公司。
1.2 仪器与设备
Multiskan GO全波长读数仪,美国赛默飞世尔公司;UV1800紫外-可见分光光度计,日本岛津公司;VD-1320超净工作台,北京东联哈尔仪器制造有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;SHP-250生化培养箱,上海精宏实验设备有限公司;AL204电子天平,上海梅特勒托利多仪器有限公司。
1.3 实验方法
1.3.1 乳酸菌的分离与纯化
吸取25 mL泡菜汁液到50 mL MRS肉汤中,于37 ℃下增菌培养24 h,然后用生理盐水进行梯度稀释,取合适稀释度的菌液0.1 mL涂布于含有CaCO3的MRS琼脂平板上,并于37 ℃下培养48 h。挑取平板上有明显溶钙圈且表面湿润的单菌落,于MRS平板上反复划线纯化,然后对纯化菌株进行革兰氏染色和过氧化氢酶实验,将革兰氏阳性与过氧化氢酶阴性菌株进行4 ℃斜面保存以及-20 ℃甘油管保存,并进行后续实验。
1.3.2 降解亚硝酸盐乳酸菌的筛选
1.3.2.1 亚硝酸盐的测定
基于GB/T 5009.33—2016中的分光光度法[13],并结合茹晓[14]测定亚硝酸盐含量的方法进行修改。取离心去菌体后发酵液1 mL,依次加入2.5 mL硼砂、1 mL亚铁氰化钾、1 mL乙酸锌,而后用超纯水定容至50 mL,混匀后静置30 min,用滤纸过滤得到滤液备用。加入合适量的滤液到50 mL比色管中,加入2 mL对氨基苯磺酸溶液,混匀后静置3 min,加入1 mL盐酸萘乙二胺溶液,用超纯水定容至50 mL,混匀后静置15 min,以不添加滤液的零管调零,于538 nm波长下测定吸光值。同时做各不同添加量滤液对应的试剂空白。按照GB/T 5009.33—2016中的分光光度法测定并绘制亚硝酸盐含量标准曲线,根据标准曲线得到亚硝酸盐含量。亚硝酸盐降解率按照公式(1)计算:
(1)
式中:R表示亚硝酸盐降解率,%;C0表示培养基中NaNO2初始含量,mg/L;C1表示不同培养时刻培养基中NaNO2含量,mg/L。
1.3.2.2 降解亚硝酸盐乳酸菌的初筛
参考郭志华等[15]的方法,对降解亚硝酸盐的乳酸菌进行初步筛选。将上述纯化保存的菌株接种到MRS肉汤中活化2次,并以体积分数为2%的添加量将活化菌液接种于含有150 mg/L NaNO2的10 mL MRS肉汤中,37 ℃下培养48 h。向培养基中加入2 mL对氨基苯磺酸溶液,混匀后静置3 min,再加入1 mL盐酸萘乙二胺溶液,混匀后静置15 min,观察各菌株培养基的颜色,与添加150 mg/L NaNO2的MRS肉汤以及不添加 NaNO2的MRS培养基进行颜色对比,选出颜色浅的菌株进行后续筛选。
1.3.2.3 降解亚硝酸盐乳酸菌的复筛
将初筛中得到的菌株接种到MRS肉汤培养基中活化2次,然后以体积分数为2%的接种量接种到含有150 mg/L NaNO2的MRS肉汤中,在37 ℃下培养48 h,并按照1.3.2.1中的方法测定48 h内菌株对亚硝酸盐的降解率,筛选出降解亚硝酸盐效果好的菌株。
1.3.3 菌种鉴定
1.3.3.1 生理生化鉴定
使用乳酸菌成套生化鉴定管测定菌株的糖发酵结果,结合《常见细菌系统鉴定手册》[16]初步判定菌株种类。
1.3.3.2 16S rDNA鉴定
将活化的菌液交于上海生工生物工程有限公司进行16S rDNA的测序,将得到的序列与NCBI中序列进行BLAST同源性对比,并用MEGA 7.0绘制系统进化树,最终确定菌株种属。
1.3.4 生长曲线的测定
将菌株接种到MRS肉汤培养基中活化2次,并以体积分数为2%的接种量接种于MRS肉汤中,于37 ℃培养,每2 h测定OD600nm吸光值。
1.3.5 乳酸菌发酵特性的测定
1.3.5.1 产酸能力的测定
将菌株接种到MRS肉汤培养基中活化2次,并以体积分数为2%的接种量接种于MRS肉汤中,于37 ℃培养72 h,在0、4、8、12、24、36、48、60、72 h测定发酵液pH值及总酸含量。总酸含量按照GB/T 12456—2008[17]中的酸碱滴定法测定。
1.3.5.2 降解亚硝酸盐速率的测定
将菌株接种到MRS肉汤培养基中活化2次,并以体积分数为2%的接种量接种于含有150 mg/L NaNO2的MRS肉汤中,于37 ℃培养48 h,在0、4、8、12、24、36、48、60、72 h测定发酵液pH值以及亚硝酸盐降解率。按照1.3.2中的方法进行测定。
1.3.6 乳酸菌耐受性测定
1.3.6.1 耐亚硝酸盐能力的测定
将菌株接种到MRS肉汤培养基中活化2次,以体积分数为2%的接种量接入含有50、100、150、200、250、300 mg/L NaNO2的MRS肉汤中,以不添加NaNO2的肉汤作为对照,于37 ℃培养24 h,测定0和24 h的OD600nm吸光值。
1.3.6.2 耐NaCl能力的测定
将菌株接种到MRS肉汤培养基中活化2次,以体积分数为2%的接种量接入含有20、40、60、80、100、120、140 g/L NaCl的MRS肉汤中,以不添加NaCl的肉汤作为对照,于37 ℃培养24 h,测定0和24 h的OD600nm吸光值。
1.3.7 数据统计与分析
所有实验重复2次,用SPSS 23.0进行显著性分析,用Origin 2016绘图,数据表示为平均值±标准差。
2 结果与分析
2.1 降解亚硝酸盐乳酸菌初筛与复筛结果
从陕西泡菜中分离出15株有明显溶钙圈的菌株,其革兰氏染色结果均为阳性,过氧化氢酶实验结果均为阴性,初步判定为乳酸菌,编号为PC1~PC15。将15株菌接种至MRS肉汤中活化时,有9株菌生长浑浊,在含有150 mg/L NaNO2的肉汤培养基中培养48 h后,直接显色结果如图1,其中PC5、PC8、PC10、PC11和PC14的颜色较浅,推测培养基中残留的NaNO2含量较少,将此5株菌进行复筛。
5株菌的复筛结果如表1所示。培养36 h后,5株菌的亚硝酸盐降解率均达到80%以上,其中菌株PC5和菌株PC11在培养到12 h时,其亚硝酸盐降解率远高于其他3株菌。在培养至12 h时,菌株PC5的亚硝酸盐降解率显著高于菌株PC11,并且在发酵过程中,菌株PC5的亚硝酸盐降解率一直高于PC11,因此选择菌株PC5作为后续的研究对象。

图1 部分菌株的培养基中NaNO2显色反应结果Fig.1 Color reaction results of NaNO2 in the culture medium of partial strains
2.2 生化鉴定结果
图2显示了菌株PC5的革兰氏染色图和菌落形态图,菌株PC5为杆状,其菌落乳白色湿润且凸起。表2显示了菌株PC5发酵糖类的特性,其中菌株PC5可以发酵七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、菊糖和乳糖等10种糖。在参考《常见细菌鉴定手册》[16]中关于部分乳杆菌的部分发酵特性后,推测其有可能是植物乳杆菌或敏捷乳杆菌(Lactobacillusagilis)。

表1 五株菌48 h内的亚硝酸盐降解率 单位:%

a-革兰氏染色结果;b-菌落形态图2 菌株PC5的菌落形态和革兰氏染色结果Fig.2 Colony morphology and Gram staining result of strain PC5注:革兰氏染色镜检放大倍数为1 000倍

表2 菌株PC5糖发酵反应结果Table 2 Sugar fermentation reaction results of strain PC5
2.3 16S rDNA鉴定
菌株通过Ezup柱式细菌基因组DNA抽提试剂盒提取DNA,然后用细菌引物进行PCR扩增,最后回收纯化后测序,将测序结果用BLAST进行对比,用MEGA 7.0进行系统进化树的绘制。如图3所示,菌株PC5与植物乳杆菌AMT74419的同源性为100%,综合生化鉴定结果,菌株PC5为植物乳杆菌。

图3 菌株PC5的系统发育树Fig.3 Phylogenetic tree of strain PC5
2.4 生长曲线的测定
由图4可知,菌株PC5的对数生长期是2~16 h,16 h后进入稳定期,因此活化时培养至16 h最优。菌株PC5延滞期短,2 h时便可进入对数期,菌量迅速增加,更适宜于培养发酵。
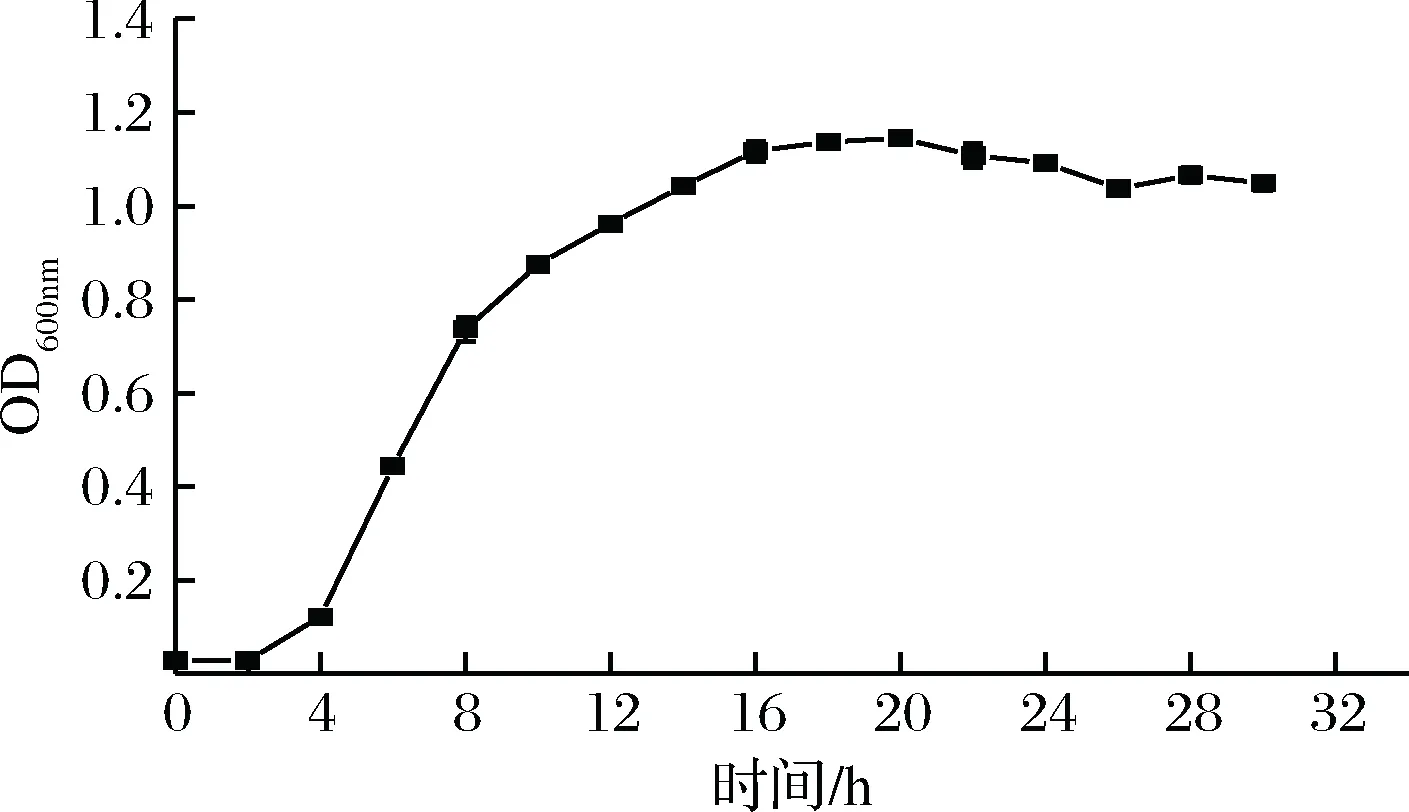
图4 菌株PC5的生长曲线Fig.4 The growth curve of strain PC5
2.5 乳酸菌发酵特性的测定
2.5.1 产酸能力的测定
由图5可知,在菌株PC5发酵12 h时,发酵液pH值已经降低至3.96±0.00,发酵24 h时,pH值降至3.73±0.01。菌株PC5发酵液的滴定总酸在4~24 h内迅速积累,在24 h时已达到(1.99±0.01)%,发酵液中总酸的迅速积累使得pH值迅速下降。菌株PC5发酵液的滴定总酸和pH值在24 h之后均趋于稳定,当发酵至72 h,发酵液pH值达到3.72±0.00,滴定总酸为(2.02±0.05)%。菌株PC5发酵产酸能将培养基pH值降低至3.72左右,有利于泡菜的发酵酸化和抑制有害菌。

图5 菌株PC5培养过程中pH值与滴定总酸的变化Fig.5 Changes of pH value and total acid titration during the culture of strain PC5
2.5.2 降解亚硝酸盐速率的测定
由图6可知,在添加150 mg/L NaNO2的MRS肉汤中,菌株PC5发酵8 h可降解(49.46±3.65)%的NaNO2,此时发酵液的pH值为4.21±0.03。当发酵至12 h时,菌株PC5的亚硝酸盐降解率达到(83.31±3.96)%,发酵液pH值降低至3.93±0.01。而发酵至24 h时,菌株PC5亚硝酸盐降解率可达(99.37±0.56)%,此时发酵液的pH值降低至3.74±0.01,此后pH值趋于稳定,NaNO2基本降解完全。在张庆芳等[18]的研究中指出,亚硝酸盐的降解主要分为2个阶段,在发酵液pH值高于4.5时,乳酸菌降解亚硝酸盐以亚硝酸盐还原酶降解为主,当发酵液pH值低于4.0时,主要是酸降解亚硝酸盐,由此推测,菌株PC5降解亚硝酸盐的方式既有酶降解也有酸降解。
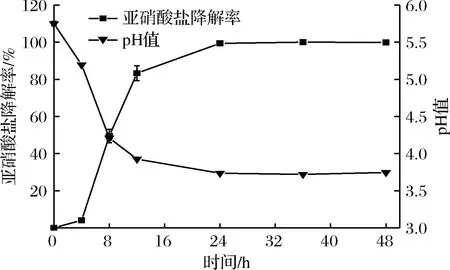
图6 菌株PC5培养过程中pH值与亚硝酸盐降解率的变化Fig.6 Changes of pH value and nitrite degradation rate during the culture of strain PC5
2.6 乳酸菌耐受性的测定
2.6.1 耐亚硝酸盐能力的测定
由图7可知,菌株PC5在含有50和100 mg/L NaNO2的培养基中生长24 h,OD600nm能达到0.80以上,与不添加NaNO2时无显著性差异。在NaNO2质量浓度为150和200 mg/L时,菌株PC5生长24 h后,OD600nm在0.50~0.70。当NaNO2质量浓度达到250和300 mg/L时,菌株PC5生长24 h后OD600nm在0.30~0.50,显著低于NaNO2质量浓度为200 mg/L时菌株PC5的OD600 nm。乳酸菌在泡菜发酵过程中会面临亚硝酸盐含量升高的问题,因此作为接种发酵的乳酸菌需要具备一定程度的亚硝酸盐耐受能力。由图7可见,菌株PC5对ρ(NaNO2)≤200 mg/L具有较强的耐受能力,对250~300 mg/L的高质量浓度NaNO2具有一定程度的耐受能力,因此PC5具备成为接种发酵泡菜的潜力。

图7 菌株PC5在不同质量浓度NaNO2中的生长情况Fig.7 The growth of strain PC5 under different mass concentrations of NaNO2注:不同小写字母表示差异显著(P<0.05)(下同)
2.6.2 耐NaCl能力的测定
泡菜发酵时通常需要加入一定量的食盐,既能调节泡菜风味也能抑菌,因此适合发酵泡菜的乳酸菌应该具备一定程度的耐NaCl能力[19]。由图8可知,在含有0~60 g/L NaCl的培养基中,菌株PC5培养24 h后均可以生长,且OD600nm可达到0.60以上。当NaCl质量浓度为0和20 g/L时,菌株PC5生长最好,其中20 g/L NaCl更适合PC5的生长,OD600nm可达到1.15。当NaCl质量浓度为40 g/L时,菌株PC5的生长与不添加NaCl无显著性差异。而NaCl质量浓度增加至60 g/L时,PC5的OD600nm显著下降至0.62,但仍然具有一定程度的耐受性,当NaCl质量浓度增加至80 g/L及以上时,菌株PC5几乎不能生长。由此可得菌株PC5对ρ(NaCl)≤60 g/L有较好的耐受性。

图8 菌株PC5在不同质量浓度NaCl中的生长Fig.8 The growth of strain PC5 in different mass concentrations of NaCl
3 结论与讨论
乳酸菌在传统泡菜发酵过程中占主导地位,因此泡菜中有丰富的乳酸菌资源[20]。在泡菜发酵过程中,杂菌生长会将蔬菜中的硝酸盐还原成亚硝酸盐,而接种乳酸菌发酵泡菜能迅速降低发酵泡菜的pH值,即抑制杂菌生长以及硝酸盐的转化,促进亚硝酸盐的降解,因此筛选产酸能力和降解亚硝酸盐能力强的乳酸菌有利于接种发酵泡菜的研究[21]。
在本研究中,从陕西家庭自制泡菜中分离出了1株植物乳杆菌PC5,它具有较强的降解亚硝酸盐能力,在含有150 mg/L NaNO2的培养基中发酵24 h能将pH值降低至3.74±0.01,同时亚硝酸盐降解率达到(99.37±0.56)%。在发酵8 h时,菌株PC5的亚硝酸盐降解率达到(49.46±3.65)%,推测菌株PC5可能存在酶降解与酸降解2种亚硝酸盐降解方式。
泡菜中添加的食盐以及产生的亚硝酸盐都会对乳酸菌的生长产生威胁,因此接种发酵泡菜的乳酸菌需要对食盐与亚硝酸盐具备一定耐受能力。菌株PC5在含有0~40 g/L NaCl的环境条件下生长良好,对60 g/L NaCl具有较好耐受能力。对0~200 mg/L NaNO2,菌株PC5具有较好的耐受性,OD600nm能达到0.5以上。菌株PC5生长延滞期短,产酸快且降解亚硝酸盐能力强,同时具有较好的亚硝酸盐和NaCl耐受能力,在提升泡菜品质与安全性方面有较大应用潜力,为开发益生菌制剂提供基础。

