固相萃取联合高效液相色谱-串联质谱测定人血浆中肌苷浓度的方法学建立
金冠钦,孙 黎,夏玲红,林厚文
上海交通大学医学院附属仁济医院药学部,上海200127
肌苷是一种核苷,可由次黄嘌呤通过β-N9 糖苷键与核糖环(也称为呋喃核糖)连接形成。作为ATP、辅酶A、RNA 及DNA 等物质的组成部分之一,肌苷在人体的物质代谢及能量代谢过程中起关键作用。在嘌呤从头合成过程中,肌苷是腺苷酸和鸟苷酸的前体,通常存在于转移RNA(transfer RNA,tRNA)中。肌苷能直接通过细胞膜进入体细胞,在核酸代谢、能量代谢和蛋白质合成中发挥作用。目前的研究[1]发现,嘌呤和嘧啶代谢有关的遗传性疾病有多种临床表现,包括贫血、肾结石、免疫缺陷、抽搐、智力低下、自闭症和生长迟缓。急性心肌缺血患者血液中ATP 分解代谢产物的水平会升高,因此测定肌苷可以帮助对这一疾病的诊断[2-3]。肌苷作为辅酶类药物,收录于2020版《中国药典》,用于白细胞减少症、血小板减少症、急性及慢性肝炎以及肝硬化等疾病的辅助治疗。近年来,肌酐越来越多的药理作用逐步被发现,包括修复外周组织损伤[4]及脑损伤[5-8]、抗抑郁[9]等。该药在保护中枢神经系统方面[10]也具有广阔的开发前景。
肌苷的测定在医学诊断领域有着广泛的应用。关于动物血清[11-13]或血浆[14]中的肌苷的检测方法国内外均已有报道。近年来,质谱检测也越来越多地运用于核苷和核苷酸类似物的定量分析[15-18]。但目前为止,这些方法均费时费力,且缺乏专门的检测系统。本文建立了一种简便、快速、选择性高的固相萃取联合高效液相色谱-串联质谱(solid-phase extraction-high performance liquid chromatography-tandem mass spectrometry, SPE-LC-MS/MS)测定血浆中肌苷浓度的方法,并对2 名健康志愿者12 h血浆中的肌苷浓度进行了测定。
1 材料与方法
1.1 实验仪器和材料
三重四级杆串联质谱仪及Analyst 1.5.1 数据分析软件(3200QTrap,美国AB Sciex 公司),高效液相色谱仪(LC-20AD,日本Shimadzu 公司),电子分析天平(AE240,美国Mettler-Toledo 公司),高速冷冻离心机(Avanti30,美国Beckman公司),涡旋混合器(XW-80A,上海医科大学仪器厂),-70 ℃超低温冰箱(MDF-382E,日本Sanyo 公司),SPE 装置(Vac Elut SPS 24,美国Varian 公司),OasisTMHLB Cartridge SPE 小柱(美国Waters公司),微孔滤膜(0.22 μm,上海半岛实业有限公司),Milli-Q超纯水处理系统(美国Millipore公司)。
1.2 实验药品及试剂
肌苷对照品(纯度99.1%,中国食品药品检定研究院,批号140669-201104),内标物拉米夫定(纯度99.7%,中国食品药品检定研究院,批号101007-200701)。甲醇、磷酸、氨水、乙酸均为质谱纯,均购自美国Merck公司;实验用超纯水(电阻率18.2 MΩ·cm) 由Milli-Q 纯水仪制备。
1.3 研究对象
本研究所使用的血浆样本来源于6 名健康志愿者(24~30岁)。生物样本采集均已通过上海交通大学医学院附属仁济医院伦理委员会的伦理审批。志愿者对研究内容知情同意并签署知情同意书。最终纳入2名志愿者,分别在0、3、8、10 h 采血,15 min 后清淡饮食。血浆样本采集后储存于-70 ℃冰箱,实验前置于室温解冻后即可进行样品前处理。
1.4 检测方法
1.4.1 HPLC 条件 色谱柱为Waters XBridge C18柱(100 mm×2.1 mm,3.5 μm),等度洗脱,流动相为甲醇−50 mmol/L 乙酸铵水溶液(1︰1),流速0.2 mL/min,柱温40 ℃,进样量10 μL。采用高效液相色谱仪检测。
1.4.2 MS 条件 采用电喷雾离子化(electrospray ionization,ESI) 正离子模式和多反应监测(multiple reaction monitoring,MRM)扫描方式,离子源温度为700 ℃,离子喷雾电压为5 000 V。在MRM模式下肌苷和内标物的定量离子对分别为m/z 269.1/137.1,m/z 230.2/112.2。去簇电压为26 V,碰撞电压为15 V。肌苷及拉米夫定结构裂解形式见图1。
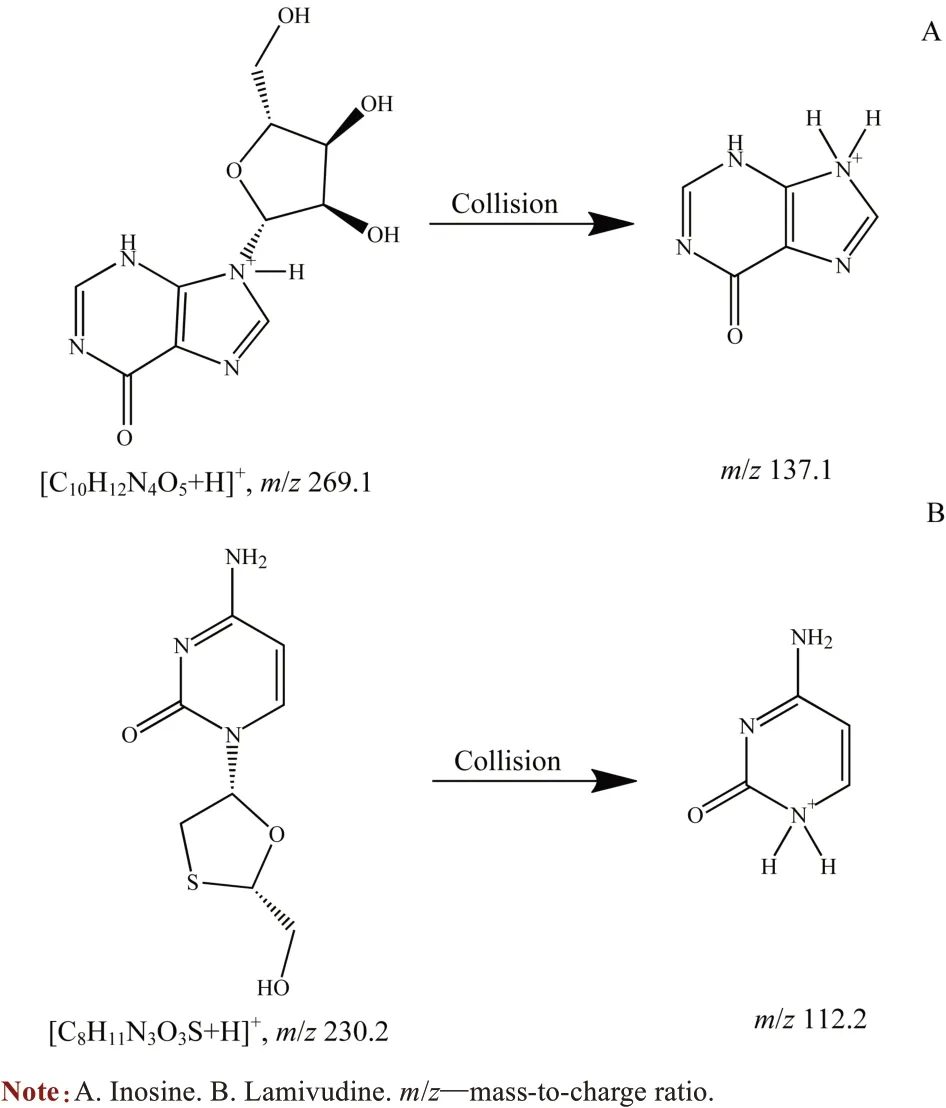
图1 肌苷及拉米夫定结构裂解图Fig 1 Chemical structures and fragmentations of inosine and lamivudine
1.5 溶液配制
1.5.1 标准血浆及质控样品的配制 取肌苷标准品适量,用流动相溶液(甲醇︰50 mmol/L 乙酸铵水溶液=1︰1)溶解后得到肌苷储备液。分别取适量储备液,用空白血浆(室温放置3 d)稀释至标准曲线所需浓度,其中肌苷的质量浓度分别为28.5、57.0、114.0、228.0、456.0、
912.0 ng/mL。
1.5.2 内标溶液的配制 取拉米夫定适量,用甲醇稀释得到质量浓度为1 μg/mL的内标溶液,备用。
1.5.3 血浆样品的配制 全血取出后置于肝素化试管中,立即4 ℃冰浴,待样品收集完毕后,1 123×g离心15 min,取 上 清 液250 μL,加 入 内 标 溶 液25 μL 及250 μL 的4.25%磷酸溶液,涡旋30 s,混匀后在HLB SPE 柱上样。先后使用1 mL 水及1 mL 甲醇洗脱除杂,最后使用1 mL流动相溶液收集,36 670×g 离心10 min,取上清液100 μL,按“1.4”项下条件检测。
1.6 方法学验证
1.6.1 色谱柱及流动相选择 使用制备的质控样品,对检测过程使用的色谱柱(Waters XBridge C18柱及Zorbax SB-C18柱)及流动相(有机相:甲醇及乙腈。水相:10 mmol/L 及50 mmol/L 乙酸铵水溶液)进行选择,其他步骤按“1.4”项下条件进行。根据肌苷及内标物的峰形、出峰时间以及信号响应强弱进行选择。
1.6.2 样品前处理方法的选择 血浆样品的前处理过程中,分别用5 种SPE 小柱(Waters Oasis HLB、Oasis MCX、Oasis MAX、Oasis WCX、Oasis WAX)进行考察与比较,其他步骤按“1.5.3”项下条件进行样品处理。根据肌苷的信号响应强弱进行选择。
1.6.3 专属性考察 分别取6 名健康志愿者的空白血浆样本,不加入内标物标准液及肌苷标准液。另取3份空白血浆样本,分别仅加入内标物标准液、仅加入肌苷标准液和同时加入内标物及肌苷标准液,按照“1.5.3”项下方法处理后进样分析。
1.6.4 血浆样品标准曲线及定量下限考察 取“1.5.1”项下肌苷标准血浆样品,按“1.5.3”项下方法处理,即得体内标准曲线样品。以肌苷与内标物峰面积比值(x)对浓度(y)进行线性回归,加权最小二乘法作回归运算,得到回归方程。
1.6.5 准确度和精密度考察 按照“1.5.1”项下方法制备定量下限及低、中、高质量浓度(28.5、57.0、228.0、912.0 ng/mL)的肌苷质控样品各6 份,再按“1.5.3”项下方法处理后,连续3 d 进样分析测定。根据当日标准曲线计算各质控样品的实测浓度,考察本方法的准确度以及日内和日间精密度。
1.6.6 提取回收率及基质效应考察 分别配制含肌苷的低、中、高质量浓度(57.0、228.0、912.0 ng/mL)的质控样品,按“1.5.3”项下方法操作,每个浓度取6 份样品进样分析;取人空白血浆按“1.5.3”项下方法操作后,取上清液分别加入适量的低、中、高质量浓度的肌苷标准溶液及内标溶液,涡旋混合后离心,每个浓度平行测定6 个样本;在250 μL 流动相中分别加入25 μL 低、中、高浓度的肌苷质控样品,25 μL 内标溶液,按照“1.5.3”项下方法处理,每个浓度取6 份样品进样分析。肌苷或内标物的基质效应=经过前处理的空白基质制备的样本的峰面积/溶剂配制的样本的峰面积×100%;肌苷或内标物的回收率=血清制备的样本的峰面积/经过前处理的空白基质配制的样本的峰面积×100%。
1.6.7 稳定性考察 配制肌苷低、中、高3 个质量浓度的质控样品,按“1.5.3”项下方法处理,进样测定峰面积。分别考察样品室温放置4 h、反复冻融3 次、-70 ℃放置7 d 和处理后自动进样器(4 ℃) 放置24 h 的稳定性。
1.7 健康志愿者12 h血浆浓度测定
采用本方法测定2 例健康志愿者血浆中肌苷的浓度。分别于0、0.5、1、1.5、2、2.5、3.5、4、5、6、8、10、12 h 抽取血浆,按“1.5.3”项下方法测定其中肌苷浓度。
2 结果
2.1 方法学验证
在进行色谱柱及流动相选择过程中,确定使用Waters XBridge C18柱时,肌苷及内标物的峰形较好,出峰时间也较快。流动相的组成对肌苷和内标物的电离程度有较大影响。有机相中,甲醇较乙腈可产生较高的信噪比且缩短了样品的出峰时间;水相中,乙酸铵水溶液浓度为50 mmol/L 时相比浓度为10 mmol/L 时可产生更强的信号响应。使用的SPE小柱以Oasis HLB可获得更高的回收率。
专属性考察结果见图2。6 名健康受试者的空白血浆样本均无内源性物质干扰。在28.5~912.0 ng/mL 的范围内,肌苷的线性关系良好(R2>0.999,表1)。肌苷在各浓度水平的日内精密度相对标准偏差(relative standard deviation,RSD)在3.1%~9.7%之间,日间精密度RSD在0.2%~7.0%之间,日内和日间RSD 均小于10%;准确度在96.9%~103.8%之间(表2)。准确度和精密度符合生物样品测定要求。提取回收率为98.9%~102.3%(表3)。在室温放置4 h、反复冻融3 次、−70 ℃放置7 d 和处理后自动进样器(4 ℃)放置24 h的情况下,肌苷的稳定性变化率均小于15%(表4)。肌苷和内标物的保留时间分别为2.5 min,分析运行时间仅为4 min。

图2 不同血浆样品肌苷及拉米夫定MRM色谱图Fig 2 Representative MRM chromatograms of inosine and lamivudine in different plasma samples

表1 线性关系与定量下限考察结果Tab 1 Results of linear relations and quantitative lower limits

表2 精密度和准确度结果Tab 2 Results of precision and accuracy test
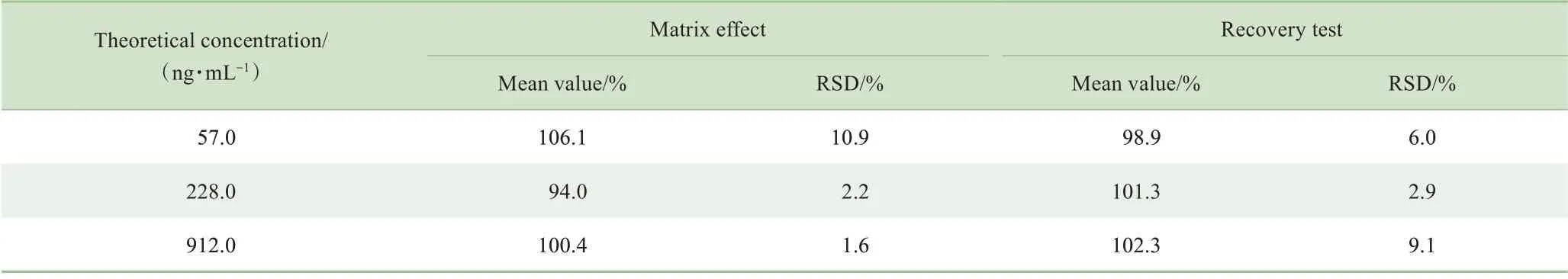
表3 提取回收率和基质效应Tab 3 Results of matrix effect and recovery test

表4 不同条件下稳定性考察结果Tab 4 Results of stability test under different conditions
2.2 健康志愿者12 h血浆浓度测定
2 例健康志愿者血浆肌苷浓度的药时曲线趋势相似,均存在多个峰(图3)。
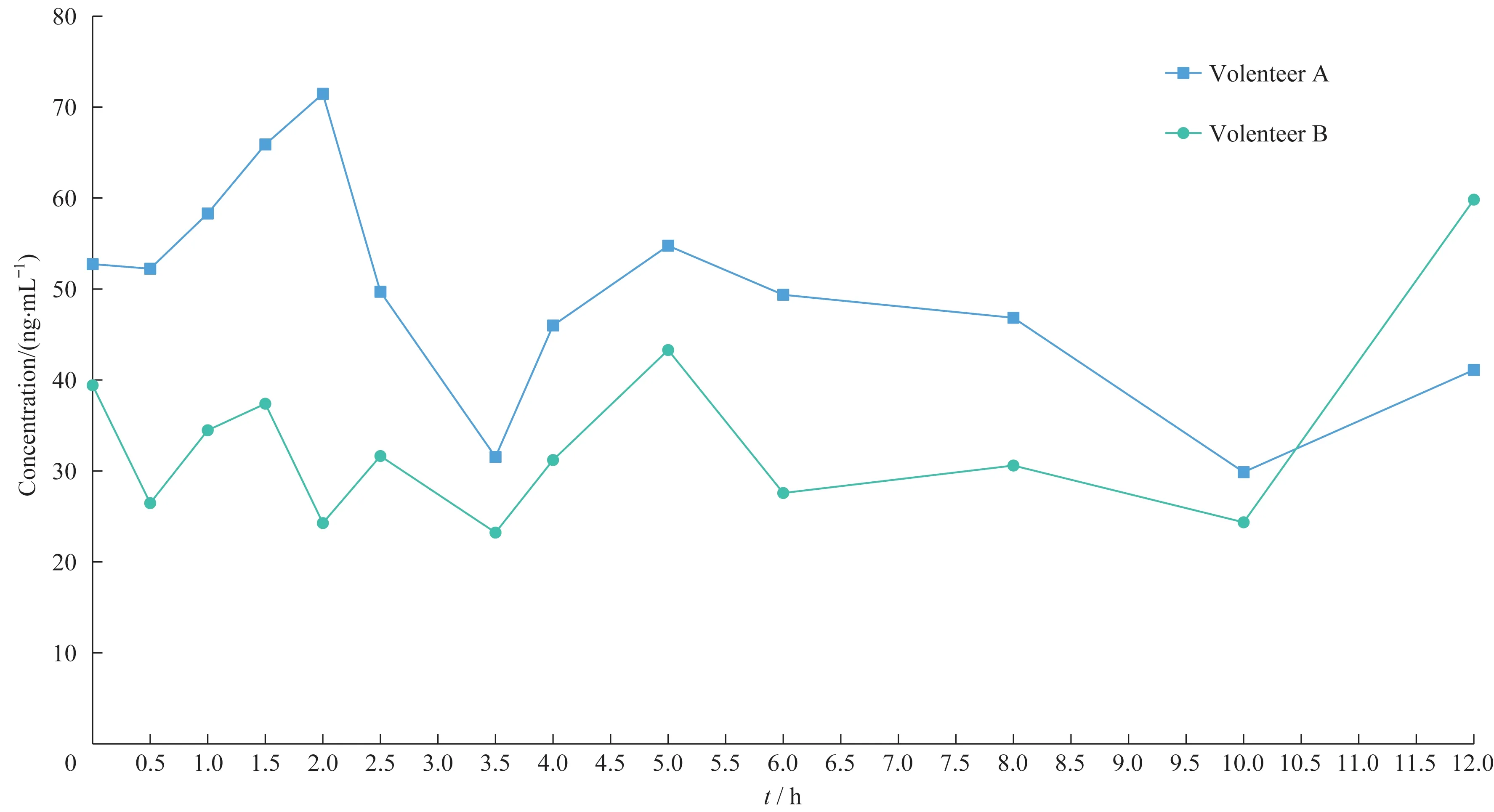
图3 2名健康志愿者的血浆中肌苷药时曲线Fig 3 Observed concentration-time curves of inosine in plasma of two healthy volunteers
3 讨论
目前,血浆样品的前处理过程中较为常用的有蛋白沉淀法、液液萃取法和SPE 法。蛋白沉淀法和使用乙酸乙酯的液液萃取法均可导致肌苷的回收率和灵敏度处于较低的水平。而HPLC-MS/MS 法与SPE 法结合用于生物样品的定量[19]在国外已被运用。使用SPE 法,可以在满足定量准确度的同时,提高样品的提取回收率。在分别考察了5 种SPE 小柱(Waters Oasis HLB、Oasis MCX、Oasis MAX、Oasis WCX、Oasis WAX) 后证实Waters Oasis HLB 小柱处理后的样品,可获得更好的回收率,并具有较低的基质效应。原因是Waters Oasis HLB小柱使用较平衡的亲水和亲脂性反相吸附剂,而肌苷作为一种亲水亲脂相对适中的化合物,可通过疏水作用与HLB 反相吸附剂相互作用,从而达到过滤和纯化样品的作用。
肌苷在血浆中不稳定,为了确保样品在处理及进样过程中的稳定性,本方法将血浆样品储存在-70 ℃的超低温冰箱中。经过实验发现,血浆中的肌苷放置在室温条件下,3 d 内降解至初始浓度的3.5%,远低于定量下限(28.5 ng/mL),可视为已降解完全。故本方法所使用的空白血浆即使用此方法获得。
由药时曲线可推测,进餐可能是影响人体血浆中肌苷浓度的重要因素之一。此外,肌苷的代谢途径复杂多样。作为人体嘌呤代谢的中间代谢产物,肌苷可由腺苷、次黄嘌呤核苷酸和次黄嘌呤产生,亦可以被代谢为次黄嘌呤以及次黄嘌呤核苷酸。由于代偿性反应,人体会进行自我调节增加或减少包括肌苷在内的内源性物质。其中,饮食、昼夜规律和生理周期会影响血浆中肌苷的浓度。而肌苷作为人体血浆中的内源性物质,它的代偿反应机制至今仍尚未被发现。
本研究建立的测定人血浆中肌苷的SPE-HPLC-MS/MS 方法准确、灵敏、简便。通过测定血浆中肌苷的浓度,可为临床肌苷检测提供有力依据,并且也可为后续的药代动力学研究提供支持。

