云南杂交玉米SSR标记核心引物的筛选及多样性分析
姚宗泽 杨肖艳 张艳明 段 忠 赵自仙
(1云南农业大学农学与生物技术学院,云南 昆明 650201;2大理白族自治州农业科学推广研究院,云南 大理 671005;3云南省绿色食品发展中心,云南 昆明 650224)
简单重复序列(simple sequence repeat,SSR)也称为微卫星标记,由2~5 个核苷酸为重复单位串联组成,广泛分布在整个真核生物基因组中。同一种植物中,在各个位点上重复单位的数量也不完全相同,从而形成了多态性,即SSR 分子标记[1]。大量研究表明,除在个别作物中SSR 位点等位基因数目不多外,很多作物中均表现出较高的多态性,一个SSR 位点等位基因数目最多可达几十个[2-3]。不同作物品种的遗传组成不同,使得基因组DNA 中SSR 的重复次数也存在差异,这种差异可先通过PCR 扩增,再借助琼脂糖凝胶电泳或聚丙稀酸胺凝胶电泳等技术检测到SSR[4]。
根据重复单位碱基数可将SSR 分为1~6 核苷酸重复类型[5],所有类型的微卫星中,单核苷酸重复和二核苷酸重复的微卫星在基因组中出现的频率最高。同一重复类型中,不同的碱基重复多态性也不一致。大豆中大于15 个重复单位的(GA)n的多态性较低,而较多的(AT)n重复的SSR 具有较高的多态性信息量[6]。Weber[7]按照微卫星核心序列结构的不同将微卫星标记分为三种类型:完全型(perfect)、不完全型(imperfect)和复合型(compound)。与其他分子标记技术相比,SSR 技术具有多态性高、呈共显性、对DNA 数量及质量要求不高、操作简单、成本低等优点[4]。
相关研究报道比较了DNA 指纹技术在植物新品种判定中的可行性,表明DNA 指纹技术的鉴定结果客观可靠[8-12]。SSR 标记已广泛应用于玉米、水稻、马铃薯、番茄、棉花和麦类等作物的遗传作图、遗传标记、DNA 指纹图谱、品种鉴定、遗传多样性以及遗传分化等方面的研究[13-16]。刘文彬等[17]筛选出多态性高、稳定性好、适用于自动化分型(荧光毛细管电泳)的9对SSR 引物。胡萍等[18]为构建玉米种质DNA 指纹库,分别筛选出作贵州普通玉米和贵州糯玉米的SSR核心引物23 对和15 对。韩凤龙[19]筛选得到6 个SSR标记,适用于河南小麦品种特异性和一致性鉴定。SSR 标记应用于大豆(Glycine max)[20]、油菜(Brassica campestrisL.)[21]、玉米(Zea mays)[22-23]、番茄(Solanum lyooper)等[24]作物的特异性、一致性、稳定性(distinetness,uniformity,stability,DUS)检测在日益增加。在Maize database 网站上公布的SSR 引物已有1 800 多种,但真正具有利用价值的引物较少,只有那些多态性高、带型清晰稳定和重复性好的引物才能被有效应用[25]。玉米品种SSR 标记鉴定技术规程,推荐了40 对SSR 引物用于品种鉴定,本研究对这40 对引物进行进一步筛选,旨在选出可用于云南玉米杂交种特异性鉴定使用的核心引物,从而降低引物合成成本,加快鉴定程序。
1 材料与方法
1.1 材料
试验涉及的220 个杂交玉米品种材料见表1,其中113 个购自云南市场,23 个为云南种业集团联合体提供的2017—2018年区试品种,33 个为未审定玉米新组配,51 个为未提供品种名称的已通过云南省审定的杂交玉米品种,在本研究材料名称中暂记为未知。研究选用的40 对SSR 引物,均为玉米SSR 标记鉴定规程中推荐的引物[26]。
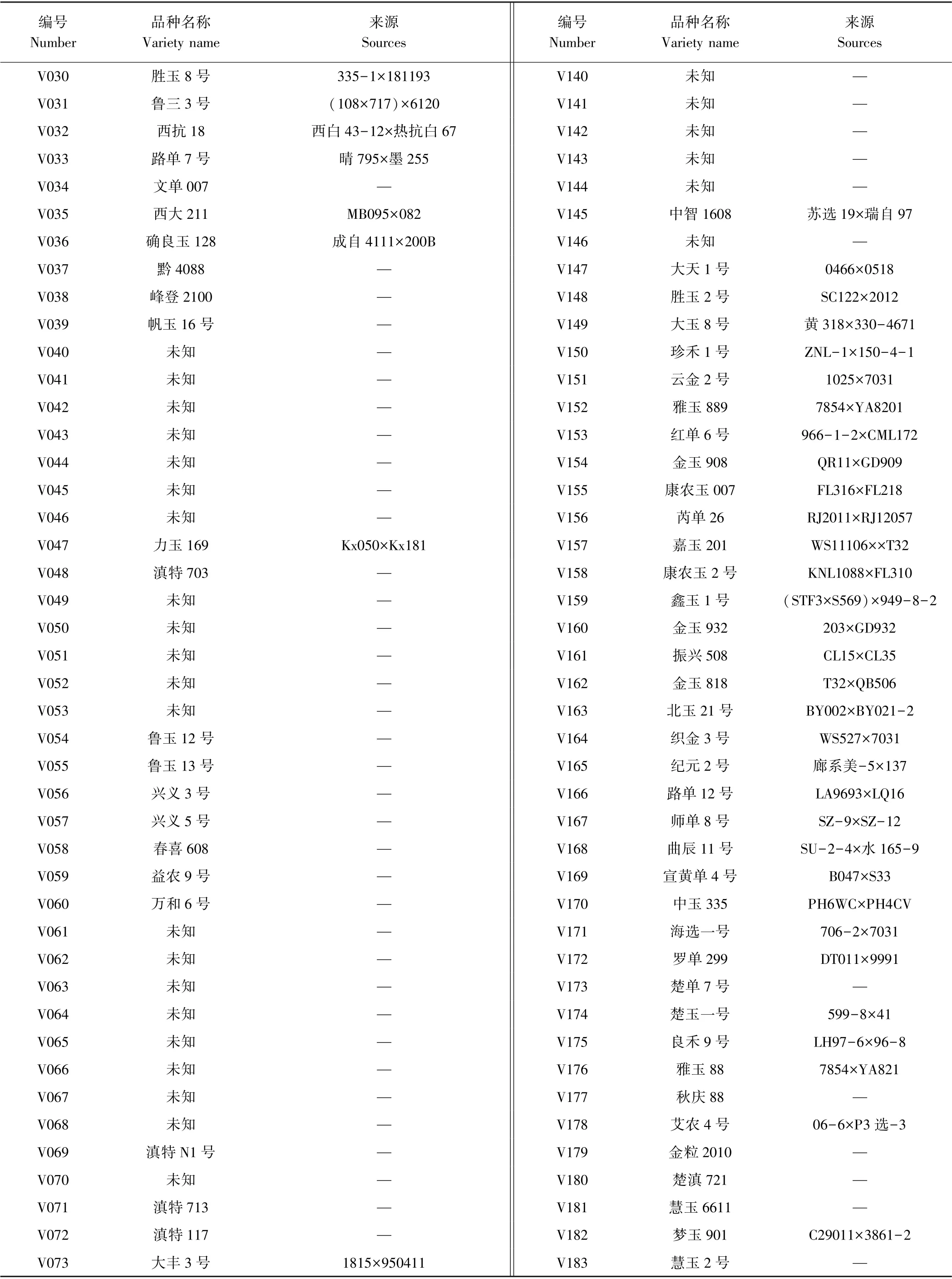
表1(续)

表1(续)
1.2 方法
1.2.1 材料准备 用发芽盒在光照培养箱中培育玉米幼苗,每个品种30 粒,以每天16 h 黑暗/25℃、8 h光照/30℃条件培养6 d,即可取样提基因组DNA。每个材料剪取20 片相等叶面积的幼苗叶片,每株幼苗取1 片,剪碎充分混合,再取样提取基因组DNA。
1.2.2 基因组DNA 提取 取约250 mg 叶片,基因组DNA 提取具体步骤参照Saghai-Maroof 等的[27]方法,以100 μL 超纯水充分溶解基因组DNA。用琼脂糖电泳对提取DNA 质量进行检测。
1.2.3 PCR 扩增及普通非变性PAGE PCR 反应体系为20 μL,包括Green Taq Mix 12.0 μL、正反向引物合1.0 μL、DNA 1.0 μL,ddH2O 6.0 μL,整个操作过程均在冰上完成。PCR 反应程序:94℃预变性5 min,1次循环;94℃变性40 s,57~61℃退火35 s,72℃延伸45 s,35 次循环;72℃,7 min。待PCR 扩增完成后,用0.8%琼脂糖凝胶电泳对PCR 扩增产物进行检测。
普通非变性聚丙烯酰胺凝胶电泳(polyacrylamidegegel gel electrophoresis,PAGE)参照玉米SSR 标记鉴定规程中的要求进行[26]。
1.2.4 引物筛选 试验先以表1中编号V001-V012杂交玉米品种为材料,从40 对标准SSR 引物中筛选出20 对多态性高、扩增条带清晰、稳定性好的引物,作为SSR 标记分析核心引物。并以表1中的220 个杂交玉米为材料,对所筛选的20 个SSR 核心引物作进一步分析评价。
1.2.5 SSR 遗传多样性分析 采用Shannon-Weaver多样性指数为指标[28],利用PopGen32 软件分析不同SSR 标记的多样性大小。Shannon-Weaver 多样性信息指数(H′)的计算公式为:
式中,Pi为某个SSR 标记位点中第i个等位基因出现的频率,i≤Na,Na 为SSR 标记的等位变异数目。Ne 为有效等位变异数[29-30],其计算公式如下:
1.2.6 聚类分析 根据220 个杂交玉米材料的基因类型,利用NTSYSpc2.10e 统计软件中similarity 程序计算相似系数,以Clustering 程序中SHAN 进行UPGMA(unweighted pair group method with arithmetic mean,非加权组平均法)聚类分析[28]获得品种间的相似系数。并用MEGA6 软件中Phylogeny 绘制各玉米品种的遗传聚类系统树。
2 结果与分析
2.1 DNA 检测结果
用1%琼脂糖凝胶电泳对提取的DNA 样品质量进行检测,如图1所示,DNA 条带明亮、清晰完整、拖尾不明显。说明所提取的DNA 纯度好、质量高,杂质含量较少,可用于后续试验。
2.2 核心引物筛选结果
用12 个杂交玉米品种对40 个SSR 引物进行筛选,结果如表2所示,40 对引物中每对引物扩增出6~15 个等位变异位点,共检测到412 个等位基因,平均每对引物检测到10.30 个;具有多态性位点有4~15个,平均每对引物检测到多态性位点9.40 个;多态性位点百分率为50.00%~100.00%,平均每对引物多态性位点百分率为90.53%。有7 对引物扩增条带效果较好,16 对引物扩增效果为好,11 对引物扩增效果差,6 对引物扩增效果较差(图2)。
综合考虑引物多态性及扩增效果,筛选出20 对引物,引物编号分别为P1、P2、P3、P4、P5、P6、P7、P8、P11、P12、P13、P15、P17、P19、P21、P22、P24、P25、P28、P33,推荐其作为核心引物,在SSR 标记鉴定云南杂交玉米品种时优先使用。通过分析,20 对核心引物在12 个杂交玉米品种中共检测到216 个等位基因,20对核心引物检测到的等位基因占总数的52.43%,平均每对引物检测到10.80 个,变幅为7~15 个;具有多态性位点有4~14 个,平均每对引物检测到多态性位点9.70 个;多态性位点百分率为50.00%~100.00%,平均每对引物多态性位点百分率为88.66%。
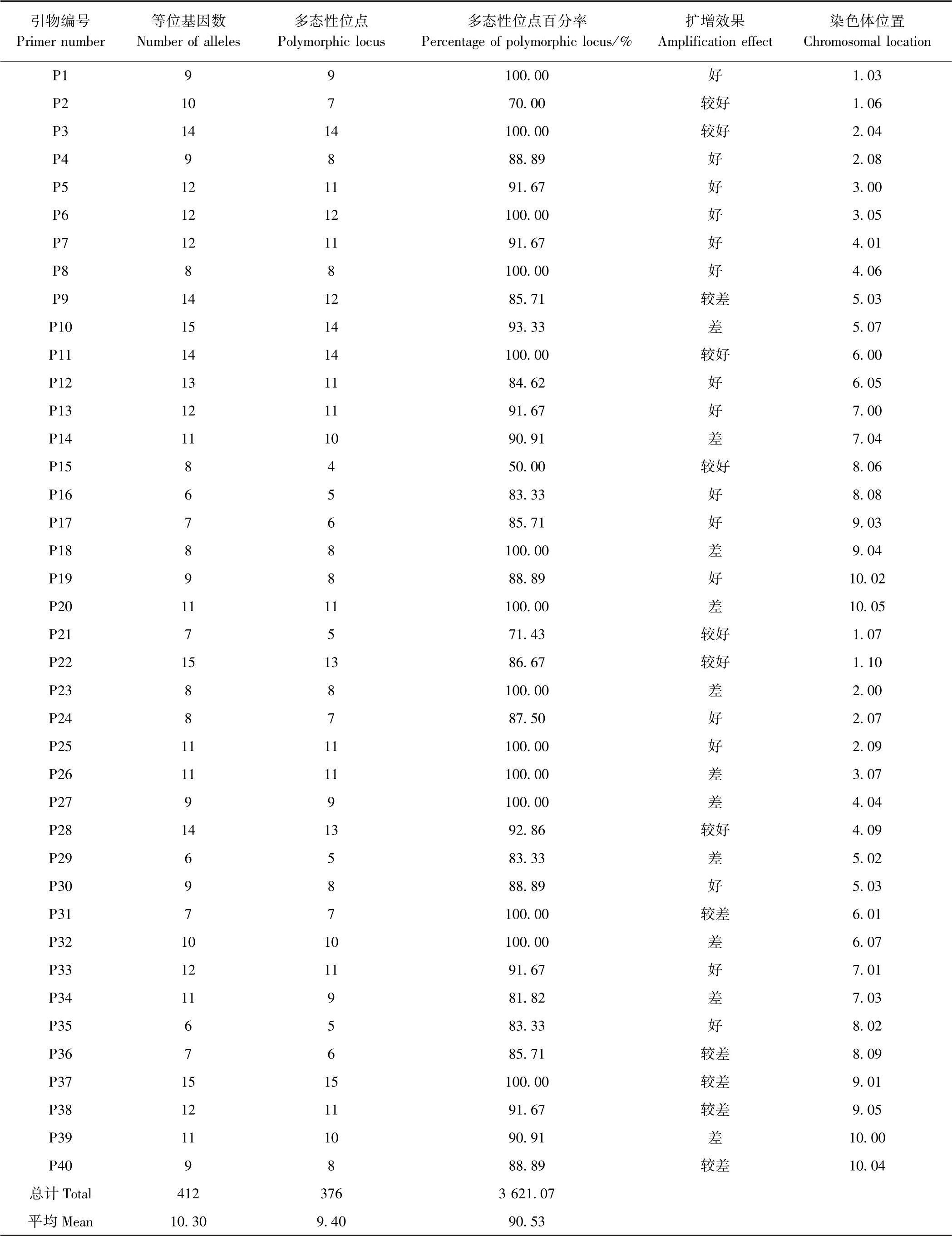
表2 40 对SSR 引物扩增结果Table 2 Amplification results for 40 pairs of SSR primer
2.3 杂交玉米材料SSR 遗传多样性分析
利用PopGen32 软件分析220 个杂交玉米材料中20 个标记的等位变异数(Na)、有效等位变异数(Ne)和Shannon-Weaver 多样性信息指数(H′)。由表3可知,20 对SSR 核心引物在220 个杂交玉米材料中共检测到236 个等位变异,平均每个引物检测到11.80 个,变幅为7~17 个;平均有效等位变异为3.158 8,变幅为1.241 3~5.671 1;平均Shannon-Weaver 多样性信息指数为3.028 2,变幅为1.426 2~4.813 9。
2.4 杂交玉米材料聚类分析
采用UPGMA 法对220 个杂交玉米材料进行聚类分析,结果表明220 个杂交玉米材料间的相似系数为0.62~0.95,聚类结果如图3所示。以最低相似系数0.62 为阈值可将220 个杂交玉米材料划分为两大类群,其中第Ⅰ类群共有10 个杂交玉米材料,占4.5%;第Ⅱ类群共有210 个杂交玉米材料,占95.5%。第Ⅰ类群的10 个杂交玉米材料均为区试品种,表明该10个区试品种的亲本较其他亲本亲缘关系更远,具有一定的创新性。聚类结果显示,良禾668(V198)与宣瑞4 号(V218)的相似系数最高,为0.95;V187 与胜玉607(V204)的相似系数最低,为0.62。220 个杂交玉米材料均为在云南各地区种植的品种和试验示范的材料,从聚类图可看出,220 个杂交玉米材料间最高相似系数达到0.95,但未出现同时有几个材料聚集在一起的情况,说明本研究所选的材料来源广泛,具有代表性,研究结果具有一定的科学依据和参考价值。
3 讨论
3.1 SSR 核心引物筛选
筛选的20 对SSR 核心引物,在12 个杂交玉米品种中共检测到216 个等位基因,平均每对引物检测到10.80 个,变幅为7~15。在220 个杂交玉米材料中共检测到236 个等位变异,平均每个引物检测到11.80个,变幅为7~17;平均有效等位变异为3.15 88,变幅为1.241 3~5.671 1;平均Shannon-Weaver 多样性信息指数为3.028 2,变幅为1.426 2~4.813 9。从两组杂交玉米材料的鉴定分析结果可知,两组数据比较接近,说明该20 对SSR 引物扩增结果比较稳定、重复性好。20 对SSR 核心引物分布在9 条染色体上,覆盖90%的玉米染色体组。20 对核心引物在玉米5 号染色体上未分布,在其他染色体上均有分布。可能是由于在玉米5 号染色体上SSR 较少或者多态性低,也有可能是玉米品种SSR 标记鉴定技术规程中推荐的40对标准引物,并不适用于5 号染色体中SSR 的扩增。SSR 在个别作物中存在较少,但广泛分布在玉米[31]、水稻[32]、大麦[33]等作物中。故推断这20 对SSR 引物适合用于云南杂交玉米品种的特异性鉴定,推荐其作为核心引物,在云南玉米杂交种特异性鉴定时优先使用。
核心引物的确定是SSR 标记鉴定的重要组成部分,不仅大大降低了引物合成的成本,而且还可减少很多不必要的工作[34]。如果统一使用一套核心引物,可以比较与整合来自不同研究单位的不同材料的指纹结果,促进资源共享。Li 等[35]推荐了13 对多态性较高的核心SSR 引物,认为13 对核心引物非常适合用于陆地棉、海岛棉和亚洲棉的鉴定和DNA 指纹图谱构建,减少SSR 引物数量,降低成本。
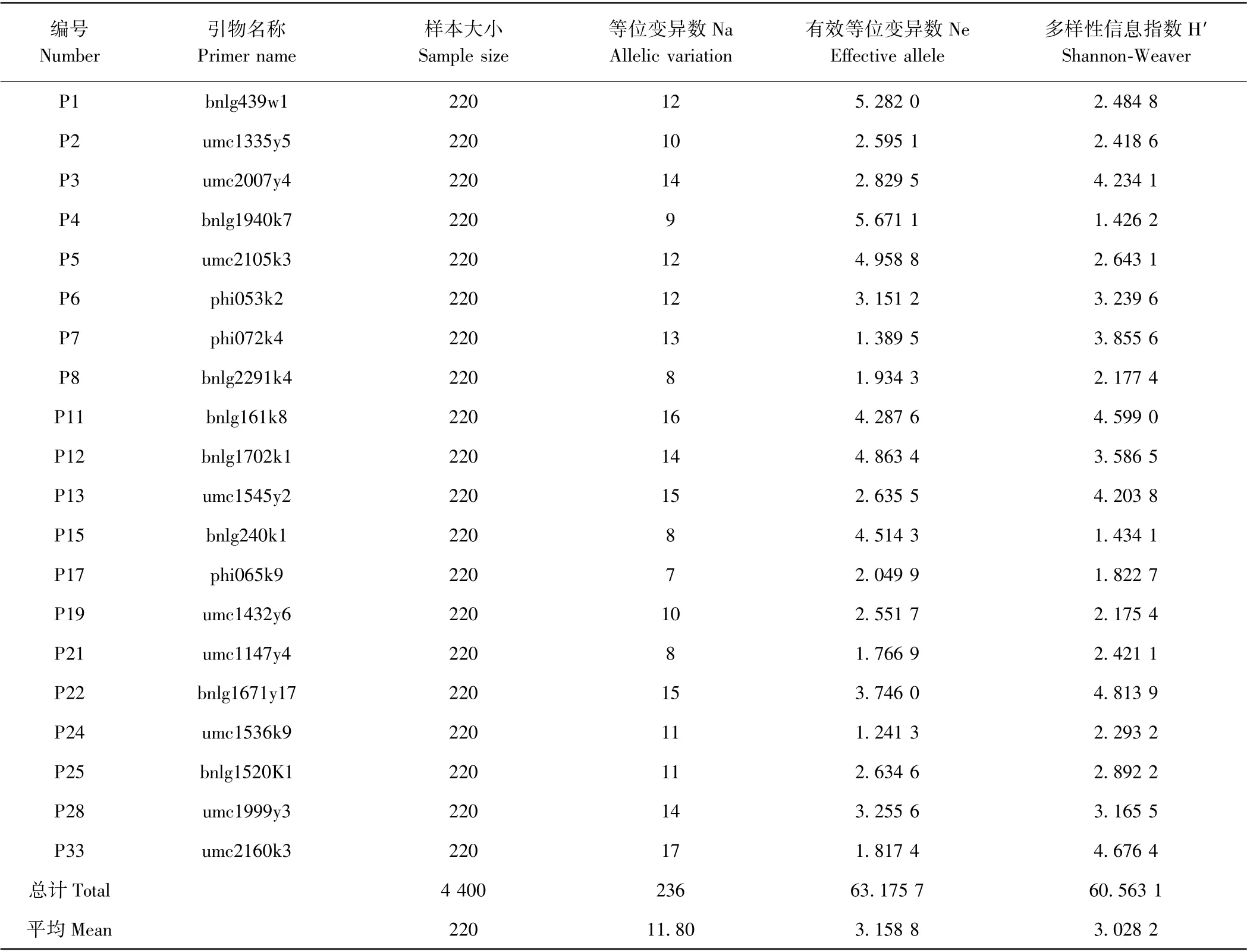
表3 20 对SSR 标记在220 个杂交玉米材料中的多样性参数Table 3 Diversity parameters of 20 pairs of SSR markers in 220 maize hybrid materials
3.2 220 个杂交玉米材料多样性分析
220 个杂交玉米材料间的相似系数为0.62~0.95,以0.62 为阈值可将材料分为两大类群,第Ⅰ类群包括10 个玉米材料,第Ⅱ类群包含210 个玉米材料。第Ⅰ类群的10 个杂交玉米材料均为区试品种,表明该10 个区试品种的亲本较其他亲本亲缘关系更远。聚类结果显示,良禾668(V198)与宣瑞4 号(V218)的相似系数最高,为0.95;V187 与胜玉607(V204)的相似系数最低,为0.62。尽管有一些杂交玉米材料与其他材料之间存在一定的遗传差异,但整体差异不大。本研究的220 个杂交玉米材料中不仅包括一些正在区试的杂交玉米品种,还有已经在市场上推广的杂交玉米品种,说明当前培育的杂交玉米品种,与其他作物存在同样的问题,在基因型上存在同质化趋势,导致很多品种在表型上没有区别[36]。导致品种同质化的原因,可能是核心亲本的集中使用,也有可能是核心亲本之间亲缘关系较近。突破这一瓶颈,势必要加强基础材料收集、研究与创新[37]。拓宽基础材料,选择来源和生态差异较大的材料,充分发挥现代生物技术在农作物新品种培育过程中的作用[38-39],将有可能培育出综合性状优良,且超越当前主推品种的新品种。
4 结论
本研究从玉米SSR 标记鉴定规程推荐的40 对SSR 引物中筛选出多态性高、扩增效果好、稳定性好的20 对引物,推荐其作为核心引物,在云南玉米杂交种特异性鉴定时优先使用。

