桥接起搏器在经导管主动脉瓣置换术后合并高度房室传导阻滞中应用的安全性及可行性分析
王明蛟 李光照 胡彩娜 郭胜存 刘亚东 户富栋 付新 姜正明 陈魁
自2002年经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)被首次成功运用于临床,由于其显著的优势,TAVR近20年来在全球各大心脏中心发展迅猛并日渐成熟。然而,TAVR后并发症仍是不可避免的问题。尤其TAVR后心脏传导阻滞并永久性心脏起搏器(permanent pacemaker,PPM)植入发生率持续较高。国际上多个注册临床试验报道的TAVR后PPM植入率普遍在13%~33.7%[1-2];而国内5家大型心脏病中心进行的TAVR临床研究显示术后6个月内,19例(18.8%)患者植入PPM[3]。然而,目前研究显示相当比例PPM植入患者的心脏传导功能可在一定时间内恢复,只有短期起搏的必要[4-5]。因此,TAVR后出现高度房室传导阻滞的患者是否需要植入PPM有待进一步证实。在临床上发现对于TAVR后新发高度房室传导阻滞且2 d内未恢复传导功能的患者,应用桥接起搏器期间部分患者可恢复心脏传导功能,进而避免了PPM植入而降低了患者的非计划手术率及经济负担,且不会影响患者的心功能恢复情况。本研究旨在针对TAVR术后合并高度房室传导阻滞患者应用桥接起搏器的安全性和可行性进一步的分析和探讨。
1 对象与方法
1. 1 研究对象
纳入2019年8月1日至2020年8月1日在郑州大学第一附属医院接受TAVR治疗的患者63例中术后出现高度房室传导阻滞且2 d内未恢复传导功能的主动脉瓣重度狭窄患者10例(15.9%)。高度房室传导阻滞指莫氏Ⅱ型房室传导阻滞及三度房室传导阻滞。10例均使用Venus-A瓣膜, 随访30 d。入选标准:(1)症状性的重度主动脉瓣狭窄,有效瓣口面积≤1.0 cm2和(或)平均跨瓣压差≥40 mmHg(1 mmHg=0.133 kPa);(2)纽约心脏病协会(New York Heart Association,NYHA)心功能分级≥Ⅱ级;(3)CT显示解剖结构适合TAVR;(4)外科手术高危或禁忌。排除标准:(1)术前CT测量主动脉瓣狭窄患者的主动脉根部内径≥40 mm;(2)主动脉瓣狭窄患者预期寿命<1年;(3)主动脉瓣狭窄患者在近30 d内发生过心肌梗死或合并未处理的严重冠状动脉狭窄;(4)合并梗阻性肥厚型心肌病;(5)心导管手术禁忌,如急性感染、心脏内血栓等。高度、莫氏Ⅱ型房室传导阻滞及三度房室传导阻滞诊断标准参考《黄宛临床心电图学》。本研究获得郑州大学第一附属医院科研和临床试验伦理委员会的批准(批准文号:2020-KY-290)。
1. 2 手术方法
TAVR后出现高度房室传导阻滞的患者常规留置临时起搏器2 d,观察组10例均未恢复窦性心律,行桥接起搏器植入术。术前签署知情同意书,告知患者桥接起搏器所涉及伦理风险问题。选用波科4471电极(桥接起搏器植入费用由本中心提供,其他治疗费用患者自行承担),具体方法为:选取右侧锁骨下静脉为首选穿刺点,次选右颈内静脉。患者取仰卧位。常规消毒铺巾,2%利多卡因局部麻醉,穿刺成功后送入8 F可撕开鞘。经鞘管送入心室电极至右心室低位间隔,旋出电极头端螺旋固定于间隔,撕除鞘管,测试起搏参数:起搏阈值<1.5 V(脉宽0.4 ms)、R波感知>5 V、阻抗参数<1300 Ω,满意后将保护套送入穿刺口缝线固定,并将电极连接至消毒后的单腔永久起搏器或双腔永久起搏器(因故弃用但电量充足)的心室电极插孔内,程控为VVI模式(起搏频率60次/分,输出电压3.5 V,脉宽0.40 ms),以无菌纱布覆盖起搏器电极,将起搏器固定于胸壁上,定期换药,观察至TAVR术后30 d。如TAVR术后30 d心脏传导功能仍未恢复则拔除桥接起搏器(电极废弃),行PPM植入术,若传导恢复则拔除桥接起搏器。桥接起搏器植入后不影响患者出院时间。
1. 3 观察指标
10例患者TAVR术后2 d内行心电监护,术后30 d内每日行常规心电图检查,第30天门诊复查超声心动图。观察指标为可行性和安全性。可行性为桥接起搏器植入期间患者心脏传导功能恢复。安全性为桥接起搏器植入期间并发症发生率及心功能恢复情况。桥接起搏器并发症包括心室电极脱位、心室穿孔、起搏器相关感染等。
1. 4 统计学分析
所有数据运用SPSS 21.0软件进行统计分析。计量资料以 (±s)表示,计数资料以例(比)表示。
2 结果
2. 1 基线资料
10例患者平均年龄为(74.9±7.0)岁, 其中男性5例(5/10),平均STS评分(9.10±3.75)%(表1)。10 例患者均采用股动脉切开入径,10例均采用全身麻醉。10例患者在置入瓣膜前均予以球囊预扩张,3例患者使用瓣膜直径≥29 mm,平均瓣膜置入深度9.32 mm。所有患者术后即刻超声心动图均无大量瓣周漏,无瓣膜移位,无瓣中瓣。10例患者均成功经股动脉入径置入人工心脏瓣膜。其中1例发生左主干阻塞并循环崩溃,术中已行冠状动脉保护,迅速于左主干开口置入1枚支架后血流动力学指标恢复,手术成功;其余9例术中、术后无急性心肌梗死、无脑血管意外事件、入径并发症等发生;术后8例患者出现三度房室传导阻滞, 1例高度房室传导阻滞,1例莫氏Ⅱ型房室传导阻滞(表2)。
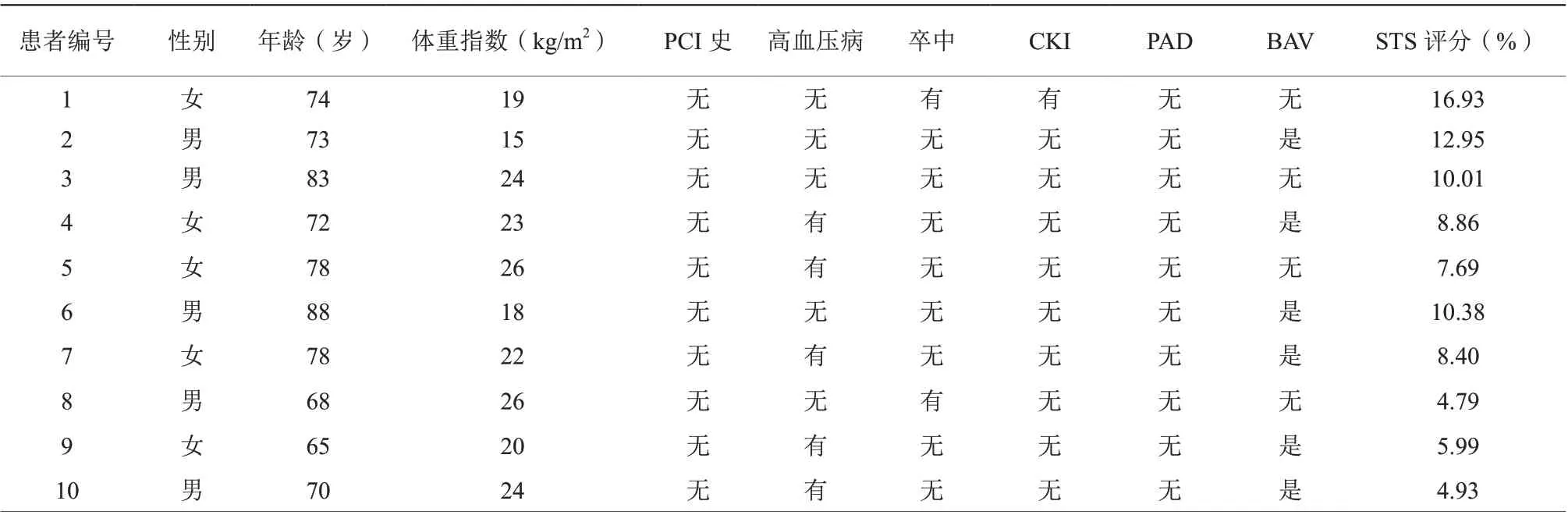
表1 10 例患者基线资料
2. 2 桥接起搏器应用及心脏传导恢复时间
10例出现高度房室传导阻滞的患者在TAVR后2 d内均未恢复传导功能,均于TAVR后2 d行桥接起搏器植入术,入径均为经右侧锁骨下静脉入径,10例均成功植入桥接起搏器,平均心室电极感知(9±2)mV,平均心室电极起搏阈值(0.8±0.2)V,平均心室电极阻抗(721±134)Ω。随访30 d期间,10例患者中3例患者恢复心脏传导功能(首次恢复时间分别是TAVR术后第8天、第21天、第7天),并于TAVR术后第30天对其进行评估均无起搏器植入适应证,予以拔除桥接起搏器;余7例患者未恢复心脏传导,并于TAVR术后第30天评估均有植入PPM适应证,则植入PPM。10例患者在植入桥接起搏器的28 d内均未见电极脱位、心室穿孔、起搏器相关感染等并发症发生。
2. 3 TAVR前、后血流动力学变化
1个月后随访10例患者临床症状均显著改善,超声心动图提示血流动力学改善(表3)。
3 讨论
传导阻滞是TAVR后最常见的并发症之一,主要包括新发左束支传导阻滞(left bundle branch block,LBBB)和高度房室传导阻滞,治疗方案主要为植入PPM。TAVR后出现高度房室传导阻滞的机制并未完全清楚,研究显示,TAVR后置入人工瓣膜的瓣架在高位对房室结或希氏束压迫导致其炎症水肿可能为高度房室传导阻滞发生的机制[6]。尸检报道,置入Sapein 3瓣膜后,室间隔基底部发生了局部缺血性坏死,并波及到了局部纤维传导系统[7]。Rodés-Cabau等[8]研究显示,PPM的危险因素包括使用直径过大的瓣膜、使用直径过大的球囊、术前存在右束支传导阻滞(right bundle branch block,RBBB)、瓣膜置入过深、一度房室传导阻滞、使用自膨胀瓣膜、室间隔膜部长度、无冠状动脉瓣钙化容积等解剖因素。

表2 10 例患者桥接起搏器使用及其心脏传导恢复时间
虽然TAVR器械在不断更新,但传导阻滞的发生率并没有显著下降[9],当前临床研究显示不论是第三代Corevalve瓣膜(即Corevalve Accutrak)与其第二代瓣膜对比,还是Edwards新一代瓣膜Sapein 3与其老一代瓣膜对比,TAVR后PPM植入率并未下降[10-11]。因此对TAVR后合并高度房室传导阻滞患者的起搏器植入适应证及植入时机的选择对患者预后及其经济负担都有很大影响。但当前国内、外各心脏中心对此尚未有统一定论。欧洲的一项多中心研究建议对TAVR术后出现莫氏Ⅱ型或者高度房室传导阻滞的患者进行7 d的临床观察和心电监护,明确传导阻滞是暂时性还是永久性,再决定是否植入PPM[12]。当前国内专家共识认为,术中或术后出现高度房室传导阻滞,且在术后2 d内未恢复心脏传导功能的患者应植入PPM[13]。此外,Boerlage-Van等[4]研究发现约20%术后新发的LBBB是暂时的,20%PPM植入的患者只有短期心脏起搏必要[4]。Ramazzia等[5]通过随访TAVR后植入PPM的患者发现,只有约1/3的患者真正需要心室起搏,且均是高度房室传导阻滞患者。以上研究提示TAVR后出现高度房室传导阻滞患者,如未经充分评估而过早植入PPM,可能会增加其中可恢复传导功能患者的非计划手术次数及经济负担,因此,对于这部分患者,在一定时间段内采用经济有效的措施,进行充分的评估以及合理的PPM植入是很有必要的。桥接起搏器的应用为该类患者提供了一个最佳观察时机,在一定程度上降低了PPM植入率。
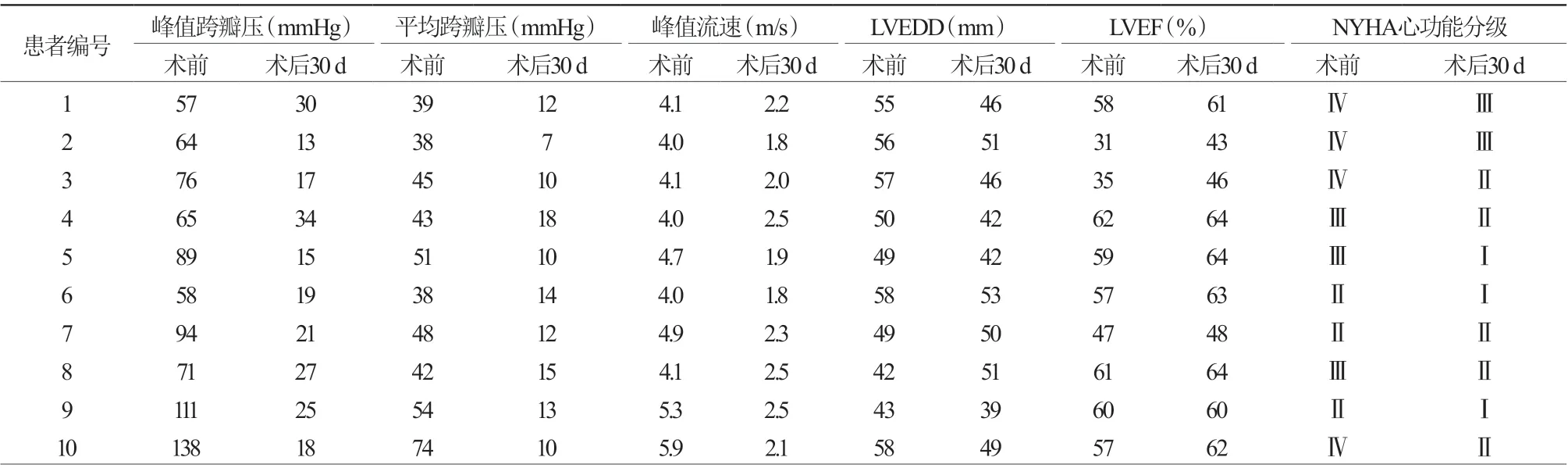
表3 10 例患者TAVR 术前、后血流动力学变化
桥接起搏器这一技术在国内的报道较少,较早由郭飞等[14]应用于起搏器感染拔除原有PPM与新的PPM植入之间的桥接起搏,并证实了主动固定临时起搏的安全性和有效性。传统临时起搏电极脱位率较高[15],对于起搏器依赖患者而言,电极脱位会带来巨大风险,轻者引起心动过缓、血流动力学不稳定,严重者甚至导致心搏骤停或者室性心动过速、心室颤动而死亡。普通临时起搏器电极柔顺性差,易引起心室穿孔[16]。普通临时起搏器电极植入的时间越长,电极脱位及心室穿孔的风险就越大。此外,为了降低脱位风险常常要求患者长时间制动,但会增加其发生静脉血栓的风险,且易导致老年患者严重不适。而研究显示应用桥接起搏器时,电极脱位及心室穿孔发生率明显降低[17-18]。本研究中10例桥接起搏器植入后无电极脱位、心室穿孔及起搏器相关感染发生。整体而言,桥接起搏器有以下优势:(1)临时起搏的周期更长,方便对患者传导功能的恢复进行充分的观察,减少不必要的PPM植入;(2)对患者体位要求低,无需严格制动,可在院外使用;(3)降低临时起搏电极脱位及心室穿孔风险;(4)利用废弃起搏器,能够通过减少PPM植入,降低费用或少量增加患者费用。
通过对本研究入选的10例桥接起搏器植入患者的随访观察发现,10例患者均成功经股动脉入径置入人工心脏瓣膜,其中1例发生左主干阻塞并循环崩溃,术中已行冠状动脉保护,迅速于左主干开口置入1枚支架后血流动力学指标恢复,手术成功;其余9例术中、术后无急性心肌梗死、无脑血管意外事件、入径并发症等发生。术后30 d,10例患者超声心动图指标及NYHA心功能分级均优于术前,说明TAVR后患者血流动力学均取得良好改善。3例患者在观察期间恢复传导功能,并且均在TAVR后2 d以后,提示2 d的观察周期可能不够充分。所有患者在植入桥接起搏器期间均未出现电极脱位、心室穿孔及起搏器相关感染等并发症,证明了桥接起搏器的安全性。
总之,本研究初步说明桥接起搏器增加传导功能的观察时间并具有极低并发症发生率,减少了PPM的植入,且不影响其心功能恢复,在TAVR后出现高度房室传导阻滞的患者中值得临床推广应用。但是,本研究尚存在局限性:病例数较少,为单中心、回顾性、非随机研究,故结论需要更大样本、多中心和前瞻性研究的进一步证实。

