急性冠状动脉综合征合并肾功能不全患者抗血小板治疗致出血危险因素分析
张璐,张玉娇,王谦,任乐,田会萍,董亚琳*(.西安交通大学第一附属医院药学部,西安 7006;.陕西科技大学食品与生物工程学院,西安 700)
急性冠状动脉综合征(acute coronary syndrome,ACS)是以冠状动脉粥样硬化易损斑块破裂,继发完全或不完全闭塞性血栓形成为病理基础的一组临床综合征。抗血小板治疗是ACS患者最重要的治疗手段。双联抗血小板药物阿司匹林和P2Y12 受体抑制剂是目前ACS 和/或经皮冠状动脉介入治疗术(percutaneous coronary intervention,PCI)术后预防血栓事件的基石[1-2]。研究表明,ACS 中合并肾功能不全的患者约占20%~40%,但在大型临床试验中,由于随机对照的人数不足,针对这一患者群的双联抗血小板治疗的安全性与有效性报道较少[3]。然而,肾功能障碍会导致动脉粥样硬化加速,血栓形成风险增加,并且增加了使用抗血栓药物不良反应的风险[4]。双联抗血小板药物用于ACS 合并肾功能不全患者的PCI 术后的抗血小板治疗,降低二次心肌梗死、卒中及心血管死亡事件发生的同时,其导致出血的不良反应仍不容忽视。本文旨在通过回顾性分析ACS 合并肾功能不全患者的临床资料,探索与出血有关的危险因素,为预防和减少ACS 患者发生出血事件提供参考。
1 资料与方法
1.1 一般资料
调取2018年1月-2019年12月出院的ACS 合并肾功能不全[肾小球滤过率(glomerular filtration rate,GFR)<90 mL/(min·1.73 m2)]的患者资料,所有患者均符合2018年美国心脏协会AHA/美国心脏病学会ACC STEMI 及NSTEACS 诊断与治疗指南[5]。
入选患者的纳入标准为:① ACS 成人患者(≥18 岁);② 入院期间PCI 术后使用双联抗血小板药物;③ 患者的GFR:≥30 mL/(min·1.73 m2)且<90 mL/(min·1.73 m2)。排除标准为:① 近期(<6 个月)手术、外伤史,出血性疾病史和脑血管疾病史,凝血功能异常,严重贫血和血小板减少症以及未能控制的严重高血压(收缩压>180 mmHg 和/或舒张压>110 mmHg)等影响出血发生的病史;② 血小板计数:>450×109·L-1或<100×109·L-1;③ 窦性停搏、高度房室传导阻滞及对氯吡格雷、替格瑞洛及腺苷过敏者;④ 肝功能异常(丙氨酸转氨酶和天冬氨酸氨基转移酶大于正常参考值3 倍)。
利用Excel 表格对病例内容包括患者年龄、性别、收缩压、舒张压、空腹血糖、三酰甘油(TG)、GFR 的水平、抗血小板治疗方案、剂量、治疗周期及抗凝血药物和质子泵抑制剂的使用情况等内容进行汇总,分析抗血小板治疗后一个月内发生出血的危险因素。患者出院后,临床药师每周进行电话随访,收集患者用药信息,对患者的出血情况进行记录。
1.2 治疗方法
患者行急诊PCI 术前均给予负荷剂量的抗血小板药物,即阿司匹林300 mg 联合氯吡格雷300 mg 或阿司匹林300 mg 联合替格瑞洛180 mg。术中给予静脉注射肝素,术后给予阿司匹林100 mg qd 联合氯吡格雷150 mg qd(104例,一个月后调整为75 mg)或阿司匹林100 mg qd 联合替格瑞洛90 mg bid(97例,部分患者住院2 次以上,记为1例),疗程为一个月。根据P2Y12 受体抑制剂的种类不同,将患者分为观察组(替格瑞洛组)与对照组(氯吡格雷组)。
1.3 对于出血的定义
根据2011年出血学术研究会(Bleeding Academic Research Consortium,BARC)制定了统一的出血分类标准,即BARC 出血定义,用于评估ACS 患者远期预后[6]。出血类型共分为5 种类型。其中0 型为未出血;1 型为非活动性出血;2 型为任何明显活动性出血;3 型为明显活动性出血,血红蛋白下降为3 ~5 g·dL-1,需要输血的明显出血(3a);3 型为明显活动性出血,血红蛋白下降>5 g·dL-1(3b),颅内出血(3c);4型为冠状动脉旁路移植术(coronary artery bypass grafting,CABG)相关出血、48 h 内围手术期的颅内出血、胸骨闭合后需再次手术来控制的出血、48 h 内输全血或红细胞≥5 U、24 h 内胸导管引流≥2 L;5 型为致命性出血。
1.4 统计学方法
采用Excel 收集资料并整理。采用SPSS 24.0 统计软件分析。计数资料用χ2检验,采用 Logistic 回归分析确立ACS 合并肾功能不全患者发生出血的独立危险因素。P<0.05 表示差异具有统计学意义。
2 结果
2.1 出血组与非出血组患者基本特征比较
根据术后服用药物治疗过程中是否出血的情况分为非出血组133例,男114例,女19例;出血组68例,男58例,女10例。其中,出血组与非出血组患者相比,年龄(岁)、收缩压(mmHg)、术前及术后血小板计数、术前白细胞计数及TG、GFR 等因素差异均具有统计学意义(P<0.05),详见表1。
2.2 不同P2Y12 受体抑制剂组间出血并发症比较
根据PCI 术后应用P2Y12 受体抑制剂的品种不同分为替格瑞洛组与氯吡格雷组,两组的出血率差异具有统计学意义(P<0.05),结果见表2。
2.3 出血组与非出血组患者既往史、心血管事件高危因素比较
与非出血组相比,出血组中既往行CABG 者(13.24%vs0.75%)、心血管事件高危因素为高血脂者(42.65%vs20.30%)出血发生率较高,差异具有统计学意义(P<0.05),结果见表3及表4。
2.4 出血相关的危险因素分析
以是否出血作为因变量,以年龄、收缩压、GFR、P2Y12 受体抑制剂品种、CABG 手术史、高血脂、术前血小板计数、术前白细胞、术后血小板计数、TG 10 项(出血组与非出血组各因素相比,P<0.05)可能与PCI 术后出血风险相关的影响因素为自变量,进行多因素Logistic 回归分析,结果表明GFR <60 [ mL/(min·1.73 m2)]、高龄、收缩压较高[(147±23.3)mmHg]、PCI 术后选择替格瑞洛抗血小板治疗及既往行CABG 手术史5 项因素为ACS 合并肾功能不全患者PCI 术后双联抗血小板治疗出血发生率较高的危险因素,见表5。
3 讨论
3.1 肾小球过滤降低与出血的关系
ACS 合并肾功能不全患者目前普遍存在,Anavekar 等[7]发现在14 527例急性心肌梗死患者中就有33.6%的患者合并慢性肾功能不全。肾功能不全导致ACS 患者与肾功能正常的ACS 患者相比,出血风险更高,预后更差,死亡率也相应升高。研究表明ACS 合并肾功能不全患者GFR 每下降5 mL/(min·1.73 m2),1年内主要心血管事件(MACE)发生率增加12%,死亡风险增加19%[8]。
3.2 年龄与出血的关系
表1中可见 ACS 合并肾功能不全患者中,出血组与非出血组患者的平均年龄相比,差异具有统计学意义(P<0.05)。随着患者年龄增大,血管壁弹力下降,小血管破裂出血概率增加,从而导致出血风险增加[9]。针对这类情况,在临床中可以对患者进行CRUSADE 评分,评估高龄患者的出血风险,必要时可预防使用质子泵抑制剂,降低消化道出血事件的发生率。
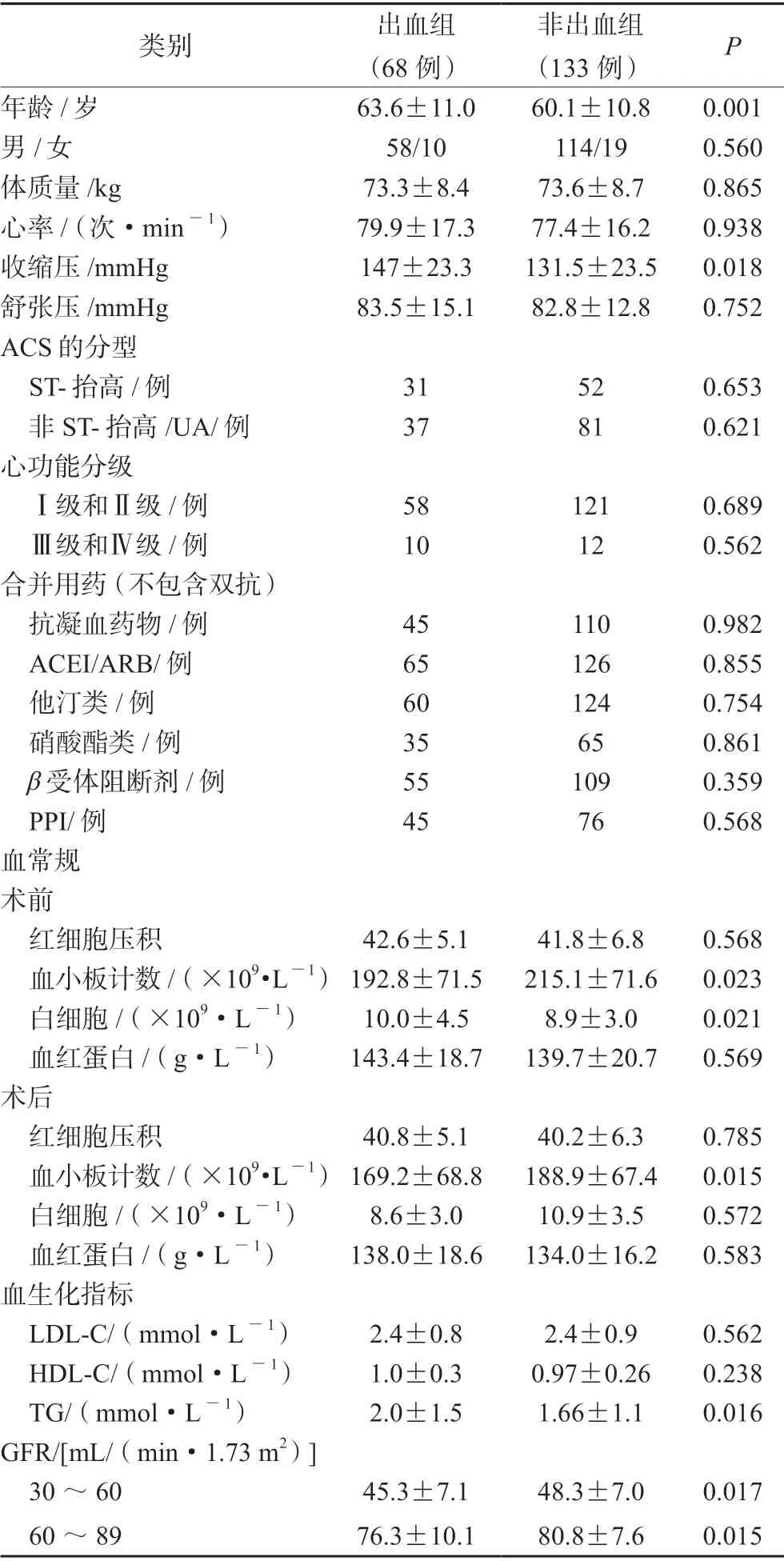
表1 患者基本特征表Tab 1 Basic characteristics of patients

表2 不同P2Y12 受体抑制剂组间出血并发症的比较Tab 2 Bleeding complications in different P2Y12 receptor inhibitor groups

表3 出血组与非出血组患者既往史比较[n(%)]Tab 3 Past history of patients in the bleeding group and the non-bleeding group [n(%)]
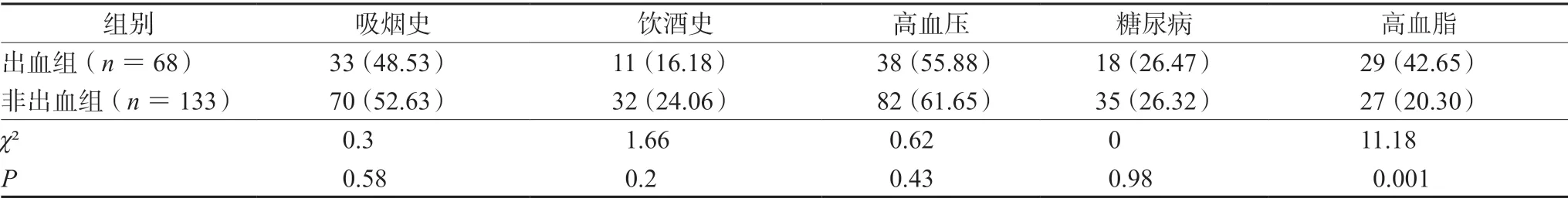
表4 出血组与非出血组患者心血管事件高危因素比较[n(%)]Tab 4 High-risk factors for cardiovascular events in the bleeding group and the non-bleeding group [n(%)]
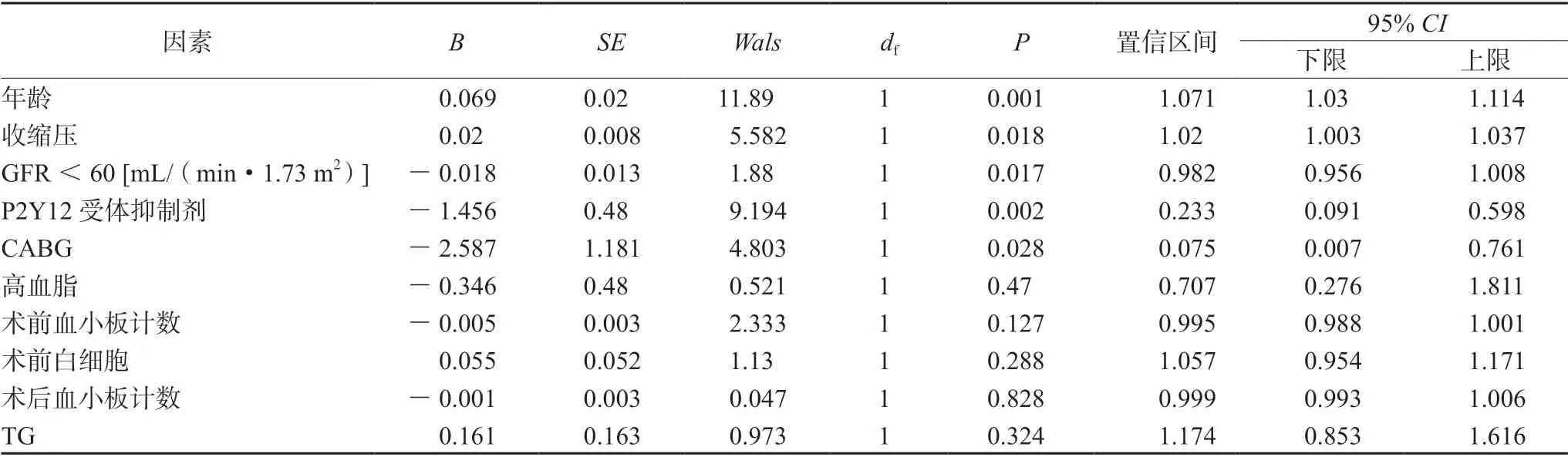
表5 出血相关因素Logistic 回归分析结果Tab 5 Logistic regression of bleeding related factors
3.3 收缩压与出血的关系
从表1可以看出,出血组与非出血组的ACS合并慢性肾功能不全患者的平均收缩压相比差异具有统计学意义(P<0.05)。研究表明,高血压是ACS 患者PCI 术后抗血小板治疗发生出血的危险因素之一。高血压会引起血管透明样变性,血管脆性增大,血管重构,易致血管破裂出血[9]。另外,高血压也是冠心病患者发生心血管事件的危险因素,因此,控制血压平稳,不仅能够减少心血管事件的发生,也能够在抗血栓治疗的过程中降低出血事件的发生率。
3.4 P2Y12 受体抑制剂的选择
表2的结果表明,P2Y12 受体抑制剂的选择不同,发生出血事件的概率不同。替格瑞洛组的出血率为47.72%,而氯吡格雷组仅为 21.15%。研究表明,氯吡格雷是当前应用最广泛的 P2Y12 受体抑制剂之一,但是受基因多态性的影响,部分氯吡格雷为慢代谢基因型的患者在治疗过程中仍会发生支架内血栓、再发心肌梗死等缺血事件。替格瑞洛为新一代的强效P2Y12 受体抑制剂,是各大指南首推的一线用药,但会增加出血的概率,影响临床获益及患者的依从性[10]。PLATO 研究显示,替格瑞洛并不增加主要出血的发生率,但非CABG 相关主要出血发生率(4.5%)高于氯吡格雷(3.8%),包括致命性颅内出血发生率(0.1%)高于氯吡格雷(0.01%)[11]。DISPERSE-2 研究发现在同时服用阿司匹林的条件下,替格瑞洛次要出血的发生率高于氯吡格雷[12]。针对上述情况,对于ACS 合并肾功能不全的患者而言,替格瑞洛仍然是首选,若GFR >15 mL/(min·1.73 m2),患者服用替格瑞洛发生出血且不能耐受时,根据2017年ESC P2Y12 受体抑制剂转换国际专家共识建议[13],出血风险增加仍是降低升级的最重要原因,可根据血小板功能检测结果进行P2Y12 受体抑制剂的转换,早期抗血小板降级可作为ACS 患者PCI 术后双联抗血小板替代治疗方案。
3.5 CABG 手术史与出血的关系
研究表明患者在进行CABG 手术时需建立体外循环,而体外循环激活了机体内炎性反应、血液凝固等系统,促进炎症介质、细胞因子、变性血浆蛋白及血管活性物质等的释放[14],增加了重要脏器组织及功能受损的风险,这也是存在CABG 手术史的患者,发生出血事件概率较高的原因之一。
此外单因素研究结果表明,高血脂、TG 升高均是导致患者双抗治疗期间发生出血的因素,这可能是由于血脂升高,导致血管通透性降低,血管壁脆弱,损伤增大,从而导致出血[15];术前白细胞计数升高也是导致出血的危险因素之一,炎性反应能直接损害心肌细胞,降低心脏收缩功能;还能致全身血管扩张,增加毛细血管的渗透作用,从而增加出血的概率[16]。但多因素分析未得到证实,未来的研究将进一步扩大样本,更深入研究上述因素与出血的关系。
3.6 小结
本研究存在一定的局限性。首先,它是一项回顾性研究,临床数据的收集依赖于医疗记录,若某些情况在医疗记录中没有注释,可能会出现数据偏差。其次,病例来源于同一家医院,样本数量较少,样本的代表性也受到影响,从而可能影响多变量Logistic 分析结果。
综上所述,ACS 合并肾功能不全患者PCI 术后双联抗血小板治疗时,合并高龄、收缩压较高、肾功能不全程度高、既往CABG 手术史及抗血小板治疗选择替格瑞洛,均可能增加出血事件的发生率,因此合并上述危险因素之一的患者进行双抗治疗时更需谨慎。

