TNF-α 刺激下牙周膜干细胞与CD3+T 细胞共培养对Wnt/β-catenin信号通路的影响*
刘 娜 李 影 王燕一 张 维 顾 斌
慢性牙周炎是以局部免疫反应为主的炎症疾病,其不可逆转地侵袭破坏牙周组织,致使牙周再生能力丧失[1]。有效地抑制消除感染,并对损伤的牙周组织进行再生修复是治疗牙周炎的关键。2004年,Seo 首次从牙周膜中分离出人牙周膜干细胞(periodontal ligament stem cells,PDLSCs),其具有成体干细胞共有的特性,具有多向分化及自我更新能力,体内可形成牙周膜-牙骨质样结构,是牙周组织再生修复的理想种子细胞[2]。我们的前期研究证实在炎症微环境作用下PDLSCs 的成骨分化能力明显下降,主要是因为炎症微环境激活了Wnt/β-catenin 经典信号通路,还证实单纯调控β-catenin 仅能部分恢复干细胞功能,还不能使炎症微环境作用下的干细胞再生功能完全恢复[3],但其作用机制不清。
近期有研究表明Wnt 信号通路除调控间充质干细胞的成骨分化外还参与了炎症微环境作用下干细胞的免疫调节功能。巨噬细胞发挥先天免疫的关键作用,它的先天免疫功能有一部分是通过一个Rac1 依赖性自我平衡的Wnt5a-FZ5-NF-κB(P65)信号调控。自分泌/旁分泌的Wnt5a-FZ5-Rac1-P65 信号级联反应不仅保持了免疫防御调节干扰素和CD14 的基础水平,它也支持的巨噬细胞的存活[4]。结合Liu D 等近期的研究:正常组织来源PDLSCs 与炎症组织来源的PDLSCs 分别与外周血单核细胞共培养后,炎症PDLSCs 对T 细胞增殖抑制能力较健康组显著降低,此外在共培养体系中与正常PDLSCs 相比炎症PDLSCs 诱导CD4+CD25+Foxp3+调节性T 细胞和IL-10 分泌量显著降低[5]。我们推测Wnt 信号通路参与了炎症条件下PDLSCs的免疫调节。
鉴于此,本研究将体外构建炎症环境并将其与CD3+T 细胞共培养,检测Wnt 信号通路在牙周膜干细胞免疫调节功能中的作用。
1.材料与方法
1.1 样本来源 从解放军总医院第一医学中心口腔颌面外科门诊收集健康的因正畸拔除前磨牙及第三磨牙。所有患者身体健康,无近期急性感染,近期均无服药史;本课题中所有的患者均没有吸烟史、家族遗传病史以及全身系统性疾病史。患者年龄在20~35 岁之间,样本量共8 例。另外,从解放军总医院第一医学中心输血科获取人外周血白膜层细胞浓缩样本,所有样本来源捐献者均健康,近半年无服药史,无系统性疾病,均签署知情同意书,样本量共8。本研究经中国人民解放军总医院伦理委员会批准(批准号:IACUC-2016067),所有获取样本的患者均签署了知情同意书。
1.2 主要试剂和仪器 α-MEM,RPMI-1640培养基、FBS(美国Gibco);EDTA-胰酶,青链霉素,PBS(北京Solarbio);Trans-well 插入式细胞培养皿(Millipore,美国);红细胞裂解液(上海碧云天生物技术有限公司);人外周血单个核淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司);磁力分选架,磁力分选柱,CD3 磁珠(MiltenyiBiotec GmbH,德国);外源性因子TNFα(Peprotech,美国);DAPI(Sigma,美国);β-catenin 抗体,LEF-1抗体(cell signaling,美国);山羊抗鼠/兔荧光二抗(美国R&D Systems);RNA 抽提试剂盒;逆转录试剂盒(Fermentas,美国);Syber Green 荧光定量PCR 检测试剂盒(Takara,日本);FX96 实时定量PCR 仪(Bio-rad);5810R 高速冷冻离心机(Eppendorf,德国);流式细胞仪(BD,美国)。
1.3 实验方法
1.3.1 人牙周膜干细胞分离培养 将我们获取的新鲜离体牙样本,按我们前期的实验方法进行牙周膜干细胞的分离培养[3],使用含1%青链霉素的PBS 从牙根向牙冠方向冲洗5~7 次,无菌刀片小心刮取根中1/3 部分牙周膜,置于15mL 离心管,室温下水平离心机800r/min 离心5min。使用1mL EDTA-胰蛋白酶消化液消化2~4min 后终止消化,置于直径10cm 的培养皿,加入5mL 1%青链霉素、10%FBS 的α-MEM,培养7d 左右,倒置显微镜下可见纺锤形细胞爬出,形似成纤维细胞。待细胞长至80%汇合时传代。人牙周膜干细胞的分离培养参考本实验室的前期步骤,采用有限稀释法进行克隆培养。
健康离体牙样本分离培养的人牙周膜干细胞(Periodontalligament stem cells)标记为:H-PDLSCs(Healthy-Periodontal ligament stem cells);我们将健康离体牙样本分离培养的人牙周膜干细胞采用10ng/mL 的TNFα 提前刺激24h 作为炎症诱导条件下的牙周膜干细胞,标记为:I-PDLSCs(Inflammatory-Periodontal ligament stem cells)。
1.3.2 CD3+T 细胞的体外分离培养 将全血白膜层10mL 加PBS10ml 稀释,缓慢加入20mL人淋巴细胞分离液(天津灏洋生物技术有限公司),离心(2000rpm,15min)。白膜层吸取物用PBS(加入5ml 的RPMI1640 培养液)洗2 次,沉淀物富含单个核细胞,进行细胞计数。调整细胞密度1×107/100μL 按照说明书流程进行CD3+T 细胞提取:按照107细胞添加10μL CD3+-biotin 试剂并混匀;4℃避光孵育10min,清洗后离心弃上清;重悬,按107 细胞添加20μL anti-biotin 磁珠并混匀,4℃避光孵育10min,清洗后离心弃上清;重悬,添加2 mL Buffer 润湿细胞分选柱;收集细胞并用1mL Buffer 清洗2 次分选柱,此为未标记CD3+部分细胞;将细胞分选柱撤离磁力架,Buffer 冲洗分选柱2 次,所得的细胞即我们需要的T 淋巴细胞。随后按照实验需求,进行CD3+T 细胞活化:按照实验需求,对分选的T 细胞计数并分取合适的T细胞置于离心管中;一部分按照实验所需浓度加入配制的RPMI 1640 刺激液4mL,调整细胞密度为8×105/100uL,另一部分加入配制的RPMI 1640培养液,分别混合均匀后置于两个直径6cm 的培养皿中,标记,放入37℃,5%CO2孵箱内进行培养。用于下步实验。
1.3.3 PDLSCs 与CD3+T 细胞共培养 将第三代PDLSCs 消化后重悬后进行细胞计数:8×104/100μL,按PDLSCs:CD3+T 比 例 分4 组:1∶10,1∶20,1∶50,1∶100。各组设3 个副孔。分别取100μL、100μL、50μL、20μL、10μL PDLSCs混悬液接种在48 孔板相应孔中。各组补液量分别为100μL、100μL、150μL、180μL、190μL。培养12h 后观察细胞伸展状态,加入活化后的CD3+T细胞。细胞分组如表1 所示:
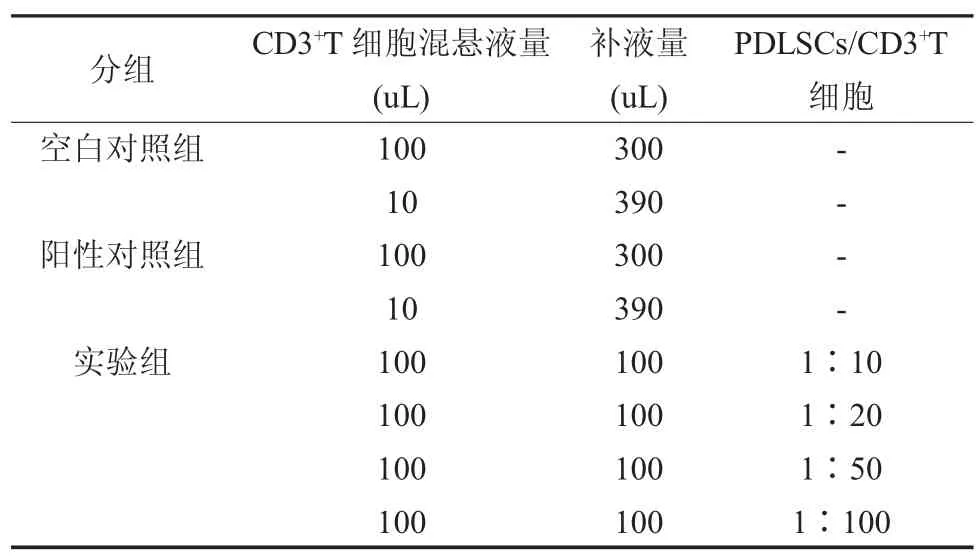
表1 共培养加样表
共培养时间为48h。炎症因子组加入的均为含10ng/mL TNFα 的培养液。
1.3.4 免疫荧光检测 将H-PDLSCs 胰酶消化后,以2×104/孔的密度接种于24 孔培养板,待细胞贴壁后取一组H-PDLSCs 加入TNF-α(10ng/mL)进行炎症因子刺激24h。随后细胞于40g/L 多聚甲醛固定液中室温固定20min。加0.25%Triton X-100,37℃,15min;清洗3 次,滴加4%山羊血清,37℃孵育30min;加入一抗β-catenin(1 ∶200)、LEF-1(1 ∶200),37℃孵 育2h;避光滴加FITC 或者罗丹标记的兔抗羊、羊抗兔二抗(1∶200),37℃孵育60min;DAPI 进行细胞核衬染定位。激光扫描共聚焦进行试验结果检测及采集。
1.3.5 实时定量qRT-PCR 利用Trizol 裂解各组H-PDLSCs 和I-PDLSCs,以及各组CD3+T细胞,提取RNA,并测定RNA 浓度,分别反转录为cDNA。逆转录所得cDNA 利用Syber Green 荧光定量PCR 检测试剂盒进行荧光定量PCR 检测,反应体系均为20μl。引物序列:β 连蛋白(β-catenin):forward 5′-GCAGCAACAGTCTTACCT-3′,reverse 5′-GCAGCAACAGTCTTACCT-3′;淋巴样增强因子-1(Lymphoid Enhancer Factor-1,LEF-1):forward5′-CCCGTGAAGAGCAGGCTAAA-3′,reverse 5′-AGGCAGCTGTCATTCTTGGA-3′;T 细胞因子-4(T Cell Factor,TCF-4):forward5′-CGACTTCCCCTGACCTGAAC-3′,reverse 5′-GGTGTCAGGTCCTCATCGTC-3′;GAPDH:forward5′-TCTGACGACTCTGCTTCACG-3′,reverse 5′-GCAGCAACAGTCTTACCT-3′。反应条件:95℃变性20min,95℃30s,60℃1min,40 个循环。IQ5 型实时荧光定量PCR 仪监测记录数据,结果根据标准曲线由软件自动计算后得出。验证该方法的重复性和扩增效率。本实验进行三次重复。
1.3.6 流式细胞仪检测细胞周期 取第三代H-PDLSCs 和I-PDLSCs 细胞按照上述实验分组与CD3+T 共培养,共培养48h 后收集各组PDLSCs,制备细胞悬液,调整细胞密度为5×106/mL,PBS重悬细胞,后加入预冷的70%乙醇1.5mL 吹打混匀,4℃过夜,离心弃乙醇,0.01M PBS 洗2 遍,加入5mol/L 的碘化丙锭1mL,4℃避光染色30min,过200 目的尼龙筛网,流式细胞仪测定DNA 含量,根据细胞不同的DNA 含量判定细胞周期,细胞的增殖指数为(Proliferation index PI=G2M+S)。该实验进行4 个独立样本的3 次生物学重复实验。
1.4 统计学分析 多组间比较,使用SPSS 22.0软件,进行方差齐性检验后采用方差分析,P<0.05代表具有统计学差异。
2.结果
2.1 炎症因子刺激作用下牙周膜干细胞可激活Wnt/β-catenin 信号通路 我们将H-PDLSCs 与I-PDLSCs 常规培养后后检测经典Wnt/β-catenin信号通路核心蛋白β-catenin 及细胞内Wnt 经典信号通路下游关键分子LEF-1 的表达。免疫荧光结果显示绿色荧光为β-catenin 阳性表达,而红色荧光表达即为LEF-1,用DAPI 进行细胞核的定位衬染荧光镜下显示为蓝色。首先,我们观察到H-PDLSCs 细胞浆及细胞核中均表达β-catenin,LEF-1 在细胞核内聚集性阳性表达。在人外源性炎症因子TNF-α 的作用下I-PDLSCs 组细胞浆及细胞核内的β-catenin、LEF-1 的荧光表达强度及阳性细胞数量较H-PDLSCs 组而言明显增强(图1)。

图1 免疫荧光检测H/I-PDLSCs Wnt 信号通路关键蛋白β-catenin 及LEF-1 的表达,×400。
2.2 与CD3+T 细胞共培养后H-PDLSC、IPDLSC Wnt 关键基因的表达 在PDLSCs 与CD3+T 细胞的比例为1∶10-1∶100 范围内,二者共培养比例为1∶20 和1∶50 时,正常组PDLSCs Wnt 通路关键基因β-catenin、LEF1 的mRNA表达水平均降低。1∶20 时,有趣的是TCF4 mRNA的表达水平增加,但是1∶50 时降低。1∶20 时,炎症因子组β-catenin、LEF1 的mRNA 表达水平均增加,而在1∶50 时基因的表达水平均降低。1∶20 及1∶50 时TCF-4 的表达水平均降低(图2)。
2.3 流式细胞仪检测与CD3+T 细胞共培养后H-PDLSC、I-PDLSC 增殖指数 流式细胞周期分析结果示,I-PDLSCs 相对于H-PDLSCs 增殖能力增强。H-PDLSCs 与I-PDLSCs PI 指数分别为32.09%、39.66%,I-PDLSCs 增殖能力显著增强(P<0.05)。H-PDLSCs 与CD3+T 细胞共培养比例为1∶10 时与H-PDLSCs 对照组相比其增殖指数显著提高;1∶20、1∶50 及1∶100 时其PI 指数显著降低,1∶100 时增殖指数降低至11.21(表2)。I-PDLSCs 与CD3+T 细胞共培养比例为1∶10、1∶50 及1∶100 时与I-PDLSCs 对照组相比其增殖指数显著降低(P<0.05);而1∶20 时其PI 指数为37.17,与其对照组相比没有统计学差异(表2)。

图2 PDLSCs Wnt 通路相关基因mRNA 表达结果
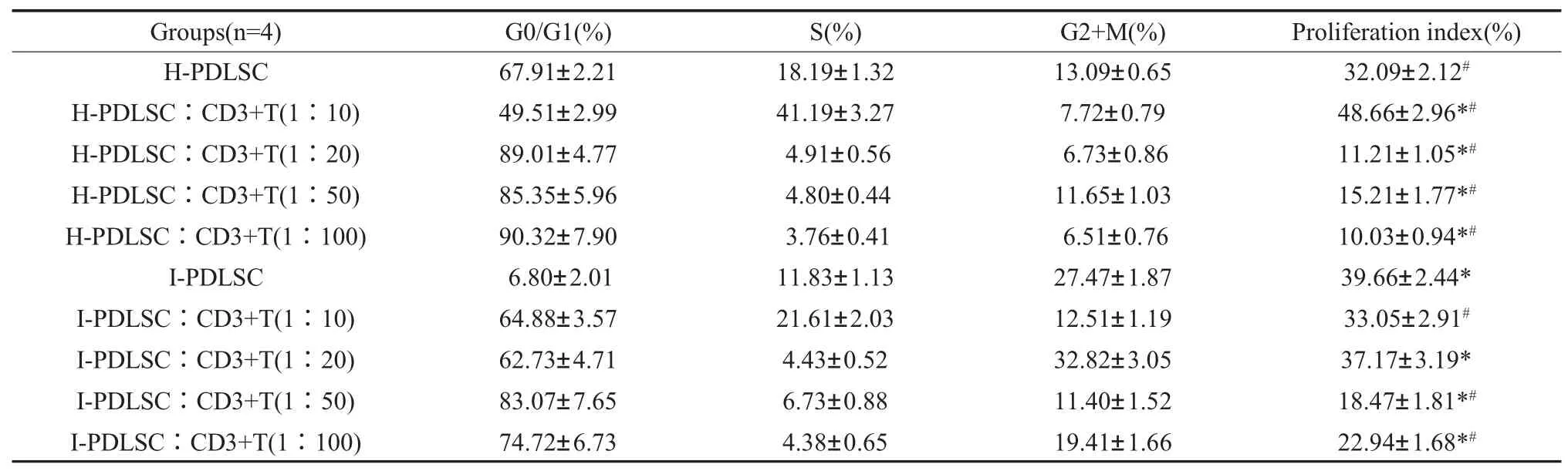
表2 流式细胞仪检测各组细胞周期以及增殖指数(Proliferation IndexPI)。PI=(S+G2/M)/(G0/G1+S+G2/M)×100%;均值±标准差
3.讨论
牙周炎在国内外均有很高的发病率,牙周炎致病复杂,除了菌斑生物膜中含有复杂的细菌构成可导致牙周炎的发生促进其发展外,另外一些病毒也可导致牙周炎,甚至患者全身系统性疾病在一定条件下也与牙周炎发生发展相关。牙周炎的进展伴随着牙周支持组织的逐渐丧失进而导致牙齿最终脱落,严重影响患者生活质量,而这些病理性的变化都与患病宿主的免疫反应水平上升有关。研究显示细菌侵入的牙龈龈沟液中血清抗体水平增高,说明机体系统内的免疫因素从一开始就参与了牙周炎的发生发展[6]。在慢性牙周炎的微环境作用下,多种细胞因子的表达量增高及活化的T、B 淋巴细胞及巨噬细胞产生破坏作用,导致牙周组织中的RANKL/RANK/OPG 调节系统失衡,最终造成牙周膜、牙槽骨破坏[7-9]。成体干细胞在维持组织动态平衡和疾病缺损后的修复再生方面具有重要作用。牙周膜干细胞为牙周组织再生修复提供了新思路,牙周膜干细胞不仅体内体外均具有牙周再生的能力,同时还具备免疫调节功能,在一定条件下对炎症的发生、发展有抑制作用。
Wnt 信号通路在骨形成和改建过程中发挥了重要作用。我们的研究结果发现炎症影响下干细胞Wnt 经典信号通路被激活,这是导致干细胞骨向分化能力降低的重要原因,siRNA 技术下调β-catenin 后,减弱了炎症微环境对PDLSCs 成骨分化的抑制作用[3]。另有研究表明GSK3β 是Wnt经典信号通路中一个非常重要的负调控因子,可以持续磷酸化β-catenin,从而使β-catenin 被泛素华降解,在慢性炎症微环境中TNF-α 通过磷酸化GSK3β,从而激活Wnt/β-catenin 经典信号通路,抑制PDLSCs 的成骨分化[10]。但在炎症微环境作用下抑制经典Wnt 信号通路可以导致PDLSCs 成骨能力显著增强,但对于炎症微环境作用下的BMSCs则需激活Wnt 经典信号通路才能增强其成骨能力,这表明Wnt 信号通路对不同组织来源的间充质干细胞在炎症微环境下的调控作用是不同的[11]。由于慢性牙周炎的条件下牙周袋内存在多种炎症因子含TNF 家族、白介素家族、INF-γ、PEG2 等多种不同细胞因子参与炎症反应,前期大量临床取样研究以及基础研究均已证实TNF-α 为慢性牙周炎的重要致病因子,可影响牙槽骨的吸收破坏,在牙槽骨改建过程中也发挥重要作用,因此,本研究中我们采用人外源性细胞因子TNF-α 刺激正常组织来源的牙周膜干细胞,在经过24 小时的体外干扰后通过免疫荧光染色检测炎症因子对PDLSCs Wnt 信号通路的影响,我们的研究结果显示炎症条件下PDLSCs 细胞内的β-catenin 及LEF-1 的阳性细胞数量及荧光强度有一定程度的增强,提示炎症可以促进Wnt/β-catenin 信号通路的活化。
随着干细胞技术的深入研究以及拓展,将牙周膜作为种子细胞应用于牙周组织修复再生及其他骨损伤性疾病已屡有报道。为了明确牙周膜干细胞的生物学性能,免疫调节能力是不可或缺的一部分研究。鉴于此本研究从志愿者的外周血中获取了人的T 细胞。T 细胞具有免疫抑制能力,在免疫系统调节和外周耐受中发挥重要的作用,它是适应性免疫系统的主要效应细胞,其具有抗原特异性,是同源免疫记忆的核心。调节性T 细胞不仅在自身免疫性疾病中发挥作用,在炎症性、感染性疾病中也发挥重要的作用[12,13]。鉴于之前的研究已证实Wnt 信号通路参与TNF-α 刺激下PDLSCs 的成骨分化能力,结合前期研究已证实Wnt 通路已被阐明影响细胞的先天和后天免疫性能[14],因此本研究在将正常及炎症刺激下的牙周膜干细胞与CD3+T 细胞共培养后检测Wnt/β-catenin 信号通路是否在牙周膜干细胞的免疫调节方面也存在一定的调控作用。针对此,我们的结果表明,在PDLSCs 与CD3+T细胞共培养比例为1∶20 和1∶50 时,H-PDLSCs β-catenin、LEF1 的mRNA 表达水平均降低。在I-PDLSCs 与CD3+T 细胞共培养比例为1∶20 时β-catenin、LEF1 的mRNA 表达水平均增加,而在1∶50 时基因的表达水平均降低。针对我们所检测的Wnt 经典信号通路的核心分子β-catenin 与其核心参与基因转录的LEF/TCF 分子的基因表达水平变化可反映出Wnt 信号通路参与了TNF-α刺激下人牙周膜干细胞的免疫调节,而我们的研究结果与崔晓霞等的研究结果一致,在牙周炎患者中β-catenin、GSK3β、LEF/TCF 复合体等Wnt 经典信号通路关键分子活化,导致Wnt 经典信号通路增强,促进了炎症进展,抑制了成骨[15]。巨噬细胞的先天免疫功能有一部分是通过Wnt5a-FZ5-NF-κB(P65)信号调控。自分泌/旁分泌的Wnt5a-FZ5-Rac1-P65 信号级联反应不仅保持了免疫防御调节干扰素和CD14 的基础水平,它也支持的巨噬细胞的存活[16]。本研究结合上述相关研究显示细胞内的Wnt 通路水平和胞外微环境中的炎症因素密切相关,它不仅参与干细胞的成骨分化也影响干细胞的免疫调控能力,此外对炎症相关细胞也有一定的调控作用。
Wnt 经典信号通路激活的状态下,β-catenin在细胞浆中积累,并进入细胞核与TCF/LEF 转录因子相互作用,调节靶基因的表达。TCF/LEF是一类具有双向调节功能的转录因子,结合β-catenin 之后则可以促进下游靶基因的转录。前期研究已证实LEF-1 及TCF-4 结合的靶基因与细胞的增殖密切相关[17]。细胞周期是反映细胞增殖动力学的重要参考指标。我们的研究显示各组牙周膜干细胞与CD3+T 细胞共培养后其增殖指数与β-catenin、LEF-1 及TCF-4 的基因检测结果基本一致,这也间接证实了Wnt/β-catenin 信号通路调控间充质干细胞的增殖。H-PDLSCs 与CD3+T细胞以1∶10 的比例共培养后其增殖能力显著增强PI 指数高于I-PDLSCs 组,但随着与免疫细胞共培养比例增高其PI 指数显著降低。H-PDLSCs 与CD3+T 细胞以不同比例共培养后其增殖指数显著降低。
我们的研究结果表明:炎症条件下人牙周膜干细胞的Wnt/β-catenin 信号通络活化,使细胞具备一定的炎症特性;无论正常条件还是炎症条件下牙周膜干细胞均具备免疫调节能力,设置不同比例与CD3+T 细胞共培养可影响Wnt 信号通路关键基因的表达进而影响细胞的增殖活性,然而具体的作用机制不清,下步我们将深入研究Wnt 信号通路在PDLSCs 免疫调节方面的具体作用机制。

