中脑腹侧被盖区多巴胺转运体在丙泊酚全麻大鼠苏醒中的作用
郭佳,许珂,殷姜文,葛明月,秦新磊,樊世文,张晗,李燕*
(1 石河子大学医学院,新疆 石河子 832000;2 石河子大学医学院第一附属医院,新疆 石河子 832000)
随着医疗水平的发展,全身麻醉在手术患者中的应用越来越普遍,但全身麻醉在苏醒期间仍存在诸多的并发症,如围术期神经认知紊乱、术后低血压、术后低氧血症、误吸等,苏醒延迟更是增加了其发生的概率。全身麻醉的机制目前尚不明确,有研究表明全身麻醉状态与自然睡眠具有相似的脑电图改变及特定部位脑功能变化[1]。经典的觉醒通路包括:胆碱能通路、食欲素能通路、组胺能通路、去甲肾上腺素能通路和多巴胺能通路[2]。中脑腹侧被盖区(VTA)是睡眠觉醒相关最重要的核团之一[3],目前鲜有研究,该核团内含有大量多巴胺能神经元并接受来自下丘脑腹外侧视前核(ventrolateral preoptic nucleus,VLPO)及中缝背核(dorsal raphe nucleus,DR)的投射,经典研究已证实VTA与吸入麻醉苏醒相关,可能原因是VTA内多巴胺能神经元可将神经纤维投射至前额叶皮层(Prefrontal cortex,PFC)、伏隔核(nucleus accumben,NAc)等觉醒相关部位[4]。多巴胺转运体(DAT)作为特异性分布在多巴胺能神经元表面的跨膜蛋白,其变化是否对丙泊酚全麻苏醒产生影响尚不明确。因此,本研究选用经典麻醉药丙泊酚,通过构建一个slc6a3基因敲低DAT的腺相关病毒来探讨VTA区DAT在丙泊酚全麻苏醒中的作用。
1 材料与方法
1.1 实验动物及分组
雄性SD大鼠,体质量250~300 g。为观察VTA在丙泊酚麻醉中的作用,将20只大鼠随机分为2组:对照组(Negative control,NC)、6-OHDA毁损组(6-OHDA),每组10只。为观察丙泊酚麻醉对VTA内DAT的影响,将20只大鼠随机分为2组:生理盐水组(Saline,S)、丙泊酚麻醉组(Propofol,P),每组10只。其余实验部分将30只大鼠随机分为3组:对照组(Negative control,NC)、AAV空载组(AAV·NC)、AAV2·DAT·RNAi组(AAV),每组10只。为观察丙泊酚对前额叶皮层(PFC)c-fos蛋白表达的影响,免疫荧光及Western blot实验部分另添加生理盐水注射组(Saline,S)和丙泊酚麻醉组(Propofol,P)两个亚分组,每组10只。实验动物均由新疆实验动物中心提供,喂养环境为石河子大学医学院第一附属医院转化医学实验动物房。饲养环境:大鼠自由活动、饮水、摄食,12 h昼夜,室温 21~23 ℃,相对湿度为45%~55%。所有实验动物程序均获石河子大学医学院第一附属医院伦理委员会批准。实验过程遵循中国国家科学技术部2006年发布的《关于善待实验动物的指导性意见》。
1.2 VTA区毁损模型建立
在异氟醚麻醉下通过耳杆和齿栓将大鼠头部固定于脑立体定位仪上,维持大鼠肛温于37~38 ℃范围内。经脑立体定位仪定位VTA坐标:距离囟门后1 mm,横向6.0 mm,深度7.0 mm。在大鼠颅骨表面钻孔后,利用微量注射针注入1 μL的6-OHDA,注射时间为1 min,注射完毕后停留10 min,以免药物溢出。恢复14 d后行尾静脉置管。
1.3 AAV介导RNAi的构建
用AAV载体构建包装了一个Slc6a3敲低的病毒,血清型2型(Genchem,Shanghai),其靶点序列为:5′-CGCTGAGTACTTCGAAATGTC-3′,元件顺序为:U6-MCS-CAG-mCherry。
1.4 VTA区立体定位注射AAV2·DAT·RNAi及EEG电极植入
在异氟醚麻醉下,经脑立体定位仪定位VTA坐标(如前所述),在大鼠颅骨表面钻孔后,利用微量注射针注入AAV2·DAT·RNAi,注射总量为3 μL,注射时间为10 min,注射完毕后停留10 min,待药物完全扩散再缓慢移除注射针,其后在其硬脑膜外植入四个不锈钢螺丝用于监测脑电图(Electroencephalogram EEG)。脑电电极分布位置:两个额部电极分别位于前囟向前3.9 mm并旁开2.0 mm处;两个枕部电极位置位于前囟向后7.4 mm并且旁开5 mm。外套管与电极均由牙科胶水固定于颅骨表面后缝皮。术毕连续3 d肌肉注射青霉素20U预防感染。待其从麻醉状态下安全苏醒,放入单独鼠笼内饲养并恢复21 d并行尾静脉置管。
1.5 翻正反射
各组大鼠分别经尾静脉以11 mg·kg-1的剂量缓慢推注丙泊酚,观察其翻正反射消失(LORR)时间及恢复(RORR)时间。翻正反射消失定义为药物注射完毕后,将大鼠置于屈膝仰卧位,大鼠在30 s内不能从仰卧位变为俯卧位。LORR 即为静脉丙泊酚注射完毕至大鼠翻正反射消失的时间,称为麻醉诱导时间。翻正反射恢复定义为大鼠在仰卧位时,5 s内能够恢复正常的体位,即四脚同时着地,RORR即为丙泊酚注射完毕后待大鼠翻正反射恢复的时间,称为麻醉苏醒时间。超过30 min后翻正反射未恢复,则排除该只老鼠。
1.6 在体脑电记录
各组大鼠经尾静脉以11 mg·kg-1的剂量缓慢推注丙泊酚进行诱导,后以70 mg·kg-1·h-1的剂量持续泵入丙泊酚,维持30 min后停止输注,记录大鼠丙泊酚全麻中麻醉期和苏醒期的脑电活动。
1.7 免疫荧光实验
P组大鼠经尾静脉以11 mg·kg-1的剂量缓慢推注丙泊酚进行诱导,后以70 mg·kg-1·h-1的剂量持续泵入丙泊酚,共30 min;S组大鼠经尾静脉以相同速度输注等剂量生理盐水,共计30 min;NC组、AAV·NC组和AAV组大鼠经尾静脉以11 mg·kg-1的剂量缓慢推注丙泊酚进行诱导,然后以70 mg·kg-1·h-1的剂量泵入丙泊酚,共计60 min;各组大鼠停药后10 min用戊巴比妥钠按60 mg·kg-1腹腔注射深麻醉,用4%多聚甲醛固定液经心脏实施灌注取脑,制备石蜡切片。取PFC区或VTA区脑片用5%BSA封闭1 h,滴加c-fos(bs-0469R)或DAT(ab-120607)一抗4 ℃孵育12 h,PBS洗涤后,滴加相应的荧光二抗,湿盒避光室温孵育2 h,PBS洗涤后暗室下用0.5 μg·mL-1的DAPI溶液染细胞核15 min,封片后荧光显微镜下观察。每张切片在200×视野下随机选3个不同视野进行采图。
1.8 Western blot检测目标蛋白的表达量
各组大鼠停药后10 min取脑,快速剥离PFC,常规提蛋白法获得PFC组织总蛋白样品。取10 μL样品常规电泳、转模。室温封闭后按浓度1∶500进行内参及目的蛋白一抗孵育过夜,室温孵育二抗2 h,暗室曝光。应用image J图像分析软件测定各组目的蛋白与内参蛋白灰度值之比来分析各组蛋白含量。
1.9 统计分析
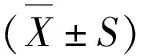
2 结果
2.1 毁损VTA区后各组大鼠LORR、RORR比较
与对照组(NC)比较,6-OHDA毁损组(6-OHDA)大鼠LORR缩短(P<0.001),RORR延长(P<0.001)(图1)。
与NC相比,***P<0.01
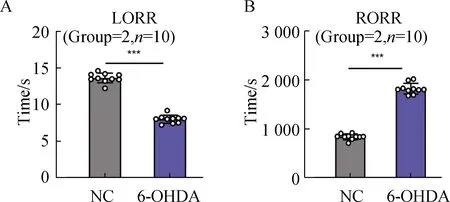
2.2 丙泊酚麻醉对VTA区DAT表达影响
与盐水组(Saline,S)比较,丙泊酚麻醉组(Propofol,P)大鼠VTA区DAT表达降低(P<0.05)(图2)。

与NC相比,**P<0.05
2.3 VTA区内注射AAV2·DAT·RNAi转染验证
AAV转染21 d后取VTA区组织切片,激光共聚焦显微镜下观察到病毒转染细胞出现明显红色荧光(mcCherry),提示转染成功(图3)。
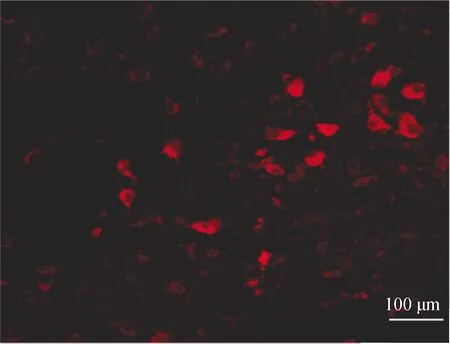
图3 VTA区内神经元红色荧光(mCherry)表达
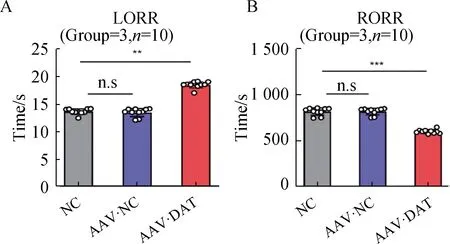
2.4 各组大鼠LORR、RORR结果比较
与NC组比较,AAV组LORR延长(P<0.005),RORR缩短(P<0.001),表明AAV组大鼠丙泊酚麻醉诱导的时间延长,从丙泊酚麻醉中苏醒的时间缩短。AAV·NC组LORR、RORR差异无统计学意义(P>0.05)(图4)。
与NC组相比,**P<0.005;与NC组相比,***P<0.001
2.5 各组大鼠皮层脑电分析
在丙泊酚麻醉期及苏醒期记录各组大鼠脑电,与NC组比较,AAV组在丙泊酚麻醉期α波、β波频率增多(P<0.05),θ波频率减少(P<0.05);丙泊酚麻醉苏醒期,与NC组比,AAV组β波频率增多(P<0.05),θ波频率减少(P<0.05),余各波无统计学差异(P>0.05);与NC组比,AAV·NC组各波无统计学差异(P>0.05)(表1)。通过丙泊酚麻醉期间的脑电图可观察到,NC组麻醉期脑电图呈明显爆发-抑制状态(图5),提示大鼠皮层活动处于深抑制状态;AAV组在麻醉期爆发-抑制波减少且频率快、振幅小,提示麻醉深度浅于NC组(图6)。

表1 丙泊酚麻醉期及苏醒期各组大鼠脑电图各波频率占比
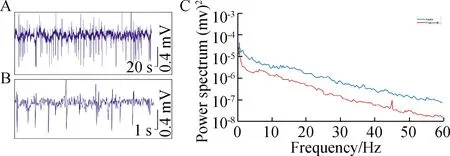
图5 丙泊酚麻醉下NC组脑电图及时频图分析

图6 丙泊酚麻醉下AAV组脑电图及时频图分析
2.6 各组大鼠PFC区c-fos蛋白表达
2.6.1 免疫荧光
免疫荧光结果如图7所示,前额叶皮层绿色荧光标记的为c-fos阳性神经元,其表达情况可反应PFC神经元的活性。
与盐水组(Saline,S)比较,丙泊酚组(Propofol,P)c-fos蛋白表达降低(P<0.05),表明大鼠在丙泊酚麻醉期间PFC神经元活性降低;丙泊酚麻醉苏醒期间,与NC组比较,AAV组c-fos蛋白表达增高(P<0.05),表明AAV组大鼠在丙泊酚麻醉苏醒期PFC神经元活性较NC组增强;与NC组比较,AAV·NC组c-fos蛋白表达无统计学差异(P>0.05)(图7)。
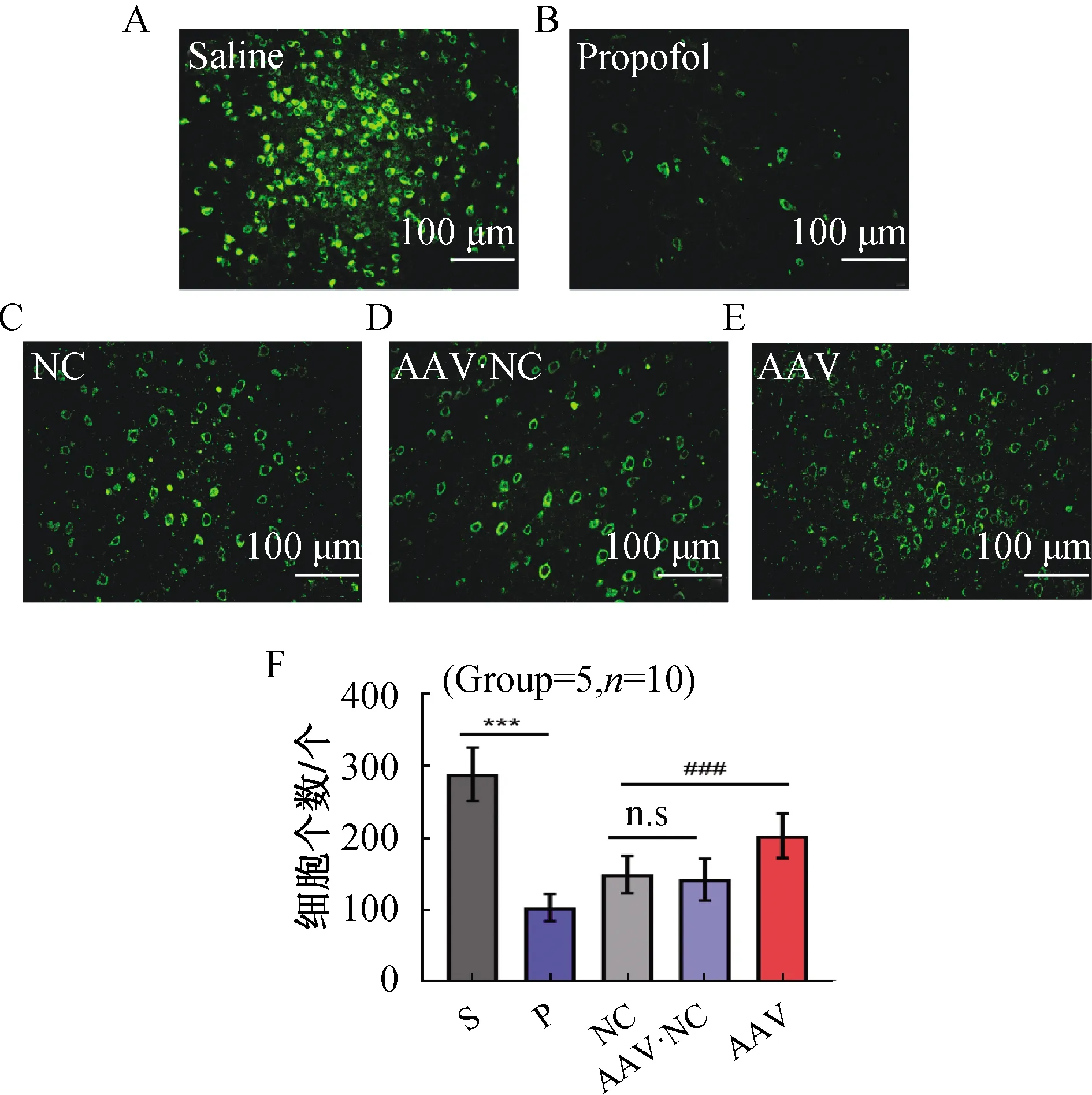
与S相比,***P<0.01;与NC组相比,***P<0.01
2.6.2 Western blot
与S组比较,P组c-fos蛋白含量明降低(P<0.01)。与NC组比较,AAV组c-fos蛋白含量增高(P<0.01);与NC组比较,AAV·NC组c-fos蛋白含量无统计学差异(P>0.05)(图8)。

与S相比,***P<0.01;与NC组相比,***P<0.01
3 讨论
全身麻醉是一种可逆的、药物诱导的中枢抑制状态,包括意识消失、遗忘、镇痛和无体动。因此,全身麻醉是一种可逆的昏迷,而并非类似于任何阶段的睡眠[5-6]。丙泊酚凭借其起效快、无蓄积等优势已成为全球最常用的静脉麻醉药,其主要通过GABAA受体发挥作用,通过肝肾进行代谢,在临床中,有7%左右的患者可发生丙泊酚麻醉苏醒延迟,尤以老年人或肝肾功能不全的患者为著,且目前暂无有效的促苏醒药物。
中脑腹侧被盖区(VTA)位于中脑边缘,具有密集的多巴胺能神经元,已被证实参与了多方面的调节:如奖赏及成瘾行为、睡眠与觉醒、情绪等[2],但其在调节丙泊酚全身麻醉-觉醒中的作用机制尚不明确。多巴胺是脑内重要的神经递质,多巴胺分泌及代谢异常可造成一系列病理性改变[7-8],临床上常用安非他命等药物增加胞外多巴胺的释放用来治疗注意力缺陷多动症,这些药物也被证实与觉醒相关,被用来治疗睡眠障碍方面的疾病[9-12],但其是否可调节全身麻醉的觉醒还尚不明确。VTA区中除了含有大量多巴胺神经元外还含有一部分GABA能神经元及谷氨酸能神经元,有研究显示,VTA中的多巴胺能神经元及GABA能神经元处于相互平衡的状态,清醒状态下,VTA中多巴胺能神经通路发挥主导作用并且抑制GABA能神经通路,使机体处于觉醒状态[13]。故VTA内多巴胺能通路在丙泊酚全身麻醉及苏醒的作用可能是通过脑内多种机制共同调节的。
在本研究中,通过6-OHDA毁损VTA后发现大鼠翻正反射消失时间缩短,翻正反射恢复时间延长,表明VTA参与丙泊酚全身麻醉的诱导与苏醒,由此进一步验证DAT在丙泊酚麻醉过程中含量的动态变化,从而证明DAT参与丙泊酚全身麻醉过程。其后本研究通过腺病毒转染,使DAT表达下降,得出AAV组的大鼠翻正反射消失时间延长,翻正反射恢复时间减少,提示DAT在丙泊酚麻醉致意识消失及恢复的过程中都发挥了作用。有研究表明,丙泊酚可通过诱导产生慢振荡损害皮层内通路,并通过皮层、丘脑及其他觉醒相关核团共同产生作用,丙泊酚麻醉时的脑电变化表现为随着麻醉的加深出现紊乱的高频活动,当进入深麻醉状态时,出现δ波增多及爆发-抑制样波形,且麻醉越深,抑制时间越长[14-15]。在本实验中,当VTA区DAT敲低后,脑电中低频δ波减少,高频α波及β波增多,爆发抑制率降低,脑电转为类觉醒波,该结果与行为学结果相一致。c-fos是反应神经元活性的经典指标,大量研究表明,在睡眠状态下c-fos可降低其表达。在本研究中,丙泊酚麻醉组大鼠额叶皮层的c-fos与输注生理盐水组大鼠相比显著降低,提示丙泊酚麻醉期间额叶皮层神经元活性降低,而AAV组大鼠在丙泊酚麻醉苏醒期间额叶皮层的c-fos表达较NC组增多,表明DAT敲低后可进一步兴奋大脑皮层,从而促进丙泊酚麻醉觉醒。
综上,本研究证实了VTA区DAT参与了大鼠丙泊酚全麻的苏醒,可能机制是VTA区DAT通过调节胞外多巴胺浓度,进而兴奋PFC神经元,最终促使大鼠从丙泊酚麻醉中苏醒。

