大型杂交鲟不同部位肌肉的理化特性
黄 攀,高瑞昌,白 帆,徐 鹏,宫 臣,王瑞红,汪金林,,赵元晖,
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.江苏大学食品与生物工程学院,江苏 镇江 212013;3.衢州鲟龙水产食品科技开发有限公司,浙江 衢州 324002)
鲟鱼是现存起源最早的脊椎动物之一,由于其富含优质的蛋白质以及多种维生素和矿物质,经济价值很高[1]。据2019年《中国渔业统计年鉴》[2]和《中国鲟鱼产业发展报告》[3]报道,2018年中国鲟鱼总产量达96 914 t,占世界总产量的80%以上,其中用于生产鱼子酱的大型鲟鱼约占总养殖量的20%。在鲟鱼养殖业中,杂交鲟由于具有杂交优势和高存活率的特点被广泛养殖[4],史氏鲟×达氏鳇的杂交鲟便是中国水产养殖中最常见的物种[5]。
大型鲟鱼养殖成本高,鱼卵占鱼体质量的10%左右[6],是大型鲟鱼最主要的经济来源。虽然鱼子酱加工产业提高了大型鲟鱼的经济价值,但仍有约90%左右的加工副产物未得到充分利用。鲟鱼肉作为生产鱼子酱后的主要副产品,具有重要的商业价值[7]。目前,市面上的鲟鱼肉加工产品很少,包括鲟鱼扒和部分鱼肉加工的熏制产品等[8]。国内市场鲟鱼消费仍主要以鲜活鲟鱼和初加工的生鲜产品为主[9-10],鲟鱼肉加工利用率较低,限制了鲟鱼养殖业的发展。
不同部位肌肉的品质特性可能是影响鲟鱼精深加工的关键因素。目前已有关于大型鱼类不同部位营养成分分析的相关报道,如王煜坤等[11]以体质量12~18 kg的西伯利亚鲟为原料,研究不同部位的营养成分;Chaijan等[12]研究了大型鲶鱼不同部位的化学组成;Mohanty等[13]研究大型鲶鱼不同部位的基本营养成分、氨基酸和矿物质含量,结果均表明鱼类不同部位肌肉营养成分存在差异。但是,鲜见有关大型鱼类不同部位肌肉的理化性质比较研究。因此,本研究以取卵后的大型杂交鲟(达氏鳇♀×史氏鲟♂)为原料,参考鲟鱼形态学和鱼类肌肉分割方法[14],对躯干部和尾部肌肉进行精细分割,研究不同部位肌肉的理化特性,并探究大型杂交鲟不同部位肌肉制作生鱼片的可行性,以期为大型鲟鱼分部位销售和精深加工提供理论参考,促进鲟鱼加工产业的发展。
1 材料与方法
1.1 材料与试剂
鲟鱼(史氏鲟♂和达氏鳇♀杂交得到的雌性鲟鱼,体质量48~59 kg) 衢州鲟龙水产食品科技开发有限公司。
氯化钠、浓硫酸、硫酸铜、硫酸钾、硼酸、氢氧化钠、磷酸二氢钾、磷酸氢二钾、乙二胺四乙酸、考马斯亮蓝R-250(均为分析纯) 国药集团化学试剂有限公司;苏木精-伊红染液 武汉谷歌生物科技;BC3185双缩脲法蛋白质含量检测试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
TJ12-H绞肉机 广东恒联食品机械有限公司;FJ-200高速均质机 上海标本模型厂;LG10-3A冷冻离心机 北京医用离心机厂;8400全自动凯氏定氮仪丹麦福斯分析仪器公司;5200Multi全自动化学发光成像分析系统 上海天能科技有限公司;NR60CP色差计 深圳市三恩时科技有限公司;TMS-PRO食品物性分析仪 美国FTC公司;Eclipse Ci光学显微镜日本Nikon株式会社。
1.3 方法
1.3.1 样品处理
大型杂交鲟取鱼卵后,去头、去内脏、预冻、称质量,在鲟鱼内脏和周围均放置冰袋,由企业运至实验室。到达实验室之后,对鲟鱼躯干部和尾部肌肉进行划分并取肉,如图1所示,鲟鱼躯干部肌肉总共分为6 个部分,分别为背上部(A)、背中部(B)、背下部(C)、腹上部(D)、腹中部(E)和腹下部(F);尾部肌肉分为前尾部(G)和后尾部(H)两部分。其中AD、BE、CF分别为躯干部前部、中部和后部肌肉,ABC为背部肌肉,DEF为腹部肌肉。8 个部位的肌肉分别用绞肉机搅碎,样品均放置于-20 ℃冷冻备用。

图1 大型杂交鲟肌肉分割示意图Fig.1 Schematic diagram of muscle sampling in giant hybrid sturgeon
1.3.2 蛋白质组成分析
取10 g新鲜鱼肉,加入100 mL缓冲液A(20 mmol/L磷酸盐缓冲液、50 mmol/L NaCl、1 mmol/L乙二胺四乙酸,pH 7.0),均质1 min,4 ℃下搅拌30 min后,离心(4 ℃、10 000×g)15 min,取上清液。沉淀加缓冲液A重复以上操作一次,取上清液,两次上清液为肌浆蛋白(可溶性蛋白)。沉淀加80 mL缓冲液B(25 mmol/L磷酸盐缓冲液、0.6 mol/L NaCl,pH 7.0),4 ℃下搅拌60 min后,离心(4 ℃、10 000×g)15 min,取上清液为肌原纤维蛋白(盐溶性蛋白),沉淀为不溶性蛋白,使用凯氏定氮法测定蛋白质相对含量。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
参考唐淑玮等[15]的方法,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定鲟鱼肌肉蛋白的组成。肌浆蛋白和肌原纤维蛋白均采用Tris-Gly-SDS缓冲液溶解,分离胶质量分数分别为15%和12%,浓缩胶质量分数均为5%,蛋白条带采用5~245 kDa标准品校准。染色和脱色后,使用5200Multi全自动化学发光成像分析系统扫描凝胶。
1.3.4 肉色的测定
使用NR60CP色差计对8 个样品进行颜色测定,并记录L*和a*值。每个部位的样品选取6 个位置进行测定后取平均值。
1.3.5 质地剖面分析和嫩度的测定
质地剖面分析参照胡芬等[16]的方法,在鲟鱼8 个部位分别切取1.0 cm×1.0 cm×1.0 cm整块肉样,将样品置于TMS-PRO食品物性分析仪上,探头类型为P36/R,测试速率为60 mm/min,测试后探头回程速率为100 mm/min,压缩比为40%,每个样品进行6 次平行实验。嫩度参考徐柳等[10]的方法,不同部位分别切取3.0 cm×1.0 cm×1.0 cm整块肉样,将样品置于物性分析仪上,探头类型为HDP/PS燕尾型刀具,测试速率为60 mm/min,每个样品进行6 次平行实验。
1.3.6 肌纤维组织学特性分析
参考王伟等[17]的方法,采集不同部位肌肉,切块(约1.0 cm×0.5 cm×0.5 cm),固定于组织固定液中,采用组织学石蜡切片技术沿垂直于肌纤维方向进行切片,切片厚度4 μm,使用苏木精-伊红染色,用光学显微镜(10×10)观察肌纤维组织结构,采集图像并进行分析。用ImageJ软件对肌纤维直径和密度进行测量并计算平均值。
1.3.7 生鱼片品质评定
1.3.7.1 感官评定
各部位的生鱼片由企业提供,鱼片到达实验室后进行急速冷冻处理,放置于-20 ℃条件下24 h,然后置于4 ℃解冻1 h后进行感官评定。感官评定在感官评定室进行,组织12 名接受过相关培训的食品专业学生进行评价,每个成员之间相互不接触交流,每次样品评定后用清水漱口。参照金枪鱼生肉的感官评价方法[18],感官评分主要从色泽、组织形态、滋味气味和嫩度4 个方面进行,总分以各项目占比进行计算,具体的感官评价标准见表1。

表1 生鱼片感官评价标准Table 1 Criteria for sensory evaluation of sashimi
1.3.7.2 卫生指标测定
依据GB 10136—2015《食品安全国家标准 动物性水产制品》进行寄生虫指标和微生物指标的检测。寄生虫检测采用胃蛋白酶消化液对肌肉进行消化,于37 ℃恒温箱中放置4 h,离心,弃去上清液,再加适量蒸馏水,搅拌后离心,如此重复几次,直至上清液透明为止,沉淀制成切片后在显微镜下观察寄生虫情况。菌落总数和大肠菌群数的测定分别依据GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》和GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》平板计数法进行。
1.3.7.3 体外消化性实验
参考Wen Siying等[19]的方法并略作修改。称取2 g鱼肉样品,加入10 mL蒸馏水均质1 min,用1 mol/L HCl溶液调节pH值至2.0,将胃蛋白酶以质量比1∶31.25添加至鱼肉中,在37 ℃下连续搅拌2 h。消化完成后,用1 mol/L NaOH溶液将pH值调节至7.5使酶失活,以1∶50的质量比添加胰蛋白酶消化,37 ℃消化2 h,通过在100 ℃加热5 min进行灭酶。消化后定容至20 mL,离心(4 ℃、10 000×g)20 min,取上清液使用双缩脲法蛋白质含量检测试剂盒测定可溶性蛋白质量浓度。取鱼肉均质液采用凯氏定氮法测定总蛋白质量浓度。消化率按下式计算。

式中:ρs为可溶性蛋白质量浓度/(mg/mL);ρt为总蛋白质量浓度/(mg/mL)。
1.4 数据处理与分析
每个样品至少设3 个平行,实验数据采用SPSS Statistics 25软件通过单因素方差分析法进行差异显著性分析,以P<0.05表示差异显著,结果表示为平均值±标准差,运用Origin 2018软件作图。
2 结果与分析
2.1 大型杂交鲟不同部位肌肉蛋白质组成分析结果
肌肉蛋白质由水溶性蛋白、盐溶性蛋白和不溶性蛋白组成。水溶性蛋白包括很多与代谢有关的酶蛋白,主要影响肉的呈味特性与色泽;盐溶性蛋白是鱼肉肌肉中最主要的蛋白质,主要包括肌球蛋白、肌动蛋白、肌动球蛋白和调节蛋白等形成的复合体;而不溶性蛋白包括胶原蛋白和弹性蛋白,即肌基质蛋白,是结缔组织的主要成分。从图2A中可以看出,杂交鲟肌肉水溶性蛋白相对含量为23.2%~40.1%,盐溶性蛋白相对含量为47.1%~66.1%,不溶性蛋白相对含量为9.91%~14.4%。杂交鲟腹部较背部和尾部肌肉含有较高含量的水溶性蛋白和较低含量的盐溶性蛋白,其中腹上部肌肉水溶性蛋白相对含量(40.1%)最高,盐溶性蛋白相对含量(47.1%)最低,而前尾部肌肉则相反。后尾部肌肉中不溶性蛋白相对含量最高(14.4%),且躯干部前部肌肉的不溶性蛋白质相对含量高于躯干部中部和后部肌肉,这表明杂交鲟躯干部前部和后尾部肌肉含有较多的结缔组织。
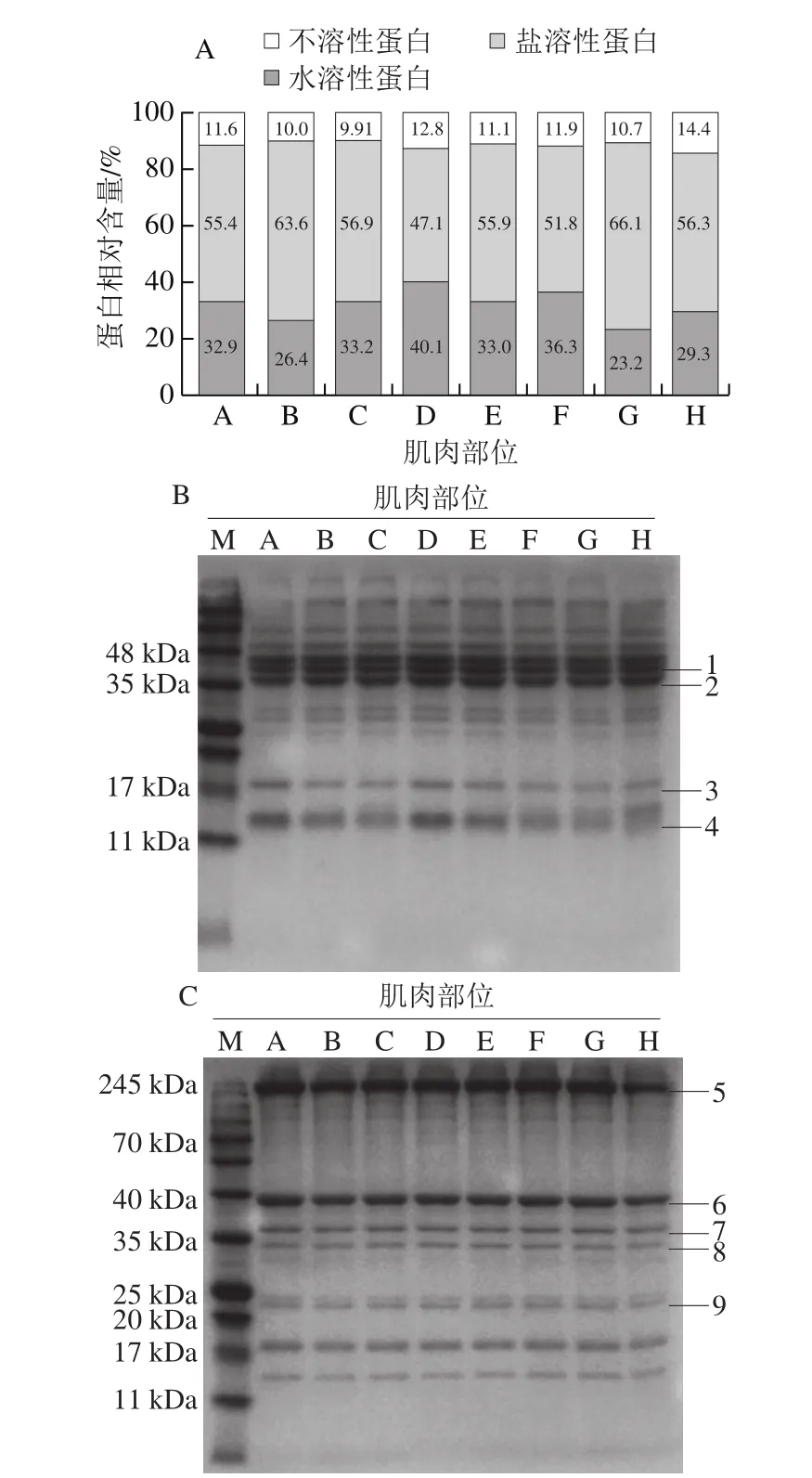
图2 大型杂交鲟不同部位的蛋白质组成(A)及肌浆蛋白(B)和肌原纤维蛋白(C)SDS-PAGE图Fig.2 Protein composition (A) and sodium dodecyl sulfatepolyacrylamide gel electrophoresis of sarcoplasmic (B) and myofibrillar proteins (C) in different parts of giant hybrid sturgeon
不同部位肌肉的肌浆蛋白和肌原纤维蛋白电泳如图2B和图2C所示,不同部位肌肉中蛋白质组成几乎没有差异。Mohan等[20]研究表明鲭鱼不同部位白色肌肉肌浆蛋白和肌原纤维蛋白的电泳谱带相似,与本研究结果一致。杂交鲟肌肉中肌浆蛋白包括肌红蛋白(16.7 kDa)和小清蛋白(12 kDa)以及一些酶蛋白等。肌原纤维蛋白由几种蛋白组成,电泳图中分别对应肌球蛋白重链(205 kDa)、肌动蛋白(45 kDa)、原肌球蛋白(36 kDa)、肌钙蛋白(35 kDa)和肌球蛋白轻链(20 kDa)。由图2可知,肌原纤维蛋白是鱼肉中含量最高的蛋白质,肌球蛋白重链和肌动蛋白是肌原纤维蛋白最主要的蛋白质,这与Chaijan等[12]的研究结果一致。
2.2 大型杂交鲟不同部位肌肉色差分析结果
在鲜肉的几个品质属性中,颜色是影响消费者购买决策的最重要因素[21]。通过测定8 个不同部位肌肉的亮度(L*值)和红度(a*值),分析不同部位肌肉的颜色差异。杂交鲟不同部位肌肉的颜色如图3所示,不同部位肌肉的颜色差异明显,从头部至尾部肌肉亮度逐渐降低,红度逐渐增加,这与Wedekind[22]研究的结果一致。有研究表明,鱼肉不同部位肌肉中的肌红蛋白含量和毛细血管中的血红蛋白含量不同,这可能是造成不同部位肌肉颜色差异的主要原因[23]。大型杂交鲟由头部至尾部肌肉逐渐呈现更暗的红色,这可能主要是肌肉中肌红蛋白比例逐渐升高的缘故。
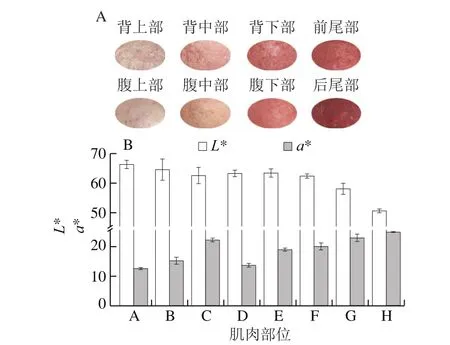
图3 大型杂交鲟不同部位的表观色泽(A)及色泽指标(B)Fig.3 Color appearance (A) and instrumental color parameters (B) of muscles in different parts of giant hybrid sturgeon
2.3 大型杂交鲟不同部位肌肉质构特性分析结果
鱼肉的质地是评价鱼肉组织结构的重要指标。由表2可知,腹部的硬度高于背部,且头部至尾部肌肉硬度先降低后升高,腹上部肌肉硬度显著高于其他部位(P<0.05)。躯干部前部肌肉的弹性高于中部和后部,后尾部肌肉的弹性显著高于其他部位(P<0.05)。咀嚼性与硬度和弹性呈正相关,其中躯干部前部和后尾部肌肉咀嚼所需的能量较高,腹中部肌肉咀嚼所需的能量最低。黏附性是克服食品表面同其他接触物质表面之间吸引力所需要的能量,各部位肌肉的黏附性无显著性差异。在嫩度方面,背上部和背中部的剪切力较大,且背上部至背下部肌肉的剪切力逐渐减小,而背下部、腹部和尾部肌肉之间的剪切力无显著性差异,这表明背下部、腹部和尾部肌肉的嫩度较好。内聚性反映鱼肉抵抗受损并紧密连接使其保持完整的特性,其中背上部肌肉的内聚性最高,其次是尾部和腹上部肌肉,而中部和后部肌肉的内聚性较低,这可能与不同部位鱼肌肉纤维的微观结构及紧密程度有关。

表2 大型杂交鲟不同部位肌肉的质构特性Table 2 Texture profile analysis of muscles from different parts of giant hybrid sturgeon
2.4 大型杂交鲟不同部位肌肉组织学特性分析结果
从图4可以看出,不同部位肌肉形态结构完整,形状呈圆形或椭圆形,以50~150 根肌纤维聚集为束,由肌束膜包裹形成肌束。肌束之间的间隙主要是脱水过程中被除去的脂肪细胞,主要是因为脂肪细胞富含脂滴,在制片染色过程中细胞质内的物质都被破坏,因此不能被染色。在肌束内,背上部至背下部(图4A~C)和腹上部至腹下部(图4D~E)的肌纤维间隙逐渐增加,肌纤维之间的结合变得疏松,坚韧度下降,硬度逐渐降低[24],这与质构指标分析结果一致。
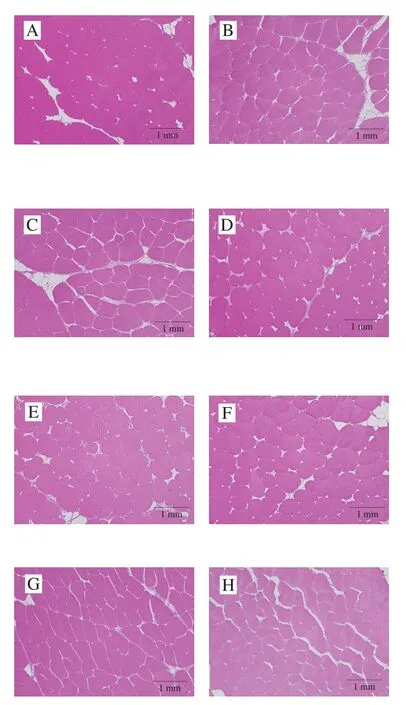
图4 大型杂交鲟不同部位的肌纤维结构(100×)Fig.4 Characteristics of muscle fibers in different parts of giant hybrid sturgeon (100 ×)
鱼肉肌纤维的直径和密度被认为是决定其质地的一个重要指标。由表3可知,杂交鲟肌纤维直径在180.6~274.8 μm之间,肌纤维密度在354~725 根/cm2之间。背上部至背下部的肌纤维直径逐渐降低,密度逐渐增加;腹上部至腹下部的肌纤维直径略微增加,密度基本一致;前尾部和后尾部的肌纤维直径较小,密度较大,其中后尾部的肌纤维直径最小。有研究表明肌肉肌纤维直接越小,密度越大,肌肉嫩度越柔嫩,口感较好[25],这与不同部位肌肉的剪切力指标分析结果一致。但后尾部肌纤维直径较小,剪切力较高,可能是后尾部的结缔组织含量高,影响了肌肉的嫩度。

表3 大型杂交鲟不同部位肌肉的肌纤维直径及密度Table 3 Muscle fiber diameters and density in different parts of giant hybrid sturgeon
2.5 大型杂交鲟不同部位肌肉生鱼片品质分析结果
2.5.1 感官评定结果
感官得分是评价生鱼片质量的重要指标。从表4可以看出,除背下部、前尾部和后尾部总体评分较低外,其余部位评分均较高,受评价人员所喜爱。消费者通常比较喜欢明亮的鲜红色鱼肉[23,26],而暗红色的鱼肉视觉评分较低,使其整体感观评价分值降低[27]。杂交鲟不同部位的生鱼片如图5所示,头部至尾部肌肉由淡红色至暗红色变化。杂交鲟生鱼片除后尾部、前尾部和背下部肌肉外,色泽评分为6.1~7.1 分,其中背上部评分最高。嫩度是影响生鱼片口感的重要指标。除后尾部外,生鱼片嫩度评分均在6.0 分以上,而背上部、背中部、腹上部和腹中部的嫩度评分为6.5~7.7 分,更受消费者喜爱。整体来看,在感官上背上部、背中部、腹上部、腹中部和腹下部制作的生鱼片可能会较受消费者所喜爱。
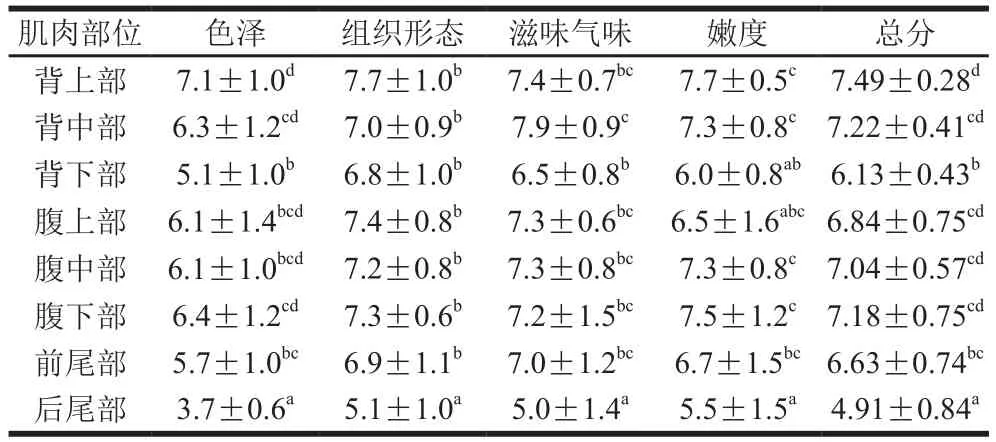
表4 大型杂交鲟生鱼片感官评定结果Table 4 Sensory evaluation of giant hybrid sturgeon sashimi

图5 大型杂交鲟不同部位生鱼片Fig.5 Sashimi prepared from different parts of giant hybrid sturgeon
2.5.2 卫生指标分析结果
根据GB 10136—2015微生物限量,生鱼片卫生指标应符合菌落总数小于5×104CFU/g和大肠菌群数小于10 CFU/g的标准,且不得检出吸虫囊蚴、线虫幼虫、绦虫裂头蚴等寄生虫。通过对各部位的微生物指标和寄生虫进行检测,各部位生鱼片菌落总数均小于5×103CFU/g,挑取可疑大肠菌群菌落接种于BGLB肉汤管中进行证实实验,报告结果为大肠菌群阴性。杂交鲟不同部位生鱼片消化后沉淀的显微镜观察结果如图6所示,各部位生鱼片通过显微镜观察检查均未发现寄生虫,报告为寄生虫未检出。因此,杂交鲟所制作生鱼片符合国家卫生标准。
图6 大型杂交鲟生鱼片消化沉淀观察Fig.6 Observation of precipitates left after digestion of giant hybrid sturgeon sashimi
2.5.3 蛋白体外消化率测定结果
鱼肉具有很高的蛋白质含量,是人体必需蛋白质和氨基酸的重要来源。氨基酸的生物利用度在很大程度上取决于鱼肉蛋白质在体内的消化能力,可以通过体外消化产物的生物利用度来评估。杂交鲟不同部位生鱼片的体外蛋白消化率如图7所示,杂交鲟各部位的体外蛋白消化率为67.40%~78.01%,背上部消化率最低,其次是背中部和腹上部,前尾部消化率最高,这可能主要与前尾部蛋白中的胶原蛋白含量高有关。
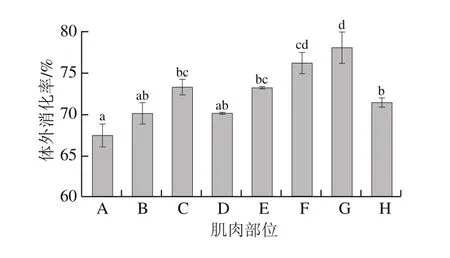
图7 大型杂交鲟不同部位肌肉的体外蛋白消化率Fig.7 In vitro protein digestibility of muscles from different parts of giant hybrid sturgeon
2.6 相关性分析结果
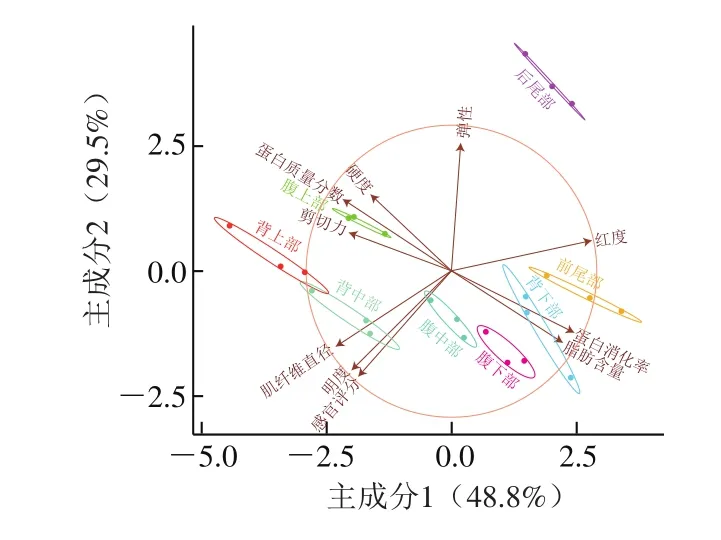
图8 大型杂交鲟不同部位肌肉各指标的主成分分析Fig.8 Principal component analysis of physicochemical, texture and sensory characteristics and in vitro protein digestibility of muscles from different parts of giant hybrid sturgeon
采用主成分分析法对8 个部位肌肉的蛋白质量分数、脂肪含量[28]、色差、硬度、弹性、剪切力、硬度、肌纤维直径、生鱼片的蛋白消化率和感官评分进行相关性分析。由图8可知,硬度和弹性与蛋白质量分数呈正相关,与脂肪含量呈负相关;剪切力与蛋白质量分数和肌纤维直径呈正相关,与脂肪含量呈负相关。有研究表明质构特性与营养成分和肌纤维特性均密切相关[29-30],且肌纤维排列结构和尺寸是影响肌肉质构特性的主要因素[31]。蛋白消化率与蛋白质量分数呈显著负相关,这主要与结缔组织不易消化有关,与蛋白质组成分析结果一致。感官评分与蛋白质量分数、脂肪含量和蛋白消化率无相关性,而与肌纤维直径和亮度(L*值)呈正相关,与弹性和红度(a*值)呈负相关。不同部位肌肉之间蛋白质量分数和脂肪含量等营养指标的变化并不会影响其生鱼片的口感和评分,影响感官评分最直接的因素是弹性、颜色和肌纤维特性。由于生鱼片厚度很薄,颜色作为最直观的主观评价因素,相对于其他因素对感官评分的影响更大[32],消费者可能更喜爱颜色淡红色的鲟鱼生鱼片。由图8可知,腹中部和腹下部蛋白质量分数低,蛋白质消化率高,易消化;明度高,红度低,颜色鲜亮;硬度和剪切力小,脂肪含量高,口感柔软肥美;感官评分高,受到评定者的喜爱。因此,腹中部和腹下部肌肉制作的生鱼片品质较好。
3 讨 论
鲟鱼作为淡水鱼类中体型最大的鱼类之一,骨刺少,非常适合加工。通过分析鲟鱼不同部位肌肉的理化特性,可为鲟鱼深加工制品的开发提供理论依据。唐淑玮[15]和Wang Ruihong[33]等研究表明,盐溶性蛋白含量和白度高的鲟鱼糜制品具有较好的品质,大型杂交鲟背中部肌肉盐溶性蛋白含量较高且肉质较白,用于制作鱼糜具有较好的品质。杂交鲟不同部位肌肉的颜色差异明显,头部至尾部肌肉红色逐渐加深,而腹中部和腹下部肌肉与金枪鱼的红度接近[34]。与金枪鱼[34]和三文鱼[35]相比,鲟鱼肉质硬度更高,但是低于鲤鱼和鲢鱼肌肉的硬度[36]。微观结构的变化会影响鱼肉的质地,杂交鲟不同部位肌肉的质构存在明显差异。由于杂交鲟躯干部由前至后肌肉肌纤维间隙增大,肌纤维疏松,鱼肉的硬度降低。相关性分析结果也表明,肌纤维直径与硬度不相关,而与剪切力呈正相关。这表明肌纤维的紧密程度影响鱼肉的硬度,而肌纤维直径影响鱼肉的嫩度。
生鱼片是以新鲜的鱼贝类生切成片,蘸调味料食用的水产品总称。为了保留生鱼片的营养和口感,制备过程不使用高温烹饪工艺,这可能导致部分生鱼片中存在人畜共患细菌和寄生虫,对消费者构成潜在的健康风险。生鱼片最常用的原料是海水鱼,常见的有金枪鱼、三文鱼、鲷鱼、鲭鱼、鰤鱼等,也有鲤鱼、鲫鱼等淡水鱼[37]。有研究表明,淡水鱼中的寄生虫比海水鱼更多样化[38],但一项关于华盛顿州普吉特海湾野生三文鱼和养殖三文鱼寄生虫研究的结果表明,所有的野生三文鱼均检测到能够感染人的异尖线虫幼虫,而养殖三文鱼没有发现此类幼虫[39]。Ramos[40]通过对不同的海鲜产品进行寄生虫检测,也未在养殖的鱼类中发现异尖线虫幼虫,这表明良好的养殖环境中淡水鱼可能存在的寄生虫风险更低。养殖杂交鲟未检测到寄生虫,且符合即食生制动物性水产制品的微生物限量指标,可作为生食的原料。在质地方面,鲟鱼生鱼片的口感不及金枪鱼和三文鱼,但是相较于鲤鱼、鲢鱼等淡水鱼,鲟鱼生鱼片具有优良的口感。鲟鱼腹中部和腹下部肌肉品质高于其他部位,且颜色与金枪鱼相似,用于制作生鱼片具有较好的品质。
4 结 论
本实验通过对大型杂交鲟肌肉进行精细分割,分析不同部位肌肉的理化性质,并探讨了其制作生鱼片的可行性。结果表明,大型鲟鱼不同部位的肌肉品质差异明显,并且肉色、硬度和肌纤维特性方面沿头部至尾部方向均存在一定变化趋势,质构方面的差异主要与肌纤维特性有关。大型杂交鲟各部位肌肉具有制作生鱼片的可行性,且腹中部和腹下部的生鱼片品质较好,但制样大小、厚度和暗色肉比例对鲟鱼生鱼片品质的影响仍需进一步研究。本研究为大型鲟鱼的精细加工及销售提供了理论参考,对进一步提高大型鲟鱼的加工利用价值、促进鲟鱼养殖业的发展具有一定的意义。

