澳洲坚果青皮不同极性溶剂分步提取物功能成分与抗氧化活性及其相关性分析
郭刚军,胡小静,付镓榕,马尚玄,徐 荣,黄克昌,彭志东,贺熙勇,邹建云,
(1.云南省热带作物科学研究所,云南 景洪 666100;2.文山学院化学与工程学院,云南 文山 663000)
自由基是人体新陈代谢酶促反应所产生具有未成对电子的原子、分子、离子和基团,其性质活泼且具有强烈的氧化作用[1]。过量的自由基对人体危害很大,它可以氧化各种酶和蛋白质的巯基,改变其功能和结构;破坏细胞膜上的多糖结构,影响细胞功能的发挥;损害核酸和染色体,使生物体发生突变或产生病变。摄入具有自由基清除能力的食物或药物(即通常所说的抗氧化剂)可减缓自由基对机体的侵害,预防动脉粥样硬化、糖尿病、心脑血管疾病、肿瘤、机体衰老及各种炎症等病变的发生[2-3]。许多研究证实植物源提取物和酚类、黄酮类、醌类、皂苷、多糖、生物碱等功能成分具有很好的抗氧化活性[4-6]。
澳洲坚果(Macadamia ternifoliaF.Muell)又名夏威夷果、昆士兰果、昆士兰栗、澳洲胡桃等,原产于澳大利亚的亚热带雨林[7],因其果仁营养丰富、口感细腻、味美可口、营养价值高,被誉为“坚果之王”[8]。我国澳洲坚果自上世纪九十年代开始商业化种植,现主要分布在云南、广西和贵州等省(区),2017年种植面积279.64万 hm2,占全球总种植面积的61.86%[9]。澳洲坚果果实由青皮、果壳和果仁组成,其青皮占鲜果质量的45%~60%,产量巨大[10-11]。研究表明,澳洲坚果青皮中蕴含蛋白质、糖类、酚类、单宁、黄酮、酚酸、有机酸、皂苷、P、K、Ca、Mg、Zn、Cu、Fe、Mn等多种营养与功能成分;其中,酚类中包含没食子酸、对羟基苯甲醇、3,4-二羟基苯甲酸、对羟基苯甲酸和对羟基苯甲醛等化合物,皂苷中含有极具生物活性与药理作用的豆腐果苷和熊果苷成分[12-14]。澳洲坚果青皮是采后处理加工环节的主要副产物,目前仅有极少量用作沤肥或饲料,绝大部分被丢弃,其本身所具有的保健、药用和经济价值尚未引起足够的重视,其提取物中总酚、黄酮、多糖等抗氧化成分含量及活性的相关研究也尚不多见。为此,本研究以澳洲坚果青皮为实验材料,通过提取与萃取获得其不同极性部位的分步提取物,测定其总酚、黄酮与多糖等主要功能成分含量,评价其1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、超氧阴离子、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力与还原力,并分析它们之间的相关性,以期为开发利用澳洲坚果青皮资源提供一定的技术依据,有效促进澳洲坚果产业的健康、可持续发展。
1 材料与方法
1.1 材料与试剂
澳洲坚果青皮采自云南省热带作物科学研究所实验基地。
没食子酸(色谱纯)、芦丁(色谱纯)、葡萄糖(色谱纯)标准品 合肥博美生物科技有限公司;DPPH 美国Sigma-Aldrich公司;ABTS 上海华蓝化学科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
SB-5200DT型超声波清洗器 宁波新芝生物科技股份有限公司;BGZ-240型电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;RV10型旋转蒸发仪 德国IKA集团;SGIA-100F型冷冻干燥机 宁波市双嘉仪器有限公司;DZKW-4型电子恒温水浴锅 上海科析试验仪器厂;UV-754N型紫外-可见分光光度计 上海菁华科技有限公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 澳洲坚果青皮不同极性溶剂分步提取物的制备
新鲜澳洲坚果青皮经挑拣、清洗,40 ℃烘干,粉碎,过60 目筛,用80%(体积分数,下同)乙醇在温度60 ℃、料液比1∶8(m/V)条件下超声提取2 h,重复3 次,合并提取液,过滤,减压浓缩至无乙醇味。将80%乙醇提取物用适量蒸馏水充分混悬后,依次用石油醚、氯仿、乙酸乙酯、正丁醇进行萃取,分别重复3 次,剩余提取液为水溶解物,减压回收溶剂,冷冻干燥,得到澳洲坚果青皮80%乙醇提取物、石油醚提取物、氯仿提取物、乙酸乙酯提取物、正丁醇提取物与水溶解物,备用[15]。
1.3.2 澳洲坚果青皮不同极性溶剂分步提取物功能成分测定
1.3.2.1 总酚质量分数的测定
采用福林-酚法测定总酚质量分数:总酚标准曲线绘制参照文献[16],以没食子酸标准品为标样,采用最小二乘法作线性回归,得到没食子酸标准溶液质量浓度x/(μg/mL)与吸光度y标准曲线的回归方程:y=0.013 9x+0.001 8,决定系数R2=0.999 5。然后分别取10 mg澳洲坚果青皮不同极性溶剂分步提取物,加蒸馏水溶解并定容至100 mL,摇匀。量取1.0 mL定容液,依次加入1.0 mL福林-酚溶液与5.0 mL蒸馏水,室温放置3~4 min,再加入3.0 mL质量分数15%的Na2CO3溶液,40 ℃水浴60 min,在762 nm波长处测定其吸光度,对照标准曲线,换算得出澳洲坚果青皮不同极性溶剂分步提取物的总酚质量分数。
1.3.2.2 黄酮质量分数的测定
NaNO2-Al(NO3)3比色法测定黄酮质量分数:黄酮标准曲线绘制参照文献[17],以芦丁标准品为标样,采用最小二乘法作线性回归,得芦丁标准溶液质量浓度x/(mg/mL)与吸光度y标准曲线的回归方程:y=11.695x+0.01,决定系数R2=0.999 5。然后分别取10 mg澳洲坚果青皮不同极性溶剂分步提取物,加蒸馏水溶解并定容至1 000 mL,摇匀。量取2.0 mL定容液,加入质量分数5% NaNO2溶液1.0 mL,室温静置5 min,加入质量分数10% Al(NO3)3溶液1.0 mL,摇匀,静置6 min,再加入质量分数4% NaOH溶液10 mL,蒸馏水定容至25 mL,静置30 min,显色,在510 nm波长处测定其吸光度,对照标准曲线,换算得出澳洲坚果青皮不同极性溶剂分步提取物的黄酮质量分数。
1.3.2.3 多糖质量分数的测定
苯酚-硫酸法测定多糖质量分数:多糖标准曲线绘制参照文献[18],以葡萄糖标准品为标样,采用最小二乘法进行线性回归,得葡萄糖标准溶液质量浓度x/(μg/mL)与吸光度y标准曲线的回归方程:y=0.017 3x+0.008 5,决定系数R2=0.999 2。然后分别取10 mg澳洲坚果青皮不同极性溶剂分步提取物,加蒸馏水溶解并定容至100 mL,摇匀。量取2.0 mL定容液,加入1.0 mL 5%苯酚溶液与5.0 mL浓硫酸,摇匀,70 ℃水浴15 min,在490 nm波长处测定其吸光度,对照标准曲线,换算得出澳洲坚果青皮不同极性溶剂分步提取物的多糖质量分数。
1.3.3 澳洲坚果青皮不同极性溶剂分步提取物抗氧化活性测定
1.3.3.1 DPPH自由基清除率测定
在10 mL试管中依次加入3.9 mL 0.04 mg/mL DPPH溶液和0.1 mL不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL,下同)澳洲坚果青皮不同极性溶剂分步提取物与芦丁标准品样液,混匀后,在517 nm波长处测定其吸光度,记为As;再对0.04 mg/mL DPPH溶液在517 nm波长处测定吸光度,记为Ao,按式(1)计算DPPH自由基清除率[19]。
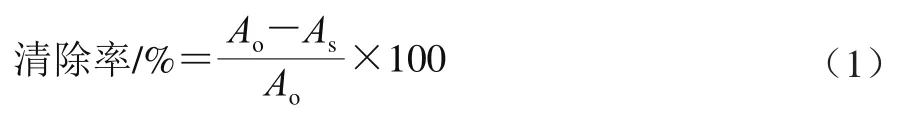
1.3.3.2 超氧阴离子自由基清除率测定
邻苯三酚自氧化速率的测定:取4.5 mL 50 mmol/L Tris-HCl缓冲溶液(pH 8.2)、4.2 mL蒸馏水混匀,25 ℃水浴保温20 min,取出后立即加入25 ℃预热过的3.0 mmol/L邻苯三酚0.3 mL,迅速摇匀后,在325 nm波长处每隔30 s测定其吸光度,计算线性范围每分钟内吸光度的增加量,并以10 mmol/L HCl溶液配制空白管作为对照。
加入不同质量浓度澳洲坚果青皮不同极性溶剂分步提取物与芦丁标准品样液后邻苯三酚自氧化速率的测定:按照上述步骤在加入邻苯三酚前先分别加入0.1 mL样品液,蒸馏水相应减少0.1 mL。同样以10 mmol/L HCl溶液配制空白管作为对照。按照式(2)计算超氧阴离子自由基清除率[15]。

式中:ΔA1/Δt为邻苯三酚自氧化反应速率;ΔA2/Δt为加入样品液后邻苯三酚自氧化反应速率。
1.3.3.3 ABTS阳离子自由基清除率测定
取440 μL 140 mmol/L过硫酸钾溶液加入到25 mL 7 mmol/L ABTS溶液中混合,避光反应12~16 h。使用前用80%乙醇溶液稀释100 倍,使405 nm波长处吸光度为0.70±0.02,得到ABTS工作液。然后分别取0.15 mL不同质量浓度澳洲坚果青皮不同极性溶剂分步提取物与芦丁标准品样液加入5.7 mL ABTS工作液,混匀,室温放置10 min,在734 nm波长处测定吸光度。按照式(3)计算ABTS阳离子自由基清除率[20]。
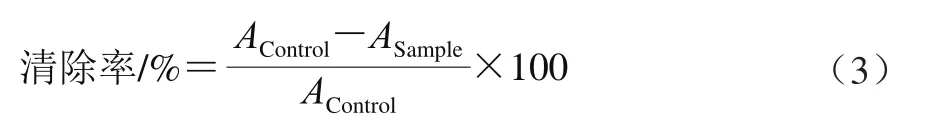
式中:AControl为5.7 mL ABTS工作液与0.15 mL 80%乙醇混合后的吸光度;ASample为5.7mL ABTS工作液与0.15 mL样品液混合后的吸光度。
1.3.3.4 还原力测定
分别取2.5 mL不同质量浓度澳洲坚果青皮不同极性溶剂分步提取物与芦丁标准品样液置于10 mL试管中,分别加入2.5 mL磷酸缓冲液(pH 6.6)和1.0 mL质量分数1.0%铁氰化钾溶液,50 ℃反应20 min,冰浴。冷却至室温后,加入1.0 mL质量分数10%三氯乙酸溶液,2 500 r/min离心20 min。取上清液5.0 mL加入4.0 mL蒸馏水,混匀,再加入1.0 mL质量分数0.1% FeCl3溶液,室温静置10 min,在700 nm波长处测定其吸光度,还原力用样品吸光度A表示[21]。
1.3.3.5 抗氧化能力评价指标的计算
以澳洲坚果青皮不同极性溶剂分步提取物样品质量浓度为横坐标,抗氧化能力为纵坐标,研究其相关性与变化趋势,求得线性回归方程,以50%清除率对应质量浓度为样品自由基清除能力半抑制浓度(half maximal inhibitory concentration,IC50)(IC50越低,抗氧化能力越强),斜率为增加系数(增加系数越大,随质量浓度增加,抗氧化能力增加越快),R2为决定系数,表示拟合性(R2越接近1,拟合效果越好)。
1.4 数据统计分析
数据采用SAS 9.2软件处理,应用方差分析与邓肯法进行显著性分析,以P<0.05表示差异具有统计学意义;采用皮尔逊法进行相关性分析;运用REG过程进行多元线性回归分析。实验结果以平均值±标准差表示。
2 结果与分析
2.1 澳洲坚果青皮不同极性溶剂分步提取物功能成分分析结果

表1 澳洲坚果青皮不同极性溶剂分步提取物功能成分及质量分数Table 1 Contents of bioactive components in successive solvent extracts from macadamia green husk
酚类、黄酮与多糖等功能成分是植物生长代谢中的次生产物,广泛存在于其叶、种子、根、茎、皮内,是具有抗氧化活性的天然化合物[22]。由表1可知,澳洲坚果青皮不同极性溶剂分步提取物中的总酚、黄酮、多糖与皂苷及其他成分质量分数差异明显。其中,总酚质量分数最高的是乙酸乙酯提取物,为(40.36±0.48)%,与其他提取物均有显著差异(P<0.05);其次是正丁醇提取物,质量分数为(22.40±0.25)%,质量分数最低的是石油醚提取物,为(12.62±0.49)%。黄酮质量分数最高的也是乙酸乙酯提取物,为(41.68±0.93)%,与其他提取物均有显著差异(P<0.05);其次是石油醚提取物,质量分数为(24.80±0.86)%,质量分数最低的是正丁醇提取物与水溶解物,分别仅为(8.84±0.49)%与(7.55±0.96)%,两者之间无显著差异(P>0.05)。多糖质量分数最高的是正丁醇提取物,为(22.08±2.09)%,与其他提取物均有显著差异(P<0.05);其次是乙酸乙酯提取物,质量分数为(8.78±0.46)%,质量分数最低的是氯仿提取物,仅为(0.74±0.09)%。张明楷等[23]研究表明不同品种澳洲坚果青皮中含有5.04%~9.21%的蛋白质;施蕊等[24]研究表明澳洲坚果青皮乙醇提取物中含有豆腐果苷、熊果苷等皂苷类物质。由此推测,本研究制备的澳洲坚果青皮不同极性溶剂分步提取物还含有皂苷、蛋白质等其他成分,其质量分数最高的是水溶解物,为(67.27±1.48)%,与其他提取物均有显著差异(P<0.05);其次是80%乙醇提取物,质量分数为(62.50±0.79)%,质量分数最低的是乙酸乙酯提取物,仅为(9.17±1.15)%。综上可知,80%乙醇从澳洲坚果青皮中提取了大量的功能成分。其中,乙酸乙酯从其提取物中富集的总酚和黄酮质量分数最高,正丁醇富集的多糖质量分数最高,可见它们对澳洲坚果青皮中酚类、黄酮与多糖等成分的初步分离是有效的。
2.2 澳洲坚果青皮不同极性溶剂分步提取物的抗氧化活性
2.2.1 澳洲坚果青皮不同极性溶剂分步提取物对DPPH自由基的清除作用

表2 澳洲坚果青皮不同极性溶剂分步提取物对DPPH自由基的清除能力Table 2 DPPH radical scavenging capacity of successive solvent extracts from macadamia green husk at different concentrations

表3 澳洲坚果青皮不同极性溶剂分步提取物对DPPH自由基的清除效果指标Table 3 Linear regression equations of DPPH radical scavenging capacity of successive solvent extracts from macadamia green husk versus concentration and IC50
DPPH自由基是一种人工合成的、稳定的有机自由基,具有制备方便、实验重现性好等优点,其清除率被广泛用于样品抗氧化能力的评价[25-26]。由表2、3可知,澳洲坚果青皮不同极性溶剂分步提取物对DPPH自由基的清除率在不同质量浓度间存在显著差异(P<0.05),相同质量浓度不同提取物间也存在显著差异(P<0.05)。在质量浓度0.2~1.0 mg/mL范围内,不同提取物对DPPH自由基清除率与其质量浓度呈良好的线性正相关关系。其中乙酸乙酯提取物清除能力较强,相同质量浓度下仅次于芦丁标准品,在质量浓度0.2 mg/mL时清除率为(22.50±0.53)%,与其他提取物与芦丁标准品存在显著差异(P<0.05),随着质量浓度的增加,乙酸乙酯提取物清除率增加最快,增加系数为58.085,当质量浓度达到1.0 mg/mL时,清除率为(70.09±0.73)%,与其他提取物、芦丁标准品存在显著差异(P<0.05);其次为正丁醇提取物,在质量浓度0.2 mg/mL时清除率为(17.86±0.71)%,随质量浓度的增加,其清除率增加也较快,增加系数为45.100,当质量浓度达到1.0 mg/mL时,清除率为(54.03±0.50)%。对DPPH自由基清除能力最差的为80%乙醇提取物,在质量浓度0.2 mg/mL时清除率仅为(5.20±0.39)%,与相同质量浓度下的水溶解物无显著差异(P>0.05),且随质量浓度的增加其清除率增加较慢,增加系数仅为10.105,当质量浓度达到1.0 mg/mL时,清除率仅为(13.08±0.62)%。从评价样品对DPPH自由基清除能力的IC50来看,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品对DPPH自由基清除能力的大小顺序为芦丁标准品(IC500.29 mg/mL)>乙酸乙酯提取物(IC500.67 mg/mL)>正丁醇提取物(IC500.92 mg/mL)>氯仿提取物(IC501.41 mg/mL)>石油醚提取物(IC502.36 mg/mL)>水溶解物(IC503.41 mg/mL)>80%乙醇提取物(IC504.65 mg/mL)。
2.2.2 澳洲坚果青皮不同极性溶剂分步提取物对超氧阴离子自由基的清除作用

表4 澳洲坚果青皮不同极性溶剂分步提取物对超氧阴离子自由基的清除能力Table 4 Superoxide anion radical scavenging activity of successive solvent extracts from macadamia green husk at different concentrations

表5 澳洲坚果青皮不同极性溶剂分步提取物对超氧阴离子自由基的清除效果指标Table 5 Linear regression equations of superoxide anion radical scavenging capacity of successive solvent extracts from macadamia green husk versus concentration and IC50
生物体内氧化还原反应中,大约有2%~5%的氧会产生超氧阴离子自由基,其是羟基等多种自由基的衍生源,超氧阴离子自由基的清除能力是评价样品抗氧化能力的一个重要指标[27]。由表4、5可知,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品对超氧阴离子自由基清除率与其质量浓度呈较好的正相关关系。其中,正丁醇提取物清除能力最强,相同质量浓度下优于芦丁标准品及其他提取物,且差异显著(P<0.05),在质量浓度0.2 mg/mL时清除率便达到(64.95±0.62)%,随着质量浓度的增加,其清除率增加相对较快,增加系数为16.290,当质量浓度达到1.0 mg/mL时,清除率为(90.72±0.49)%;其次为氯仿提取物,在质量浓度0.2 mg/mL时清除率为(44.67±0.64)%,与芦丁标准品及其他提取物存在显著差异(P<0.05),随着质量浓度的增加,其清除率增加相对较慢,增加系数为9.800,当质量浓度达到1.0 mg/mL时,清除率仅为(52.92±0.67)%,与石油醚提取物无显著差异(P>0.05)。对超氧阴离子自由基清除能力较差的为80%乙醇提取物与水溶解物,在质量浓度1.0 mg/mL时清除率分别仅为(24.45±0.32)%与(33.84±0.68)%。从评价样品对自由基清除能力的IC50来看,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品对超氧阴离子自由基清除能力的大小顺序为正丁醇提取物(IC500.08 mg/mL)>芦丁标准品(IC500.18 mg/mL)>氯仿提取物(IC500.72 mg/mL)>石油醚提取物(IC500.89 mg/mL)>乙酸乙酯提取物(IC501.02 mg/mL)>水溶解物(IC501.16 mg/mL)>80%乙醇提取物(IC502.57 mg/mL)。
2.2.3 澳洲坚果青皮不同极性溶剂分步提取物对ABTS阳离子自由基的清除作用

表6 澳洲坚果青皮不同极性溶剂分步提取物对ABTS阳离子自由基的清除能力Table 6 ABTS cation radical scavenging capacity of successive solvent extracts from macadamia green husk at different concentrations
表7 澳洲坚果青皮不同极性溶剂分步提取物对ABTS阳离子自由基的清除效果指标Table 7 Linear regression equations of ABTS cation free radical scavenging capacity of successive solvent extracts from macadamia green husk versus concentration and IC50
ABTS阳离子自由基是通过过硫酸钾氧化ABTS产生的一种自由基,其性质非常稳定,目前被广泛应用于样品抗氧化能力的测定[28-29]。由表6、7可知,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品对ABTS阳离子自由基均有较强的清除作用,且清除率与其质量浓度呈良好的正相关关系。其中,乙酸乙酯提取物的清除能力较强,在质量浓度0.2 mg/mL时,其清除率为(67.08±2.41)%,仅次于芦丁标准品,与其他提取物存在显著差异(P<0.05),随着质量浓度的增加,其清除率增加相对较快,当质量浓度为0.4 mg/mL时便达到(96.99±0.18)%,与其质量浓度在0.6、0.8、1.0 mg/mL时的清除率无显著差异(P>0.05),优于相同质量浓度的芦丁标准品及其他提取物。正丁醇提取物的清除率也较高,在质量浓度0.6 mg/mL时便达到了(97.07±0.18)%,与其质量浓度在0.8 mg/mL及1.0 mg/mL时的清除率无显著差异(P>0.05),也与相同质量浓度的乙酸乙酯提取物无显著差异(P>0.05),优于芦丁标准品与其他提取物。80%乙醇提取物对ABTS阳离子自由基的清除能力相对较差,在质量浓度0.2 mg/mL时的清除率仅为(27.30±2.38)%,但随着质量浓度的增加,其清除率增加较快,增加系数最大,为77.635,当质量浓度增加到1.0 mg/mL时,清除率达到了(89.14±0.33)%。从评价样品对自由基清除能力的IC50来看,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品对ABTS阳离子自由基清除能力的大小顺序为乙酸乙酯提取物(IC500.05 mg/mL)>芦丁标准品(IC500.07 mg/mL)>正丁醇提取物(IC500.12 mg/mL)>氯仿提取物(IC500.18 mg/mL)>石油醚提取物(IC500.35 mg/mL)>水溶解物(IC500.36 mg/mL)>80%乙醇提取物(IC500.48 mg/mL)。
2.2.4 澳洲坚果青皮不同极性溶剂分步提取物还原力分析结果
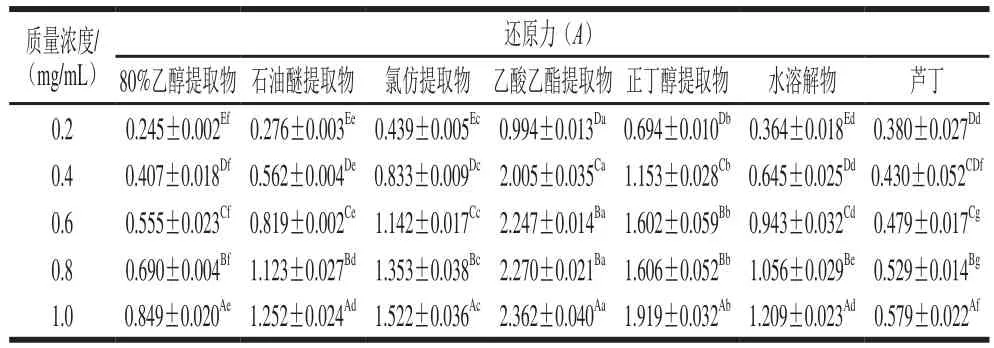
表8 澳洲坚果青皮不同极性溶剂分步提取物的还原力Table 8 Reducing power of successive solvent extracts from macadamia green husk at different concentrations
还原力是评价生物样品抗氧化活性的一个重要指标,吸光度越大还原力越大[30]。由表8、9可知,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品具有较强的还原力,且还原力与其质量浓度呈良好的正相关关系。其中,乙酸乙酯提取物的还原力最强,在质量浓度0.2 mg/mL时便达到0.994±0.013,当质量浓度增加到1.0 mg/mL时,还原力达到2.362±0.040,均与芦丁标准品及其他提取物存在显著差异(P<0.05);其次为正丁醇提取物,相同质量浓度下的还原力仅次于乙酸乙酯提取物,在质量浓度0.2 mg/mL时的还原力为0.694±0.010,当质量浓度增加到1.0 mg/mL时,还原力达到1.919±0.032。随着质量浓度的增加,氯仿提取物的还原力增加较快,增加系数最大,为1.343 0,在质量浓度0.2 mg/mL时还原力为0.439±0.005,当质量浓度增加到1.0 mg/mL时,其还原力达到1.522±0.036。80%乙醇提取物的还原力相对较低,相同质量浓度下还原力低于其他提取物,但在0.6~1.0 mg/mL质量浓度范围内的还原力仍高于芦丁标准品。从评价样品还原力的IC50来看,澳洲坚果青皮不同极性溶剂分步提取物及芦丁标准品还原力的大小顺序为乙酸乙酯提取物(IC500.09 mg/mL)>正丁醇提取物(IC500.16 mg/mL)>氯仿提取物(IC500.19 mg/mL)>水溶解物(IC500.27 mg/mL)>石油醚提取物(IC500.36 mg/mL)>80%乙醇提取物(IC500.53 mg/mL)>芦丁标准品(IC500.68 mg/mL)。
2.3 澳洲坚果青皮不同极性溶剂分步提取物抗氧化活性及功能成分质量分数相关性分析结果
2.3.1 澳洲坚果青皮不同极性溶剂分步提取物各项指标相关性分析结果
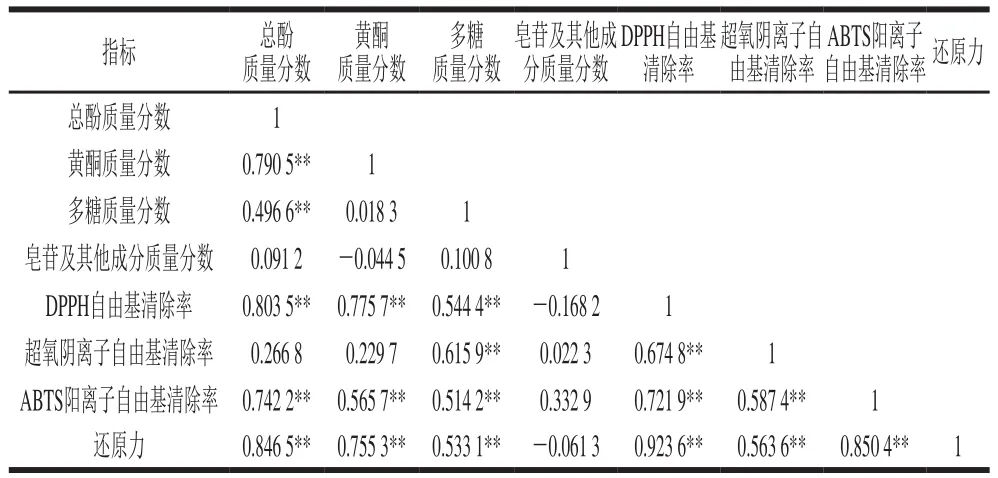
表10 澳洲坚果青皮不同极性溶剂分步提取物各项指标的皮尔逊相关系数及其相关性检验结果Table 10 Pearson coefficients between antioxidant properties and bioactive components and correlation test of successive solvent extracts from macadamia green husk
由表10可知,澳洲坚果青皮不同极性溶剂分步提取物抗氧化活性与功能成分质量分数间存在良好的相关性,其对DPPH自由基的清除率与总酚、黄酮、多糖质量分数呈极显著正相关(P<0.01),相关系数分别为0.803 5、0.775 7与0.544 4;对超氧阴离子自由基的清除率与多糖质量分数呈极显著正相关(P<0.01),相关系数为0.615 9;对ABTS阳离子自由基的清除率与总酚、黄酮、多糖质量分数呈极显著正相关(P<0.01),相关系数分别为0.742 2、0.565 7与0.514 2;还原力与总酚、黄酮、多糖质量分数呈极显著正相关(P<0.01),相关系数分别为0.846 5、0.755 3与0.533 1。其抗氧化指标间存在极好的相关性,其还原力与DPPH自由基、超氧阴离子自由基、ABTS阳离子自由基清除率呈极显著正相关(P<0.01),相关系数分别为0.923 6、0.563 6与0.850 4;对ABTS阳离子自由基的清除率与DPPH自由基、超氧阴离子自由基清除率呈极显著正相关(P<0.01),相关系数分别为0.721 9与0.587 4;对超氧阴离子自由基清除率与DPPH自由基清除率呈极显著正相关(P<0.01),相关系数为0.674 8。其功能成分间也存在良好的相关性,总酚质量分数与黄酮、多糖质量分数呈极显著正相关(P<0.01),相关系数分别为0.790 5与0.496 6。上述分析结果表明,澳洲坚果青皮不同极性溶剂分步提取物抗氧化活性与其所含有的功能成分种类及质量分数密切相关,但其功能成分对抗氧化活性的贡献是复合作用的结果,需进一步进行多元回归分析。
2.3.2 澳洲坚果不同极性溶剂分步提取物抗氧化活性与功能成分多元回归分析结果
植物及其不同部位提取物的强抗氧化能力并非单一功能成分的贡献,而是多种成分共同作用的结果。不同功能成分联用时可能会出现不同的结果,当复合成分效果大于单独成分效果时为协同作用,等于时为加和作用,而小于时则为拮抗作用[31]。为找出澳洲坚果青皮不同极性溶剂分步提取物不同功能成分质量分数对其抗氧化活性的作用,分别以DPPH自由基清除率(Y1)、超氧阴离子自由基清除率(Y2)、ABTS阳离子自由基清除率(Y3)与还原力(Y4)为因变量,总酚(X1)、黄酮(X2)、多糖(X3)与皂苷及其他成分(X4)质量分数为自变量进行逐步回归分析,建立多元线性回归方程(分别为I、II、III、IV),结果见表11。

表11 澳洲坚果不同极性溶剂分步提取物抗氧化活性与功能成分多元回归分析结果Table 11 Results of multiple regression analysis between antioxidant activities and functional components of successive solvent extracts from macadamia green husk
由表11可知,澳洲坚果青皮不同极性溶剂分步提取物对DPPH自由基的清除率与其总酚、黄酮、多糖、皂苷及其他成分质量分数之间的线性关系经逐步回归分析后,4 个成分变量因对DPPH自由基清除率的回归均达到极显著水平(P<0.01)而被引入方程。同时总酚、黄酮、多糖、皂苷及其他成分质量分数变量的标准回归系数分别为-0.371 6、1.049 0、0.726 0与-0.160 8,表明其对DPPH自由基清除率作用的大小顺序依次为黄酮>多糖>总酚>皂苷及其他成分。经方差分析,该模型的F值为93.51,P<0.000 1,决定系数R2为0.968 2,说明其有统计学意义,效果理想。得到的回归方程为Y1=7.634 4-0.071 0X1+0.170 2X2+0.227 6X3-0.013 3X4,它可以把提取物的清除DPPH自由基活性与功能成分之间的关系量化,表明在共同作用时,其与黄酮、多糖质量分数呈极显著正相关,与总酚、皂苷及其他成分质量分数呈极显著负相关。
澳洲坚果青皮不同极性溶剂分步提取物对超氧阴离子自由基的清除率与总酚、黄酮、多糖、皂苷及其他成分质量分数之间的线性关系经逐步回归分析后,皂苷及其他成分质量分数变量被剔除,总酚、黄酮、多糖质量分数变量因对超氧阴离子自由基清除率的回归达到极显著水平(P<0.01)而被引入回归方程。同时总酚、黄酮与多糖质量分数变量的标准回归系数分别为-1.471 8、1.369 0与1.321 7,表明其对超氧阴离子自由基清除率作用的大小顺序依次为总酚>黄酮>多糖。经方差分析,该模型的F值为24.15,P<0.000 1,决定系数R2为0.857 8,说明其有统计学意义,效果理想。得到的回归方程为Y2=29.024 5-0.405 0X1+0.320 0X2+0.597 2X3,它可以把提取物清除超氧阴离子自由基活性与总酚、黄酮与多糖质量分数之间的关系量化,表明在共同作用时,其与黄酮、多糖质量分数呈极显著正相关,与总酚质量分数呈极显著负相关,与皂苷及其他成分质量分数相关性不显著。
澳洲坚果青皮不同极性溶剂分步提取物对ABTS阳离子自由基的清除率与总酚、黄酮、多糖、皂苷及其他成分质量分数之间的线性关系经逐步回归分析后,黄酮、多糖质量分数变量均被剔除,总酚质量分数变量因对清除率的回归达到极显著水平(P<0.01),皂苷及其他成分质量分数变量因对清除率的回归达到显著水平(P<0.05)而被引入回归方程。总酚、皂苷及其他成分质量分数变量的标准回归系数分别为0.717 8与0.267 4,表明其对ABTS阳离子自由基清除率作用的大小顺序为总酚>皂苷及其他成分。经方差分析,该模型的F值为22.20,P<0.000 1,决定系数R2为0.788 5,说明其具有统计学意义,效果理想。得到的回归方程为Y3=40.305 6+0.188 8X1+0.030 4X4,它可以把提取物清除ABTS阳离子自由基活性与总酚、皂苷及其他成分质量分数之间的关系量化,表明在共同作用时,其与总酚质量分数呈极显著正相关,与皂苷及其他成分质量分数呈显著正相关,与黄酮、多糖质量分数相关性不显著。
澳洲坚果青皮不同极性溶剂分步提取物的还原力与总酚、黄酮、多糖、皂苷及其他成分质量分数之间的线性关系经逐步回归分析后,总酚、皂苷及其他成分质量分数变量均被剔除,黄酮、多糖质量分数变量因对还原力的回归达到极显著水平(P<0.01)而被引入回归方程。黄酮、多糖质量分数变量的标准回归系数分别为0.745 8与0.519 5,表明其对还原力作用的大小顺序为黄酮>多糖。经方差分析,该模型的F值为71.00,P<0.000 1,决定系数R2为0.916 6,说明其具有统计学意义,效果理想。得到的回归方程为:Y4=0.298 2+0.004 5X2+0.006 0X3,它可以把提取物还原力与黄酮、多糖质量分数之间的关系量化,表明在共同作用时,其与黄酮、多糖质量分数呈极显著正相关,与总酚、皂苷及其他成分质量分数相关性不显著。
3 结 论
澳洲坚果青皮不同极性溶剂分步提取物中,乙酸乙酯提取物总酚与黄酮质量分数最高,正丁醇提取物多糖质量分数最高。澳洲坚果青皮不同极性溶剂分步提取物与芦丁标准品具有较强的清除ABTS阳离子自由基能力与较高的还原力,对DPPH自由基与超氧阴离子自由基有一定的清除作用。其中,乙酸乙酯提取物对DPPH自由基清除能力优于其他5 种提取物,但低于芦丁标准品,对ABTS阳离子自由基的清除能力与还原力优于芦丁标准品及其他提取物;正丁醇提取物对超氧阴离子自由基的清除能力优于芦丁标准品及其他提取物。澳洲坚果青皮不同极性溶剂分步提取物的抗氧化活性与其所含有的功能成分密切相关,是其共同作用的结果,对DPPH自由基的清除率与其黄酮、多糖质量分数呈极显著正相关,与总酚、皂苷及其他成分质量分数呈极显著负相关;对超氧阴离子自由基的清除率与其黄酮、多糖质量分数呈极显著正相关,与总酚质量分数呈极显著负相关,与皂苷及其他成分质量分数相关性不显著;对ABTS阳离子自由基的清除率与其总酚质量分数呈极显著正相关,与皂苷及其他成分质量分数呈显著正相关,与黄酮、多糖质量分数相关性不显著;还原力与黄酮、多糖质量分数呈极显著正相关,与总酚、皂苷及其他成分质量分数相关性不显著。实验结果表明澳洲坚果青皮不同极性溶剂分步提取物尤其是乙酸乙酯提取物与正丁醇提取物具有较好的抗氧化活性,下一步可对其进行系统的分离与分析,确定具体的抗氧化物质,为澳洲坚果青皮的深度开发提供一定的理论依据。

