超声复合碱处理对大豆分离蛋白乳化性影响及其对表没食子儿茶素没食子酸酯保护作用
闫世长,徐静雯,武利春,孙禹凡,齐宝坤,,李 杨,2,3,
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.哈尔滨市食品产业研究院,黑龙江 哈尔滨 150000;3.国家大豆工程技术研究中心,黑龙江 哈尔滨 150000)
大豆分离蛋白(soybean protein isolate,SPI)主要是由7S(β-伴球蛋白)和11S(球蛋白)两种球形蛋白组成,可以提供包括赖氨酸在内的必需氨基酸,其具有较高的营养价值[1]。然而,未改性的SPI其功能特性如乳化特性、凝胶特性及其他加工特性等[2]的应用常常受限。SPI相对较低的乳化性可能是由7S和11S球蛋白三级和四级结构的复杂性、紧密堆积的球形构象以及低分子柔韧性引起的[1]。因此,需要对SPI进行修饰处理以获得更优的乳化特性,这对其作为功能性和营养性成分在食品和药品中的应用有着重要的意义。
近年来,酸碱处理、超声处理被广泛用于蛋白改性。酸碱处理主要是依靠产生的静电斥力来引起分子结构展开[3]。超声处理通过产生机械作用、空化作用来促使蛋白肽键断裂、破坏蛋白聚集颗粒间的非共价作用,从而引起天然蛋白分子聚集状态的改变[4]。Jiang Lianzhou等[5]研究发现超声处理黑豆蛋白可使蛋白的亚基发生解离、疏水基团暴露、乳化特性增加。Zhang Zhaoli等[6]研究发现碱处理可以使蛋白亚基解离、二硫键断裂,从而改善其功能特性。然而,单一的改性方式对蛋白功能特性的提升效果并不理想,近年来,复合改性方法引起了人们的关注。Jiang Shanshan等[7]研究发现超声复合酸处理可改变豌豆蛋白的结构,从而提升其功能性。Li Suyun等[8]研究发现超声复合碱处理可使大米蛋白的α-螺旋含量减少,无规卷曲含量增加,导致结构变得松散。然而,目前关于超声复合碱处理对SPI的影响还鲜见报道。
表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)是绿茶多酚的主要成分。EGCG富含酚羟基,具有强抗氧化活性,并可在预防癌症、心血管疾病以及其他慢性疾病方面发挥作用[9]。但是,EGCG在中性和碱性溶液中非常不稳定,随着pH值、氧气浓度或温度的升高,EGCG降解速度加快[10]。因此,寻找理想的方法防止EGCG降解迫在眉睫,Chen Weijun等[11]利用碱处理改性的乳清蛋白与EGCG结合,显著提高了乳清蛋白与EGCG的结合力,阻止了EGCG在贮存过程中的降解。Shpigelman等[12]研究发现热改性的乳蛋白与EGCG的结合能力增强,有效降低了EGCG的降解速度。然而,关于超声复合碱处理SPI对EGCG的保护作用目前鲜见报道。因此,本实验旨在研究超声复合碱处理对SPI分子结构及功能特性的影响及其对EGCG的保护作用,以期为SPI作为生物活性成分载体的设计提供理论和方法指导。
1 材料与方法
1.1 材料与试剂
大豆 市售;EGCG(色谱纯) 上海源叶生物科技有限公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、1-苯胺基-8-萘磺酸盐(1-anilino-8-naphthalene-sulfonate,ANS)美国Sigma公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯) 北京新光化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平 梅勒特-托利多仪器(上海)有限公司;PHS-3C型实验室pH计 上海仪电科学仪器股份有限公司;F-6000荧光分光光度计 日本Hitachi公司;TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;JJ-1增力电动搅拌器 江苏金城国胜仪器厂;Allegra64R台式高速冷冻离心机 美国贝克曼公司;IRTracer-100傅里叶变换红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 SPI的制备与处理
1.3.1.1 SPI制备
根据Li Yang等[13]的方法制备SPI。将大豆磨粉,过60 目筛,用正己烷脱脂,将脱脂豆粉分散于去离子水中(1∶10,m/V),用2 mol/L NaOH溶液调节pH值至9.0,搅拌1 h,9 000 r/min离心30 min,取其上清液,然后用2 mol/L HCl溶液调节pH值至4.5,得到蛋白沉淀物,将蛋白沉淀物水洗如何溶解3 次,6 500 r/min离心30 min得到沉淀物,将沉淀物用蒸馏水溶解后,用2 mol/L NaOH溶液调节pH值至中性,冻干,即得SPI,使用凯氏定氮法测定蛋白质量分数,为(92.35±0.26)%。
1.3.1.2 SPI处理
根据Hu Hao[14]与Huang Liurong[15]等的方法对SPI进行处理。
对照组:称取SPI 1.0 g,加入蒸馏水100 mL,25 ℃搅拌1 h,搅拌过程中利用0.1 mol/L NaOH溶液维持pH值为7.0,在5 000 r/min下离心15 min得上清液,然后冻干。
碱处理:称取SPI 1.0 g,加入蒸馏水100 mL,25 ℃搅拌1 h,搅拌过程中利用0.1 mol/L NaOH溶液维持pH值为12.0,然后调节pH值至7.0保持1 h,在5 000 r/min下离心15 min得上清液,然后冻干。
超声处理:称取SPI 1.0 g,加入蒸馏水100 mL,25 ℃搅拌1 h,搅拌过程中利用0.1 mol/L NaOH溶液维持pH值为7.0,然后200 W超声处理5 min(工作/间歇时间比为5 s/5 s),蒸馏水定容到100 mL,在5 000 r/min下离心15 min得上清液,然后冻干。
超声复合碱处理:称取超声处理的SPI 1.0 g,加入100 mL蒸馏水,25 ℃搅拌1 h,并用浓度为0.1 mol/L NaOH溶液维持pH值为12.0,然后调节pH值至7.0,保持1 h,在5 000 r/min下离心15 min得上清液,然后冻干。
超声处理、碱处理、超声复合碱处理的样品分别记作USPI、HSPI、UHSPI。
1.3.2 傅里叶变换红外光谱分析
用IRTracer-100傅里叶变换红外光谱仪在室温下记录SPI的红外光谱。将样品与KBr混合(质量比1∶100),然后压片。在500~4 000 cm-1的范围内记录光谱,分辨率为4 cm-1。采用Peakfit 4.12软件中高斯曲线拟合α-螺旋、β-折叠、β-转角和无规卷曲的特征峰[16],分析其相对含量。
1.3.3 荧光光谱分析
根据He Zhiyong等[17]的方法并稍作修改,对SPI进行荧光光谱分析,使用F-6000荧光分光光度计,在连续扫描模式下,发射光谱范围为200~500 nm,激发波长设定为200~350 nm,共进行16 次扫描。
1.3.4 巯基含量测定
巯基含量参照Lee等[1]的方法进行测定。将15 mg样品溶解于5.0 mL的缓冲液(0.086 mol/L Tris、0.09 mol/L甘氨酸、4 mmol/L乙二胺四乙酸、8 mol/L尿素,pH 8.0)中,在该蛋白液中加入50 μL的Ellman试剂,漩涡混匀后在室温((25±1)℃)下反应1 h,然后再经10 000×g离心15 min。得到的上清液在412 nm波长处测定吸光度,以未加蛋白的Ellman试剂为空白。巯基含量以DTNB摩尔消光系数13 600 L/(mol·cm)计算,单位为μmol/g。
1.3.5 表面疏水性测定
采用Kang Dacheng等[18]的方法,以ANS为荧光探针测定的蛋白质表面疏水性。利用磷酸盐缓冲液(0.01 mol/L、pH 7.0)将各处理蛋白配制成2 mg/mL的蛋白溶液。然后用磷酸盐缓冲液将蛋白质量浓度稀释至0.005~0.500 mg/mL之间。取不同质量浓度的稀释样品4 mL,加入50 μL的ANS溶液(采用0.01 mol/L pH 7.0的磷酸盐缓冲液配制成,浓度8 mmol/L)。采用F-6000型荧光分光光度计在365 nm的激发波长和484 nm的发射波长处测定样品的荧光强度,以荧光强度为纵坐标、蛋白质量浓度为横坐标作图,曲线斜率即为蛋白质分子的表面疏水性。
1.3.6 乳化性测定
乳化性的测定参考Gao Hao等[19]的方法并稍作修改。将1.3.5节样品溶液用磷酸盐缓冲液稀释(10 mmol/L、pH 7.0)至质量浓度为1 mg/mL,将稀释的样品以3∶1(V/V)溶解于大豆油中,使用高速剪切均质机以10 000 r/min均质1 min形成乳状液,立即从乳状液底部提取50 μL乳液分散于质量分数0.1%的十二烷基硫酸钠溶液,稀释100 倍。经漩涡振荡后用分光光度计在500 nm波长处测定样品的吸光度A500nm,用相同质量分数的十二烷基硫酸钠溶液作为对照。经10 min后再次测定其吸光度。用吸光度表示乳化活性,A500nm越高表示乳化活性越高;按公式(1)计算乳化稳定性。
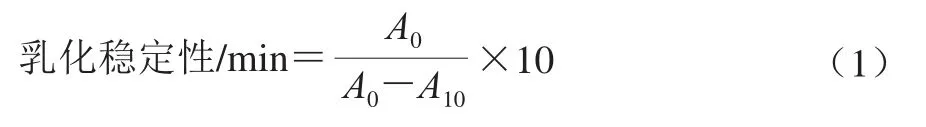
式中:A0、A10分别为乳状液在0、10 min时的吸光度。
1.3.7 荧光猝灭分析
根据Chen Weijun等[11]的方法,向10 mL不同方式处理的SPI溶液(1 mg/mL)中分别逐滴加100 μL 2.5×10-6、5.0×10-6、7.5×10-6、10.0×10-6、12.5×10-6、15.0×10-6、17.5×10-6、20.0×10-6mol/L的EGCG溶液,漩涡振荡后,选择激发波长280 nm、激发狭缝5 nm、扫描速率600 nm/min、连续扫描记录发射波长300~400 nm。荧光猝灭一般可分为动态猝灭和静态猝灭2 种作用机制。应用Stern-Volmer方程判断猝灭类型[20],见公式(2)。

式中:F0和F分别为未加入和加入猝灭剂EGCG时SPI溶液的荧光强度;[Q]为EGCG的浓度/(10-6mol/L);Kq为双分子猝灭速率常数/(L/(mol·s));Ksv为动态猝灭常数/(L/mol);τ0为猝灭剂不存在时荧光体的寿命,生物大分子的平均寿命约为10-8s。
一般情况猝灭剂对于生物大分子最大猝灭速率常数为2×1010L/(mol·s),当大于这一速率时,则为静态猝灭,静态猝灭按公式(3)计算。

式中:Ka为表观结合常数/(L/mol);n为结合位点数。
1.3.8 EGCG稳定性测定
通过将EGCG溶液(0.5 mg/mL,溶解于0.01 mol/L磷酸盐缓冲液中,pH 7.0)和SPI溶液(1 mg/mL,溶解于0.01 mol/L磷酸盐缓冲液,pH 7.0)以1∶1的体积比混合制备SPI-EGCG复合物。使用相同的缓冲液制备游离EGCG溶液(0.25 mg/mL)。将所有样品在室温下放置7 d。在425 nm波长处测定其吸光度[12],以吸光度表示EGCG的稳定性。
1.4 数据统计与分析
所有实验重复3 次,结果采用平均值±标准差表示。利用SPSS 20软件中的方差分析法进行差异显著性分析,P<0.05表示差异显著。利用Origin 2020软件作图。
2 结果与分析
2.1 SPI的傅里叶变换红外光谱分析结果
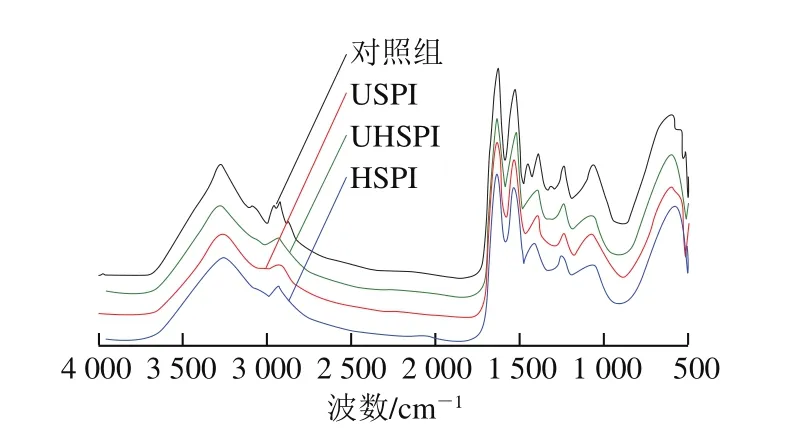
图1 超声与碱处理SPI的傅里叶变换红外光谱图Fig.1 Fourier transform infrared spectra of native and treated SPI

表1 超声与碱处理SPI的二级结构相对含量Table 1 Relative contents of secondary structures in native and treated SPI%
傅里叶变换红外光谱常被用来分析蛋白质二级结构的变化情况。由图1可知,经过不同条件处理后,各样品酰胺I带的半峰宽变窄、强度减弱及峰位(SPI:1 631.73 cm-1;HSPI:1 632.81 cm-1;USPI:1 633.02 cm-1;UHSPI:1 633.48 cm-1)发生改变,由此可知SPI二级结构发生变化。SPI二级结构相对含量分析如表1所示,与对照组相比,碱处理可以使蛋白的α-螺旋与β-折叠相对含量降低,这可能是碱处理提高静电斥力导致的[21]。Chen Weijun等[11]发现碱处理可以降低乳清蛋白蛋白的α-螺旋与β-折叠含量,这与本实验结果一致。超声处理SPI的α-螺旋相对含量显著降低,表明超声波可以破坏蛋白质分子的氢键和蛋白的刚性结构,并改善蛋白质分子柔性[19]。此外,与对照组相比,超声辅助碱处理的SPIα-螺旋相对含量显著降低(降低13.23%)、无规卷曲含量显著升高(升高8.44%),可能是由于蛋白质表面的氢键含量减少和碱处理提供的静电相互作用降低了蛋白质的稳定性[22]。
2.2 SPI的荧光光谱分析结果

图2 超声与碱处理SPI的荧光光谱Fig.2 Fluorescence spectra of native and treated SPI
色氨酸在280 nm波长处具有最大吸收峰,因此可通过280 nm激发波长处的荧光强度变化考察蛋白内部色氨酸的变化。SPI含有一定数量的色氨酸,当色氨酸存在于天然蛋白质内部时,荧光强度降低,荧光峰位会发生蓝移,当蛋白质结构展开时,荧光强度增加,荧光峰位会发生红移[23]。本研究利用荧光光谱来表征蛋白三级结构的变化,如图2所示,与对照蛋白相比,碱处理的SPI没有发生明显的红移或蓝移现象,但是其荧光强度明显增加,这是由于碱诱导促使蛋白分子结构展开,使内部的发色基团暴露[11]。超声处理的SPI荧光强度增加并发生明显的红移现象,这是由于超声产生的空化作用或机械剪切应力导致蛋白结构变得松散,内部的芳香族氨基酸暴露出来,造成荧光强度增加[8]。超声辅助碱处理与单独的超声或碱处理相比,其荧光强度进一步增加,表明超声与碱处理有协同作用,可以使蛋白结构发生解折叠,使疏水基团暴露,荧光强度增加[24]。
2.3 SPI的表面疏水性分析结果
表面疏水性是蛋白质一种重要的表面性质,与蛋白的乳化特性相关。如图3所示,与对照蛋白相比,超声处理的SPI表面疏水性显著增加(P<0.05),可能是因为超声波产生的空化作用破坏了蛋白质分子空间结构,暴露出分子内部的疏水性氨基酸残基,这些疏水性基团吸附在蛋白质表面,导致蛋白质的表面疏水性增加[7]。碱处理的SPI表面疏水性也发生显著的变化(P<0.05),这是因为碱诱导使蛋白质二硫键遭到破坏,亚基发生解离,造成包埋在分子内部的疏水基团暴露在分子表面,进而导致表面疏水性增加[11,21]。超声处理SPI比碱处理SPI表面疏水性增加程度更显著,这可能是恢复到中性条件时,蛋白结构发生部分重新折叠,部分疏水基团被重新包裹在蛋白内部[7,21]。超声辅助碱处理的SPI与单独超声处理或碱处理相比,其表面疏水性增加更显著,这表明超声处理产生的空化作用与碱处理提供的静电斥力相辅相成,使难溶的SPI结构展开,暴露出更多的疏水作用位点,增加了蛋白的表面疏水性[19]。

图3 超声与碱处理SPI的表面疏水性Fig.3 Surface hydrophobicity of native and treated SPI
2.4 SPI的巯基含量分析结果
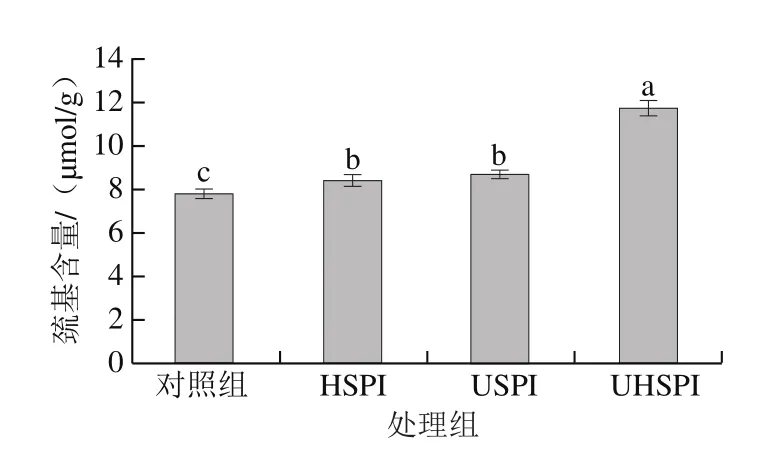
图4 超声及碱处理SPI的巯基含量Fig.4 Sulfhydryl contents of native and treated SPI
蛋白质巯基含量的变化也表征着蛋白质结构的改变,巯基含量的测定结果如图4所示,与对照组相比,超声处理的SPI巯基含量增多,可能的原因是超声处理后蛋白质空间结构被破坏,蛋白内部的巯基基团暴露出来[1]。碱处理的SPI巯基含量也增加,可能是碱处理使蛋白质二硫键遭到破坏,亚基发生解离,进而使巯基含量增加[7,21]。超声辅助碱处理的SPI与单独超声或单独碱处理SPI相比,其巯基含量显著增加(P<0.05),这可能是超声与碱处理产生协同作用,使蛋白的结构变得松散,亚基发生解离,二硫键断裂,内部的巯基基团暴露出来[25]。
2.5 SPI的乳化性分析结果
乳化活性与乳化稳定性是表征蛋白乳化能力与稳定乳状液能力的重要指标,其中乳化活性表示蛋白乳液形成油-水界面的能力,乳化稳定性是指乳状液形成小液滴的稳定能力[26]。由图5可知,与对照SPI相比,单独碱处理的SPI乳化活性与乳化稳定性显著增加,可能是由于pH 12距离蛋白的等电点较远,产生较高的静电斥力,蛋白分子间的相互作用减弱,粒径分布均匀,表面疏水性增加,从而改善其乳化特性[7,19]。单独超声处理的SPI乳化活性与乳化稳定性也呈现显著增加趋势,可能是由于超声处理破坏蛋白质分子的空间结构,使SPI分子展开,暴露出埋藏在分子内部的疏水性基团,促进了SPI在油-水界面上的展开,有利于形成稳定的网络结构[27]。超声辅助碱处理的蛋白表现出最高的乳化活性(1.714)与乳化稳定性(364.68 min),这可能是碱处理产生的静电斥力使蛋白结构变得松散,疏水性基团暴露,同时超声处理可以使蛋白形成稳定的胶束包裹在油滴表面,进而提升蛋白的乳化性[24]。
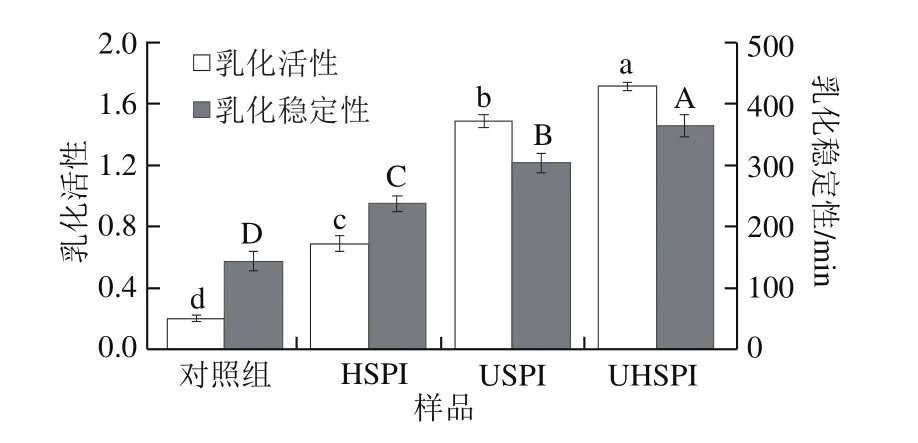
图5 超声及碱处理SPI的乳化活性与乳化稳定性Fig.5 Emulsifying activity and emulsion stability of native and treated SPI
2.6 SPI的荧光猝灭分析结果
蛋白质荧光图被认为是研究多酚与蛋白质相互作用和结合的实用工具。本实验采用荧光猝灭光谱法评价EGCG与SPI在pH 7.0下的相互作用,结果如图6所示。随着EGCG浓度的增加,SPI、HSPI、USPI、UHSPI的荧光强度降低,并发生轻微红移,这一结果表明EGCG的加入改变了蛋白的结构,使疏水性基团进一步暴露[11]。其中,超声辅助碱处理的SPI与EGCG相互作用,其荧光损失率最大。
图7A为不同浓度EGCG猝灭超声及碱处理SPI的Stern-Volmer图,其猝灭相关常数如表2所示,SPI、HSPI、USPI、UHSPI的双分子猝灭速率常数分别为1.390×1012、2.060×1012、2.450×1012、3.150×1012L/(mol·s),其均高于最大动态猝灭速率常数(2×1010L/(mol·s)),因此SPI、HSPI、USPI、UHSPI与EGCG之间的猝灭为静态的。Kq和Ksv反映了生物分子与猝灭剂的结合强度,较高的Kq和Ksv可能表明生物分子与猝灭剂更易结合[20]。对于静态猝灭,用式(3)计算表观结合常数(Ka)和结合位点数(n),结果如图7B和表2所示,超声辅助碱处理的SPI显示出最大的表观结合常数(6.560×104L/mol)与结合位点数(1.43),表明UHSPI对EGCG具有更大的结合力。由于蛋白质与多酚的相互作用与蛋白质的表面性质明显相关,蛋白质结构的变化可能会影响多酚的结合反应,Chen Weijun等[11]研究发现,碱处理可以改变乳清蛋白的结构,进而增强蛋白与EGCG之间的结合力;此外,Shpigelman等[12]还提出,蛋白与EGCG结合强度的增加可能是热处理使蛋白的疏水基团暴露进而与EGCG发生疏水性结合所致,因此,超声辅助碱处理的SPI有着最强的结合能力可能是由于其结构变化,这与本实验前面结构变化讨论的结果一致。

图6 EGCG对SPI的荧光猝灭Fig.6 Fluoresecence quenching of native and treated SPI in the presence of EGCG


图7 EGCG猝灭超声及碱处理SPI的Stern-Volmer图(A)及双对数图(B)Fig.7 Stern-Volmer plot (A) and double logarithm plot (B) of fluorescence quenching of native and treated SPI in the presence of EGCG

表2 SPI-EGCG复合物的双分子猝灭速率常数、动态猝灭常数、表观结合常数和结合位点数Table 2 Fluorescence quenching rate constant, dynamic quenching constant, apparent binding constant and binding site number of SPI-EGCG complex
2.7 EGCG的稳定性分析结果

图8 EGCG与不同处理SPI复合后的贮藏稳定性Fig.8 Storage stability of EGCG complexed with native or treated SPI
多酚易受环境压力的影响,从而发生氧化形成带有颜色的醌类物质,因此,研究多酚物质的降解情况可以有效防止其发生降解,进而提高其利用率[28]。图8显示了在室温下贮存7 d期间对照组、HSPI、USPI和UHSPI对EGCG降解的保护情况。可以看出,随着贮藏时间的延长,游离EGCG的吸光度迅速上升,这表示EGCG发生了氧化降解[29-30]。SPI与EGCG复合后,其吸光度轻微降低,表明SPI对EGCG有较弱的保护能力,可能与蛋白的结构及与EGCG的结合强度有关,EGCG与超声处理、碱处理以及超声辅助碱处理的SPI复合之后,其吸光度与对照组相比均进一步降低;其中,超声辅助碱处理展现出最好的保护作用,这可能与UHSPI具有较高的巯基含量及与EGCG较强的结合能力有关。Bae等[31]的研究表明蛋白质的巯基可以作为抗氧化剂,从而抑制EGCG的氧化降解。Shpigelman等[12]研究发现热处理的蛋白结构发生改变,与EGCG的结合强度增加,能够保护EGCG不被降解。Chen Weijun等[11]还指出,碱处理的乳清蛋白与EGCG的结合位点数增加,从而提高了EGCG的抗氧化性并延缓其降解速率。
3 结 论
本研究探究了超声复合碱处理SPI结构、功能的变化及其对EGCG的保护作用,结果发现,超声复合碱处理中碱处理可以诱导蛋白分子展开,同时超声提供的机械剪切及空化作用使蛋白分子结构变得更松散,暴露出更多的疏水性基团,比单一处理的方式更有效;碱处理、超声处理、超声复合碱处理均可以提高蛋白的乳化特性,超声复合碱处理的效果最佳;荧光猝灭光谱分析结果表明,超声复合碱处理的SPI与EGCG具有最强的结合能力,结合位点数最多(1.43);碱处理、超声处理、超声复合碱处理均可以防止EGCG氧化,超声复合碱处理的保护效果最优。本研究可为SPI在食品工业中作为乳化剂和功能性活性物质载体的应用提供理论参考。

