乳铁蛋白生物活性肽及其功能机制研究进展
石璞洁,许诗琦,王震宇,吴 超,卢卫红,,杜 明,,
(1.哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150001;2.大连工业大学食品学院,海洋食品深加工省部共建协同创新中心,国家海洋食品工程技术研究中心,辽宁 大连 116034)
1939年,Sorensen等[1]在牛乳的乳清中发现了一种红色的蛋白质,之后陆续有研究人员在人乳和牛乳中纯化出这种红色的蛋白质。直到1960年,Groves[2]针对这种红色蛋白质进行了理化性质的鉴定,发现该蛋白与铁转运蛋白具有相似的性质,之后被称为乳铁转运蛋白,现在也称乳铁蛋白(lactoferrin,LF)。乳铁蛋白是一种由约690 个氨基酸组成的铁结合糖蛋白,分子质量约为80 kDa,主要由嗜中性粒细胞和乳腺上皮细胞表达和分泌,在哺乳动物中广泛分布,具有抗菌、抗炎、抗肿瘤和免疫调节等多种生理活性[3]。乳铁蛋白仅包含一条多肽链,折叠成两个基本对称且高度同源的球状叶结构,称之为N叶与C叶。1992年,Bellamy等[4]从乳铁蛋白分子的N-末端分离到一条多肽——乳铁素(lactoferricin,Lfcin),它的抗菌效果是乳铁蛋白的400多倍,除此之外,其生物活性与乳铁蛋白密切相关,同样具有抗肿瘤、免疫调节以及抗氧化等多重生物功能,因此引起了国内外科学家对乳铁蛋白水解产物的关注。
过去人们认为,人体主要是以氨基酸的形式吸收蛋白质,但现代营养学研究发现,多肽与完全游离氨基酸相比可以更快地被机体吸收利用[5-6]。由于Lfcin的发现及其所具有的多重生理活性,近年来,关于乳铁蛋白生物活性肽的研究逐渐增多。相较于乳铁蛋白来说,乳铁蛋白生物活性肽具有分子质量小、消化吸收好、更高的生物活性等优点,在功能食品领域有广泛的应用前景。因此,本文基于目前的研究结果,综述了乳铁蛋白生物活性肽的种类、结构以及作用机制,同时探讨了其在食品领域中的应用。
1 乳铁蛋白生物活性肽的分类
乳铁蛋白经蛋白酶水解后可得到多种具有不同生理功能的活性多肽,主要包括抗微生物肽、降血压肽、抗肿瘤肽以及免疫调节肽等[7-10]。本文总结了近年来文献报道的乳铁蛋白来源的生物活性肽(图1),其中主要以抗微生物活性肽为主,约占多肽总数量的46.7%;其次是与预防血管疾病有关的降血压肽,约占21.0%;抗肿瘤肽与抗炎及免疫调节肽分别占14.5%和11.3%;除此之外,仍有部分来源于乳铁蛋白的抗氧化肽和促进细胞增殖活性肽被报道,约占多肽总数的6.5%。对于来源于乳铁蛋白的生物活性肽,大部分多肽的氨基酸数量主要在10~20 个之间。其中抗微生物活性肽的氨基酸数量分布范围更广泛,既有10 个氨基酸以下的寡肽,又有长达47 个氨基酸的多肽。而对于降血压肽来说,主要以10 个氨基酸分子以下的寡肽为主。
随着乳铁蛋白生物活性肽研究的不断发展,对其作用机制的研究也不断加深。目前已报道的乳铁蛋白肽根据其生物活性不同,具有不同的作用机制(表1)。来源于乳铁蛋白的抗微生物活性肽,主要集中在乳铁蛋白的N-末端,具有强阳离子特性。其作用机制与乳铁蛋白不同,多肽并不能与微生物竞争性结合铁离子,但由于多肽的强阳离子特性,其可以对微生物的细胞膜造成损伤,且因分子质量小更易被机体吸收,对微生物的抑制效果更强。血管紧张素I可以被血管紧张素I转化酶(angiotensin I-converting enzyme,ACE)催化转变成促使血管收缩的血管紧张素II,从而使具有血管舒张作用的缓激肽失活,导致高血压[21]。乳铁蛋白经蛋白酶水解得到的小分子寡肽也更容易与ACE的活性位点结合,作为ACE的抑制剂,通过抑制其活性从而达到降血压的效果。而对于肿瘤细胞,乳铁蛋白活性肽可以使细胞生长周期停滞,诱导细胞凋亡,从而阻止细胞扩散,甚至导致细胞死亡。与乳铁蛋白相似,乳铁蛋白来源的生物活性肽也具有免疫调节作用,一方面可抑制免疫细胞促炎因子的分泌;另一方面可促进巨噬细胞等免疫细胞的增殖,提高免疫细胞的活性,从而发挥免疫调节作用。

图1 乳铁蛋白生物活性肽的分布Fig.1 Distribution of lactoferrin-derived bioactive peptides
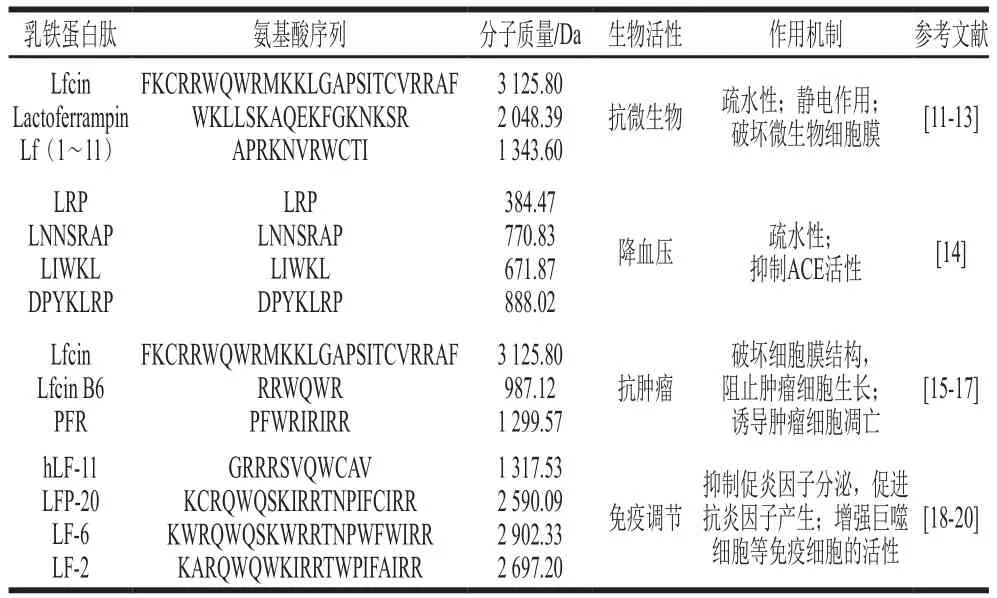
表1 乳铁蛋白生物活性肽的作用机制Table 1 Mechanisms of action of lactoferrin-derived bioactive peptides
2 乳铁蛋白生物活性肽及其作用机制
2.1 乳铁蛋白抗微生物活性肽
Lfcin是乳铁蛋白在酸性条件下经胃蛋白酶水解产生的多肽,来源于乳铁蛋白的N-末端,与乳铁蛋白功能密切相关。虽然Lfcin不能结合铁离子,但它的抗菌活性是乳铁蛋白的400多倍。Lfcin首先在牛乳中被发现,之后陆续在人、小鼠、猪等动物中发现了它的同源物。不同物种来源Lfcin的一级结构具有较高的同源性且它们包括的氨基酸长度不同(表2)。其中,来源于牛的Lfcin B与来源于人的Lfcin H是最主要的两个研究对象,这是因为Lfcin B的活性最高,而Lfcin H与人的关系最密切。Lfcin B含有25 个氨基酸残基,分子质量约为3 125.80 Da,等电点大于8.5。Lfcin B由牛乳铁蛋白中第17~41位氨基酸残基组成,其中包括5 个色氨酸、3 个赖氨酸和多个芳香族氨基酸残基,其中的两个半胱氨酸通过形成分子内二硫键使Lfcin B分子呈不完全的环状[23]。而Lfcin H含有47 个氨基酸残基,由人乳铁蛋白中第1~47位氨基酸残基组成,分子质量约为3 021.56 Da。其一级结构与Lfcin B类似,由二硫键连接,都呈环状,分为Lfcin H1~11和Lfcin H12~47两个片段[24]。Lfcin具有广谱抗菌的作用,包括许多G+和G-菌,如肠炎沙门氏菌(Salmonella enteritidis)、金黄色葡萄球菌(Staphyloccocus aureus)、大肠杆菌(Escherichia coli)以及绿脓杆菌(Pseudomonas aeruginosa)。Lfcin对结核支杆菌(Mycobacterium tuberculosis)等引起肺部感染的菌种有较强的抑制作用并且对一些乳铁蛋白有抗性的真菌,如白色念珠菌(Canidia Albicans)、病毒以及弓形虫等均有抑制作用[25-26]。但Lfcin对肠道菌的抑制具有选择作用,对动物肠道有益菌(如双歧杆菌、荧光假单胞菌以及乳酸菌等)抗菌效果差或无抗菌作用[27]。Lfcin的抗菌机理被认为与细胞膜的相互作用有关,原核细胞膜含有大量带负电的磷脂酰甘油,使细胞膜带有净负电荷,强碱性的Lfcin可与细胞膜表面的负电荷基团通过静电吸引结合。在与微生物细胞膜作用过程中,Lfcin B序列中的第4~9位氨基酸残基(RRWQWR)被认为是Lfcin B的活性中心,其中3 个精氨酸残基侧链与细胞膜成分通过正负电荷吸引,而色氨酸的芳香结构环与磷脂头部的甘油相互作用,通过疏水作用将肽附着于外膜表面,利用疏水结构使抗菌肽通过跨膜进入细胞,或者实现多个抗菌肽聚集到细胞膜上形成离子通道,使细胞膜通透性增强,引起细胞的自溶[11]。
除抗菌活性外,Lfcin同样可以抑制肝炎病毒、疱疹I型和II型病毒、流感病毒等的复制和繁殖,也可以抑制人免疫缺陷病毒-1对MT4细胞和成纤维细胞的致病变作用[28-29]。病毒对宿主细胞的感染一般都要经历不同的阶段,包括吸附、穿入、脱壳、核酸复制、转移翻录、包装等,阻止这其中任何一步,均可以抑制病毒的感染。McCann等[30]在研究Lfcin B对猫科杯状病毒的抑制效果中,通过免疫荧光观察发现,培养细胞表面结合有Lfcin B,揭示Lfcin B可能作用于被感染细胞表面,干扰病毒与宿主细胞表面受体的相互作用。而进一步的研究也显示Lfcin可与宿主表面的硫酸肝磷脂和黏多糖结合,从而阻止病毒与宿主细胞吸附[31]。
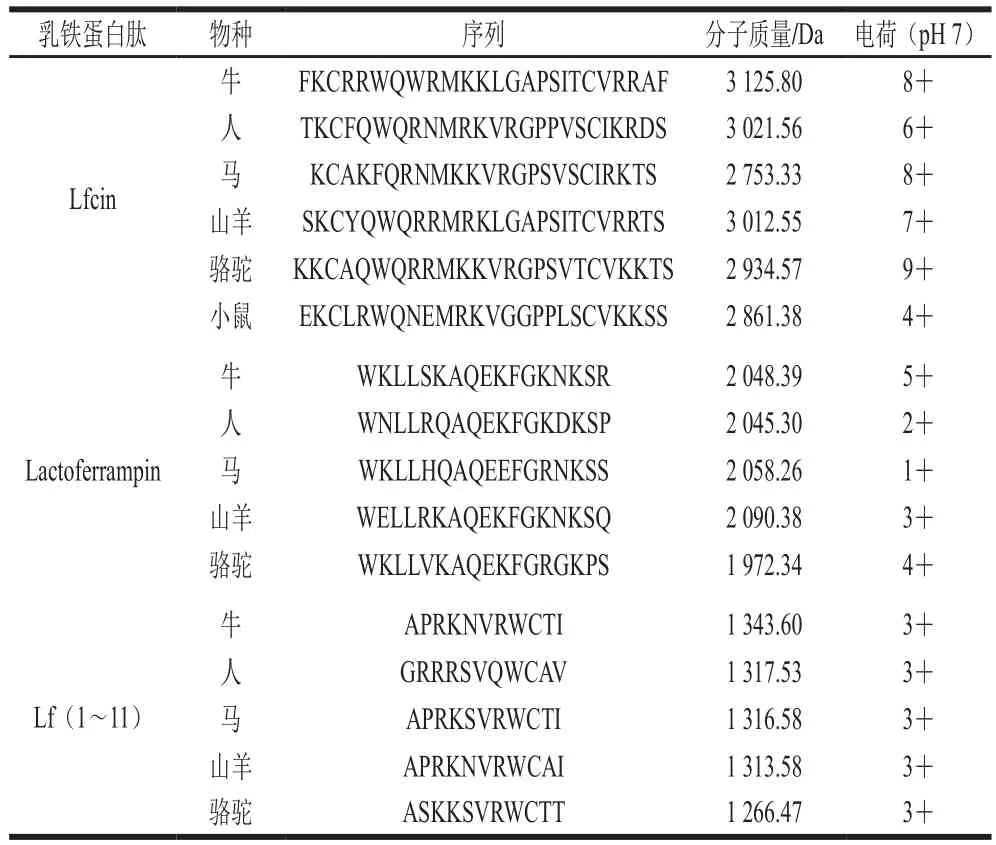
表2 不同物种来源的乳铁蛋白抗微生物活性肽氨基酸序列对比[22]Table 2 Comparison of amino acid sequences of antimicrobial peptides derived from lactoferrin[22]
同样来源于牛乳铁蛋白N-末端的Lf(1~11)也具有强阳离子特性,等电点大于11,并对多种细菌引起的感染有治疗作用。Brouwer等[12]的研究结果显示,Lf(1~11)对G+菌如葡萄球菌(Staphylococcus)以及链球菌(Streptococcus mitis)的最小抑菌质量浓度为1.6~6.3 μg/mL,对G-菌如鲍氏不动杆菌(Acinetobacter baumannii)、假单胞菌(Pseudomonasspp.)以及克雷白杆菌(Klebsiellaspp.)的最小抑菌质量浓度为6.3~12.5 μg/mL。除此之外,van der Kraan等[13]在牛乳铁蛋白的N-末端也发现了一条包含17 个氨基酸的抗菌肽Lactoferrampin,由乳铁蛋白的第268~284位氨基酸残基组成。虽然与Lfcin类似,Lactoferrampin分子同样具有两亲性质、高抗菌活性和强阳离子特性,但与Lfcin氨基酸组成与链长不同,结构有很大差异。Lfcin、Lf(1~11)与Lactoferrampin在乳铁蛋白中的位置都集中在乳铁蛋白N-末端(图2[7])。乳铁蛋白本身不仅具有较高的等电点,而且表面具有多个带正电荷的碱性区域,且分布不均匀,主要集中在N-末端,这不仅是其具有抗微生物活性的关键,也是乳铁蛋白具有与其他生物分子结合特性的基础。
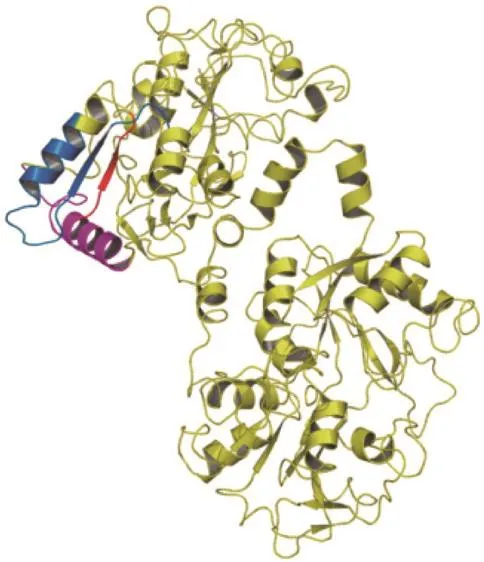
图2 抗微生物肽在牛乳铁蛋白结构中的位置[7]Fig.2 Structure of bovine lactoferrin showing positions of the antimicrobial peptides[7]
2.2 乳铁蛋白降血压活性肽
随着人们饮食和生活方式的改变,高血压成为目前危害健康的常见疾病。高血压作为一种慢性病,是冠心病、外周动脉疾病以及中风等多种疾病的诱因,并且大部分患者需要长期药物治疗。ACE是一种二肽羧肽酶,在血压调节系统中起重要作用。其中肾素-血管紧张素系统为升压系统,激肽释放酶-激肽系统为降压系统,这两个系统在血压调节方面互为拮抗作用。肾素-血管紧张素系统中由肾素分解所释放出的血管紧张素I可以被ACE切除其C-末端的二肽(H-L),生成血管紧张素II,使血管收缩。同时也可以促进醛固酮的分泌,导致水钠滞留,引起血压升高。因此,抑制ACE活性可以降低血管紧张素II的产生,从而有效降低血压,预防和高血压相关疾病的发生[32-33]。目前,ACE活性抑制类药物在临床方面具有显著的降压效果,如卡托普利、依那普利和赖诺普利等[34-35]。然而此类降压药物长期服用往往会引起喉咙疼痛、肾脏损坏、味觉失调以及皮疹等副作用。食源性降血压肽与化学合成药物相比具有无副作用、吸收好等特点。Ruiz-Giménez等[36]利用猪胃蛋白酶水解牛乳铁蛋白制备了ACE抑制肽。对水解组分进行超滤处理后发现,分子质量低于3 kDa水解物具有较高的ACE抑制活性。对分子质量低于3 kDa的水解物,经分离纯化、质谱鉴定后发现了3 条新的ACE抑制肽,序列分别为LIWKL、RPYL和LNNSRAP,半抑制浓度分别为0.47、56.50 μmol/L和105.30 μmol/L。Gobbetti等[37]通过研究ACE抑制肽的构效关系认为,当多肽的C-末端为疏水性氨基酸或者多肽中疏水性氨基酸所占比例大于60%时,该多肽即具有较高的ACE抑制活性,这3 条多肽都符合此结构特性。
García-Tejedor等[38]在牛乳铁蛋白酵母菌水解液中分离鉴定了4 条肽,分别为DPYKLRP、PYKLRP、YKLRP、GILRP,对体外ACE活性均有明显抑制作用。自发性高血压大鼠摄入DPYKLRP与LRP后收缩压有效降低,血液中血管紧张素II的活性和水平也明显降低,从而表明LRP序列对ACE的活性有明显的抑制效果。Li Peng等[14]利用计算机模拟研究ACE抑制肽,发现多肽的C-末端为脯氨酸时,该段多肽与ACE的活性位点更具亲和性。目前常用于治疗高血压疾病中的赖诺普利和依那普利的C-末端都为脯氨酸,这是可能是由于脯氨酸残基中的咪唑环与ACE活性中心氨基酸残基具有高亲和性。目前所发现的来自于乳铁蛋白的降血压肽,主要以低于10 个氨基酸的寡肽为主,且多肽中的疏水氨基酸与抑制ACE的活性密切相关,并且当C-末端为脯氨酸时,更可能具有ACE抑制活性。
2.3 乳铁蛋白抗肿瘤活性肽
对正常细胞来说,乳铁蛋白可促进其增殖,但乳铁蛋白对肿瘤细胞增殖却有明显的抑制而非刺激作用。各种体外实验表明,乳铁蛋白可抑制乳腺癌、结肠癌以及宫颈癌等细胞系的生长[39-40]。目前认为乳铁蛋白可通过调节免疫以及肿瘤发生阶段的酶(如谷胱甘肽S转移酶(glutathioneS-transferse,GST))活性来抑制癌症的发生。Pan Weiru等[41]也报道了Lfcin B与乳腺癌细胞系MDA-MB-231中GST-P1的相互作用,结果显示Lfcin B可与GST-P1的活性位点G与H结合,抑制GST-P1的活性,从而抑制乳腺癌细胞的生长。除此之外,研究发现Lfcin对各种肿瘤细胞也表现出明显的抑制作用,如卵巢癌细胞、鼻咽癌、结肠癌以及乳腺癌细胞等,但对人体正常细胞却无毒害作用[42]。
目前认为Lfcin对肿瘤细胞的选择作用机制一般是由于癌细胞质膜磷脂头部成分的丢失,暴露出带有净负电荷的磷脂酰丝氨酸,而正常细胞仅在质膜泡液中存在。因此,Lfcin可以与肿瘤细胞膜上带有净负电荷的磷脂酰丝氨酸结合,抑制肿瘤细胞生长,但不作用于正常细胞[15]。此外,Lfcin所具有的强阳离子特性、稳定的二级结构和两性分子特性以及依靠二硫键形成的环状结构都是Lfcin具有抗肿瘤活性的必要条件。对于Lfcin抗肿瘤机制的研究表明,一方面,Lfcin与肿瘤细胞结合后,可破坏肿瘤细胞的细胞膜,抑制细胞的增殖;另一方面,Lfcin通过启动Ca2+/Mg2+依赖型核酸内切酶活性和氧依赖性的细胞凋亡机制,从而促使细胞凋亡[16]。Mader等[43]的研究证实,Lfcin B可促使白血病Jurkat T细胞产生活性氧,从而诱导线粒体跨膜电位耗散,导致白血病细胞凋亡。Lfcin B序列中的第4~9位氨基酸残基(RRWQWR)被认为是Lfcin B的活性中心,Richardson等[44]根据Lfcin B的活性中心合成了该段具有6 个氨基酸残基的多肽——Lfcin B6(RRWQWR),对其抗肿瘤机制与Lfcin B进行了对比,并对不同给药方式对细胞的毒性进行了探讨,认为Lfcin B6对肿瘤细胞的诱导细胞毒性不同于Lfcin B,游离的Lfcin B6对T-白血病细胞和乳腺癌细胞无杀伤作用,但Lfcin B6经溶栓性脂质体传递至胞质腔室时具有较强的细胞毒性;Lfcin B6与分离的线粒体结合较弱,与LfcinB不同的是,Lfcin B6并未使线粒体通透,也未引起细胞色素c的释放;组织蛋白酶B和Caspase活性对细胞内Lfcin B6引起的细胞毒性很重要,而活性氧则不涉及,因此认为Lfcin B6可与溶酶原脂质体结合构建药物传递系统,对恶性肿瘤靶向给药。然而Lu Yan等[17]报道了一段来自于人乳铁蛋白的PFR多肽(PFWRIRIRR),其并不是通过诱导凋亡来抑制小鼠红白血病细胞和HL-60白血病细胞增殖。PFR多肽可诱导细胞膜破坏,上调细胞内钙水平,从而导致白血病细胞死亡。同时,PFR多肽还可诱导G0/G1细胞周期阻滞,从而表现出良好的抗肿瘤活性。
2.4 乳铁蛋白抗炎及免疫调节肽
乳铁蛋白属于人体先天性非特异性免疫系统成分,位于分泌液和上皮细胞表面,通过抑制微生物繁殖、吸附或者杀死微生物而发挥抗微生物作用,参与机体抗炎症反应,并且其可以作用于免疫细胞和细胞因子,发挥免疫调节作用。在对乳铁蛋白抗炎及免疫调节机制的研究中发现,一方面,乳铁蛋白可以通过与脂多糖(lipopolysaccharide,LPS)结合,阻止Toll样受体信号通路激活,从而抑制白细胞介素(interleukin,IL)-1β、IL-6、IL-8等促炎因子的分泌或者促进IL-10、IL-11和IL-14等抗炎因子间接发挥作用;另一方面,乳铁蛋白也可通过促进T细胞、B细胞和巨噬细胞的成熟与活化从而发挥免疫调节作用[18-19]。van der Does等[45]报道了来源于人乳铁蛋白的hLF-11可刺激人和小鼠单核细胞释放抗炎因子,从而增强免疫反应。研究表明,hLF-11可与人单核细胞结合,随后穿透单核细胞膜,通过抑制髓过氧化物酶活性从而发挥免疫调节作用。LFP-20(KCRQWQSKIRRTNPIFCIRR)是来源于猪乳铁蛋白N-末端的多肽,Zong Xin等[20]探讨了其在体外猪肺泡巨噬细胞中的抗炎作用以及在体内小鼠模型中的全身炎症反应。研究发现,LFP-20对促炎因子产生的抑制作用与LPS结合特性无关,但可降低核因子κB和丝裂原活化蛋白激酶相关的信号中髓样分化因子的水平,从而抑制促炎因子的分泌。此外,Jiang Qin等[46]对LFP-20进行了修饰,并在大肠杆菌中成功表达了同样具有免疫调节活性的多肽LF-6,其序列为KWRQWQSKWRRTNPWFWIRR。体内免疫实验显示,重组LF-6可显著降低感染产肠毒素的大肠杆菌-k88的小鼠血浆和肠道中促炎因子水平,并对感染小鼠肠黏膜损伤有一定的抑制作用。韩菲菲[47]也将猪乳铁蛋白肽LFP-20改良,制备了改良肽LF-2。与模板肽LFP-20相比,改良肽LF-2具有更高的破坏细胞膜的能力,可通过改善小鼠胸腺指数、外周血中B细胞比例、刺激脾脏淋巴细胞转化等发挥免疫调节功能,控制由于大肠杆菌感染导致的小鼠模型免疫指标异常变化。此外,Miyauchi等[48]的研究也证实,牛乳铁蛋白经胃蛋白酶水解后的水解物相较于T细胞而言,可明显提高B细胞的增殖活性。由此可见,乳铁蛋白肽对抗炎和免疫调节的作用机制与乳铁蛋白相似,都可促进免疫细胞的活性并抑制促炎因子的表达。
2.5 其他乳铁蛋白活性肽
除以上报道的来源于乳铁蛋白的生物活性肽之外,还有部分抗凝血活性肽和促进细胞增殖的乳铁蛋白肽被报道。Xu Shiqi等[49]在牛乳铁蛋白的胃蛋白酶的水解液中鉴定到一条含有LRP的多肽LF-LR,序列为LRPVAAEIY。体外实验结果表明,LF-LR可与凝血酶的活性位点结合,对凝血酶的活性有明显的抑制效果。Hagiwara等[50]研究了乳铁蛋白及其胰蛋白酶水解物对大鼠肠道细胞的影响,在水解产物中鉴定到一条序列为AEIYGTKESPOTHYY的多肽,发现该条多肽可促进大鼠小肠上皮细胞增殖。乳铁蛋白分子本身一直作为新型的骨生长因子被广泛关注,Shi Pujie等[51]利用计算机模拟在牛乳铁蛋白胃蛋白酶水解物中筛选出一段来自乳铁蛋白C-末端的多肽LFP-C(FKSETKNLL),其对成骨细胞MC3TC-E1的增殖有明显的促进作用,并且可以调控细胞周期,诱导细胞从G0期向G2/M期转化。
3 乳铁蛋白及其生物活性肽在食品领域中的应用
乳铁蛋白及其多肽片段因具有多种生理活性而受到越来越广泛的关注。目前含有乳铁蛋白的产品有很多,包括婴幼儿配方食品、发酵乳制品以及保健食品等。除此之外,因其对微生物生长具有抑制作用,也可作为一种天然的防腐剂,应用于大豆蛋白制品、肉品中,控制病原微生物的生长,延长食品的货架期。
3.1 幼儿配方食品
早在1986年,日本Morinaga乳品公司就开始生产并销售含乳铁蛋白的婴儿配方奶粉,此后关于乳铁蛋白添加到婴儿配方奶粉中的报道不断涌现。婴幼儿奶粉中添加乳铁蛋白源的生物活性肽对于新生儿具有及其重要的生理功能[52]。一方面,乳铁蛋白是母乳中含量丰富的天然成分,可作为氨基酸的膳食蛋白源;另一方面,新生儿的免疫系统发育不完全,不能有效抵抗外界各种病原微生物的入侵。乳铁蛋白及其生物活性肽具有广谱抗菌、抗病毒和调节肠道菌群的生理功能,在奶粉中添加乳铁蛋白及其生物活性肽,可以抑制婴幼儿肠道内大肠杆菌和梭状芽孢杆菌的增殖,并将婴幼儿的肠道菌群改善为有益菌处于优势的环境,促进益生菌的生长;此外,还可提高小肠黏膜的免疫功能,减少婴儿疾病发生。
3.2 保健食品
乳铁蛋白及其生物活性肽在保健食品领域也有广泛的应用。在病毒多发季节和地区,提高人体自身免疫力是抵抗由病毒引发疾病的有效措施。乳铁蛋白及其相关的多肽经常作为一种免疫调节剂应用于保健食品,对病毒性葡萄球菌感染引起的呼吸道感染等都有很好的预防和治疗作用,并且在预防丙型肝炎病毒感染和治疗慢性肝炎方面都可以起到积极作用。经口服的乳铁蛋白和Lfcin能通过小鼠上皮细胞诱导IL-18的分泌,从而增强免疫细胞的功能和活性,对提高机体免疫力有重要作用。除此之外,乳铁蛋白肽在降低血压、血脂方面具有良好疗效,将其加入焙烤类保健食品中,既具营养价值,又对高血压、高血脂等病情的缓解有一定的辅助作用。
3.3 天然防腐剂
由于乳铁蛋白及其生物活性肽(如Lfcin)具有广谱抗菌的活性,它们也可作为天然防腐剂添加到乳品、大豆制品和肉制品中。美国食品药品监督管理局表示,在生牛肉上面喷洒乳铁蛋白,防治如大肠杆菌、肠炎沙门氏菌等致病菌的污染是一种安全可行的方法[53],可以从生物表面除去活体或死亡微生物,抑制微生物生长繁殖,中和内毒素。也有研究表明,利用溶菌酶与乳铁蛋白的协同作用抑制微生物的生长,干预微生物的吸附,可以延长冷却牦牛肉的货架期[54]。同时,此方法也可应用于鱼类或其他海产品及食品的加工过程中,延长食品的货架期。
3.4 其他
相关研究表明,相比蛋白质类,多肽类在人体吸收速率和吸收率方面都占据优势。随着对乳铁蛋白生物活性肽生理作用的认识,发现其作为一种助消化剂,制成片剂或速溶饮料后,可作为运动员的营养品。同时乳铁蛋白及其生物活性肽也是发酵乳制品中的新型配料,可作为双歧杆菌的生长促进剂,增加产品的功能特性和风味。除此之外,乳铁蛋白也可作为一种高效补铁食品添加剂,改变孕妇及其他特殊人群缺铁的现状,还可将其制成含铁饮料或补铁胶囊,提高造血功能,改善贫血。
4 结 语
随着人们对乳铁蛋白研究不断加深,关于对乳铁蛋白来源的生物活性肽的研究也层出不穷。与完整蛋白相比,多肽易于消化吸收,可以最大限度地发挥其生理活性。迄今为止,关于乳铁蛋白来源的抗微生物活性肽、降血压肽、抗肿瘤肽以及免疫调节肽已有较多研究,包括比完整乳铁蛋白具有更高生物活性的Lfcin、Lactoferrampin以及LFP-20等多肽。目前,乳铁蛋白及其生物活性肽在食品中的应用主要集中在抗菌活性方面,其在降血压和增强免疫等保健食品中的应用仍然有较大的发展前景,有待进一步的开发。
本文主要对乳铁蛋白生物活性肽的种类、结构及其作用机制进行了综述,但多肽氨基酸种类、数量以及结构的不同导致其活性机制有较大的差异,目前仍然处于研究阶段。随着研究的不断深入,乳铁蛋白来源的生物活性肽在食品、药品等领域的应用潜力被不断发掘,人们有望研制出多种与乳铁蛋白生物活性肽相关的功能食品。

