基于食品大分子结构组装的载铁复合物研究进展
徐 凯,姚晓琳,,,刘华兵,姚晓雪,陈晓雨,刘 宁,李 娜
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2.陕西科技大学食品与生物工程学院,陕西 西安 710021;3.陕西科技大学电气与控制工程学院,陕西 西安 710021)
铁元素在人体中含量约为0.004%,是人体进行生命活动必需的微量元素之一。作为氧和能量代谢所必需的许多蛋白质和酶的辅助因子,其在人体代谢过程中发挥着不可或缺的作用[1]。铁稳态的破坏与各种人类疾病相关:由铁元素获得或分布缺陷导致的铁缺乏会引起贫血[2];由过量的铁吸收或使用不良引起的铁过量会导致异常组织铁沉积,从而引起氧化损伤等[3]。人体利用不同机制来调节生理代谢系统和细胞水平的铁稳态,主要利用铁调素和铁调节蛋白[4]共同确保机体铁稳态平衡。目前铁元素被认为是人类普遍缺乏的营养素之一,经世界卫生组织调查数据显示,全球约1/4人群中均有不同程度的铁缺乏,缺铁性贫血是影响全球人口健康的重要问题。据2019年中国居民营养与健康现状的调查分析报告数据显示[5],钙、铁、锌等微量营养素缺乏症是我国居民普遍存在的问题,我国城乡居民贫血的平均患病率约为15.2%,而患贫血症的人群主要为2 岁以内婴幼儿、60 岁以上老人及育龄妇女,其贫血患病率分别为24.2%、21.5%和20.6%。因此,我国在《国民营养计划(2017—2030年)》[6]中提出“计划在2030年之前在降低人群贫血率方面取得明显进步和改善”。
饮食中铁摄入不足和食物中铁元素的低利用率是导致铁缺乏的主要原因,通过铁补充剂或食品强化的方法增加铁摄入量是解决该问题的有效方法。当前食品工业中应用最为广泛的食品铁强化剂为传统铁强化剂,但传统强化剂因溶解性差、异味、促氧化等问题使铁强化食品易发生品质劣变,且消费者适应性低。近年来不断发展的大分子螯合铁和铁包载微粒有吸收利用度好、副作用少、性质稳定等优势,且其中的大分子物质还具有抗氧化、抑菌、免疫调节等生物活性[7-9],受到了广大科研工作者的青睐,目前研究工作主要集中在载铁体系的结构设计方面。采用食品加工的物理手段调控食品大分子与铁离子间的相互作用来定向构建铁复合物结构,改善铁离子的感官特性和生物效价,是目前铁强化剂的研究热点和发展趋势。深入理解铁复合物结构与其功能性之间的构效关系对发展新型复合铁强化食品配料技术具有重要的科学意义。本文从食品中铁强化特性、铁元素的吸收特性、铁强化剂的发展历程等方面进行综述,将重点归纳基于食品大分子结构化组装构建铁强化剂的原理和优势,对发展新型复合铁强化食品配料技术具有重要的指导意义。
1 食品中铁强化特性
食品强化是将微量元素加入食物载体以增加营养素在食物中的含量,其生产周期短、成本低、易被大众接受。由于铁的可耐受最高摄入量和推荐摄入量较接近,属于易补充过量的元素[10]。同时,铁也是食品配方中最难以强化的矿物质,其主要的技术障碍是铁强化剂与食物载体二者的合理选择与复合方式,故在选择铁强化食物载体及强化量控制方面都应较为慎重。
食物中的无机铁盐被机体摄入后,在强酸性胃液中被水解成铁离子,随食糜一起进入十二指肠和小肠待吸收。肠壁细胞对带正电荷的铁离子有一定排斥作用,导致部分铁离子不仅无法被吸收,还会对肠道产生刺激,引起机体肠道体系紊乱。不同金属离子间的拮抗作用也会限制体内铁离子利用率和沉积效率,导致其生物利用度下降。此外,无机铁盐因其带有结晶水及其他固有特性,易氧化褐变,作为食品铁强化剂极不稳定。含结晶水的无机铁盐对食物中维生素有很大的破坏作用,易使维生素氧化降解,因此需要超量添加维生素,从而提高了成本。传统食品铁强化剂,如硫酸亚铁、乙二胺四乙酸钠铁等水溶性无机铁盐,易引起食品感官劣变及胃肠道不适,消费者适应性差,且在铁代谢吸收过程中转化效率变化范围较大,影响其生物利用度[11]。对于焦磷酸铁和富马酸亚铁等难溶性铁盐,其性质较稳定,是目前在食品配方中广泛应用的铁强化剂,但在液态食物中不溶或聚集的特性导致其生物利用度很低。
铁复合物中的铁元素以结合态存在,较无机铁盐的化学稳定性高,在消化道中大大降低了与金属离子(Ca2+、Cu2+、Fe2+、Zn2+、Mn2+等)之间的拮抗作用[12-13],同时也减少了与植酸、草酸等结合生成沉淀的机会,有利于铁元素吸收,且对消化道无不良刺激。铁复合物能减少对食物中易降解成分的破坏,延缓油脂氧化酸败的发生[14],是目前铁强化剂的研究热点和发展趋势,铁复合物将成为一种新型的复合铁强化食品配料。
2 铁元素的吸收特性
2.1 铁稳态调节机制
铁元素在生命活动中是必不可少的,但其易得失电子的能力会促进高活性氧的产生,损伤组成生物体的基本生物大分子(如蛋白质、脂质等)。铁稳态是由复杂的铁吸收过程来维持,包括十二指肠的铁吸收、巨噬细胞参与的铁循环、肝脏中的铁储存等[15-16]。激素Hepcidin可通过抑制铁吸收和体细胞中的铁活性对机体铁稳态发挥调节作用[17]。Hepcidin通过与卟啉铁结合并诱导其降解,从而抑制靶细胞(肝细胞、巨噬细胞和肠细胞)中铁的释放。图1主要描绘了铁元素在十二指肠上皮细胞的吸收机制,可溶的Fe2+直接通过二价金属转运蛋白-1(divalent metal transporter-1,DMT-1)转运到肠细胞;而Fe3+首先与黏蛋白结合,随后与β3-整合素和铁蛋白相互作用,穿过管腔膜并被内化后与黄素单加氧酶(flavin monooxygenase,Flavin-Mo)和β2-微球蛋白(β2-microglobulin,β2-m)结合形成铁蛋白复合物,其中Fe3+被还原为Fe2+,最终可以通过DMT-1输出到胞浆中。
2.2 铁吸收机制
摄入人体的铁离子以两种形式存在:非血红素铁和血红素铁。非血红素铁可来源于蚕豆、菠菜等动植物食品,而血红素铁仅由猪肝、牛肉等动物类食品提供。铁元素吸收主要发生在十二指肠,但不同存在形式的铁其吸收机制也不同。
2.2.1 非血红素铁的吸收机制

图2 非血红素铁的吸收途径Fig.2 Absorption pathway of non-heme iron
非血红素铁复合物被人体摄入后,由于胃蛋白酶和消化酶作用,其在胃液中被水解为铁离子,以离子形式进入肠道并在十二指肠部位被吸收(图2)。非血红素铁在肠道的吸收机制为:先利用抗坏血酸、氨基酸或Cybrd1等还原物质促进铁离子还原成Fe2+,Fe2+由DMT-1转运摄取进入微绒毛膜上皮细胞。根据机体对铁元素的需求,可将铁分为直接吸收铁与储备铁两种形式:直接吸收铁是指Fe2+在基底膜处的膜铁转运蛋白辅助蛋白和铜蓝蛋白作用下形成Fe3+[19],以膜铁转运蛋白为载体由上皮细胞释放进入血液循环并转运;储备铁是指进入细胞的Fe2+与蛋白结合,形成稳定铁蛋白储存在机体内。
2.2.2 血红素铁的吸收机制
血红素铁的吸收几乎不受饮食因素的影响,且大部分是以铁复合物完整分子形式被吸收。其原因是在十二指肠上皮细胞的刷状边缘处存在HCP-1,其比血红素对叶酸的亲和力更高。一旦进入消化系统,血红素铁即被血氧合酶在细胞内释放,遵循与非血红素铁相同的吸收途径。研究表明,血红素铁将通过卟啉输出蛋白导出到血浆中,以血凝素形式捕获和递送,这种涉及血红素复合物CD91受体的机制可能是次要途径[20]。
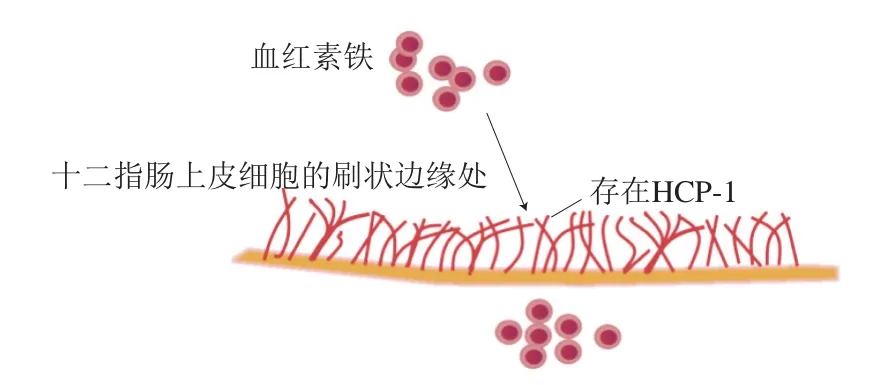
图3 血红素铁的吸收途径Fig.3 Absorption pathway of heme iron
3 传统铁强化剂
我国许可使用的铁强化剂有十几种,通常为非血红素铁强化剂,常用的铁强化剂及其特性见表1。铁强化剂的相对生物利用度通常以硫酸亚铁为基准,不仅与铁强化剂中铁质量分数相关,与溶解性也有密切关系。一般来说,水溶性铁强化剂的相对生物利用度最高,但对食物基质的影响也较大,胃肠刺激性较明显。稀酸可溶性铁强化剂不溶于水而溶于稀酸,不易引起食品色泽和口味改变,但其在胃酸中的溶解度不稳定,导致其吸收率波动范围大。

表1 常用的铁强化剂及其特性Table 1 Characteristics of traditional iron fortifiers
3.1 第一代铁强化剂
第一代铁强化剂是以硫酸亚铁、焦磷酸铁为代表的无机铁盐类。该类铁强化剂铁相对含量高,价格低,但性质极不稳定,易使食品基质中的脂质、维生素等敏感成分氧化降解,造成食品变质、变色等不良影响;具有浓重铁腥味,胃肠刺激强烈;生物利用度低,稳定性差,在铁代谢吸收过程中转化效率变化范围较大。硫酸亚铁的生物利用度常被作为铁强化剂的参考基准,但其氧化程度取决于环境条件,易造成人体胃肠不适。此外,其高氧化还原反应活性可能会对其他食品成分造成不良影响,如与植酸盐、草酸多酚和四氢呋喃等化合物形成不溶性复合物,转化为血红蛋白的效率可从33%变化到80%[30]。
3.2 第二代铁强化剂
第二代铁强化剂即小分子有机酸盐类,包括乳酸亚铁、柠檬酸亚铁、富马酸亚铁、琥珀酸亚铁等。与第一代铁强化剂相比,此类铁强化剂可避免铁离子在胃中瞬间浓度过大,对胃肠的剌激作用降低,且其与食品基质不易发生反应。但亚铁盐性质不稳定,存在铁腥味和易使食品变色等问题,生产与贮存难度大[31]。并且有证据表明第一代和第二代铁强化剂在体内可产生大量游离亚铁离子,易通过Fenton反应产生内源性羟自由基,可能导致由细胞膜脂质过氧化而造成细胞膜损伤[32]。目前研究表明,富马酸亚铁和琥珀酸亚铁对谷物产品的储存影响较小,被推荐用来强化婴幼儿谷物类食品,但富马酸亚铁作为铁补充剂直接被婴幼儿摄入时,其吸收率仅为硫酸亚铁的30%左右,原因可能是富马酸亚铁水溶性差且易溶于稀酸,而婴幼儿胃酸分泌不足,会导致富马酸亚铁溶出缓慢。
4 基于大分子结构组装的新型铁复合物
以大分子螯合铁为代表的铁复合物是一类有发展前景的新型铁强化剂,其研究和应用均取得了一定成果。氨基酸铁、多肽铁、多糖铁、蛋白铁等是目前铁复合物存在的主要形式,主要由从天然动植物、微生物中提取的具有生物活性的氨基酸、多肽、多糖、蛋白等经进一步分离纯化后与铁离子经化学反应络合而成,即所谓第三代铁强化剂。研究表明,氨基酸或肽链中的氨基酸单元通过氨基、羰基以共价键与铁离子形成稳定的环状氨基酸螯合铁或多肽铁[33]。多糖表面的羟基、羰基等给电子基团作为配基与铁核络合形成稳定的多糖铁配合物[34]。铁复合物中的铁以结合态存在,在消化道中减弱了各类矿物质离子之间的拮抗作用,同时也降低了与植酸、草酸、纤维素等结合的几率,减少了胃肠刺激。同时,铁复合物较无机铁盐的化学稳定性高,可减少其对食品基质中营养素的破坏和由此引发的品质劣变。铁复合物与无机铁盐的根本差异在于无机盐中的铁离子与酸根离子之间仅通过离子键连接,而铁复合物则是铁离子与给电子体的多糖或蛋白间形成配位键,同时与给电子体的羧基构成离子键,从而形成环状结构[35]。铁复合物分子趋向电中性,具有适中的稳定常数,且由于其特殊结构能够有效保护其在胃肠道中稳定,阻止了植酸、磷酸根等与铁离子的结合,防止了其在消化道中出现不溶性沉淀吸附。在体内,铁复合物可直接在小肠内吸收,避免了通过离子吸收通道运转时与其他矿物元素的竞争拮抗。此外,铁复合物减轻了铁离子参与的氧化还原反应,降低了对食品中维生素、脂质等敏感成分的破坏,从而减少了营养物质的损失。
4.1 氨基酸铁
近年来,人们普遍关注用于制备铁补充剂的氨基酸如甘氨酸、苏氨酸等,可提高铁的生物利用度。氨基酸与可溶性亚铁盐按一定物质的量比例反应所制备的氨基酸-铁螯合物被称为氨基酸铁,具有由氨基酸的氨基和羧基与亚铁离子形成的五元或六元“环状结构”。甘氨酸是最简单的非必需氨基酸,可与多种金属离子(Mn2+、Co2+、Zn2+等)形成螯合环。该复合物结构稳定且具有良好生物利用度,如铁或锌离子的甘氨酸螯合物。甘氨酸螯合亚铁离子的化学过程见图4,甘氨酸的羧基和氨基与亚铁离子结合可形成稳定螯合物。碰撞理论表明,温度的升高可显著加速分子热运动并增加活化分子数量,从而提高化学反应速率。目前,有机铁螯合物常通过长时热反应获得,需精确控制反应条件(浓度、温度、pH值、反应时间等)将反应底物转化为产物。研究表明,采用脉冲电场可促进螯合反应发生:一方面,脉冲电场可通过电离水分子产生氢离子和羟基,与氨基酸相互作用来增加氨基酸分子中氨基和羧基的电负性,从而促进氨基酸与亚铁离子结合的能力;另一方面,脉冲电场可促进萃取和脱水过程中的化合物扩散,增加氨基酸分子与亚铁离子间的碰撞几率,加速螯合反应[36]。

图4 甘氨酸与Fe2+的螯合过程[36]Fig.4 Chelation process of glycine and Fe2+[36]
4.2 多肽铁
多肽铁螯合物是一种以蛋白质水解产物多肽为原料,与铁离子络合形成的具有环状结构的有机化合物,它是由铁离子按一定物质的量比例通过共价键与肽类结合而成。多肽的结构特征,包括分子质量、氨基酸组成和排列方式等是决定其铁螯合活性的主要因素。铁螯合肽来源于各种蛋白质,其分子质量分布在300~1 500 Da之间,该分子质量范围内的肽通常对铁离子具有较高亲和力。研究表明,肽序列中的精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、甲硫氨酸、丝氨酸、苏氨酸和酪氨酸等的活性基团在铁螯合肽中起重要作用,其共同点在于精氨酸残基的羧基端参与了络合作用[37]。如今,关于提高铁螯合肽的生物利用度的方法研究越来越受重视,通过研究多肽对铁吸收和转运的分子机制来分析影响铁螯合肽的生物利用度。随着与铁具有高亲和力的多肽不断被发现,铁螯合物的构效关系获得了较多关注。铁螯合肽的结构特征对螯合活性和结合方式有重要影响,包括肽链上结合位点的位置、立体化学结构、动态过程等。铁螯合肽的来源及构效关系见表2。

表2 不同铁螯合肽来源及构效关系Table 2 Sources and structure-activity relationship of different iron-chelating peptides
4.3 多糖铁
目前多糖铁复合物的研究大多集中在三价铁离子络合物,多糖铁复合物的结构决定了铁离子包载形式,而铁离子在体系中的存在形式对其感官性、稳定性和生物利用度影响显著。以天然多糖配体制备的多糖铁复合物(如茶多糖铁、当归多糖铁、木耳多糖铁等)具有高水溶性、对胃肠黏膜刺激小、吸收率与硫酸亚铁相当、在十二指肠被吸收且呈稳定的可溶状态等优点。多糖铁被体内还原性物质如VC等还原成亚铁离子被吸收利用,临床疗效显著,不良反应少[44-46]。多糖可通过离子交换、吸附和螯合作用与铁离子结合。Fe3+在多糖重复的聚合单元中具有很高结合率,并诱导多糖主链发生卷曲。在水相中铁氧化颗粒可在海藻酸钠链表面成核生长。海藻酸盐的分子骨架受构象限制,会导致铁围绕分子链成核聚集。Sreeram等认为是Fe3+连接在海藻酸钠结合位点上,在海藻酸钠骨架上形成空间分离的铁离子中心,而不是FeOOH沉淀覆盖在骨架上[47]。Nesterova等采用无定型水合氧化铁和聚乙烯醇、聚丙烯酸、海藻酸钠等高分子合成了具有超顺磁性的三价铁复合物,显著影响了三价铁的稳定性及其水解产物形式[48]。多糖铁复合物被广泛报道是以三价铁离子通过氧桥和羟基桥聚合形成的β-FeOOH聚合铁核为结构中心,多糖末端羧基通过共价键包围环绕在铁核表面形成的复合物[47]。多糖配体可保持β-FeOOH聚合铁核表面的亲水性,从而防止其产生聚集和沉淀[49]。多糖与Fe3+形成复合物的结构存在如下假设:Fe3+通过糖基结合位点沿着多糖聚合物骨架形成空间分离的Fe3+中心(位点结合模型)[50-52];FeOOH沉淀和多糖之间的非特异性相互作用被认为是形成高水溶性铁氢氧化物的主要原因(胶体模型)[53-54]。上述两种结合机制中,多糖供体作为铁离子成核作用位点,通过氢氧化物架桥作用与铁离子结合并原位组装形成形态各异的纳米结构,其形状与尺寸取决于多糖种类和性质[55]。多糖铁复合物呈现出与高生物效价的天然铁贮存蛋白相似的结构特性,由此可理解多糖铁复合物呈现出的良好补铁效果[56]。
4.4 蛋白铁
Bolisetty等研究表明,酸性条件下带正电的β-乳球蛋白与带负电的Fe3O4磁性纳米粒可形成静电复合物,在不同pH值下热诱导形成不同形貌聚集体,如纤维状(pH 3.0)、球状(pH 4.5),该蛋白铁复合物在磁场作用下呈现出有序排列和溶胶-凝胶间的可逆转变[57](图5)。β-乳球蛋白在pH 2.0、90 ℃作用5 h后生成的β-乳球蛋白纤维与Fe3+发生静电结合,Fe3+在蛋白纤维上聚集并原位还原形成亚铁离子纳米颗粒(图6),呈现出良好的水分散性。在模拟胃肠液消化中可快速释放铁离子,在Caco-2肠上皮细胞和动物实验中显示出具有与硫酸亚铁相近的血红蛋白转化量,呈现高生物利用度和生物安全性,且对食品感官影响较小[58]。
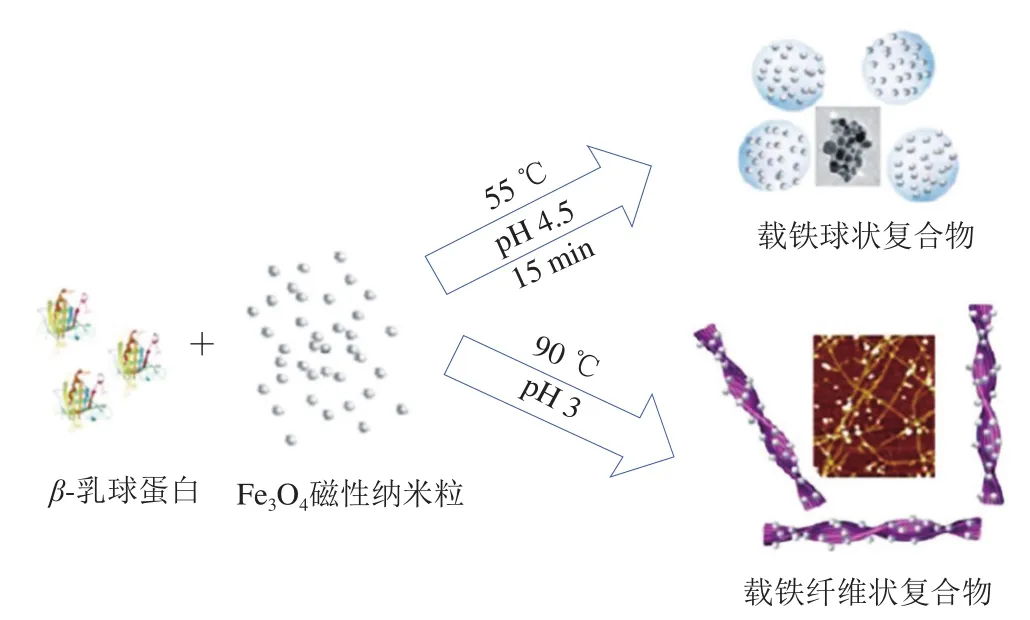
图5 β-乳球蛋白与Fe3O4在不同pH值和热力诱导下形成的蛋白铁复合物[57]Fig.5 Protein-iron complex formed by β-lactoglobulin and Fe3O4 under different pH and thermal induction[57]
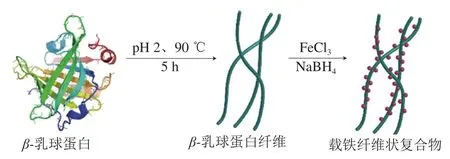
图6 β-乳球蛋白与FeCl3形成纤维状蛋白铁复合物示意图[58]Fig.6 Fibrin-iron complex formed between β-lactoglobulin and FeCl[58]3
5 铁包载微粒
尽管铁复合物在防治缺铁症时更高效、更利于人体吸收,但也有学者认为其与无机铁盐相比并未表现出明显优势。主要原因在于铁螯合物制备工艺的复杂性导致产品品质良莠不齐、螯合态在胃肠道环境中易解离成无机离子、贮存期易与食品组分发生反应而导致物理化学性质不稳定等。以氨基酸螯合铁为例,Mayumi Mimura等研究发现在治疗胃切除病人缺铁性贫血时,甘氨酸螯合铁并不比硫酸亚铁产生更好的治疗效果[59]。Fox等研究认为胃部强酸性环境使得甘氨酸螯合铁在胃肠道中全部或部分解离为无机态,导致铁的生物利用度未得到提高[60]。氨基酸螯合铁仅在螯合态才能发挥效果,螯合率越高,生物学效价也越高;而在胃液等强酸环境下,氨基酸螯合铁会被解离成无机铁盐,降低了吸收率和生物利用度。因此,不少学者采用物理手段将无机铁盐进行包埋,构建如脂质体、固体脂质微粒、凝胶微粒等铁包载体系,以降低铁离子与外界的接触机率和减轻胃肠道刺激,提高铁离子的生物利用度[61-63]。研究表明,铁包载体系被证实具有很好的代谢动力学和组织分布特性。铁包载微粒的结构决定了铁离子的存在形式,铁离子存在形式对其感官特性、稳定性和生物利用度有显著影响,同样是提高铁强化剂稳定性和生物利用度的重要途径。
5.1 脂质体
脂质体是由一层或多层包裹着水核心的磷脂双层组成的球形颗粒(尺寸为20 nm~2 μm)。脂质体固有的亲脂性可以促进颗粒在小肠细胞的双分子脂质膜上转运,其还具有生物黏附特性,易黏附在胃肠道上从而增加细胞摄取的可能性。一些研究表明,脂类化合物能提高肠道药物的生物利用度,通过减少外排转运蛋白,如位于根尖肠黏膜上的p-糖蛋白[64],从而改变胃肠道屏障功能的通透性。脂质体在体内容易被吸收和降解,提高其吸收效率可以改善被封装的保健食品化合物的生物利用度、稳定性、持续释放能力和细胞抗氧化活性。Xia Shuqin等发现脂质体可有效包埋硫酸亚铁,其铁元素的生物利用度与硫酸亚铁接近,但脂质体外层磷脂膜可将铁与胃肠道中的其他成分隔离,降低了亚铁离子的反应活性[65]。Yuan Li等发现脂质体对柠檬酸铁和血红素铁的包封率分别为35%和36%,通过膜融合或膜扩散很容易进入体内,血清铁水平明显提高,对治疗贫血导致的炎症效果较好[66]。Fathy等成功制备了含有VE和氧化铁磁性纳米颗粒的脂质体,其在治疗缺铁性贫血方面比氧化铁磁性纳米颗粒和FeSO4更高效,可使血红素含量、红细胞值和白细胞值升至正常水平[67]。由此可知,脂质体作为载体包封可明显提高铁的生物利用度,增强生物相容性,降低对重要器官(肝、脾、肾)的毒性[67]。Wang Shan等采用膜法超声制备了具有良好缓释性能的柠檬酸铁脂质体(ferric citrate liposome,FAC-Lip),FAC-Lip虽然能有效地增加小鼠体内的铁含量,显著减轻贫血症状,但FAC-Lip是热力学不稳定体系,在贮存过程中易聚集[68]。同时,磷脂中含有的不饱和键易水解和氧化,导致药物泄漏和降解,严重限制了其在药品和食品中的应用。FAC-Lip在模拟胃肠液中的释放机制符合两相动力学模型,属于非菲克扩散,表明FAC-Lip的体外释放主要受药物扩散机制影响;而FAC释放机制属菲克扩散,表明用脂质体包裹FAC后,药物释放机制发生显著变化[68]。
5.2 固体脂质微粒
固体脂质微粒由脂质化合物(三酰甘油、脂肪酸、类固醇、蜡和油)和表面活性剂组成,按其组成方式可大致分为3 种类型:1)固体脂质颗粒I型。其为齐次矩阵模型,活性药物成分(active pharmaceutical ingredient,API)呈分子状分散在脂质核中或以非晶态团簇的形式存在,该模型是由脂质和其熔点之上的API通过冷高压均质技术形成,具有可控释放特性。2)固体脂质颗粒II型。其为API富集壳型,在均质纳米乳冷却过程中脂质相先析出,API在剩余熔融脂质中的浓度稳步增加。当API在剩余熔融脂质中达到饱和溶解度时,形成无API脂核,含有API的脂质外壳将在含有少量API脂核的周围凝固。该模型不适用于API的缓释,可用于突释。3)固体脂质颗粒III型。其为API强化核心模型,该模型是在API浓度接近或达到饱和的熔融脂质中形成。在纳米乳液冷却过程中,API溶解度会降低。当溶液中的API呈现过饱和状态时,就会被几乎不含API的脂质外壳覆盖,API因被固定在脂质核心中,故可用于实现API的缓释。采用固体脂质颗粒包载硫酸亚铁,保留了传统脂质体的高吸收率和生物相容性,但固体脂质颗粒比脂质体稳定性更好,既可有效防止亚铁离子直接暴露于胃肠道,保护亚铁离子与其他食品组分相互作用,又呈现出一定的胃肠缓释特性,以此降低铁添加量,最大限度地减少传统食品铁强化剂的副作用,作为铁元素递送体系具有很好的代谢动力学和组织分布特性[69]。Vasta等制备了硬脂酸/壳聚糖/铁固体脂质颗粒,采用Caco-2细胞内铁蛋白形成速率评价铁离子的生物吸收率,发现Caco-2细胞内铁蛋白生成量比硫酸亚铁高24.9%,且在十二指肠上皮细胞顶端表面包覆有净负电荷的多糖蛋白复合物层[70],这是由于壳聚糖中氨基基团带正电,通过静电作用黏附在细胞表面而使吸收率增加[71]。
5.3 凝胶微粒
凝胶微粒的网络结构使其既具有软固体的刚性,又具有对小分子/离子的渗透性,可用于微量营养素或功效成分的缓释。Xia Shuqin等采用离子凝胶法制备了包载硫酸亚铁的海藻酸钙纳米微球,有效提高了硫酸亚铁的生物利用度及感官稳定性[72]。Yao Xiaoxue等研究发现沙蒿多糖与铁离子间存在特异性结合,可形成网络状凝胶,其凝胶结构的形成可能是由于沙蒿多糖与Fe3+通过配位键络合。铁离子与沙蒿多糖中富含糖醛酸基团的大分子组分——60P中的羧基和羟基发生交联,可能发生两种结合方式(桥联和单齿结合)(图7A),其结合化学计量比例约为2.5[73]。沙蒿多糖-Fe3+复合水凝胶作为一种新型铁强化剂将在食品工业中有巨大的应用潜力[73]。Shu Meng等发现λ-卡拉胶分子中的3 个硫酸根可与Fe3+发生特异性结合而形成弱凝胶,由此制备了λ-卡拉胶-Fe3+新型纳米凝胶微球,采用玉米醇溶蛋白表面疏水化修饰可有效提高凝胶微球的物理稳定性,降低其在模拟胃肠液中的释放率[74]。这主要是由于致密而疏水的玉米醇溶蛋白表面可有效延缓λ-卡拉胶-Fe3+凝胶微球在强酸性胃液中的解离,缓解铁离子的胃肠刺激。此外,壳聚糖通过与Fe3+结合形成铁壳聚糖配合物,载铁率高,对脂质氧化程度小,且对食品感官无不良影响(图7B)[74]。
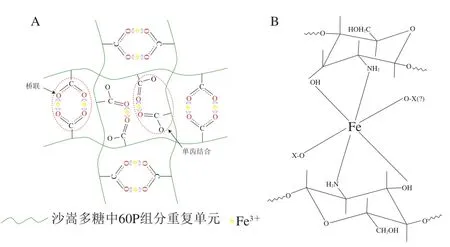
图7 沙蒿多糖-Fe3+复合水凝胶形成模型(A)和铁壳聚糖配合物结构(B)示意图Fig.7 Formation model of Artemisia sphaerocephala Krasch polysaccharide-Fe3+ composite hydrogel (A) and structural formula of iron-chitosan complex (B)
6 结 语
基于食品大分子结构化组装构建载铁胶体微结构,在改善铁离子异味、不稳定、胃肠刺激、吸收率低等方面均呈现较大潜力,将作为传统铁强化剂的替代品。本文立足于传统食品铁强化剂在食品配方应用中存在的难题,对近年来在铁强化剂结构设计方面的研究进行了综述,阐明了不同铁复合物的构建机制,聚焦铁复合物结构对其感官稳定性、氧化稳定性及生物利用度的影响。大分子螯合铁和铁包载微粒是目前铁强化剂的重要发展方向,旨在构建感官稳定性好、生物利用度高的载铁复合物。大分子螯合铁可掩蔽铁腥味,但其仍可能导致食物品质劣变。铁包载微粒虽可减少铁离子与食物基质的相互作用,生物利用度高、稳定性好,但其生产工艺复杂且成本较高。因此,在进行铁强化剂结构设计时,需深入了解食品基质特点、食品加工方法等因素,并结合载铁复合物在体内的消化动力学特性,为构建新型载铁复合物提供理论依据。

