食物致敏原表位定位技术的研究进展
胡永芯,李 欣,程剑锋,马 鑫,孟轩夷,陈红兵,武 涌,
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学中德联合研究院,江西 南昌 330047)
近年来,随着食物的多样化以及人们生活方式的改变,在澳大利亚、美国、英国、中国等国家的调查均显示食物过敏发生率呈现上升趋势[1]。经世界卫生组织与联合国粮食及农业组织认定的主要过敏食物包括牛乳、鸡蛋、花生、鱼、甲壳类水产动物、大豆、小麦和坚果。在发达国家大约有3%的成年人和8%的儿童患有食物过敏,在美国,2.4%的儿童对多种食物过敏[2]。欧洲一项志愿者自述性调查显示,食物过敏发病率为6%[3]。
食物致敏原是引起食物过敏的元凶,指在食物中能被特异性免疫细胞识别并引发免疫应答的成分。抗原分子与抗体反应或被抗原受体识别,并引发机体免疫应答的特殊化学基团称为表位,即抗原决定簇。表位按照氨基酸的组成结构特点分为线性表位和构象性表位。线性表位也称顺序表位或连续表位,是氨基酸残基线性排列组成的表位。构象性表位也称不连续表位,是氨基酸残基在空间相互靠近时形成的能被免疫活性物质识别的特定三维结构。按照表位受体的不同可分为T细胞表位与B细胞表位。T细胞抗原受体(T-cell receptor,TCR)只识别经过抗原提呈细胞(antigen presenting cell,APC)处理,并以肽-主要组织相容性复合体(peptide-major histocompatibility complex,pMHC)形式呈现于细胞膜表面的表位,由于抗原的空间构象在抗原提呈、加工过程中多被破坏,因此T细胞表位都是线性表位。而B细胞抗原受体(B-cell receptor,BCR)具有识别完整抗原的能力,因此B细胞表位既有构象性表位也有线性表位。食物致敏原的B细胞表位大多是蛋白质表位,鲜少有关于碳水化合物表位的报道[4]。
1 T细胞表位
1.1 T细胞表位的类型
T细胞表位指特定抗原经过APC处理后,结合至少一个MHC分子并以pMHC复合物形式在APC表面表达,能被T细胞受体识别并触发T细胞免疫应答的肽[5]。T细胞表位都是线性表位,不能与免疫球蛋白E(immunoglobulin E,IgE)结合。pMHC复合物的形成有MHC I类和MHC II类两种途径,分别被CD8+和CD4+T细胞识别。来自细胞外的抗原称为外源性抗原,如食物致敏原,其经APC加工后与MHC II类分子形成的复合物被CD4+T细胞的TCR识别。MHC II类分子结合长度为10~30 个氨基酸残基的肽段,最佳长度为12~16 个氨基酸[6]。CD4+T细胞在食物过敏的引发和维持中起关键作用[7]。
1.2 T细胞表位的定位方法
目前,T细胞表位的定位方法发展迅速,包括细胞毒性T细胞抗原表位的预测和辅助性T细胞(helper T cell,Th)抗原表位的预测。研究表明,pMHC II类复合物与TCR的结合是初始CD4+T细胞分化为促炎Th2的关键[8]。Th2能产生白细胞介素(interleukin,IL)-4、IL-5和IL-13等细胞因子,IL-4、IL-13能促进IgE生成,IL-4和IL-5分别在嗜碱性粒细胞和嗜酸性粒细胞的募集和启动中起重要作用[9]。Th2和其他T细胞亚群在过敏反应中的病理作用以及诱导耐受性作用在过去的几十年里已经成为一个研究热点。目前对于食物致敏原T细胞表位的研究较为广泛,可采用T细胞增殖实验[10-11]、四聚体引导表位作图法[12]、免疫信息学预测法等进行表位鉴定。
1.2.1 T细胞增殖实验
正常人体内的Th1/Th2存在平衡,当机体发生过敏反应时,此平衡被打破。因此T细胞表位可通过T细胞增殖相关的细胞因子变化来确定。首先合成包含全部蛋白质序列的重叠多肽,一般长度为15~20 个氨基酸,重叠3~5 个氨基酸[13],然后将合成肽刺激T细胞后检测T细胞增殖情况,由此可确定T细胞表位。由于过敏患者外周血单核细胞中抗原特异性CD4+T细胞的数量较少,很难观察到明显的增殖情况,比如花生过敏患者的Ara h 1特异性T细胞的含量为百万分之九,即每1 000 000 个T细胞中只有9 个Ara h 1特异性T细胞[14]。目前大多数研究使用的是外周血单核细胞中分离培养的T细胞系(T-cell line,TCL)或T细胞克隆。T细胞增殖情况的检测可采用荧光染色和酶联免疫斑点实验(enzyme-linked immunospot,ELISPOT)等方法。荧光染色法通过流式细胞仪检测细胞的荧光强度来观察细胞分裂增殖的情况,可与其他启动标记物组合使用,但大量旁观者T细胞(bystander T cells)会影响结果[15-16]。ELISPOT通过特异性抗体捕获细胞分泌的细胞因子,再利用显色法展示结果来检测单个细胞的分泌情况,最终确定能刺激T细胞增殖的表位[17]。
T细胞增殖法在食物致敏原T细胞表位定位中的运用非常广泛,这些食物包括巴西坚果、桃子、花生[18]、虾[19]、牛奶[20]等。Wai等在一项定位‘刀额新对虾’的免疫优势T细胞表位研究中,合成了18 个长度为20 个氨基酸、重叠5 个氨基酸的包含Met e 1全部序列的重叠肽,使用重叠肽刺激从Met e 1致敏的BALB/c小鼠分离出的脾细胞并检测刺激后的细胞因子变化,最终鉴定出6 个主要的Met e 1 T细胞表位[19]。Gouw等利用MHC II结合法识别出人类白细胞抗原-DRB1(human leucocyte antigen-DRB1,HLA-DRBI)限制肽,并通过人类TCL的增殖情况鉴定出13 个长度为9 个氨基酸的β-乳球蛋白的肽段,证明合成肽段能被牛乳蛋白特异性TCL识别并诱导T细胞增殖[20]。
1.2.2 四聚体引导表位作图法
四聚体引导表位作图(tetramer-guided epitope mapping,TGEM)是一种免疫学技术,利用肽和HLA II类的四聚体和染色试剂,通过肽段筛选程序快速识别致敏表位[21]。运用TGEM的两个前提是已知个体的HLA表现型和抗原的重叠肽库[22]。TCR与pMHC之间的相互作用较弱,通常仅持续几秒钟,但可溶性pMHC形成四聚体后,会延长相互作用的半衰期[23]。首先,可溶性MHC II类单体与肽段的羧基端连接,通过荧光标记的链霉亲和素组装成能被特异性TCR识别的pMHC四聚体。然后四聚体与CD4+T细胞或外周血单核细胞中的APC相互作用,使CD4+T细胞也被染色,通过流式细胞术分选阳性染色T细胞克隆,使致敏原特异性T细胞得以回收。最后将阳性染色的肽段分别加载到MHC II类单体上,重复染色[22]。TGEM法特异性和灵敏性高,但价格昂贵,一般需要使用患者血清进行体外验证实验。TGEM法可以与多种技术同时使用,如同时对MHC四聚体和胞内细胞因子进行染色是一种研究表位特异性CD4+T细胞的优化方案[24-25]。但许多HLA II类分子不容易被分离,限制了TGEM法的应用[26]。
Delong等利用HLA II类分子与花生致敏原Ara h 1肽形成的特异性四聚体测定Ara h 1反应性T细胞的水平、表型和细胞因子谱[14]。有研究者采用TGEM法鉴定出核桃致敏原Jug r 2的多个CD4+T细胞表位并构建了Jug r 2特异性T细胞克隆系[27]。Archila等利用TGEM法鉴定了几个Ana o 1和Ana o 2衍生的表位,并测定了腰果特异性T细胞的表型和功能,明确了过敏患者具有显著的Th2表型,接着采用四聚体染色技术和T细胞增殖实验探究Ana o 1和Ana o 2的特异性T细胞克隆对其他种类坚果的交叉反应活性[28]。
1.2.3 免疫信息学预测法
免疫信息学是生物信息学的一个新分支,可用于预测T细胞表位。T细胞表位与MHC分子形成pMHC复合物后才能被识别,肽和MHC分子之间的亲和力与肽段免疫原性有很强的相关性[29],故可通过pMHC复合物的亲和力来间接预测表位,称为MHC分子亲和肽预测法,可分为基于结构和数据两类[30]。基于结构法通常先建立pMHC结构模型,再通过分子动力学模拟、加权直方图分析等方法评估pMHC II类复合物的结合亲和力[31-32]。此法优势在于不需要进行实验操作,但计算量庞大且比基于数据法的准确性低,在筛选大型蛋白中的应用受到限制[33-34]。数据法是基于MHC分子与已知序列多肽的结合强度来预测T细胞表位。多肽序列一般来源于IEDB[35]、EPIMHC[36]、AntiJen[37]等表位数据库。肽段与MHC分子的亲和力强弱通过与结合亲和力阈值对比确定,结合亲和力阈值指肽段的半最大抑制浓度(half maximal inhibitory concentration,IC50),即MHC结合到一半时肽段的浓度。一般IC50小于50 nmol/L为强亲和力,IC50小于500 nmol/L为弱亲和力[5]。
MHC分子亲和肽预测中广泛运用到机器学习算法,如支持向量机(support vector machines,SVM)、特定位置评分矩阵(position-specific scoring matrices,PSSM)、人工神经网络(artificial neural networks,ANN)和隐马尔科夫模型(hidden Markov models,HMM)等。基于机器算法来预测CD4+T细胞表位的网络服务器有NetMHC II[38]、NetMHC IIpan[39]、TEPITOPE[40]、 TEPITOPEpan[41]、 ProPred[42]、RANKPEP[43]和SVRMHC[44]等,具体如表1所示。
其中,NetMHC II和NetMHC IIpan目前被认为是预测肽段与MHC II类分子结合亲和力的最佳途径[45-46],两者的主要区别在于预测MHC范围不同。NetMHC II是每个MHC分子独立网络的集合,只能预测候选库里的肽段与MHC分子的结合亲和力。而NetMHC IIpan包含一个单一的通用网络,可以预测已知蛋白序列的肽和所有MHC分子的结合亲和力[38]。后者运用范围更加广泛,如HLA有上百种I类(HLA I)和II类(HLA II)分子的等位变异,其会结合不同的肽,通过输入亲和力数据到NetMHC IIpan来预测未鉴定的HLA与肽的结合亲和力[47-48]。
以花生致敏原表位为例,Pascal等利用NetMHC IIpan-2.0和NetMHC II-2.2算法预测Ara h 1和Ara h 2肽与MHC II类分子的结合位点,鉴定出Ara h 2的4 种能诱导Th2细胞因子产生的优势肽,分别是氨基酸1~4、氨基酸5~9、氨基酸17~22和氨基酸24~27,特别地,氨基酸1~3、氨基酸19~21和氨基酸25~26被预测为强结合[49]。Ramesh等通过使用此测定法预测了Ara h 1的36 种肽段并确定了4 种可用于研发疫苗的Ara h 1候选肽[50]。
2 B细胞表位
2.1 B细胞表位的类型
B细胞受体或B细胞分泌的特异性抗体识别的表位均称为B细胞表位,可分为线性表位与构象性表位:线性表位是由一些序列连续的氨基酸残基通过肽键形成的多肽;构象性表位由在序列上不连续,通过多肽链折叠在空间上相互接近的氨基酸残基或肽段组成。据报道,90%的B细胞表位是构象性的,在分析了来自AbDb数据库的488 个抗原-抗体复合物后,发现可能只有4%的表位是线性表位[51]。线性表位与构象性表位并非完全独立,某些线性表位是构象性表位的组成部分。在食物过敏中,构象性表位发挥作用较少,因为食物致敏原通常会受到热加工变性和胃肠道消化的影响,从而使构象性表位被破坏[52]。B细胞构象性表位相对线性表位更复杂,因此预测B细胞构象性表位更困难,许多方法都很难将抗体与构象性表位的相互作用展示出来。对构象性表位的表征需要复杂的技术,例如合成肽技术、噬菌体展示技术、X射线晶体学、质谱法、氨基酸定点突变和嵌合蛋白法等。
2.2 B细胞表位的定位方法
2.2.1 合成肽技术
合成肽法是研究B细胞线性表位的常见方法,成功率较高且操作简单。首先在蛋白质数据库中获得目标蛋白的氨基酸序列,再合成一系列包含整个氨基酸序列的末端相互重叠的肽段,每段都对应蛋白抗原线状序列中的一小段。肽链长度一般为15~20 个氨基酸,重叠氨基酸的数量根据肽链长度和实验设计确定,也可预先进行表位预测或基因片段分析,用于指导合成表位候选区肽段[53]。合成肽法与氨基酸替代法结合可用于鉴定抗原表位的关键氨基酸残基,其中丙氨酸常作为替代氨基酸[54],也有其他氨基酸作为替代,如甘氨酸等,这取决于设计目的。多肽合成后要验证肽段的纯度和序列,可采用反相高效液相色谱法和质谱法。通常选用硝化纤维膜作为合成肽的固体载体,通过合成肽段与患者血清进行特异性免疫反应来确定表位。近年来,多肽微阵列芯片法已被开发出来,即采用微量点样的方法将多肽有序固定在载玻片表面,然后与已标记的待测生物样品中靶分子反应,通过特定的仪器进行快速、并行、高效地检测分析。多肽微阵列芯片技术只消耗微升量的血清,却能同时测定数千个靶点,大大降低了测定单个生物学样品的成本,促进了表位的高通量筛选,并且获得的数据也很可靠,但只能定位线性表位,不能用于探究构象性表位。随着多肽微阵列芯片技术的发展,现在其已成为高通量识别线性表位和诊断食物过敏的有力工具[55]。
Shreffler等首次使用基于肽微阵列的免疫分析方法绘制花生表位[56]。目前利用多肽芯片技术已经确定了一些可作为候选生物标记物的多肽,用于食物过敏早期诊断和预测其严重程度或耐受性建立[57],如牛乳中的3 种酪蛋白和β-乳球蛋白[58]。Lin Jing等开发和优化了一种可靠、灵敏的多肽微阵列免疫分析方法,并应用于多种食品致敏原IgE表位的标测,已成功地绘制了一系列食物致敏原的抗原表位,如花生/树坚果、牛奶、虾、大豆等[59]。Cerecedo等基于多肽微阵列的免疫测定对牛乳中酪蛋白的IgE和IgG4结合表位进行了定位,获得了αs2-酪蛋白的7 个表位、κ-酪蛋白的4 个表位和β-酪蛋白的2 个表位[60]。Otsu等通过多肽微阵列技术鉴定了Ara h 2的IgE线性表位,并与Ara h 2进行比较,发现临床症状更严重患者的血清IgE识别更少的Ara h 2和Ara h 6线性表位[61]。
2.2.2 噬菌体展示技术
噬菌体展示技术是一种从随机多肽库中筛选表位的技术。通过筛选噬菌体展示肽库或化学合成的组合多肽库得到的表位通常称为模拟表位,包含线性表位和构象性表位[62]。噬菌体展示系统的原理是将外源目的编码基因插入到噬菌体衣壳蛋白基因中,使噬菌体衣壳蛋白上展示外源蛋白或肽段,因此实现了基因型与表型的统一[63]。在噬菌体展示系统中最常用的噬菌体是M13[64]和T7[65]。自从1985年Smith首次将外源基因插入丝状噬菌体f1的基因pIII中建立该方法以来[66],噬菌体展示技术已经发展成为鉴定和表征与特定分子(如抗体)结合的模拟肽的强大工具。使用噬菌体展示技术进行食物致敏原表位定位的第一步是选择合适的噬菌体肽库。食物致敏原研究中通常使用由长度为7~12 个氨基酸的肽组成的肽库[67]。接着对噬菌体肽库进行3~5 轮的生物淘选,筛选出与目标靶分子特异性结合的高度富集噬菌体。最后进行噬菌体测序得到序列信息,利用生物信息学技术分析获得表位相关信息。噬菌体展示技术法识别模拟表位的速度很快,不需要复杂的晶体,但模拟表位的识别可能会脱靶,且需要复杂的计算机建模来分析数据,因此噬菌体展示技术与机器算法相结合是一种识别致敏原构象性表位的有效方法[68]。
Li Xin等利用噬菌体环七肽库(Ph.D.-C7C)筛选β-乳球蛋白的模拟表位,通过Peptiope服务器的Mapitope算法计算相应的构象表位,首次鉴定出线性表位和构象性表位各自的共同氨基酸残基[69]。接着从噬菌体肽库(Ph.D.-12和Ph.D.-C7C)中获得牛乳α-乳白蛋白上的线状和构象的模拟表位,使用UniProt比对工具鉴定出6 个IgE和7 个IgG线性表位,用PyMOL检测到5 个IgE和3 个IgG构象性表位[70]。此外,噬菌体展示技术在牛乳β-酪蛋白[71]、小龙虾肌球蛋白轻链[72]、青蟹肌浆蛋白[73]、鸡蛋卵转铁蛋白、桃子Pru p 3蛋白、花生Ara h 1蛋白等食物致敏原表位定位中的应用均有报道。
2.2.3 X射线晶体学
随着生物物理技术的发展,X射线晶体学分析、质谱、核磁共振技术等在B细胞线性和构象性表位定位中发挥着重要作用。由于核磁共振技术使用时,通常需要用15N和13C标记原子核,且只能分析分子质量较小的靶抗原(<30 kDa),因此其应用受到限制。在食物致敏原表位定位中,X射线晶体学分析和质谱的应用更广泛[74]。
基于抗原-抗体复合物晶体结构的X射线晶体学分析是定位构象性表位的最理想、最精准的方法[75]。X射线晶体学分析涉及抗原和单抗的纯化、抗原-单抗复合物的形成与纯化以及复合物的晶体学解析等过程[76]。获得抗原抗体复合物的结晶后,通过X射线晶体学或核磁共振波谱分析抗原-抗体复合物,可得到表位的结构,并确定与抗体残基接触的原子。Albillos等通过X-ray技术研究杏仁种子中致敏原Pru 1的致敏性,得到了纯度高、结构清晰的蛋白结晶,有助于在分子水平上进一步表征植物种子中11S球蛋白致敏原的致敏性[77]。如果两个原子间距离小于4 Å,则表示两个残基之间发生了接触,由此可获得构象性表位[72]。目前此法只针对抗原与单克隆抗体的研究,适用于细菌或病毒抗原,特别是可溶性小蛋白的研究。但此法在食物致敏原研究中的运用并不广泛,原因是较难获得高纯度的食物致敏原-抗体结晶,而且难以从食物过敏患者血清中获得大量特异性IgE抗体,有研究用致敏BALB/c小鼠杂交细胞产生的IgG代替患者血清IgE[78]。
2.2.4 质谱法
质谱法是近年来发展起来的表位定位技术,用于确定与溶液中抗体相互作用的可溶性抗原的表位。利用免疫亲和技术分离出与抗体结合的抗原肽段后,用质谱技术鉴定含有抗原表位的肽段,最后与抗原天然序列对比获得表位信息。最常用于获取抗原肽段的方法是酶解法,有“表位切除”和“表位提取”两种方法。前者是将抗原与抗体免疫共沉淀后用蛋白酶水解,抗原表位与抗体结合的部位会受到保护而不被酶解,后者是将抗原用蛋白酶消化后进行免疫共沉淀[79]。“表位切除”和“表位提取”程序均包括抗原在溶液中的水解过程以及从免疫复合物中除去未结合成分的各种洗涤步骤,且两种方法均能有效地筛选酶解后的抗原表位部分[80]。氕/氘交换-质谱技术的出现提高了质谱表位作图的精确度,但仍低于X射线晶体学技术的准确度。腰果致敏原7S球蛋白(Ana o 1)的表位通过氕/氘交换-质谱被揭示,在比较了重组Ana o 1和与mAb 2G4结合的Ana o 1 的氕/氘交换信息后,发现5 个线性表位优势区域,其中有两个区域是构象性表位的组成部分[81]。利用生物信息学预测表位后,结合质谱结果对比分析也是一种可行的思路,已经在小麦致敏原CM16线性B细胞表位的定位中得到验证[82]。
2.2.5 氨基酸定点突变和嵌合蛋白法
氨基酸定点突变和嵌合蛋白法都是研究IgE表位的常用方法,经常结合使用。氨基酸定点突变技术是指人工替换抗原序列上的某个氨基酸,然后比较突变型抗原和野生型抗原与抗体的识别情况,以此为依据鉴定表位[83]。丛艳君等利用合成肽法初步获得牛乳致敏原α-乳白蛋白的表位,再用丙氨酸依次取代作用表位的氨基酸合成新的多肽,通过酶联免疫吸附分析法识别出表位的关键氨基酸[84]。
重组蛋白是指利用基因重组技术将抗原蛋白的某一DNA区域插入载体蛋白的相关DNA区域,随后在宿主细胞内表达的蛋白。利用免疫测定法测定表达的重组蛋白,以确定抗体结合区域。此法已经成功用于腰果致敏原Ana o 3抗原表位的解析,关键抗原表位串联重组蛋白也为过敏患者血清特异性IgE的检测提供了新的思路[85]。Alcocer等通过替换结构域上的蛋白构建了几种嵌合蛋白,将巴西坚果致敏原Ber e 1的部分蛋白置换成结构相似但致敏性更低的向日葵种子蛋白。嵌合蛋白的圆二光谱显示出其与天然对照物具有相似的α-螺旋二级结构,表明二级结构在蛋白质表达过程中没有受到影响[86]。
2.2.6 细胞表位预测法
近年来,B细胞表位作图技术和生物信息学的快速发展,极大地促进了免疫信息学的发展,学者们可以在免疫学中应用计算机来揭示抗体、B细胞和致敏原的结构,便于在分子层面进一步研究抗原-抗体复合物形成过程。通过各种网络服务器对B细胞表位进行预测有助于更精确地定位B细胞表位。B细胞表位数据库综合了大量可供用户搜索的数据,可分为IEDB、AntiJen等综合型数据库,BciPep、Epitome、SDAP、SEDB等B细胞专属数据库[87-88]。
B细胞线性表位预测主要基于二级结构和蛋白质理化性质,如局部亲水性、表面可及性、可塑性、抗原性等[89]。早期多使用单参数方法进行预测,但局限性较大且效果较差。为了提高预测性能,常结合多种致敏原特征进行综合分析,并提出了基于HMM、ANN和SVM等机器学习的方法,其中最常使用的是SVM[90]。目前常用的B细胞线性表位预测服务器有ABCPred[91]、BepiPred[92]、BCPred[93]、SVMTriP[94]、LBtope[95]、APCPred[96]等(表2)。

表2 预测B细胞线性表位的服务器Table 2 List of available web servers for continuous B-cell epitope prediction
B细胞构象性表位的预测相对于线性表位较困难,但随着后基因组时代的到来、生物信息数据库的扩大、免疫信息学和计算机科学技术的快速发展,对B细胞构象性表位的预测工具应运而生。目前的研究方法主要基于三维结构信息、抗原抗体结合时的特异性或模拟表位信息[97]。最早的结构和溶剂可及性的表位预测服务器为CEP,要求使用PDB格式的的三维数据[98],后来产生了DiscoTope、ElliPro、SEPPA等基于三维结构的服务器。EpiPred通过抗体对抗原表位的特定倾向指数筛选表位残基[99]。MIMOX、PEPITOPE、EPISEARCH等服务器基于模拟表位信息预测构象性表位。目前经常使用的预测服务器有EPCES[100]、DiscoTope[101]、PEPITO[102]、ElliPro[103]、SEPPA[104]、CBTOPE[105]、EPSVR[100]、MIMOX[106]、PEPITOPE[107]等,这些服务器要求的数据输入格式不尽相同(表3)。
同源建模服务器SWISS-MODEL可对水牛β-乳球蛋白的三维结构进行建模,结合噬菌体筛选的阳性表位候选序列,经过MIMOX作图可获得水牛的构象性表位[108]。Mishra等共使用了10 个网络工具,如ABCPred、BCPred、BepiPred、BcePred等,并结合多种方法鉴定了花生的7 种致敏原的B细胞表位,一共预测出26 个线性和18 个构象性表位,发现大部分预测的B细胞残基均处于卷曲区域,预测出的6 个线性表位与大豆、榛子、番茄、玉米、苹果、香蕉等致敏原具有相似性,表明花生致敏原可能与某些已知的食物致敏原具有交叉反应性[109]。B细胞网络预测工具也已成功运用于预测日本沼虾原肌球蛋白[110]、大豆主要过敏原Gly m Bd 28K[111]等食物致敏原B细胞线性或构象性表位。
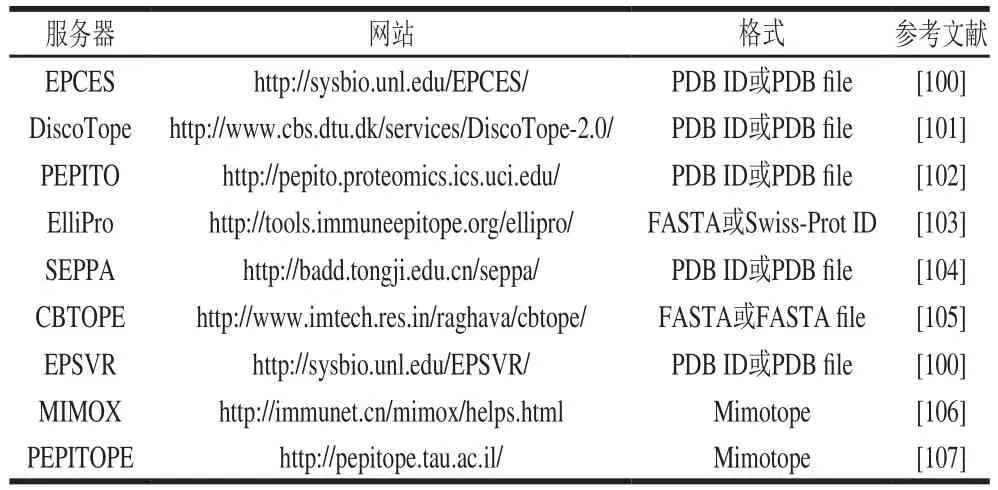
表3 预测B细胞构象性表位的服务器Table 3 List of available web servers for discontinuous/conformational B-cell epitope prediction
3 结 语
致敏原表位定位是食物过敏研究的基础和关键,为研究致敏原的结构与功能、致敏原与抗体反应机制提供理论基础。致敏原表位数据的完善可推进食物过敏的发病和免疫耐受的机制研究,指导相关食物过敏的治疗。其次,基于表位对食物致敏原进行检测能使检测操作更简单、结果更灵敏,进一步为过敏患者提供更为准确的食物过敏标签。同时表位数据可指导食品企业精准开发低致敏性产品,最大限度保证过敏患者的安全食用。
致敏原表位的定位已经通过T细胞增殖实验、TGEM法、合成肽技术、噬菌体展示技术、X射线晶体学、氨基酸定点突变等策略和技术得以实现。在生物信息学表位预测方面也有惊人的进步。相信随着各学科的不断发展和科研人员的不断努力,对食品蛋白结构和致敏原免疫反应活性的认识将逐步提高,对食物致敏原表位的研究一定会取得突破性的进展。

