八宝丹调控 TGF-β/Smad 信号通路抑制胃癌耐药细胞生长和转移的作用机制
兰炜兰,赵锦燕,2,3,彭 军,2,3,黄 彬,2,3,林久茂,2,3*
(1. 福建中医药大学 中西医结合研究院,福建 福州 350122;2. 福建省中西医结合老年性疾病重点实验室,福建 福州 350122 ;3. 中西医结合基础福建省高等学校重点实验室,福建 福州 350122)
胃癌是在东亚地区发病率和死亡率最高的恶性消化道肿瘤之一[1-5]。近年来,随着诊疗技术的进步,胃癌的发病率有所下降,但胃癌患者的总体生存率仍然很低,5 年生存率为 5% ~ 20%,中位生存率为 10个月[4]。早期胃癌的首要治疗方法是手术切除,对于晚期患者及术后复发患者,其主要的治疗方式仍然是化疗[5]。然而,由于化疗产生的肿瘤多耐药,使得化疗药物效果受限。因此,从中药中筛选出具有高效、低毒的胃癌耐药逆转剂是目前抗胃癌研究面临的新挑战。
八宝丹(Babao Dan, BBD)源自1555 年宫廷秘方,至今已有 460 余年历史。八宝丹的主要成分包括牛黄、三七、羚羊角、麝香、蛇胆、珍珠等,具有清热解毒、祛湿退黄、活血止痛等功效,主要用于湿热蕴结所致的不适症状,肝胆疾病以及病毒性肝炎。临床研究表明,八宝丹对胃癌的治疗具有显著疗效,并且服用后可以减轻药物治疗后产生的毒副作用,延长胃癌患者的生存期等[6]。本课题组前期研究结果显示,八宝丹能抑制 MGC803 和 AGS 胃癌细胞的生长及转移,抑制血管新生并诱导细胞凋亡[7-9]。八宝丹对 SGC7901/DDP 胃癌耐药细胞的研究报道较少,因此本实验旨在研究八宝丹对 SGC7901/DDP 生长及转移的影响及其相关的作用机制。
1 材料
1.1 药物与试剂
八宝丹(国药准字:Z10940006,厦门中药厂有限公司)规格:0.3 g/ 粒,批号 :180901。八宝丹溶液 :取八宝丹粉末 250 mg,溶解于 10 mL PBS(磷酸盐缓冲液)中,配制成 25 mg/mL 溶液, 超声溶解,高压灭菌后于 4℃贮存备用。顺铂(DDP)(100 mg,Cat. No. MKG2946)购于美国西格玛公司;迁移侵袭板(Cat. No.9148012) 购于美国必第基底膜基质公司;GAPDH (Cat. No.60004)、TGF-β (Cat. No.21898-1-AP)、Smad4 (Cat. No.51144-1-AP) 等购于美国沃森公 司;E-cadherin (Cat. No.14472)、N-cadherin (Cat.No.14215)、Vimentin (Cat. No.3390)、 MMP9 (Cat.No.13677)、p-Smad2/3(Cat. No. 8828)、MMP2 (Cat.No.87809)、Smad2/3(Cat. No. 8685)等抗体购于美国赛信通公司。
1.2 细胞株
SGC7901 细胞株和 SGC7901/DDP 细胞株购于北京北纳创联生物技术研究所,保存在福建中医药大学医学实验中心液氮室。
2 实验方法
2.1 细胞培养
分别将 SGC7901 和 SGC7901/DDP 细胞置于 1%的 100 U/mL 青霉素和链霉素,过滤胎牛血清(10%的 FBS) 的 RPMI 1640 中,SGC7901/DDP 另 外 再加入 1 μg 的顺铂维持细胞耐药性,培养在 37 ℃,含5% CO2的培养箱中。待细胞生长至 75% ~ 85% 时,用胰酶消化,离心,按 1 ∶ 3 传代培养(注 :在细胞培养过程中及时冻存,便于保种;每次细胞传至 7代时,重新复苏细胞)。
2.2 胃癌 SGC7901/DDP 耐药细胞 MDR 性验证
将 SGC7901、SGC7901/DDP 细 胞, 用 胰 酶消化离心后,进行细胞计数,并用不含 DDP 的RPMI1640 完全培养基重悬,将 1.0 × 104个细胞接至96 孔板中过夜培养。当细胞汇合度达 60% 时,去掉原有培养基,根据不同实验目的分别加入不同浓度的 DDP 干预 48 h 后,去除原液,加入 0.05 mg/ 孔的MTT,37 ℃孵育 4 h 后,再加入 0.1 mL 的 DMSO,室温放置 10 min 后,在 570 nm 处测吸光度值。对照组的细胞活力为 100%,计算不同浓度组细胞活力抑制率。并用 SPSS 计算 IC50,再通过 IC50计算耐药指数 RI。
细胞活力抑制率= [1-(实验组 A 值 / 对照组 A 值)] × 100%RI = IC50(SGC7901/DDP)/IC50(SGC7901)
2.3 MTT 法检测八宝丹对 SGC7901/DDP 细胞活力的影响
细胞加药干预前处理同上(耐药性验证),每孔加入 100 μL 浓度为(0、0.25、0.5、1.0 mg/mL)八宝丹的培养基,分别干预 48 h,干预后处理同上(耐药性验证),在波长为 570 nm 处测得 A 值。
细胞活力=(实验组 A 值/对照组 A 值)×100%
2.4 Transwell 分析细胞迁移和侵袭能力
将 SGC7901/DDP 细 胞 接 种 于 6 孔 板,2.5 ×105个 / 孔,置 37 ℃细胞培养箱中过夜,细胞汇合度达到 50% ~ 60% 时,分别用不同浓度八宝丹(0、0.25、0.5、1.0 mg/mL) 干 预 48 h。 重 新 消 化、 离心,调整活细胞浓度至 2.5 × 105个 /mL,取 200 μL于含基质胶(侵袭实验)或不含基质胶 (迁移实验)的 Transwell 上室,同时在下室加入 0.75 mL 含 10%FBS 培养基孵育 24 h。镜下观察,有无细胞脱落。吸出小室里的液体,放入装有 PBS 的孔中清洗,加入700 μL 和 200 μL 4% 多聚甲醛固定下室(小孔外层)和上室 10 min,轻轻吸去小室中的多聚甲醛,把小室放入含有 700 μL 结晶紫的孔中,上室加入200 μL结晶紫,染色 10 min,用 PBS 清洗上室,棉球擦干,待小室晾干后,倒置显微镜下观察细胞分布,并随机选取 5 个视野以 200 × 拍照,通过观察从Transwell上室迀移和侵袭到 Transwell 下室的细胞数目以评价细胞的迀移和侵袭能力。
2.5 粘附实验
采用粘附实验检测八宝丹对胃癌耐药细胞运动能力的影响。细胞前处理同上(Transwell 实验),吸弃各孔溶液,各孔分别进行消化,重悬,将 5 × 104个 /mL,重新接于 6 孔板孵育 6 h 后,除去各孔溶液,用 PBS 洗两遍 , 甲醛固定后,再用 1 mL 的 0.1% 结晶紫染色 15 min,清洗干净后,最后在 200 × 的显微镜下拍照。
2.6 Western Blot 实验
胃癌耐药细胞以 5×105个接种于 25 cm2培养瓶中,细胞汇合度达到 60% ~ 70% 时,加 5 mL 含不同 浓 度 八 宝 丹(0、0.25、0.5、1.0 mg/mL) 完 全培养基干预 48 h 后,用显微镜拍照记录细胞数量及状态,细胞用事先预冷好的 PBS 清洗细胞 2 次后,吸干 PBS,根据需要配制裂解液,然后根据细胞汇合度及数量将适量裂解液加到培养瓶中。用细胞刮刀将细胞刮到一角,将液体收集到 1.5 mL 小管中,隔5 min振荡 1 次,共震荡 3 次,使细胞完全裂解。然后,将液体置于低温高速离心机中 4 ℃,14 000 r/min,离心 20 min。再把上清液收集至 200 μL EP 管中,蛋白提取过程全程置冰上。用 BCA 法测定蛋白浓度,根据标准曲线法计算所需待测样品蛋白的量以及变性缓冲液的量,取 30 μg 的待测蛋白及变性缓冲液充分震荡后离心,在 100 ℃的金属浴中 5 min,充分变性 ;变性后进行电泳,转膜(PVDF 膜);然后将膜放入 TBS 中清洗两次,每次 5 min,并做好标记,用脱脂奶粉在常温摇床中封闭 1 h ;用 TBST 清洗三遍(每次 10 min),然后浸于实验所需的一抗溶液孵育(抗体浓度 1 ∶ 1 000),4 ℃摇床过夜。16 ~ 18 h后从一抗溶液中取出膜,用 TBST 漂洗滤膜 3 次,每次 10 min。然后将膜放入二抗溶液中(按说明书配制二抗),摇床上室温摇动 1 h。然后从二抗溶液中取出膜,用 TBST 漂洗滤膜 3 次,每次 10 min ;取出膜,配制显色液(ECL A 液∶ B 液为 1 ∶ 1),均匀地加在 PVDF 膜上(每条膜加 200 ~ 250 μL),避光反应1 min 后,立即进行显影观察 (美国伯乐公司)。
2.7 统计学方法
用 SPSS 21.0 软件进行数据分析。计量资料以均数 ± 标准差 (±s) 表示,两组间比较采用t 检验,多组间比较采用单因素方差分析,方差不齐,采用Games-Howell 检验。以P < 0.05 为差异具有统计学意义。
3 结果
3.1 SGC7901/DDP 细胞耐药性验证
SGC-7901/DDP 细 胞 对 DDP 的 IC50为(0.923 ±0.078), 亲 本 细 胞 SGC-7901的 IC50为 (0.476 ± 0.042),t 检验结果显示两者具有显著性差异 (P < 0.01),耐药指数 RI 为 1.94 大于 1.50,说明胃癌耐药细胞SGC7901/DDP 对 DDP 具有耐药性,如图1 所示。

图1 SGC7901/DDP 细胞对 DDP 具有耐药性(±s,n = 4)Fig. 1 The resistant of SGC7901/DDP cell to DDP(±s,n = 4)
3.2 八宝丹抑制 SGC7901/DDP 细胞的细胞活力
MTT 实 验 显 示, 各 组 细 胞 活 力 分 别 是 (100 ±2.19)%、(87.50 ± 3.52)%、(80.15 ± 4.87)%和(57.21 ± 2.32)%。表明八宝丹对 SGC7901/DDP 细胞的活力具有明显的抑制作用,而且其抑制率随着浓度的升高而增强,具有剂量依赖作用。如图 2 所示。
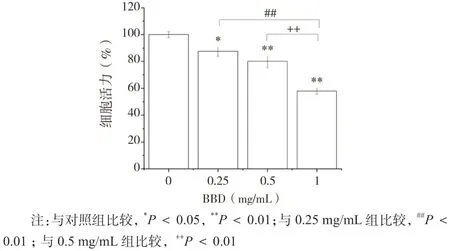
图2 BBD 抑制 SGC7901/DDP 细胞活力(±s,n = 4)Fig. 2 The cell viability of SGC7901/DDP cells inhibited by BBD(±s,n = 4)
3.3 八宝丹抑制 SGC7901/DDP 细胞的迁移
迁移实验结果表明,不同浓度的八宝丹干预后,其迁移细胞数依次为(89.33 ± 4.04)、(58.33 ± 1.53)和(33.3 ± 1.53), 与对照组(102.67 ± 3.05)比较,差异具有统计学意义(P < 0.01)。表明八宝丹能显著降低 SGC7901/DDP 细胞的迁移能力,具有剂量依赖作用。如图 3 所示。
3.4 八宝丹抑制 SGC7901/DDP 细胞的侵袭
侵袭实验结果表明,不同浓度的八宝丹干预后,其 侵 袭 细 胞 数 依 次 为(82.67 ± 3.05)、 (55 ± 3)和(15 ± 2),与对照组(100 ± 4)比较,差异具有统计学意义(P < 0.01)。表明八宝丹能显著降低 SGC7901/DDP 细胞的侵袭能力,具有剂量依赖作用。如图 4 所示。
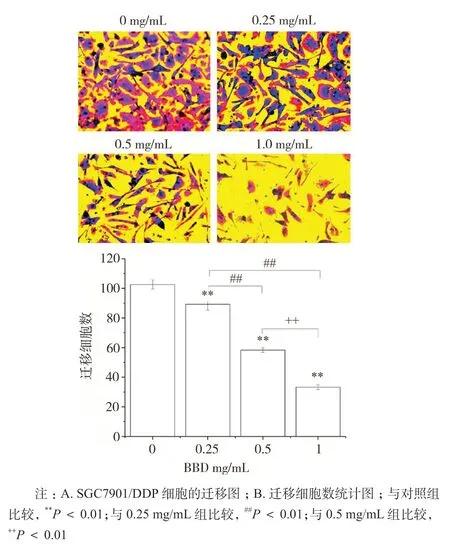
图3 八宝丹抑制 SGC7901/DDP 细胞的迁移(±s,n = 4)Fig. 3 The migration of SGC7901/DDP cells inhibited by BBD(±s,n = 4)
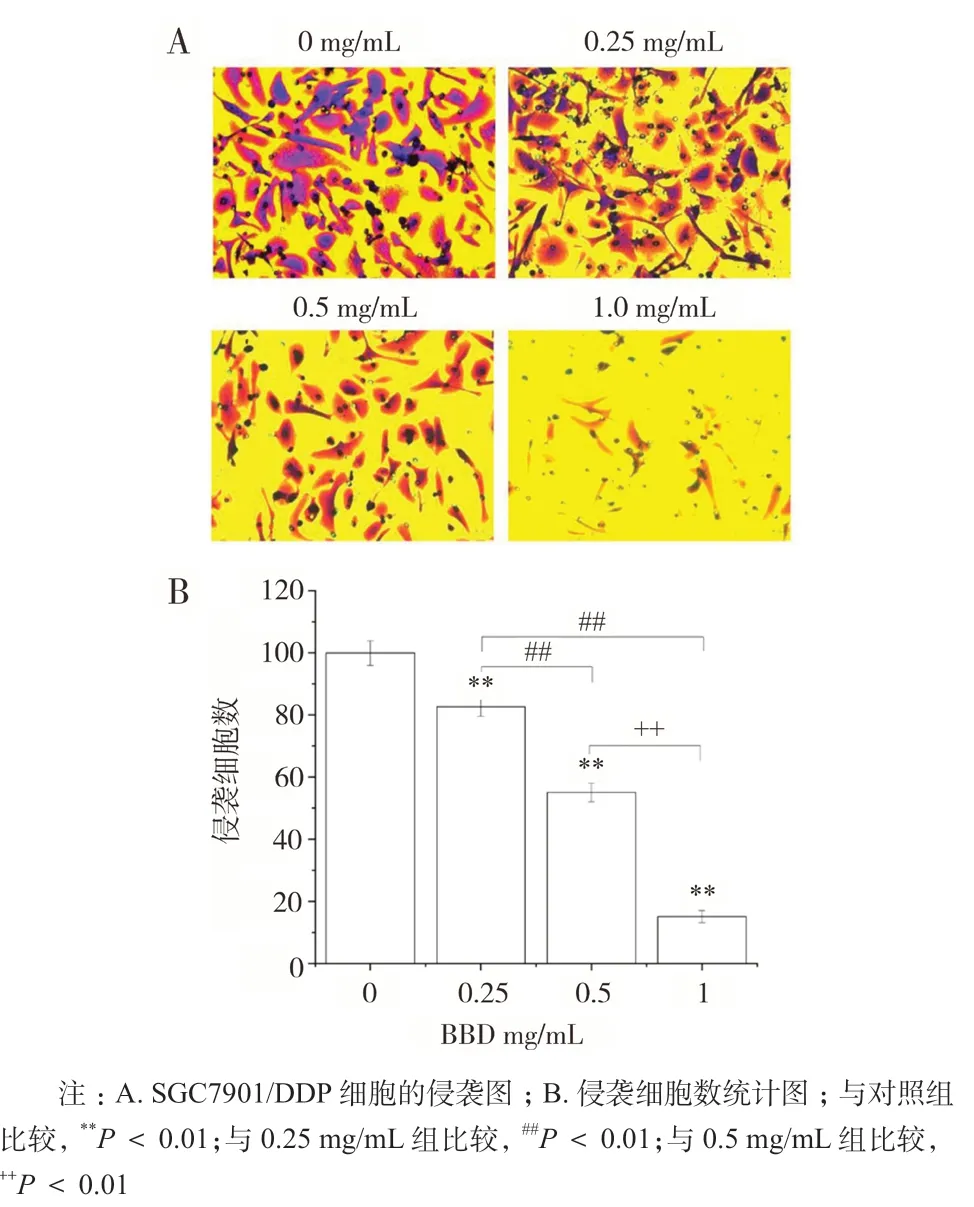
图4 八宝丹抑制 SGC7901/DDP 细胞的侵袭(±s,n = 4)Fig. 4 The invasion of SGC7901/DDP cells inhibited by BBD(±s,n = 4)
3.5 八宝丹抑制 SGC7901/DDP 细胞的粘附
细胞粘附实验结果显示,八宝丹各组细胞数分别为(32 ± 2)、(23 ± 1)和(3 ± 1), 与 对 照 组 (56 ± 4)比较,差异具有统计学意义 (P < 0.01)。结果如图 5所示。
3.6 八宝丹调控 TGF-β/Smad 通路及相关蛋白表达
Western blot 结果表明,八宝丹能下调 TGF-β、Smad4 的 表 达 以 及 p-Smad2/3 与 Smad2/3 的比 值。也可以上调 E-cadherin 蛋白的表达 , 下调Vimentin、MMP2、N-cadherin、MMP9 等相关蛋白的表达。如图 6 所示。

图5 八宝丹抑制 SGC7901/DDP 细胞的粘附(±s,n = 4)Fig. 5 BBD inhibited cell adhesion of SGC7901/DDP cells (±s,n = 4)
4 讨论
研究表明肿瘤细胞发生上皮 - 间质转化(EMT)是其发生转移的始动因素[10]。EMT 的特点之一是上皮细胞完整性或极性丢失,上皮钙黏素下调,经过骨架重构转变成运动能力更强并具有间质特性细胞的过程。通过 EMT,肿瘤细胞转变分化成丧失极性上皮细胞并获得间质特性,促进肿瘤细胞的多药耐药、侵袭、远处转移与复发[11]。此外,研究表明,EMT可以重建肿瘤微环境,从而诱导免疫治疗的耐药性,其与胃癌在内的多种肿瘤的癌细胞转移特性、耐药和较差的临床结果之间存在密切关系,因此 EMT 过程并不是一个单一的,而是由一系列广泛的过渡状态组成,在这些过渡状态中,从信号转导途径到表观遗传变化、microRNA 以及生长和转录因子等多种分子机制之间的相互作用发挥了关键的调节功能[12]。

图6 八宝丹调控 TGF-β/Smad 信号通路及蛋白的表达(±s,n = 4)Fig. 6 BBD regulates the expression of TGF-β/Smad signaling pathway and proteins(±s,n = 4)
EMT 受 多 种 信 号 通 路 调 控,TGF-β 激 活的TGF-β/Smad 通 路 高 度 参 与 了 EMT 诱 导 过 程,TGF-β 可 以 通 过 Smad 信 号 通 路 发 生 肿 瘤 转 移,Smads 是 TGF-β 信号通路从细胞表面输送到细胞核的关键因子,Smads 的羧基端被活化受体磷酸化后导致其与常见的信号转导分子 Smad4 结合并转入胞核,激活的 Smads 可以通过与转导因子的结合,调节各种不同的生物学效应。目前参与 EMT 过程的细胞外信号和细胞内信号之间的交互作用集中于细胞的深度修饰,如典型的上皮标志物 E-cadherin 的下调,N-cadherin 和其它间质蛋白的上调以及波形蛋白Vimentin 的上调等与细胞的高度迁移侵袭密切相关。此外,PERERA M等[13]研究表明,TGF-β/Smad 信号通路在高侵袭性乳腺癌细胞中的作用 , 通过激活细胞内基质金属蛋白酶(MMPs),显著促进了转移相关基因的表达。LIU J X 等[9]研究发现,八宝丹能够通过 TGF-β/Smad 信号通路促进 E-cadherin 蛋白的上调,抑制 N-cadherin、Vimentin、MMP2、MMP9 蛋 白 在AGS 和 MGC803 细胞中表达,从而抑制胃癌细胞的 EMT。本研究结果证实八宝丹对胃癌耐药细胞亦可下调 TGF-β 通路中重要因子 TGF-β 和 Smad4 表达,下调 p-Smad2/3 与 Smad2/3 的比值,同时下调N-cadherrin、Vimentin、MMP2、MMP9, 上 调E-cadherin 等转移的相关蛋白表达,进而发挥其抑制胃癌耐药细胞转移的作用。
5 结论
八 宝 丹 能 够 抑 制 胃 癌 耐 药 细 胞SGC7901/DDP 细胞生长和转移,机制可能与其调控TGF-β/Smad 通路及其下游相关蛋白的表达有关,提示了八宝丹可能是治疗肿瘤多药耐药的一种潜在药物。然而,所有的实验都是在体外进行的,因此还需要更多的体内实验进行进一步的研究。

