基于UPLC-MS/MS分析刺梨种子萌发过程中几种内源激素含量变化
李健健,尹广鹍,叶双全,邓志军,卢新雄*
(1.湖北民族大学 林学园艺学院,湖北 恩施 445000; 2.中国农业科学院 作物科学研究所,北京 100080; 3.贵州山珍宝绿色科技开发有限公司,贵州 遵义 563000)
刺梨(RosaroxburghiiTratt.)是蔷薇科(Rosaceae)蔷薇属(Rosa)多年生落叶丛生灌木,是我国特有的野生植物资源.主要分布在云贵高原和湖北、陕西等地,其中以贵州省为主要生产地.刺梨具有很高的药用价值、食用价值、经济价值[1-3].目前我国刺梨的繁殖主要是扦插、嫁接、组织培养[4]等无性繁殖的方式,这种长期的无性繁殖会对刺梨这种依靠种子繁殖的植物造成严重影响,如繁殖体根系不完整、寿命短等,且不利于品种的进化.由于刺梨种子难以萌发等因素,制约了刺梨的商业化利用.目前对于刺梨种子的研究多在其低极性化学成分分析[5-7],尚未见种子萌发过程中内源激素变化的研究,了解刺梨种子休眠与萌发的激素调控机制,可为提高刺梨的繁殖效率提供理论依据.
植物内源激素是指在植物体内合成的,对植物的生长发育起显著调节作用的有机物质[8].种子的休眠和萌发主要受内源激素动态变化的影响,特别是萌发促进类和萌发抑制类激素之间比值的动态变化.掌握刺梨种子在萌发过程中内源激素的含量变化对解除其休眠,促进种子萌发提供理论依据.但是植物体内的内源激素含量甚微,而且由于植物体内的组成复杂,相互共存的干扰组分多,对温度等条件敏感,因此对植物激素的测定非常困难,定量分析的精度也较低[9].
超高效液相色谱串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)是理想的测定分析植物内源激素的一种方法,但是由于在测定植物组织抽提液中的多种内源激素时,经常出现分离差、峰型不良及严重拖尾现象,因此选择合适的内源激素提取方法和色谱条件尤为重要.本研究采用超高效液相色谱串联质谱法,建立了同时测定刺梨种子中多种内源激素的方法,通过各激素含量变化分析刺梨种子萌发过程中休眠与萌发的激素调控机制.
1 材料与方法
1.1 研究材料
刺梨种子于2019年8月下旬采自贵州省贵阳市,将采集后的种子洗净置于室温下阴干.
1.2 种子萌发处理
参照前人对刺梨种子萌发最适温度的研究[10],将种子均匀播于垫有两层滤纸的培养皿中,在30 ℃恒温培养箱中培养,每隔24 h观察一次并加入适量蒸馏水以保持滤纸湿润,分别在培养10、20、30 d后取样,去除种皮,将胚和胚乳磨成液氮粉,对于已萌发的种子切除胚根胚芽,留取剩余胚的部分进行激素测定,样品液氮粉在-70 ℃超低温冰箱中保存,直至激素含量测定.各个处理均设3个生物学重复.
1.3 激素标准溶液的配制
准确称取脱落酸(abscisic acid,ABA)、吲哚-3-乙酸(indole-3-acetic acid,IAA)、吲哚-3-乙酸甲酯(methyl-indole-3-acetic acid,Me-IAA)、茉莉酸(jasmonic acid,JA)、茉莉酸-异亮氨酸(jasmonic acid-isoleucine,JA-Ile)、二氢茉莉酸(dihydrojasmonic acid,H2JA)和水杨酸(salicylic acid,SA)标准品10 mg(精确到0.01 mg),用100%甲醇定容到100 mL,配制100 μg/mL的标准贮备液,并置于-20 ℃冰箱中避光密封保存.质谱分析前用乙腈稀释成不同梯度浓度.激素标准品均购自Sigma-Aldrich公司.
1.4 样品激素提取
样品激素提取参照Kojima的研究[11],取出超低温保存的不同萌发天数的刺梨种子胚,用研磨仪(MM 400,Retsch)研磨(30 Hz,1 min)至粉末状,准确称取50 mg(精确至0.001 g)加入适量内标,用V甲醇∶V水∶V甲酸=15∶4∶1进行提取.提取液浓缩后用100 μL 80%甲醇-水溶液复溶,过0.22 μm PTFE滤膜,置于进样瓶中,用于UPLC-MS/MS分析.
1.5 超高效液相色谱串联质谱检测
1) 超高效液相色谱条件.Waters ACQUITY UPLC HSS T3 C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相:水相为超纯水(含0.05%的甲酸),有机相为乙腈(含0.05%的甲酸).洗脱梯度:0 min水/乙腈(体积比为95∶5),1 min水/乙腈(体积比为95∶5),8 min为5∶95(体积比),9 min为5∶95(体积比),12 min为95∶5(体积比).进样量为2 μL,柱温40 ℃,流速0.35 mL/min.
2) 质谱条件.采用电喷雾离子源(ESI),扫描方式为多反应检测(MRM),温度500 ℃,质谱电压4 500 V,帘气(CUR)35 psi,碰撞诱导电离(CAD)参数设置为medium.在Q-Trap 6500+中,每个离子对是根据优化的去簇电压(DP)和碰撞能(CE)进行扫描检测.
1.6 数据处理
统计分析和作图均通过R软件(v3.7.0)完成.采用单因素方差分析(one-way ANOVA)和Tukey检验方法(P<0.05)比较不同萌发时间内刺梨种子内源激素ABA、IAA、Me-IAA、JA、JA-Ile、H2JA、SA的变化.
2 结果与分析
2.1 激素定性分析
为了将样品的激素进行定性分析,利用不同激素的标准品质谱检测数据构建数据库,为后续样品的质谱数据分析提供基础.图1所示为激素标准品的多反应监测(multiple reaction monitoring,MRM)质谱图,由图1可看出各激素的峰型对称性和响应均良好,适用于本研究的检测分析.图2所示为全部样品混样的总离子流图,各激素的保留时间不同,无重叠.
图1 激素标准品MRM质谱图Fig.1 MRM chromatogram of standard hormone samples
图2 总离子流图Fig.2 Total ion flow chart
在对各激素进行定性后,通过不同浓度的激素标准品溶液获取对应定量信号的质谱峰强度数据,得到各激素的标准曲线,通过内标法可对样品激素进行定量分析.表1所示为激素标准品曲线线性方程及相关系数,相关系数均在0.996以上.将全部样品激素的积分峰面积代入标准曲线线性方程计算,最终可得到样品激素的绝对含量数据.
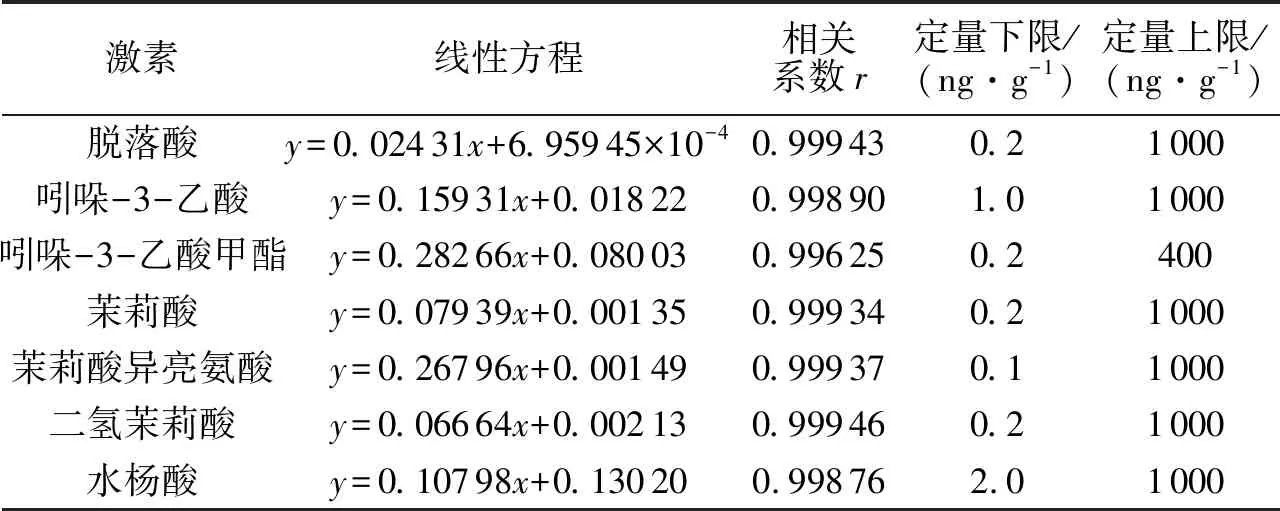
表1 激素标准品的线性方程、相关系数、定量上下限Tab.1 Linear equation,correlation coefficient,upper and lower limit of quantification of hormone standard samples
2.2 激素含量变化分析
2.2.1 脱落酸含量变化 脱落酸(ABA)在维持种子休眠过程中起着重要的作用.从图3可以看出在刺梨种子萌发过程中ABA的含量总体呈下降趋势.萌发10、 20、30 d的刺梨种子ABA含量分别为91.50、65.85、54.70 ng/g,相邻萌发阶段ABA含量差异均达到显著差异水平(P<0.05).第10 d到20 d含量下降28.03%,到第30 d时含量共下降了40.21%.
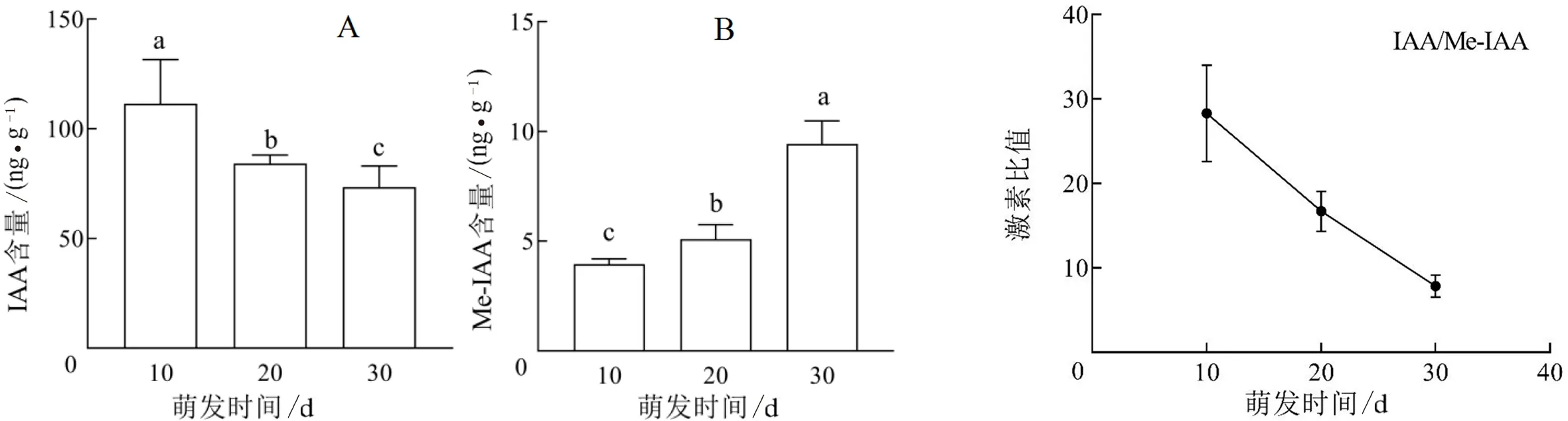
2.2.2 生长素类含量变化 吲哚-3-乙酸(indole-3-acetic acid,IAA)在植物体内普遍存在,IAA可以促进种子的萌发.如图4A 所示刺梨种子在萌发30 d内IAA含量总体呈下降趋势,萌发10、20、30 d刺梨种子IAA的含量分别为111.40、84.23、73.47 ng/g,相邻萌发阶段IAA含量均差异显著(P<0.05).IAA含量从第10 d到20 d下降24.39%,到第30 d时下降了34.05%.
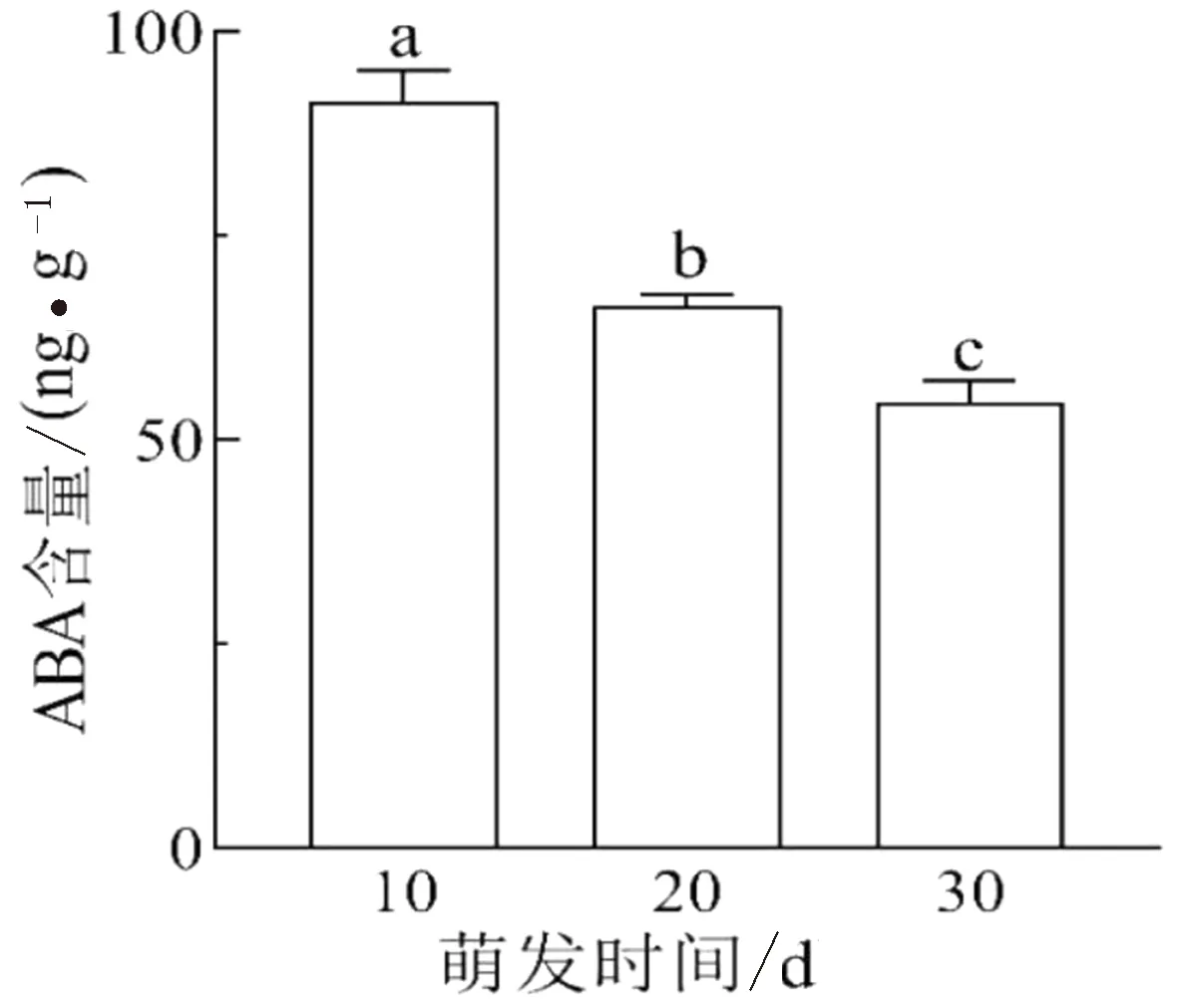
不同小写英文字母表示在P=0.05水平上存在显著差异,下同.图3 刺梨种子内源ABA含量随萌发时间的变化Fig.3 Changes of endogenous ABA content in Rosa roxburghii Tratt.seeds with germination time
吲哚-3-乙酸甲酯(methyl-indole-3-acetic acid,Me-IAA)是一种植物内源性生长素,和生长素类协同调控种子萌发.如图4B所示刺梨种子在萌发30 d内其含量总体呈上升趋势,萌发10、20、30 d的Me-IAA含量分别为3.95、5.10、9.43 ng/g,相邻萌发阶段之间含量差异均达到显著水平(P<0.05).第10 d到第20 d含量上升25.93%,到第30 d时Me-IAA含量总体上升了138.55%.
图5所示为刺梨种子内IAA/Me-IAA的比值随萌发时间的变化,从图5可以看出IAA/Me-IAA的变化趋势与IAA含量的变化趋势一致,在萌发30 d内一直呈显著下降.
2.2.3 茉莉酸类含量变化 大量研究表明茉莉酸类激素也是促进种子休眠的重要激素,且可能与ABA存在互作作用.如图6A-B所示,茉莉酸(jasmonic acid,JA)和茉莉酸-异亮氨酸(jasmonic acid-isoleucine,JA-Ile)含量均无显著性变化(P>0.05).图6C所示二氢茉莉酸(dihydrojasmonic acid,H2JA)总体呈上升趋势.萌发10、20、30 d的H2JA含量分别为2.03、2.46、4.80 ng/g.第10 d到第20 d的H2JA含量上升了21.18%,到第30 d上升了136.29%,每个萌发阶段之间含量差异均达到显著水平(P<0.05).
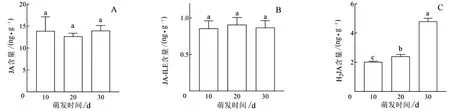
图6 刺梨种子中JA (A)、JA-Ile (B)和H2JA (C)含量随萌发时间的变化Fig.6 The changes of endogenous JA (A),JA-Ile (B) and H2JA (C) contents in Rosa roxburghii Tratt.seeds with germination time
2.2.4 水杨酸含量变化 水杨酸(salicylic acid,SA)是一种萌发促进类激素,图7可以看出刺梨种子在萌发30 d内SA含量均无显著性变化(P>0.05).萌发10 、20 、30 d的SA含量分别为266.3、241.0、237.7 ng/g.
2.2.5 各激素比值变化 种子的萌发受到激素间平衡关系的影响,主要是促进类和抑制类激素之间的平衡.由图8可知,萌发30 d内刺梨种子IAA/ABA 、SA/ABA的比值呈缓慢上升趋势,但上升不显著(P>0.05).SA/JA的比值在第10 d到20 d时由19.795 4下降至18.978 9,第30 d时比值下降为17.073 7.

3 讨论与结论
种子的休眠与萌发并非是单一激素促进或抑制的,而是多种激素共同作用的结果.ABA主要是促进种子休眠、抑制萌发的激素,赤霉素(GA3)是解除种子休眠而促进种子萌发的激素,这两种激素对彼此的生物合成和信号通路产生拮抗作用[12].ABA是在种子成熟过程中积累的,在种子成熟后达到最高含量,Andrade[13]在研究番茄种子萌发过程中发现种子解除休眠后,ABA的代谢加剧,含量随着种子萌发时间的延长而降低.付长丽[14]在研究成熟玫瑰种子无菌催芽时其ABA含量出现波动下降现象,这与本研究刺梨种子ABA含量随萌发时间的延长而降低相符合.
除了GA和ABA之外,种子的休眠和萌发还受到7类激素的调控,包括生长素(auxin)、乙烯(ET)、SA、油菜素内酯(BRs)、JA、细胞分裂素(CTKs)[15].其中生长素类是参与细胞伸长和分裂的植物激素,生长素类也是抑制种子萌发的激素.IAA是主要的生长素类之一,植物通过IAA、Me-IAA、吲哚-3-丁酸(IBA)和IAA衍生物之间互相转化维持生长素梯度和稳态[16-17].Me-IAA是由IAA羧甲基转移酶IAMT1酯化而成,IAA从酸性转化为非极性,可以促进其在细胞膜之间的运输.甲基脂酶17(MES17)水解Me-IAA生成游离的IAA,使其恢复生物活性[18-19].Liu等[20]发现在对野生型水稻单独施加外源IAA时不能降低其发芽率,而同时施用ABA和IAA显著的抑制了种子萌发,表明ABA可能通过生长素信号途径抑制种子发芽.在本研究中,ABA和IAA的含量都呈同一下降趋势,说明种子休眠在缓慢解除.而Me-IAA含量增多,但是IAA/Me-IAA的比值呈下降趋势,猜测可能是种子在萌发过程中有一小部分IAA逐渐被酯化为Me-IAA来维持生长素梯度和稳态,从而IAA含量降低,Me-IAA含量上升.
JA及其衍生物通过干扰过氧化酶体的三磷酸腺苷(ATP)结合盒转运体和β氧化过程来抑制种子萌发[21-22].Wang等[23]发现ABA通过促进JA的生物合成来协同抑制水稻种子萌发.但韩锦峰[24]发现施加低浓度的外源JA可以促进烟草种子萌发,也有研究发现植物在抗逆境中ABA与JA表现出拮抗作用[25].本研究中,JA和JA-Ile含量无显著性变化,但是H2JA含量在第20 d至30 d时快速上升,猜测在促进种子萌发时H2JA和ABA呈拮抗作用,且较低浓度的H2JA促进种子萌发.
SA是调节植物渗透能力的激素,可以诱导植物抵抗生物和非生物胁迫[26].SA是一种促进种子萌发的激素,通过SA引发技术可以显著促进豆类[27]、玉米[28]和水稻[29]的萌发.大量的研究发现SA对盐胁迫下草本种子具有一定促进作用,这种促进作用因植物种类已经胁迫程度不同存在差异[30].Nazari等[31]发现SA通过提高甜椒种子萌发相关的抗氧化酶活性和降低丙二醛(MDA)含量,减轻种子老化对发芽相关性状的影响.彭浩[32]发现ABA与SA在提高玉米种子和幼苗抗盐能力方面有相互促进的效果.在本研究中,刺梨种子在适宜萌发条件且无生物或非生物胁迫下,内源SA的含量并无显著性改变,对刺梨种子萌发作用仍需进一步研究.
在种子解除休眠和萌发的开始,起关键作用的是激素间的比例[33],且主要是萌发促进类和抑制类激素的比例.在本研究中,IAA/ABA、SA/ABA呈缓慢上升的趋势,但是变化并不显著.而SA和JA这两种激素变化并不显著,但由于种子中SA含量较高,JA含量较低,导致了SA/JA呈下降的趋势,且20 d到30 d时下降较多,推测随着萌发时间的延长,种胚中水分的累积在一定程度上抑制了种子的萌发.
综上所述,刺梨种子的萌发是ABA、IAA、Me-IAA、JA、JA-Ile、H2JA、SA等多种激素共同作用的结果,仍需进一步研究各激素调控刺梨种子萌发的分子机制,以期为更好地解决刺梨生产中的问题提供科学依据.

