干姜水煎液对心肌细胞线粒体功能损伤的改善作用研究
文建霞 赵艳玲
中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)09-1070-07
DOI 10.6039/j.issn.1001-0408.2021.09.08
摘 要 目的:探讨干姜水煎液对阿霉素致H9c2心肌细胞线粒体功能损伤的改善作用。方法:以大鼠H9c2心肌细胞为研究对象,采用CCK-8法检测不同浓度干姜水煎液(0.125、0.25、0.5、1、2、4、8 mg/mL,以生药量计,下同)对其存活率的影响;采用高内涵活细胞成像系统检测低、中、高浓度干姜水煎液(0.125、0.25、0.5 mg/mL)对阿霉素(5 μmol/L)致H9c2心肌细胞线粒体功能损伤后细胞形态学的影响,并对其相对细胞总数、相对活细胞荧光强度、相对死细胞荧光强度进行定量分析;采用生物能量分析仪检测干姜水煎液(0.5 mg/mL)对H9c2心肌细胞线粒体功能损伤后线粒体呼吸功能相关指标(耗氧率、细胞外酸化率、基线耗氧率、基线细胞外酸化率、应激耗氧率和应激细胞外酸化率)和能量代谢相关指标(基础呼吸水平、最大呼吸水平、ATP产生水平、H+质子渗漏水平、备用呼吸能力和非线粒体呼吸水平)的影响。结果:经0.125、0.25、0.5 mg/mL的干姜水煎液作用后,H9c2心肌细胞存活率显著升高(P<0.01)或差异无统计学意义(P>0.05)。阿霉素致H9c2心肌细胞线粒体功能损伤后,经0.125、0.25、0.5 mg/mL(或0.5 mg/mL)的干姜水煎液干预,细胞形态恢复正常,呈规则纤维状贴壁分布;相对细胞总数、活细胞荧光强度、耗氧率、细胞外酸化率、基线耗氧率、基线细胞外酸化率、应激耗氧率、应激细胞外酸化率、基础呼吸水平、最大呼吸水平、ATP产生水平、备用呼吸能力和非线粒体呼吸水平均显著升高(P<0.05或P<0.01),相对死细胞荧光强度、H+质子渗漏水平均显著降低(P<0.01)。结论:干姜水煎液可通过提高H9c2心肌细胞线线粒体呼吸功能和能量代谢,进而改善其粒体功能损伤。
关键词 干姜水煎液;H9c2心肌细胞;线粒体功能损伤;呼吸功能;能量代谢
Study on Improvement Effects of Zingiber officinale Decoction on Mitochondrial Function Injury of Cardiomyocytes
WEN Jianxia,ZHAO Yanling(Dept. of Pharmacy, Fifth Medical Center of PLA General Hospital, Beijing 100039, China)
ABSTRACT OBJECTIVE: To investigate the improvement effects of Zingiber officinale decoction (ZOD) on doxorubicin (DOX)-induced mitochondrial function injury of H9c2 cardiomyocytes. METHODS: Taking H9c2 cardiomyocytes as research object, the effects of different concentrations of ZOD (0.125, 0.25, 0.5, 1, 2, 4, 8 mg/mL, by crude drug, the same below) on its survival rate were investigated by CCK-8 assay. The effects of low, medium and high concentrations of ZOD (0.125, 0.25, 0.5 mg/mL) on the morphology of H9c2 cardiomyocytes after DOX (5 μmol/L) induced mitochondrial dysfunction were detected by high content living cell imaging system. The relative number of cells, the relative fluorescence intensity of living cells and the relative fluorescence intensity of dead cells were analyzed quantitatively. The effects of ZOD (0.5 mg/mL) on related indexes of mitochondrial respiratory function (oxygen consumption rate, extracellular acidification rate, baseline oxygen consumption rate, baseline extracellular acidification rate, stress oxygen consumption rate and stress extracellular acidification rate) and energy metabolism (basic respiration level, maximum respiration level, ATP production level, H+ proton leakage level, spare respiration level and non-mitochondrial respiration level) were detected by bioenergy analyzer. RESULTS: After treated with 0.125, 0.25, 0.5 mg/mL ZOD, the survival rate of H9c2 cardiomyocytes were increased significantly (P<0.01) or had no statistical significance (P>0.05). After DOX induced mitochondrial dysfunction of H9c2 cardiomyocytes, pretreated with 0.125, 0.25, 0.5 mg/mL (or 0.5 mg/mL) ZOD, the morphology of H9c2 cardiomyocytes returned to normal and showed regular fibrous adherent distribution. The relative cell number, fluorescence intensity of living cells, oxygen consumption rate, extracellular acidification rate, baseline oxygen consumption rate, baseline extracellular acidification rate, stress oxygen consumption rate, stress extracellular acidification rate, basic respiration level, maximal respiration level, ATP production level, spare respiration level and non-mitochondrial respiration level were all significantly increased (P<0.05 or P<0.01), while relative dead cell fluorescence intensity and H+ proton leakage level were significantly decreased (P<0.01). CONCLUSIONS: ZOD can improve the respiratory function and mitochondrial energy metabolism of H9c2 cardiomyocytes, so as to improve mitochondrial function injury.
KEYWORDS Zingiber officinale decoction; H9c2 cardiomyocytes; Mitochondrial function injury; Respiratory function; Energy metabolism
2019年《中国心血管健康与疾病报告》推算,我国心血管疾病现患人数约3.3亿,心力衰竭患者人数约890万,其中慢性心力衰竭患者约400万[1]。心力衰竭是各种心脏疾病的终末期,由于其较高的发病率和病死率,目前仍是严重危害人类健康的主要原因[2]。相关研究发现,心力衰竭最主要的致病因素为原发性心肌损害和异常[3]。其中,原发性心肌损害指各种类型的心肌病和心肌炎,包括扩张型心肌病和病毒性心肌炎[4]、糖尿病心肌病[5]、系统性红斑狼疮性心肌病[6]等。其次,异常的心脏负荷如压力负荷(后负荷)过重以及容量负荷(前负荷)过重也可引起心力衰竭[7-8]。此外,感染、心律失常、血容量增加以及药物治疗不当等也是诱发心力衰竭的原因[3]。
心室肌重构和神经内分泌紊乱在心力衰竭发生与发展中发挥着重要作用[3],心室肌代谢重构包括线粒体功能的改变以及能量代谢底物利用的转变[9]。线粒体为心肌细胞的能量加工厂,其能量代谢功能障碍是引起心力衰竭的重要原因[10-11]。因此,可通过药物改善心肌细胞线粒体能量代谢功能,从而防治心力衰竭[12]。
天然药物具有多成分、多靶点、多作用通路的特点,在心力衰竭的防治中发挥着独特优势[13-14]。干姜为姜科植物姜Zingiber officinale Rosc.的干燥根茎,味辛,性热,具有温中散寒、回阳通脉的功效,是“热”性中药的典型代表之一[15]。相关研究发现,干姜提取物可显著改善心力衰竭模型兔的心肌舒缩性,缓解其心力衰竭症状,保护心功能[16]。另有研究发现,干姜中活性化学成分姜辣素具有改善兔心血管功能的作用[17]。但干姜中活性成分是否可通过改善心肌细胞线粒体能量代谢功能来改善心功能,尚不明确。
基于此,本研究以干姜水煎液为研究对象,以阿霉素所致大鼠H9c2心肌细胞线粒体功能损伤模型为研究载体,检测干姜水煎液对H9c2心肌细胞增殖、形态学、呼吸功能和线粒体能量代谢的影响,来考察该水煎液对H9c2心肌细胞线粒体功能损伤的改善作用,以期为心力衰竭的新药研发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有:HERAcell 150i型CO2普通培养箱、Cellomics Array Scan XT1 Infinity型高内涵筛选系统(美国Thermo Fisher Scientific 公司),Agilent Seahorse XFp型细胞能量代谢分析仪(美国Seahorse Bioscience公司),TD5A型台式低速离心机(湖南赫西仪器装备有限公司),DM 1L LED D-35578型倒置显微镜(德国Leica公司),TC10型细胞计数器(美国BioRad公司),SynergyH1型全功能微孔板检测仪(美国BioTek公司),SXKW型数显电热套(北京中兴伟业仪器有限公司),R1002B型旋转蒸发仪(上海申生科技有限公司),SHB-B95型循环水式多用真空泵(郑州长城科工贸有限公司),Christ ALPHA 1-2 LD plus型冷冻干燥机(德国Christ公司)。
1.2 主要药品与试剂
本研究所用干姜饮片购自北京绿野药业有限公司(批号17072001),经中国人民解放军总医院第五医学中心药学部赵艳玲研究员鉴定为姜科植物姜Z. officinale Rosc.的干燥根茎。其他药品与试剂有:盐酸阿霉素(成都克洛玛生物科技有限公司,批号CHB160921,纯度≥98%),DMEM培养基(美国Hyclone公司,批号SH30022.01),FBS胎牛血清(以色列BI公司,批号04-001-1ACS),胰蛋白酶、青-链霉素、磷酸盐缓冲液(PBS)、丙酮酸、谷氨酰胺[中科迈晨(北京)科技有限公司,批号分别为CC017、CC033、CC008、CC007、CC009],二甲基亚砜(DMSO)、葡萄糖(美国Sigma公司,批号分别为D2650、G8769),细胞呼吸表型检测试剂盒、细胞线粒体压力检测试剂盒(美国Seahorse Bioscience公司,批号分别为103275-100、9832913),Seahorse XF基础培养基[安捷伦科技(中国)有限公司,批号13417002],CCK-8试剂盒(美国Med Chem Express公司,批号HY-K0301),Hoechst 33342核酸染料、钙黄绿素、溴乙啡锭二聚体1(美国Invitrogen公司,批号分别为H3570、C3099、L3224);其余试剂为实验室常用规格试剂,水为纯净水。
1.3 细胞
本研究所用细胞为大鼠H9c2心肌细胞株,购自中国医学科学院基础医学研究所细胞资源中心。
2 方法
2.1 干姜水煎液的制备
称取干姜饮片100 g,以10倍量水(按mL/g计,下同)浸泡30 min,加热回流提取1.5 h后,用双层纱布过滤;滤渣加入8倍量水,再次回流提取1 h,过滤;合并2次滤液,采用旋转蒸发仪于80 ℃、70 r/min、-0.06 MPa条件下浓缩后,于85 ℃水浴条件下蒸发得稠浸膏。浸膏于-80 ℃条件下冷冻后,置于冷冻干燥机中减压干燥,制成冻干粉末(得率为23.05%,以生药量计),备用。
2.2 细胞培养
将H9c2心肌細胞培养于含10%FBS和1%青-链霉素的DMEM培养基(以下简称培养基)中,置于37 ℃、5%CO2的恒温培养箱中培养,待细胞生长至对数期时,采用0.25%胰蛋白酶消化后进行传代、接种或冻存。
2.3 H9c2心肌细胞存活率的测定
参考文献[18]方法,采用CCK-8法进行检测。取对数生长期的H9c2心肌细胞,以培养基稀释成细胞密度为8×104 mL-1的悬液,按100 μL/孔接种于96孔板中,于37 ℃、5%CO2的恒温培养箱中培养24 h后,将细胞分为对照组和干姜水煎液不同浓度组[0.125、0.25、0.5、1、2、4、8 mg/mL,以生药量计(下同),给药质量浓度根据预试验结果设置],另设不加细胞的空白组,每组设6个复孔。空白组、对照组加入100 μL培养基,干姜水煎液不同浓度组加入含相应药物的培养基100 μL,继续培养24 h。然后每孔加入CCK-8溶液10 μL,继续培养30 min,采用酶标仪于450 nm波长下测定各孔吸光度值,并计算细胞存活率[细胞存活率=(OD给药组-OD空白组)/(OD对照组-OD空白组)×100%]。
2.4 H9c2心肌细胞形态学观察及定量分析
参考文献[19-20]方法,采用高内涵筛选系统检测。取对数生长期的H9c2心肌细胞,按8 000个/孔接种于96孔板中,分为对照组、模型组和干姜水煎液低、中、高浓度组(0.125、0.25、0.5 mg/mL,给药质量浓度根据细胞存活率实验筛选结果设置),每组设置3个复孔。对照组和模型组细胞加入培养基100 μL,干姜水煎液各浓度组细胞加入含相应药物的培养基100 μL,于37 ℃、5%CO2的恒温培养箱中培养2 h后,吸弃培养基;对照组再加入新鲜培养基100 μL,模型组和干姜水煎液各浓度组均加入含5 μmol/L阿霉素的培养基100 μL,继续培养24 h。吸弃上清液,以PBS清洗2次后,每孔加入荧光染料混合液(由Hoechst 33342核酸染料、钙黄绿素活细胞染料和溴乙啡锭二聚体1死细胞染料按50 ∶ 1 ∶ 7体积比配制而成)100 μL,避光静置30 min后,吸弃染料混合液;以PBS清洗2次后,加入PBS适量,采用高内涵筛选系统观察各组细胞形态(蓝色荧光表示所有细胞,绿色荧光表示活细胞,红色荧光表示死细胞),并进行定量分析。以对照组的细胞总数、活细胞荧光强度和死细胞荧光强度为参照,计算干姜水煎液不同浓度组和模型组细胞的相对细胞总数(相对细胞总数=给药组或模型组细胞总数/对照组细胞总数×100%)、相对活细胞荧光强度(相对活细胞荧光强度=给药组或模型组活细胞荧光强度/对照组活细胞荧光强度×100%)和相对死细胞荧光强度(相对死细胞荧光强度=给药组或模型组死细胞荧光强度/对照组死细胞荧光强度×100%)。
2.5 H9c2心肌细胞线粒体呼吸功能相关指标检测
参考文献[21]方法和细胞呼吸表型检测试剂盒说明书的相关方法,采用细胞能量代谢分析仪检测。取对数生长期的H9c2心肌细胞,按6 000个/孔接种于Seahorse XFp细胞培养板中,于37 ℃、5%CO2的恒温培养箱中培养24 h后,分为对照组、模型组和干姜水煎液0.5 mg/mL组(给药质量浓度根据细胞存活率实验结果设置),每组设置3个复孔。对照组和模型组中加入培养基80 μL,干姜水煎液0.5 mg/mL组加入含相应药液的培养基80 μL,继续培养2 h后,吸弃培养基;对照组再加入新鲜培养基80 μL,模型组加入含5 μmol/L阿霉素的培养基80 μL,干姜水煎液0.5 mg/mL组加入含5 μmol/L阿霉素和0.5 mg/mL干姜水煎液的培养基80 μL,继续培养24 h。吸弃培养基,加入Seahorse XF基础培养基清洗3~4次后,每孔均加入Seahorse XF基础培养基180 μL,继续培养1 h后,采用细胞能量代谢分析仪检测各组细胞在药物干预后0~50 min内的耗氧率、细胞外酸化率,并根据试剂盒说明书相关方法计算基线耗氧率、基线细胞外酸化率、应激耗氧率和应激细胞外酸化率。
2.6 H9c2心肌细胞中线粒体能量代谢相关指标检测
参考文献[22]方法和细胞线粒体压力检测试剂盒说明书的相关方法,采用细胞能量代谢分析仪进行检测。取对数生长期的H9c2心肌细胞,按“2.5”项下“按6 000个/孔接种……继续培养1 h后”方法操作后,采用细胞线粒体压力检测试剂盒检测各组细胞在药物干预后0~80 min内的耗氧率,并计算细胞耗氧率、基础呼吸水平、最大呼吸水平、ATP产生水平、H+质子渗漏水平、备用呼吸能力、非线粒体呼吸水平。
2.7 统计学方法
采用SPSS 19.0软件进行统计分析,计量资料以x±s表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
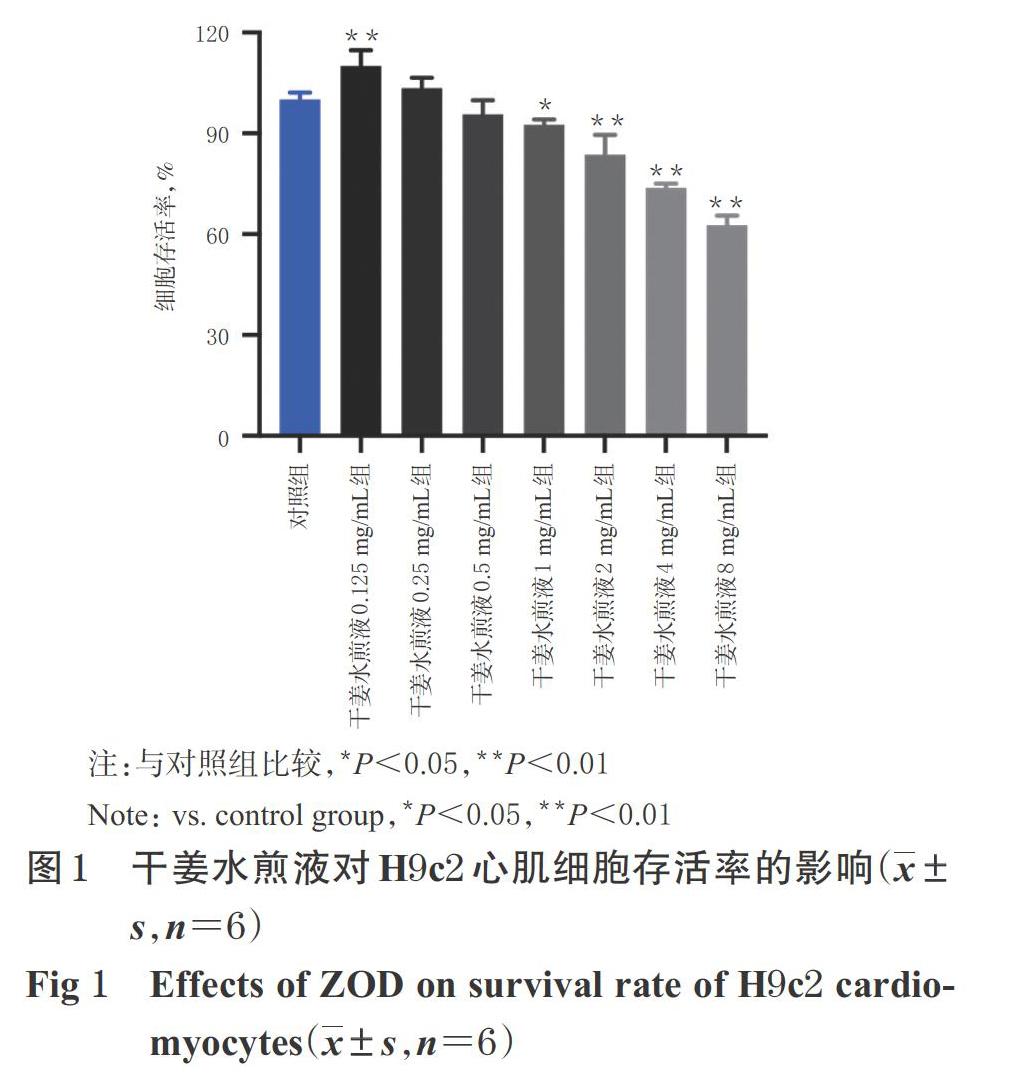
3.1 干姜水煎液對H9c2心肌细胞存活率的影响
与对照组比较,干姜水煎液0.125 mg/mL组细胞存活率显著升高(P<0.01),干姜水煎液1、2、4、8 mg/mL组细胞存活率均显著降低(P<0.05或P<0.01),干姜水煎液0.25、0.5 mg/mL组细胞存活率差异无统计学意义(P>0.05),详见图1。基于此,后续选择0.125、0.25、0.5 mg/mL的干姜水煎液研究其对H9c2心肌细胞形态学的影响。
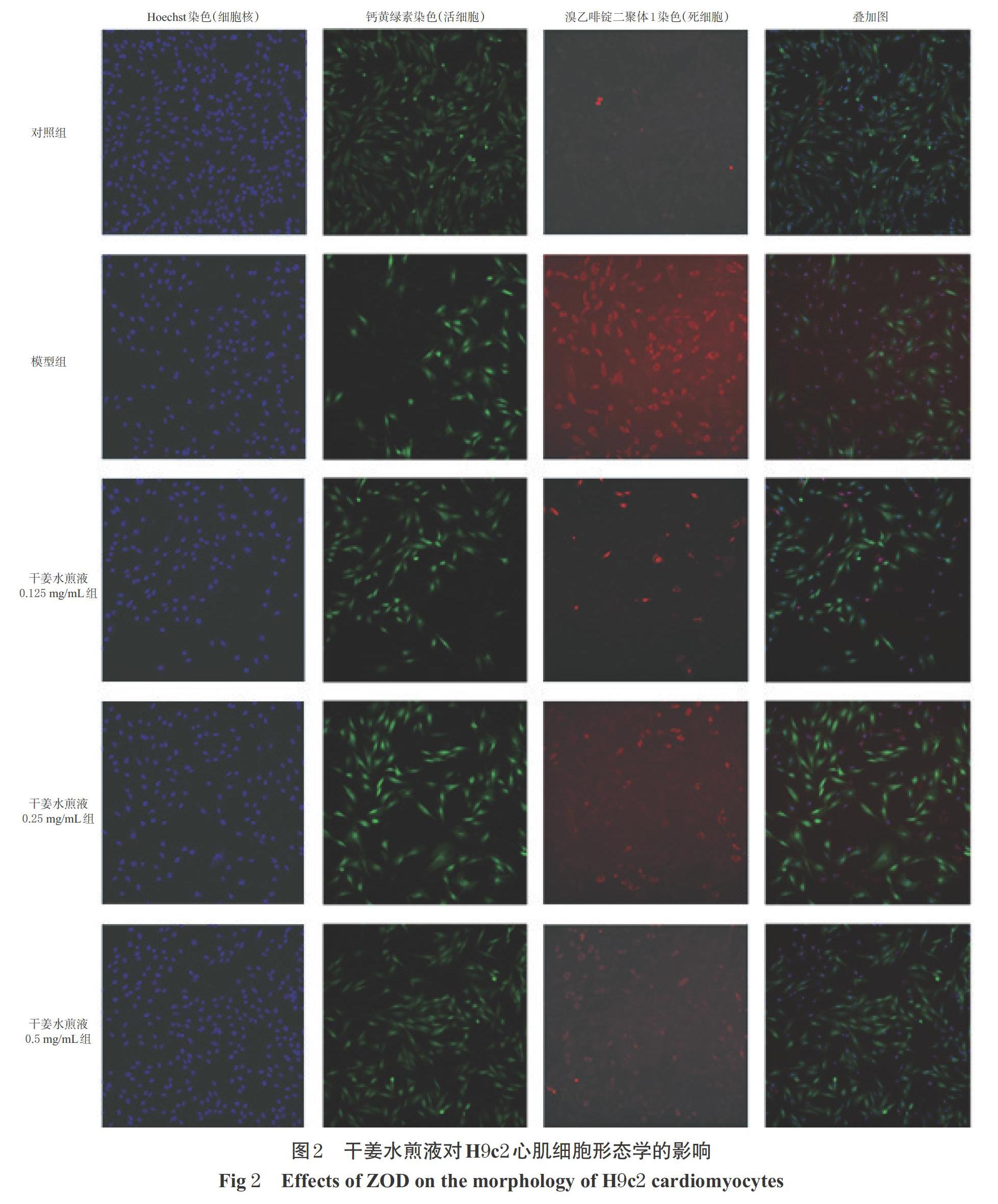
3.2 干姜水煎液对H9c2心肌细胞形态学的影响
对照组细胞形态正常,呈规则的纤维状,且贴壁分布均匀;模型组细胞皱缩,部分细胞死亡并悬浮于培养基中;干姜水煎液0.125、0.25、0.5 mg/mL组的细胞形态恢复正常,呈规则的纤维状贴壁分布,详见图2。
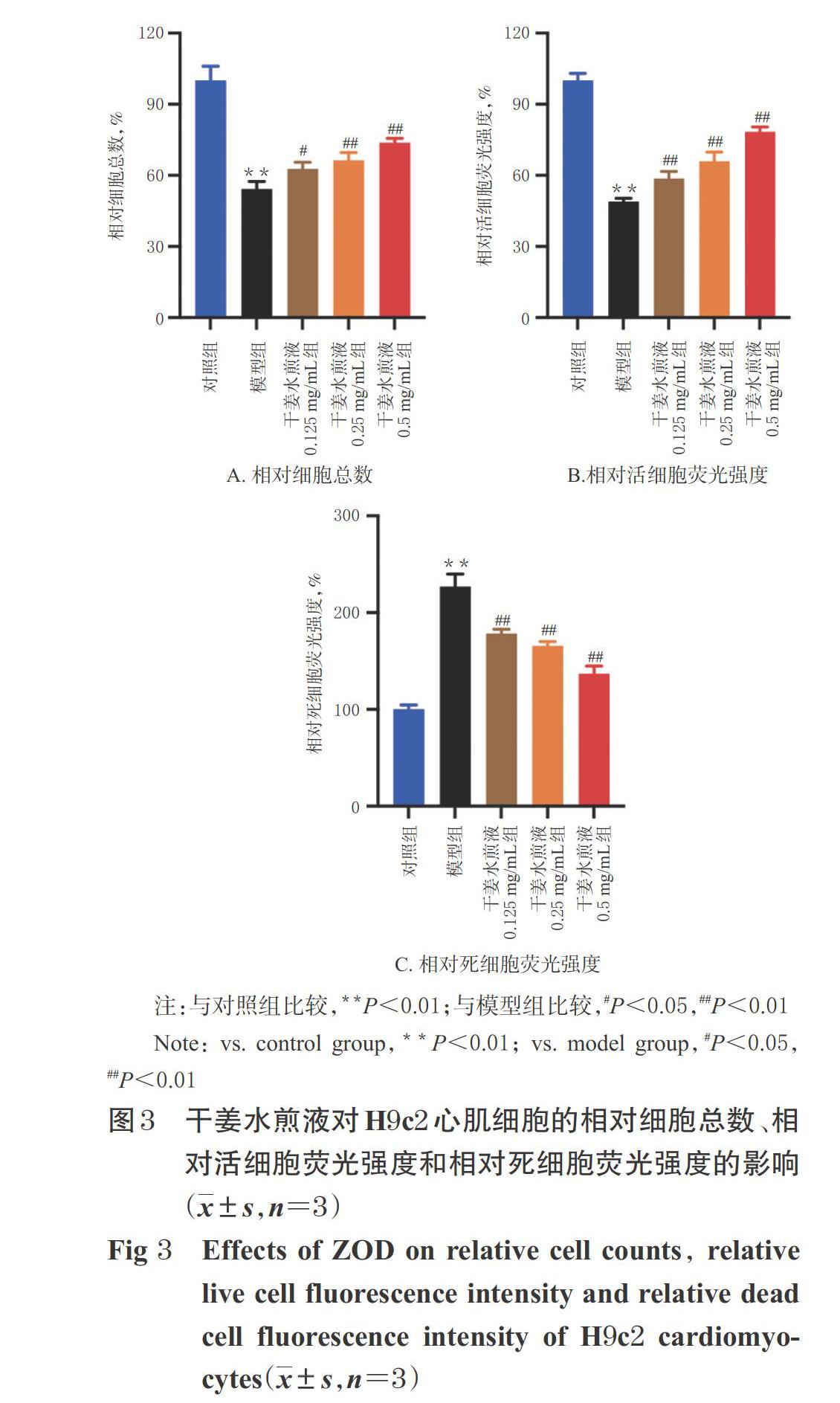
与对照组比较,模型组相对细胞总数、相对活细胞荧光强度均显著降低(P<0.01),相对死细胞荧光强度显著升高(P<0.01);与模型组比较,干姜水煎液各浓度组相对细胞总数、相对活细胞荧光强度均显著升高(P<0.05或P<0.01),相对死细胞荧光强度均显著降低(P<0.01),详见图3。
3.3 干姜水煎液對H9c2心肌细胞线粒体呼吸功能的影响
与对照组比较,模型组细胞线粒体中耗氧率(0~50 min)、细胞外酸化率(0~50 min)、基线耗氧率、基线细胞外酸化率、应激耗氧率、应激细胞外酸化率均显著降低(P<0.01);与模型组比较,干姜水煎液0.5 mg/mL组细胞上述呼吸功能指标均显著升高(P<0.01),详见图4。
3.4 干姜水煎液对心肌细胞线粒体能量代谢的影响
与对照组比较,模型组细胞耗氧率、基础呼吸水平、最大呼吸水平、ATP产生水平、H+质子渗漏水平、备用呼吸能力、非线粒体呼吸水平均显著降低(P<0.01);与模型组比较,干姜水煎液0.5 mg/mL组细胞耗氧率、基础呼吸水平、最大呼吸水平、ATP产生水平、备用呼吸能力、非线粒体呼吸水平均显著升高(P<0.01),H+质子渗漏水平显著降低(P<0.01),详见图5。
4 讨论
阿霉素是治疗不同类型肿瘤最广泛使用的广谱化疗药物之一,并且能不可逆转地抑制线粒体功能,从而诱导心肌细胞线粒体能量代谢紊乱[22]。因此,本研究采用阿霉素建立心肌细胞损伤模型。为了直观体现干姜水煎液对阿霉素致H9c2心肌细胞线粒体功能损伤的改善作用,本研究对H9c2心肌细胞的增殖、形态进行了定性和定量研究。结果发现,经0.125 mg/mL干姜水煎液作用后,H9c2心肌细胞存活率显著升高(P<0.01),经0.25、0.5 mg/mL的干姜水煎液作用后,其细胞存活率差异无统计学意义(P>0.05),因此选择这3个质量浓度研究干姜水煎液对阿霉素致H9c2心肌细胞线粒体功能损伤的改善作用。结果发现,经0.125、0.25、0.5 mg/mL的干姜水煎液干预后,细胞形态恢复正常,成规则纤维状贴壁分布,相对细胞总数、活细胞荧光强度均显著升高,相对死细胞荧光强度均显著降低,表明干姜水煎液对H9c2心肌细胞具有保护作用。
ATP的产生在维持心肌细胞能量供应中起着关键作用,药物对心肌细胞ATP生成的影响与线粒体能量代谢功能相关联[23]。心肌细胞线粒体呼吸功能和能量代谢可用于反映药物对心肌细胞线粒体功能的影响,为了解药物引起细胞线粒体功能障碍的原因和深入理解心肌细胞能量表型、代谢途径和细胞信号提供了视角。其中,耗氧率用于衡量细胞线粒体呼吸速率,反映细胞的氧化磷酸化水平;细胞外酸化率用于衡量细胞糖酵解速率;基础呼吸水平为刚开始分析时细胞的呼吸水平;最大呼吸水平为加入应激源化合物后诱导能量需求下细胞的呼吸水平,以上指标可为探讨药物对细胞氧化磷酸化和糖酵解途径的影响提供实验依据[24]。另外,H+质子渗漏水平是线粒体功能损伤的标志,其水平降低预示着线粒体ATP合成升高[25]。本研究发现,干姜水煎液可升高线粒体功能损伤H9c2心肌细胞的耗氧率、细胞外酸化率,提高心肌细胞基础呼吸和最大呼吸水平,降低H+质子渗漏水平,促进心肌细胞ATP生成;由此说明干姜水煎液可通过提高H9c2心肌细胞线粒体呼吸功能和能量代谢功能,发挥改善H9c2心肌细胞线粒体功能损伤的作用。
综上所述,干姜水煎液可通过提高H9c2心肌细胞线粒体呼吸功能和能量代谢,改善其线粒体功能损伤。后续本课题组将在动物水平开展相关研究来评价干姜水煎液对心力衰竭模型动物的干预作用及机制,以期为其在预防和治疗心力衰竭中的应用提供参考。
参考文献
[ 1 ] 中国心血管健康与疾病报告编写组.中国心血管健康与疾病报告2019概要[J].中国循环杂志,2020,35(9):833- 854.
[ 2 ] DINI F L,BAJRAKTARI G,ZARA C,et al. Optimizing management of heart failure by using echo and natriuretic peptides in the outpatient unit[J]. Adv Exp Med Biol,2018,1067:145-159.
[ 3 ] 国家卫生计生委合理用药专家委员会,中国药师协会.心力衰竭合理用药指南:第2版[J]. 中国医学前沿杂志(电子版),2019,11(7):1-78.
[ 4 ] LAWSON M A,HANSEN D E,GUPTA D K,et al. Modification of ventriculo-arterial coupling by spironolactone in nonischemic dilated cardiomyopathy[J]. ESC Heart Fail,2021,8(2):1156-1166.
[ 5 ] ELIA E,MINISTRINI S,CARBONE F,et al. Diabetic car- diomyopathy and inflammation:development of hostile microenvironment resulting in cardiac damage[J/OL]. Minerva Cardioangiol,2021[2021-02-10].https://pubmed.ncbi.nlm.nih.gov/33427423/.DOI:10.23736/S0026-4725.20. 05454-7.
[ 6 ] MADGULA A S,CONDIT D,MU J,et al. The impact of connective tissue diseases on the inpatient outcomes of congestive heart failure patients[J]. Cureus,2020,12(11):e11659.
[ 7 ] LECARPENTIER Y,MARTIN J L,GASTINEAU P,et al. Load dependence of mammalian heart relaxation during cardiac hypertrophy and heart failure[J]. Am J Physiol,1982,242(5):855-861.
[ 8 ] HUANG Y,LEI C,XIE W,et al. Oxidation of ryanodine receptors promotes Ca2+ leakage and contributes to right ventricular dysfunction in pulmonary hypertension[J]. Hypertension,2021,77(1):59-71.
[ 9 ] 陈远园,刘庆生,彭伟献,等.益气化瘀汤辅助治疗对慢性心力衰竭患者微血管损伤和心室重构及代谢重构的影响[J].中华全科医学,2020,18(9):1504-1507、1550.
[10] 李炳龙,刘鹏程,刘翠云.线粒体功能障碍与心力衰竭的关系研究进展[J].转化醫学杂志,2020,9(2):126-129.
[11] 熊燕,海春霞.线粒体功能障碍与心血管疾病[J].中国病理生理杂志,2013,29(2):364-370.
[12] 朱晓彤,李广平.线粒体功能障碍与心力衰竭的关系[J]. 中国心血管杂志,2016,21(1):65-68.
[13] 方东菲,张建永.淫羊藿及其活性成分对心血管疾病的改善作用机制研究进展[J].中国药房,2020,31(9):1139- 1143.
[14] 戢艳琼,罗娟,路玲莉,等.抗心力衰竭中药活性成分的药效基础及作用机制研究[J].中国药房,2019,30(3):427- 432.
[15] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:15-16.
[16] 许庆文,卢传坚,欧明,等.干姜提取物对兔急性心衰模型的保护和治疗作用[J].中药新药与临床药理,2004,15(4):244-247.
[17] 卢传坚,许庆文,欧明,等.干姜提取物对心衰模型兔心功能的影响[J].中药新药与临床药理,2004,15(5):301- 305.
[18] 浦延鹏,周佳明.当归挥发油对缺氧/复氧损伤大鼠心肌细胞H9c2自噬的调控作用研究[J].中国药房,2020,31(20):2492-2497.
[19] WEN J,WANG J,LI P,et al. Protective effects of higenamine combined with [6]-gingerol against doxorubicin-induced mitochondrial dysfunction and toxicity in H9c2 cells and potential mechanisms[J]. Biomed Pharmacother,2019,115:108881.
[20] WEN J,ZHANG L,LIU H,et al. Salsolinolattenuates doxorubicin-induced chronic heart failure in rats and improves mitochondrial function in H9c2 cardiomyocytes[J]. Front Pharmacol,2019,10:1135.
[21] WEN J,ZHANG L,WANG J,et al. Therapeutic effects of higenamine combined with [6]-gingerol on chronic heart failure induced by doxorubicin via ameliorating mitochondrial function[J]. J Cell Mol Med,2020,24(7):4036- 4050.
[22] HOSSEINI A,BAKHTIARI E,MOUSAVI SH. Protective effect of hibiscus sabdariffa on doxorubicin-induced cytotoxicity in H9c2 cardiomyoblast cells[J]. Iran J Pharm Res,2017,16(2):708-713.
[23] PILLAI V B,SUNDARESAN N R,JEEVANANDAM V,et al. Mitochondrial SIRT3 and heart disease[J]. Cardiovasc Res,2010,88(2):250-256.
[24] 汪春龙,郭苗苗,吴艺琦,等.生物能量分析仪在肿瘤细胞生物能量代谢中的应用研究[J].中国细胞生物学学报,2016,38(9):1066-1076.
[25] ZHANG H,ALDER N N,WANG W,et al. Reduction of elevated proton leak rejuvenates mitochondria in the aged cardiomyocyte[J]. Elife,2020,9:e60827.
(收稿日期:2020-12-10 修回日期:2021-02-05)
(编辑:唐晓莲)

