接骨木属植物化学成分和药理作用的研究进展
李巧月 李莲慧 李大山 邵立东 王葳 王文静
中图分类号 R284;R285 文献标志码 A 文章编号 1001-0408(2021)09-1118-13
DOI 10.6039/j.issn.1001-0408.2021.09.16
摘 要 目的:综述接骨木属植物化学成分和药理作用的研究进展,为其进一步研究及合理利用提供參考。方法:在查阅历代古籍的基础上,结合检索中国知网、万方数据、维普、SciFinder等数据库中的相关文献,对接骨木属植物的化学成分和药理作用的相关研究进行综述。结果与结论:接骨木属植物主要有血满草Sambucus adnata、接骨草S. chinensis、接骨木S. williamsii、西伯利亚接骨木S. sibiruca、西洋接骨木S. nigra以及S. ebulus、S. javanica等,其所含的化学成分主要有黄酮类、萜类、苯丙素类、酚及酚苷类、甾体类、生物碱类、糖及糖苷类、氰苷类化合物等。接骨木属植物中的异槲皮苷、(7R,8S)-ficusal、(7R,8S)-肥牛木素、(7R,8S)-脱氢二松柏醇、Samwinol、绿原酸等成分具有促进成骨及骨折愈合的作用;莫诺苷、熊果酸、矢车菊素-3-O-葡萄糖苷、Sambulin A、Sambulin B等成分具有抗炎、镇痛作用;矢车菊素-3-O-葡萄糖苷等成分具有抗氧化作用;落叶松树脂醇、Berchemol、(7αH,8′αH)-4,4′,8α,9-四羟基-3,3′-二甲氧基-7,9′-环氧木脂素等成分具有抗真菌作用;绿原酸、反式咖啡酸等成分具有抗病毒作用;槲皮素、山柰酚、熊果酸等成分具有降血压、降血脂、降血糖作用。
关键词 接骨木属;化学成分;药理作用
忍冬科接骨木属(Sambucus L.)植物在全世界有20余种,主要分布于北半球温带和亚热带地区;中国本土的接骨木属植物有4~5种,另从国外引种栽培了1~2种[1]。常见的接骨木属植物有血满草S. adnata、接骨草S. chinensis、接骨木S. williamsii、西伯利亚接骨木S. sibiruca、西洋接骨木S. nigra以及S. ebulus、S. javanica等[1-3]。
接骨木属植物是我国民间常用草药,尤其是彝族、苗族、傣族和蒙古族等少数民族的习用药物。其广泛用于治疗风湿痹痛、跌打损伤、骨折、黄疸、荨麻疹和水肿[2]。现代药理学研究表明,接骨木属植物具有抗骨质疏松、抗病毒、抗炎、镇痛、抗肿瘤、抗氧化和抗艾滋病等活性[4]。该属植物化学成分丰富,主要含有黄酮类、三萜类、环烯醚萜类、酚酸类、木脂素类、氰苷类及挥发油类等。
本文在查阅历代古籍的基础上,结合检索中国知网、万方数据、维普、SciFinder等数据库中的相关文献,总结了近10年来接骨木属植物的化学成分以及其在促进成骨及骨折愈合、抗炎、镇痛、抗氧化等方面的药理作用研究进展,重点对相关报道较多的化合物的药理活性及其作用机制进行了归纳和分析,以期为该属植物的进一步研究及合理利用提供参考。
1 接骨木属植物的化学成分
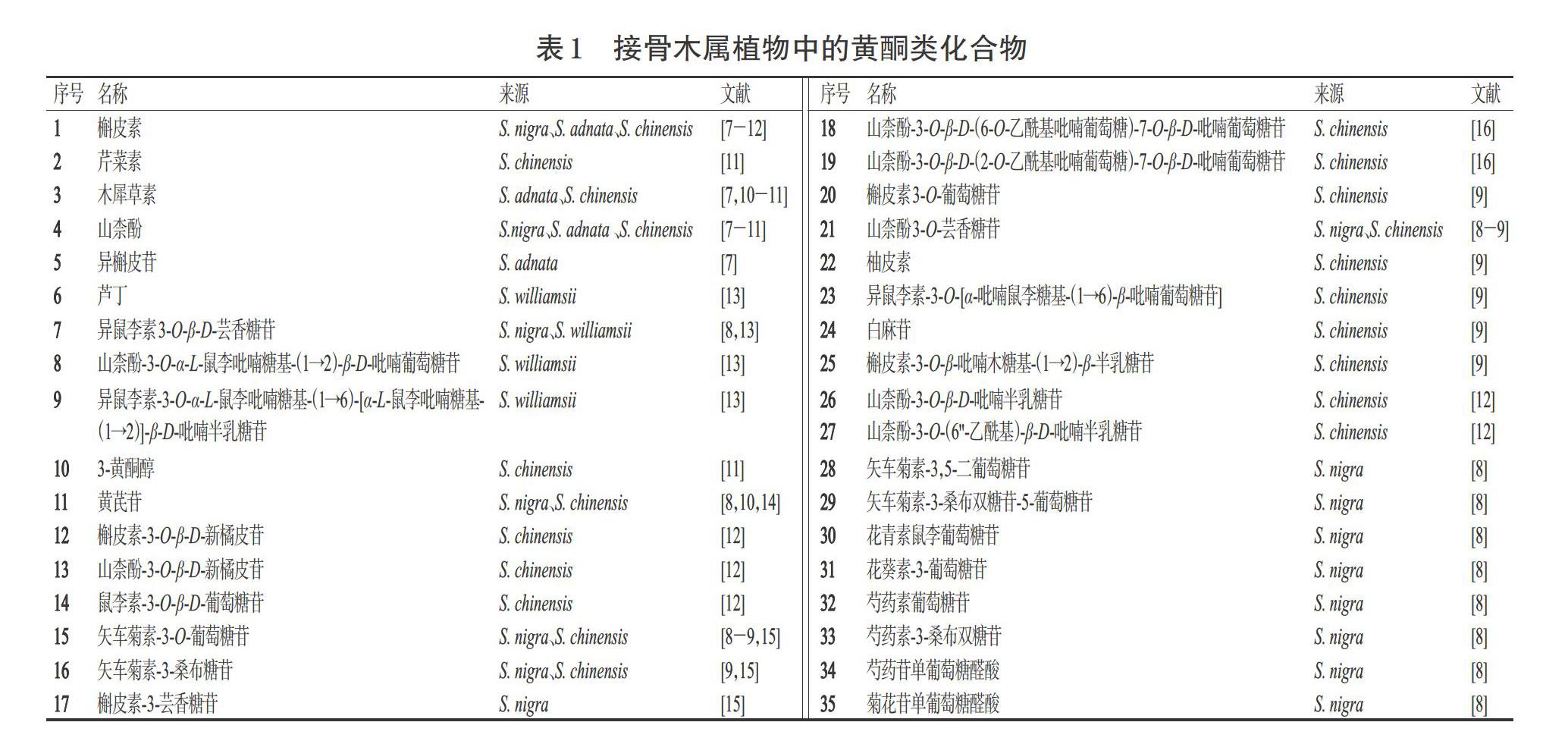
1.1 黄酮类化合物
黄酮类化合物是一类广泛分布于自然界且具有多样生物活性的天然化合物。据研究报道,黄酮类化合物大多具有促进成骨、抗氧化、降血脂和抗炎等多种药理活性[5-7]。目前,从接骨木属植物中分离得到了35个黄酮类化合物,包括黄酮、黄酮醇、二氢黄酮等类型(表1、图1)。
1.2 萜类化合物
萜类化合物在自然界分布广泛,常常根据分子结构中异戊二烯的数目进行分类[17]。据研究报道,三萜类化合物具有抗炎镇痛、降血脂和降血糖的药理活性[7,18-19];环烯醚萜类化合物具有抗炎活性[20];倍半萜类化合物具有神经保护、抗氧化、抗炎、抗血小板聚集和促进骨折愈合等药理活性[21]。迄今为止,从接骨木属植物中分离得到了51个萜类化合物,分别属于三萜类、环烯醚萜类和倍半萜类(表2、图2)。
1.3 苯丙素类化合物
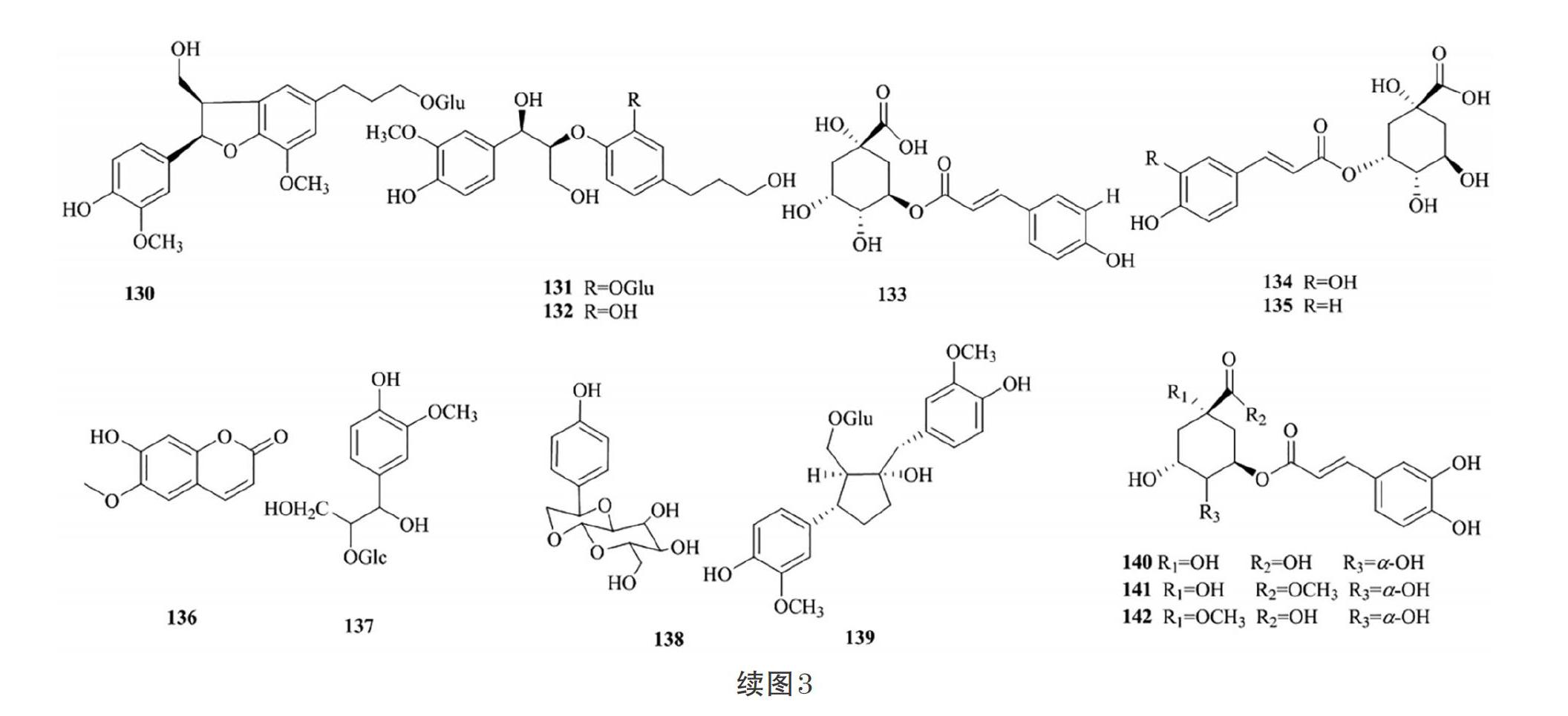
苯丙素类化合物是指基本母核具有1个或多个C6- C3单元的天然有机化合物。据研究报道,苯丙素类化合物具有促进成骨、抗真菌的药理活性[30,34-35]。目前,从接骨木属植物中提取分离得到了56个苯丙素类化合物,分别属于简单苯丙素类、香豆素类和木脂素类(表3、图3)。
1.4 酚及酚苷类化合物
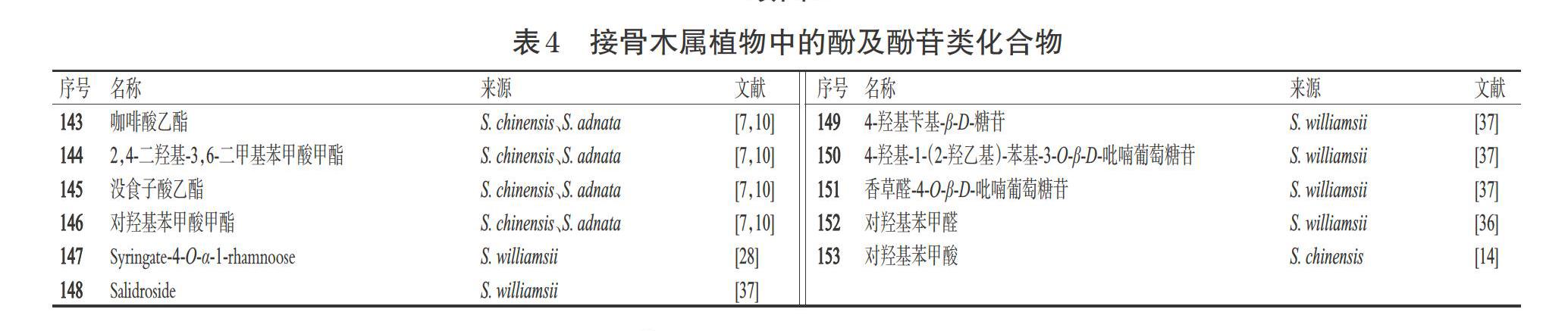
酚类化合物系指芳烃的含羟基衍生物,是植物体内重要的次生代谢产物,广泛存在于自然界中,具有特殊的芳香气味;酚苷类化合物系指苷元分子中的酚羟基与糖的端基碳原子缩合而成的苷。据研究报道,酚类化合物具有降血压和降血脂的药理活性[7];酚苷类化合物具有抗氧化、抗炎、抗细胞凋亡、抑制兴奋性损伤、减缓自噬、改善血管内皮功能等药理活性[40]。目前,从接骨木属植物中分离得到了11个酚及酚苷类化合物(表4、图4)。
1.5 甾体类化合物
甾体类化合物是广泛存在于自然界的一类具有环戊烷骈多氢菲甾体母核的天然化学成分。目前,仅从该属植物中发现了5个甾体类成分(表5、图5)。
1.6 生物碱类化合物
生物碱类化合物是存在于自然界中的一类含氮的碱性有机化合物。目前,从接骨木属植物中分离鉴定出了13个生物碱类化合物(表6、图6)。
1.7 糖及糖苷类化合物
糖类化合物是多羟基醛或多羟基酮及其衍生物、聚合物的总称;糖苷类化合物指单糖半缩醛羟基与另一个分子(例如醇、糖、嘌呤或嘧啶)的羟基、胺基或巯基缩合形成的含糖衍生物。目前,从接骨木属植物中分离得到了10个糖及糖苷类化合物(表7、图7)。
1.8 氰苷类化合物
氰苷类化合物是指由氰醇衍生物的羟基和糖缩合形成的糖苷,属于植物的次生代谢产物。目前,从接骨木属植物中分离得到了9个氰苷类化合物(表8、图8)。
1.9 其他类型化合物
接骨木属植物中挥发油的组成因种类和地域不同而有差异,主要含有芳香族化合物和饱和脂肪酸类[46-48]。
2 接骨木属植物的药理作用
2.1 促进成骨及骨折愈合作用
骨是一种特殊的动态组织,在应答外界刺激的过程中,成年人的骨骼通过成骨细胞介导的骨形成和破骨細胞进行的骨吸收来完成骨重建,从而实现自我更新[49]。接骨木乙醇提取物及其木脂素组分能有效抑制卵巢切除小鼠及大鼠的骨转换,改善骨微结构,提高骨强度[34,50]。其作用机制研究表明,接骨木中的木脂素类成分可通过促进胶原合成和无机盐的沉积,提高骨痂质量,起到促进桡骨骨折模型家兔骨折愈合的作用[34,51-52]。接骨木根皮50%乙醇提取物能促进骨折愈合,其机制可能与骨折部位募集成骨细胞上调骨形态发生蛋白2信号通路有关[53-54]。
接骨木促进骨折愈合活性成分的研究表明,化合物5(异槲皮苷)在1×10-7~1×10-5 mol/L浓度范围内能提升小鼠胚胎成骨细胞前体细胞(MC3T3-E1)的增殖、分化和矿化能力,并浓度依赖性上调Runx-2和Osterix 两个基因的mRNA表达,说明异槲皮苷有一定的成骨活性,能促进骨形成,这很可能是接骨木治疗骨折的主要药效成分[7,55]。化合物104~111、116对大鼠骨肉瘤UMR106细胞的增殖均有显著促进作用,特别是化合物104[(7R,8S)-ficusal]、105[(7R,8S)-肥牛木素]、106[(7R,8S)-脱氢二松柏醇]、107[(7R,8S)-脱氢二松柏醇-γ′-甲基醚]和109(Samwinol)在浓度分别为1×10-10、1×10-12、1×10-7、1×10-10、1×10-10 μmol/L时,可分别显著增加成骨细胞数量31.3%、28.3%、25.6%、25.1%、26.0%[31,34]。化合物140(绿原酸)在浓度为11.02~88.19 μmol/L时,可促进成骨细胞的增殖,提高成骨细胞碱性磷酸酶的活性,促进Ⅰ型胶原的表达,从而加速骨成熟、分化[9,12,56]。
2.2 抗炎、镇痛作用
炎症是免疫系统重要的生物学过程,是机体对损伤或感染的防御和保护性反应;全身性炎症会引发多种相关疾病,而阻断肿瘤坏死因子α和及其相关凋亡诱导配体的表达是治疗该类疾病的最佳方法之一[57-58]。接骨木果实提取物能够通过下调促炎基因的表达和减少炎症介质的生成来抑制脂多糖刺激的巨噬细胞的促炎通路,减弱活性氧的生成能力[59]。体外活性研究显示,化合物68(莫诺苷)在浓度为50 μmol/L时,可对肿瘤坏死因子α(50 μg/mL)刺激引起的骨炎症模型MC3T3-E1细胞产生较好的抗细胞凋亡作用(抑制率达到80%),并能够促进B淋巴细胞瘤-2(Bcl-2)的蛋白表达,降低半胱氨酸蛋白酶3(Caspase-3)、Caspase-9、Bax、磷酸化细胞外信号调节激酶(p-ERK)、磷酸化氨基末端蛋白激酶(p-JNK)和磷酸化p38丝裂原活化蛋白激酶(p-p38)的蛋白表达[60]。化合物48(齐墩果酸)是一种五环三萜苷元,属于齐墩果烷系列,传统用于抗炎、镇痛、保肝和强心[61]。富含齐墩果酸的植物提取物已显示出在热板、甩尾和扭伤伤害感受模型中的镇痛作用和对疼痛性节肢动物的有益作用[18,62]。Maia等[63]采用小鼠腹腔注射辣椒素实验模型评价受试物的抗伤害作用,发现齐墩果酸能抑制辣椒素诱发的急性痛觉,其机制可能与内源性阿片类物质、一氧化氮和ATP敏感性钾(KATp)通道开放有关。在环氧合酶(COX)活性实验中,接骨木提取物对COX-2的抑制作用[半数抑制浓度(IC50)=(46.58±5.22) μg/mL]比对COX-1的抑制作用[IC50=(65.26±4.53) μg/mL]更强;而化合物15(矢车菊素-3-O-葡萄糖苷)的IC50是接骨木提取物的1/6~1/5,表明化合物15可能抑制依赖于COX活性的促炎过程[6]。化合物84(Sambulin A)、85(Sambulin B)分别在50、25 μg/mL质量浓度下抑制了52.82%和72.88%的一氧化氮生成,显著降低了诱导型一氧化氮合酶和肿瘤坏死因子α水平;同时,化合物85能抑制白细胞介素6的产生,可通过抑制ERK和JNK的磷酸化来发挥作用[20]。
2.3 抗氧化作用
近年来,接骨木籽油的功效已经引起越来越多学者的重视。研究表明,接骨木籽油具有抗氧化、还原能力[46,64]。接骨木茎总黄酮对1,1-二苯基-2-三硝基苯肼(DPPH)自由基有较强的清除作用,且随着总黄酮浓度的增加,对DPPH自由基的清除率增高,其IC50为23.81 μg/mL[50]。
接骨木中的原花青素类物质能进入血液并具有抗氧化活性,可减少低密度脂蛋白胆固醇的氧化,用于治疗心血管疾病;同时,其还能阻止血管上皮细胞的氧化,从而预防由此引起的血管疾病[26]。接骨木提取物及化合物15(矢车菊素-3-O-葡萄糖苷)一方面可通过嵌入脂质膜并与其相互作用而对细胞产生有益的作用;另一方面,膜表面的结合与刚性化作用有助于保护花青素修饰的膜免受2,2′-偶氮二异丁基脒二盐酸盐(AAPH)自由基引起的氧化应激损伤[6]。
2.4 抗菌、抗病毒作用
接骨木的干树皮提取物和化合物94(落叶松树脂醇)、95[(7αH,8′αH)-4,4′,8α,9-四羟基-3,3′-二甲氧基-7,9′-环氧木脂素]、96(Berchemol)、97(7-羟基落叶松树脂醇)、98[(-)-梣皮树脂醇]、99[(-)-松脂素]、139[(-)-橄榄脂素-9-O-β-D-吡喃葡萄糖苷]可通过破坏真菌的细胞膜而表现出抗真菌活性[9,40,50]。
人类冠状病毒NL63(HCoV-NL63)是世界范围内流行的主要冠状病毒之一。化合物140(绿原酸)为苯丙素类化合物,在体外表现出抑制HCoV-NL63子代颗粒生成的抗病毒能力;化合物102(反式咖啡酸)是具有抗病毒活性的重要成分,可能影响HCoV-NL63与共受体(如硫酸乙酰蛋白多糖)和受体[血管紧张素转化酶2(ACE-2)]的结合[65]。
2.5 降血压、降血脂作用
血满草全草的95%乙醇提取物具有较好的体外ACE抑制活性,当其质量浓度为1 mg/mL时,体外对ACE的抑制率为54.62%;进一步研究表明,化合物1(槲皮素)、2(芹菜素)、3(木犀草素)、143(咖啡酸乙酯)可能是其发挥ACE抑制活性的主要成分[7]。
接骨木籽油具有降血脂作用,可明显降低高脂血症模型小鼠血清中总胆固醇、三酰甘油和低密度脂蛋白胆固醇水平,升高高密度脂蛋白胆固醇水平[47,64]。化合物49(熊果酸)可使高脂饮食小鼠的血浆瘦素水平提高、生长素释放肽减少、淀粉酶和脂肪酶活性下降,从而降低血糖和血脂[7,18-19]。有研究者对西洋接骨木各萃取物刺激猪原代细胞减少秀丽隐杆线虫的脂肪积累进行了研究,发现在质量浓度为200 μg/mL时,西洋接骨木二氯甲烷萃取物和甲醇萃取物组的尼罗红荧光强度分别下降了50%和25%,其中化合物4(山柰酚)、20(槲皮素3-O-葡萄糖苷)、21(山柰酚3-O-芸香糖苷)、22(柚皮素)增加了猪原代细胞培养物中的葡萄糖吸收并减少了秀丽隐杆线虫的脂肪积累[5,9]。
2.6 降血糖作用
α-葡萄糖苷酶抑制剂能竞争性抑制位于小肠的各种α-葡萄糖苷酶,使淀粉类分解为葡萄糖的速度减慢,从而减缓肠道内葡萄糖的吸收、降低血糖,同时增加胰岛素的敏感性[66]。实验证明,1.56~25.00 mg/mL质量浓度的接骨木籽油具有显著的降血糖作用,可以有效抑制α-葡萄糖苷酶[47,67]。四氧嘧啶对胰岛β细胞具有特殊的破坏作用,可以中止胰岛素分泌;而从接骨木茎提取物中得到的多糖可以促进大鼠胰岛β细胞株INS-1E胰岛细胞增殖,并且该促进作用与其质量浓度相关,其在100 mg/L质量浓度时对大鼠胰岛细胞增殖的促进作用最强,表明接骨木多糖对四氧嘧啶诱导的大鼠胰岛细胞损伤具有修护作用[50]。有研究者发现,在葡萄糖吸收试验中,西洋接骨木的二氯甲烷萃取物与甲醇萃取物在胰岛素依赖型与非依赖型的猪原代细胞中均提升了葡萄糖的摄入,其葡萄糖摄入相关信号分子在一定程度上与胰岛素信号通路有关[5,9]。
Raafat等[67]通过每48 h注射1次新鲜的四氧嘧啶(180 mg/kg)、共注射3次的实验方式诱导建立小鼠糖尿病模型,利用尾部轻拂、热板延迟和接触触觉异常性疼痛法对模型小鼠进行8周的评估。结果表明,与作为阳性对照的格列本脲和曲马多相比,化合物4(山柰酚)具有显著的降血糖活性并改善了小鼠的周围神经功能。有临床研究发现,蛋白质酪氨酸磷酸酶(PTPIB)可通过胰島素受体或其底物上的酪氨酸残基去磷酸化作用,对胰岛素信号传导进行负调节,导致下游信号传导减弱[68]。Sasaki等[69]利用PTP1B抑制剂高通量模型进行评价发现,血满草全草的甲醇提取物具有显著的PTP1B抑制活性,IC50为(0.96±0.09) ?g/mL;同法还得到其乙酸乙酯萃取部位的IC50为(0.89±0.09) ?g/mL;然后利用活性追踪的方法对乙酸乙酯萃取部位的成分进行研究,发现化合物48(齐墩果酸)、49(熊果酸)、88[(±)-赤麻木脂素]有较强的PTP1B抑制活性,其IC50分别为4.1、14.4 ?mol/L。
3 结语
我国接骨木属植物种类繁多、资源丰富,所含的化学成分复杂、结构多样,且具有多种显著的药理活性。除了以上列举的促进成骨及骨折愈合、抗炎、镇痛、抗氧化抗菌、抗病毒、降血压、降血脂、降血糖作用以外,接骨木属植物还有抗肿瘤、神经保护、抗惊厥、保肝、抗凝血、抗抑郁等作用[7,12-13,52,70-73]。近10年来,国内外学者分别从不同角度对接骨木属植物的化学成分及药理活性等方面开展了较为广泛的研究,发现接骨木属植物资源开发潜力巨大。但目前的报道以基础研究为主,尚缺乏深入和系统的研究,如化学成分和药效基础的研究尚不完整,无法阐明化学成分和临床应用之间的联系,等等。因此,进一步深入开展接骨木属植物化学成分与药理活性相关性的研究,发现活性强、毒性低、成药性高的化合物,对于指导新药研发具有重要的科学价值。
参考文献
[ 1 ] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1990:5.
[ 2 ] 国家中医药管理局中华本草编委会.中华本草[M].上海:上海科技出版社,1999:540.
[ 3 ] CHEN F L,LIU D L,WANG W,et al. Bioactive triterpenoids from Sambucus javanica Blume[J]. Nat Prod Res,2020,34(19):2816-2821.
[ 4 ] 赵京芬,周广芬.接骨木及其同属植物的化学成分和药理活性研究进展[J].中国冶金工业医学杂志,2010,27(4):398-400.
[ 5 ] BHATTACHARYA S,CHRISTENSEN K B,OLSEN L C B,et al. Bioactive components from flowers of Sambucus nigra L. increase glucose uptake in primary porcine myotube cultures and reduce fat accumulation in caenorhabditis elegans[J]. J Agric Food Chem,2013,61(46):11033- 11040.
[ 6 ] STRUGA?A P,LOI S,BA?AN?W B,et al. A comprehensive study on the biological activity of elderberry extract and cyanidin 3-O-glucoside and their interactions with membranes and human serum albumin[J]. Molecules,2018,23(10):2566.
[ 7 ] LIU D L,WANG W,CHWN F L,et al. Research on che- mical constituents and biological activity of Sambucus adnata Wall[J]. West China J Pharm Sci,2018,33(6):542- 545.
[ 8 ] PORTER R S,BODE R F. A review of the antiviral properties of black elder (Sambucus nigra L.) products[J]. Phytother Res,2017,31(4):533-554.
[ 9 ] 杨文松.中药陆英正丁醇部位化学成分研究[D].兰州:兰州理工大学,2016.
[10] 姚娜.接骨丹、葛根和绵大戟的化学成分研究[D].昆明:云南中医学院,2013.
[11] 姚元枝,伍贤进,黎晓英,等.接骨草的化学成分与药理活性研究进展[J].中成药,2015,37(12):2726-2732.
[12] 张庆.中药陆英化学成分研究[D].兰州:兰州理工大学,2015.
[13] KUANG H,TANG Z,WANG X,et al. Chemical consti- tuents from Sambucus williamsii Hance fruits and hepatoprotective effects in mouse hepatocytes[J]. Nat Prod Res,2018,32(17):2008-2016.
[14] 马建苹,张庆.接骨草花乙酸乙酯部位化学成分研究[J].中国食品工业,2015(7):58-59.
[15] SEABRA I J,BRAGA M E M,BATISTA M T P,et al. Fractioned high pressure extraction of anthocyanins from elderberry (Sambucus nigra L.) pomace[J]. Food Bioproc Tech,2010,3(5):674-683.
[16] 黄雅.接骨草质量控制研究[D].贵阳:贵阳中医学院,2017.
[17] 牟玉蘭,闫浩,龚黎黎.萜类化合物的研究概况[J].化工管理,2018(11):12-13.
[18] RAO V S,DE MELO C L,QUEIROZ M G R,et al. Ursolic acid,a pentacyclic triterpene from Sambucus australis,prevents abdominal adiposity in mice fed a high-fat diet
[J]. J Med Food,2011,14(11):1375-1382.
[19] CHOI J,JUNG H J,LEE K T,et al. Antinociceptive and anti-inflammatory effects of the saponin and sapogenins obtained from the stem of Akebia quinata[J]. J Med Food,2005,8(1):78-85.
[20] BALKAN ? A,AK?LKE A Z ?,BA?ATUR Y,et al. Sambulin A and B,non-glycosidic iridoids from Sambucus ebulus, exert significant in vitro anti-inflammatory activity in LPS-induced RAW 264.7 macrophages via inhibition of MAPKss phosphorylation[J]. J Ethnopharmacol,2017,206:347-352.
[21] 张丹丹,闫雪生.莫诺苷的药理药效作用研究进展[J].山东中医药大学学报,2015,39(1):95-97.
[22] 许蒙蒙,段营辉,戴毅,等.接骨木中1个新的降三萜成分[J].中草药,2013,44(19):2639-2641.
[23] SUH W S,KIM C S,SUBEDI L,et al. Iridoid glycosides from the twigs of Sambucus williamsii var. coreana and their biological activities[J]. J Nat Prod,2017,80(9):2502-2508.
[24] WANG Z Y,HAN H,YANG B Y,et al. Two new iridoid glycosides from the root barks of Sambucus williamsii Hance[J]. Molecules,2011,16(12):3869-3874.
[25] KUANG H X,HAN H,YANG B Y,et al. Two new iridoid glycosides from the root barks of Sambucus williamsii Hance[J]. Molecules,2012,17(2):1830-1836.
[26] 宋丹丹.接骨木根皮化学成分研究[D].哈尔滨:黑龙江中医药大学,2014.
[27] 宋丹丹,杨炳友,杨柳,等.接骨木根皮的化学成分研究[J].中医药信息,2014,31(3):4-6.
[28] 杨炳友,宋丹丹,韩华,等.接骨木根皮的化学成分研究:Ⅰ[J].中草药,2014,45(10):1367-1372.
[29] TOMASSINI L,VENTRONE A,FREZZA C,et al. A new iridoid diglycoside from Sambucus ebulus L.[J]. Nat Prod Res,2020,34(15):2137-2143.
[30] ALIPIEVA K,SIMOVA S,ZAHMANOV G,et al. New tetraacetylated iridoid glycosides from Sambucus ebulus L. leaves[J]. Phytochem Lett,2017,20:429-432.
[31] XIAO H H,DAI Y,WONG M S,et al. Two new phenylpropanoids and one new sesquiterpenoid from the bioactive fraction of Sambucus williamsii[J]. J Asian Nat Prod Res,2015,17(6):625-632.
[32] SALVADOR A C,ROCHA S M,SILVESTRE A J D. Lipophilic phytochemicals from elderberries (Sambucus nigra L.):influence of ripening,cultivar and season[J]. Ind Crops Prod,2015,71:15-23.
[33] ZAHMANOV G,ALIPIEVA K,DENEV P,et al. Flavonoid glycosides profiling in dwarf elder fruits (Sambucus ebulus L.) and evaluation of their antioxidant and anti-herpes simplex activities[J]. Ind Crops Prod,2015,63:58-64.
[34] XIAO H H,DAI Y,WONG M S,et al. New lignans from the bioactive fraction of Sambucus williamsii Hance and proliferation activities on osteoblastic-like UMR106 cells
[J]. Fitoterapia,2014,94:29-35.
[35] SUH W S,SUBEDI L,KIM S Y,et al. Bioactive lignan constituents from the twigs of Sambucus williamsii[J]. Bioorg Med Chem Lett,2016,26(8):1877-1880.
[36] 許蒙蒙,段营辉,肖辉辉,等.接骨木中的木脂素类化学成分及其对UMR106细胞增殖作用的影响[J].中国中药杂志,2014,39(14):2684-2688.
[37] 唐振球,王新国,杨炳友,等.接骨木果实化学成分的分离与结构鉴定[J].中国药物化学杂志,2017,27(3):225-229.
[38] OUYANG F,LIU Y,LI R,et al. Five lignans and an iridoid from Sambucus williamsii[J]. Chin J Nat Med,2011,9(1):26-29.
[39] CHOI H,LEE J,CHANG Y S,et al. Isolation of (-)-oli- vil-9′-O-β-d-glucopyranoside from Sambucus williamsii and its antifungal effects with membrane-disruptive action[J]. Biochim Biophys Acta,2013,1828(8):2002- 2006.
[40] 张庆光,马丽娟,朱亮,等.红景天苷防治缺血再灌注损伤的药理作用及相关机制研究进展[J].上海中医药大学学报,2021,35(1):126-133.
[41] KITE G C,LARSSON S,VEITCH N C,et al. Acyl spermidines in inflorescence extracts of elder (Sambucus ni- gra L.,adoxaceae) and elderflower drinks[J]. J Agric Food Chem,2013,61(14):3501-3508.
[42] JENSEN S R,NIELSEN B. Cyanogenic glucosides in Sambucus nigra L.[J]. J Acta Chem Scand,1973,27(7):2661-2662.
[43] 马养民,吴昊.接骨木属植物的化学成分研究进展[J].有机化学,2012,32(11):2063-2072.
[44] DABROSCA B,DELLAGRECA M,FIORENTINO A,et al. Potential allelochemicals from Sambucus nigra[J]. Phytochemistry,2001,58(7):1073-1081.
[45] DELLAGRECA M,FIORENTINO A,MONACO P,et al. Degraded cyanogenic glucosides from Sambucus nigra[J]. Tetrahedron Lett,2000,41(33):6507-6510.
[46] LV HC,CHEN S S,HAN P,et al. Component analysis,quality measurement and antioxidant activity of Sambucus williamsii seed oil[J]. Adv Mater Res,2014,941/944:1120-1123.
[47] LV H C,CHEN S S,XU X L. Isolation of linoleic acid from Sambucus williamsii seed oil extracted by high pres- sure fluid and its antioxidant,antiglycemic,hypolipidemic activities[J]. Int J Food Eng,2015,11(3):383-391.
[48] 李金英,赵春莉,刘树英,等.3种接骨木果实挥发性组分[J].东北林业大学学报,2013,41(9):91-93.
[49] KULAR J,TICKNER J,CHIM SM,et al. An overview of the regulation of bone remodelling at the cellular level[J]. Clinical Biochemistry,2012,45(12):863-873.
[50] XIAO H H,SHAM T T,CHAN C O,et al. A metabolomics study on the bone protective effects of a lignan-rich fraction from Sambucus williamsii ramulus in aged rats[J]. Front Pharmacol,2018,9:932.
[51] XIAO H H,ZHANG Y,COOPER R,et al. Phytochemicals and potential health effects of Sambucus williamsii Hance (Jiegumu)[J]. Chin Med,2016,11:36.
[52] ZHANG Y,LI Q,WAN H Y,et al. Study of the mechanisms by which Sambucus williamsii HANCE extract exert protective effects against ovariectomy-induced osteoporosis in vivo[J]. Osteoporos Int,2011,22(2):703-709.
[53] YANG B,LIN X,TAN J,et al. Root bark of Sambucus williamsii Hance promotes rat femoral fracture healing by the BMP-2/Runx2 signaling pathway[J]. J Ethnopharmacol,2016,191:107-114.
[54] YANG B,LIN X,YANG C,et al. Sambucus williamsii Hance promotes MC3T3-E1 cells proliferation and dif- ferentiation via BMP-2/Smad/p38/JNK/Runx2 signaling pathway[J]. Phytother Res,2015,29(11):1692-1699.
[55] 趙旭.IL-17F对Wistar大鼠成骨细胞增殖、ALP活性和Runx2、Osterix mRNA表达影响[D].济南:山东大学,2015.
[56] 张珠,殷军霞.氯原酸对成骨细胞增殖及碱性磷酸酶活性影响[J].武汉理工大学学报,2014,36(11):46-48、52.
[57] 陆正齐.炎症、免疫与脑血管病的研究进展[J].中山大学学报(医学科学版),2021,42(1):11-16.
[58] 胡浪,林小玲.肿瘤坏死因子拮抗剂治疗类风湿关节炎的疗效及安全性分析[J].中国医刊,2021,56(3):340-343.
[59] OLEJNIK A,KOWALSKA K,OLKOWICZ M,et al. Anti-inflammatory effects of gastrointestinal digested Sambucus nigra L. fruit extract analysed in co-cultured intestinal epithelial cells and lipopolysaccharide-stimulated macrophages[J]. J Funct Foods,2015,19:649-660.
[60] 林晓影,杨炳友,匡海学.接骨木根皮环烯醚萜类单体莫诺苷对TNF-α刺激MC3T3-E1细胞引起的骨炎症的保护作用及机制研究[C]//见:第十届全国免疫学学术大会汇编.北京:第十届全国免疫学学术大会,2015:445-446.
[61] JIE L. Pharmacology of oleanolic acid and ursolic acid[J]. J Ethnopharmacol,1995,49(2):57-68.
[62] LUKACZER D,DARLAND G,TRIPP M,et al. A pilot trial evaluating META050,a proprietary combination of reduced iso-alpha acids,rosemary extract and oleanolic acid in patients with arthritis and fibromyalgia[J]. Phyto- ther Res,2005,19(10):864-869..
[63] MAIA J L,LIMA-JúNIOR R C P,MELO C M,et al. Oleanolic acid,a pentacyclic triterpene attenuates capsaicin-induced nociception in mice:possible mechanisms[J]. Pharmacol Res,2006,54(4):282-286.
[64] HU W,LI H,LIU K. Antioxidant,hypoglycemic and hypolipidemic activities of Sambucus williamsii seed oil[J]. Medicinal Plant,2018,9(5):45-50、53.
[65] WENG J R,LIN C S,LAI H C,et al. Antiviral activity of Sambucus formosana Nakai ethanol extract and related phenolic acid constituents against human coronavirus NL63[J]. Virus Research,2019,273:197767.
[66] 郭启煜.α-葡萄糖苷酶抑制剂:降低餐后高血糖[J].糖尿病新世界,2005(6):42-43.
[67] RAAFAT K,EL-LAKANY A. Acute and subchronic in-vivo effects of Ferula hermonis L. and Sambucus nigra L. and their potential active isolates in a diabetic mouse mo- del of neuropathic pain[J]. BMC Complement Altern Med,2015,15:257.
[68] GOLDSTEIN B J,LI P M,DING W,et al. Regulation of insulin action by protein tyrosine phosphatases[J]. Vitam Horm,1998,54:67-96.
[69] SASAKI T,LI W,MORIMURA H,et al. Chemical constituents from Sambucus adnata and their protein-tyrosine phosphatase 1B inhibitory activities[J].Chem Pharm Bull (Tokyo),2011,59(11):1396-1399.
[70] KISHOR K,NATH L R,VIJAYSHANKER K,et al. Anti-inflammatory and antipyretic activities of beta-sitos- terol[J]. Planta Med,1980,39(6):157-163.
[71] ATAEE R,FALAHATI A,EBRAHIMZADEH M,et al. Anticonvulsant activities of Sambucus nigra[J]. Eur Rev Med Pharmacol Sci,2016,20(14):3123-3126.
[72] 魯柏辰,赵敏,杨晓宇,等.接骨木油对小鼠急性肝损伤的预防保护作用[J].卫生研究,2018,47(3):437-439、464.
[73] MAHMOUDI M,EBRAHIMZADEH M,DOOSHAN A,et al. Antidepressant activities of Sambucus ebulus and Sambucus nigra[J]. Eur Rev Med Pharmacol Sci,2014,18(22):3350-3353.
(收稿日期:2020-12-08 修回日期:2021-03-15)
(编辑:胡晓霖)

