电针对高脂饮食诱导的胰岛素抵抗大鼠下丘脑β淀粉样蛋白、Tau蛋白磷酸化水平与糖原合成酶激酶-3的影响*
王静芝,杜艳军△,陈 丽,黄浏娇,瞿 涛,周焕娇,陈 茜
(1.湖北中医药大学针灸骨伤学院/针灸治未病湖北省协同创新中心,武汉 430061;2.湖北中医药大学中医临床学院,武汉 430061)
随着人口老龄化日益严重, 老年期痴呆的发病率呈上升趋势。轻度认知功能损害(mild cognitive impairment, MCI)是介于正常老化和痴呆之间的一种不稳定的认知损伤状态,每3~4年有20%~66%的MCI患者认知功能持续恶化,最终导致痴呆的发生,其中大部分为阿尔茨海默型痴呆(alzheimer disease,AD),MCI是AD的重要危险因素[1-2]。胰岛素对中枢神经系统的影响包括摄食行为、能量储存、记忆认知功能[3],中枢胰岛素抵抗(insulin resistance, IR)可以引起轻度认知功能损害,轻、中度认知功能下降[4]。
Aβ是由淀粉样前体蛋白(APP)经β-和γ-分泌酶的蛋白水解作用产生,Aβ的増加与沉积可通过生成具有神经毒性的老年斑诱发神经元变性与死亡。神经元微管相关蛋白(Tau蛋白)过度磷酸化则是认知功能损害的又一发病机制[5-6]。胰岛素信号转导通路PKB/Akt的生理底物糖原合成酶激酶-3(glucogen synthase kinase-3,GSK3),具有GSK-3α和GSK-3β 2种形式的异构体,其活性与Aβ沉积、tau蛋白过度磷酸化密切相关[7]。
本研究在造模同时给予受试动物电针预防性治疗,与造模成功后的电针治疗组作为对照,旨在观察电针预防性治疗对胰岛素抵抗大鼠认知功能的保护作用。并通过观察各组大鼠下丘脑Aβ42、p-tau、GSK-3α与GSK-3β表达变化与差异,探讨电针治疗在防治胰岛素抵抗大鼠轻度认知功能损害的效应机制。
1 材料与方法
1.1 实验动物
选用清洁级雄性Wistar大鼠70只,8周龄,体质量(180±20) g,购自湖北省实验动物研究中心,实验动物许可证号SCXK(鄂)2015-0018。饲养于湖北中医药大学实验动物中心,饲养环境温度18~25 ℃,湿度45%~55%。
1.2 主要试剂与仪器
高脂饲料 (上海斯莱克实验动物有限责任公司),Aβ42、p-Tau(美国abcam,b10148、ab109390),Dako REAL EnVision Detection System(安捷伦(Dako),K5007)。小鼠单抗β-actin(42KD)(武汉博士德生物工程有限公司,BM0627),兔多抗GSK3α(51KD)、兔多抗GSK3β(48KD)(武汉三鹰生物技术有限公司,13419-1-AP、 22104-1-AP),HRP标记羊抗小鼠二抗、HRP标记羊抗兔二抗(武汉博士德生物工程有限公司,BA1051、BA1054),磷酸酶抑制剂、PMSF、RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天,S1873、ST506、P0013B、P0010),TEMED、Trise-Base(Amresco,Amresc00761、Exp2017/12), HCl(信阳市化学试剂厂,GB622-89), Tris-base(西格玛奥的(上海)贸易有限公司,v900483)。
RM 2016轮转式病理切片机(德国Leica公司);JK-6生物组织摊烤片机(武汉俊杰电子有限公司);SKG抗原修复用电陶炉;电泳仪(Bio-Rad);转膜仪(Bio-Rad);凝胶扫描成像系统(Bio-Rad);BX53型显微镜(奥林巴斯生物显微镜),LP115pH计(德国Metter-Toledo GmbH公司);酶标仪(Thermo,mμLISKANMK3);HI650离心机(湖南湘仪实验室仪器开发有限公司);华佗牌毫针(苏州医疗用品厂有限公司)。
1.3 分组与造模
适应性喂养3 d后按随机数字表法分为正常组(normal, N)、模型组(model, M)、预防组(preventing electro-acupuncture, p-EA)、电针组(electro-acupuncture,EA)、预防+阻滞剂组(p-EA+blocker LY294002, p-EA+b)、电针+阻滞剂组(EA+blocker LY294002,EA+b)、脑脊液组(cerebrospinal fluid, CSF)各10只。正常组(N)给予标准饮食(3.8kcal/g,含70%碳水化合物,20%蛋白质,10%脂肪),其余各组采用高脂饲料(5.4kcal/g,含38.5%碳水化合物,15%蛋白质,46.5%脂肪)。喂养8周后大鼠尾静脉采血检测FPG、FINS,IRI=[FPG (mmol/L)×FINS (mIU/L)]/22.5,模型大鼠IRI与正常大鼠比较明显升高时(P<0.001)为造模成功[8]。
1.4 电针干预
1.4.1 EA组 大鼠于造模成功后,使用 0.30×25 mm不锈钢毫针,参照李忠仁主编《实验针灸学》[9], 以标本配穴电针方法选择关元、足三里(后三里)、丰隆和百会进行毫针针刺。足三里和丰隆穴直刺5~10 mm,关元穴向剑突方向斜刺5~7 mm,百会向后方平刺5 mm。采用电针治疗仪(HANS-100 A型)连续波、频率(2 Hz)、强度(1 mA)、通电(10 min),同侧足三里穴和丰隆穴连接同一输出的2个电极,刺激强度根据局部肌肉收缩情况决定。每日电针10 min,每周5次治疗,总疗程为8周。以上采取的刺激频率和电针时间、疗程综合文献报道决定[10]。
1.4.2 p-EA组 从造模开始进行电针治疗,电针方法同EA组,持续16周。
1.4.3 p-EA+b组 大鼠称重后以10%水合氯醛(30 mg/kg)腹腔麻醉。将大鼠固定于脑立体定位仪,头顶局部常规备皮、消毒,依照立体定位图谱进行定位,于前囟后0.8 mm在中位颅盖骨处用牙科钻钻一直径2 mm的孔[11-12],以不锈钢导管插入(长18.0 mm,外径0.64 mm,内径0.39 mm)留置(如图1);用带帽的不锈钢制导丝插入导管内封闭导管。手术后预防感染,将大鼠置于空笼内待6~8 h可清醒。术后2 d起取LY294002 (10 μm, 10 μL;1 μL/min)缓慢注射,留针8~10 min,以防药物沿针道返流颅外。电针治疗同p-EA组,共计16周。
1.4.4 EA+b组 造模成功后,每日电针干预前1 h,大鼠称重后进行脑室灌注LY294002。脑室灌注同p-EA+b组。电针治疗同EA组,持续8周。
1.4.5 CSF组 大鼠称重后脑室留管同EA+b组。脑脊液:Na+145.5 ml/L, K+2.8 mol/L, Ca2+2.3 mol/L, Mg2+2.2 mol, Cl-128.5 mol/L, HCO3-23.1 mol/L, H2Po4-l.lmol/L, 葡萄糖0.6lg/L, 渗透压289.omosM/L, PH 值7.3配置完成等量灌注,操作方法同EA+b组。电针治疗同EA组。
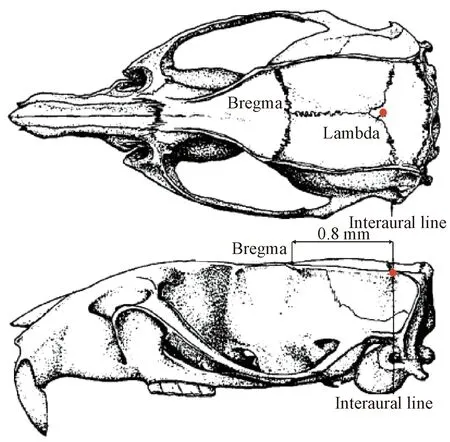
图1 大鼠脑立体定位及置管示意图
1.5 指标收集与检测
1.5.1 ELISA法检测 大鼠空腹FPG、FIN 实验16th周治疗结束后,各组大鼠禁食12 h以尾静脉采血静置,离心取上清。ELISA 法按试剂盒操作要求检测各组大鼠空腹FPG、FIN并计算各组大鼠IRI。
1.5.2 免疫组化 各组大鼠禁食12 h颈椎脱臼法处死,冰上剥取下丘脑,右侧下丘脑组织-80 ℃保存备用。左侧下丘脑组织用多聚甲醛(4%)固定后,酒精脱水并进行浸蜡及包埋。切片厚度4 μm,经脱蜡、抗原修复,滴加一抗(Aβ42 1∶100,p-tau1∶100)、二抗,镜下观察并完成镜检拍照。使用IPP6.0软件对免疫组化照片进行光密度分析,每张切片选取3张400倍照片做光密度分析,area为面积,IOD为积分光密度,density(mean)为平均光密度。
1.5.3 Western blot检测 从-80 ℃冰箱中取出下丘脑组织,加入400 μL裂解液(含PMSF)碾磨、裂解离心取上清,使蛋白变性。BSA标准品稀释为1、0.8、0.6、0.4、0.2标准蛋白,采用DG-3022 A酶标仪测定OD568并计算蛋白浓度。蛋白样品(40μg)和Marker加入上样孔,电泳1.5 h。凝胶根据Marker切下目的条带,PVDF膜甲醇浸泡后同滤纸浸泡于电转缓冲液。PVDF膜浸泡于含5%脱脂奶粉TBST,室温摇床封闭2 h;浸泡一抗(β-actin 1∶200,GSK3-α1∶500,GSK3-β1∶1000),封闭液稀释相应的HRP标记二抗(1∶50000),采用BandScan分析胶片灰度值。
1.6 统计学方法

2 结果
2.1 各组大鼠FPG、FINS与IRI水平变化比较
表1示,治疗结束与N组比较,其他各组大鼠FPG、FINS与IRI明显升高(P<0.05或P<0.01);与M组比较,p-EA组、EA组、p-EA+b组与CSF组大鼠FPG、FINS和IRI均有不同程度降低(P<0.05或P<0.01);与EA组比较,p-EA组大鼠的FINS与IRI降低(P<0.05),EA+b组FPG、FINS与IRI升高(P<0.05), p-EA+b组大鼠的FPG与IRI升高(P<0.05);与EA+b组比较,p-EA与CSF组大鼠的FPG、FINS和IRI降低(P<0.05),p-EA+b组大鼠的FINS与IRI升高(P<0.05);与CSF组比较,p-EA+b组大鼠的FPG、FINS与IRI升高(P<0.05)。

表1 各组大鼠FPG、FINS、IRI水平比较
2.2 各组大鼠下丘脑Aβ42与p-Tau表达比较
图2示,第16周电针治疗结束时,黑色箭头所示棕黄色或棕褐色细胞膜是各组大鼠下丘脑Aβ42、p-Tau的阳性表达。N组与p-EA组大鼠下丘脑见极少量棕黄色或棕褐色淡染的阳性细胞;EA组、p-EA+b组与CSF组大鼠下丘脑偶见棕黄色或棕褐色淡染的阳性细胞;M组、EA+b组棕黄色或棕褐色阳性表达聚集数量多,着色深。

图2 各组大鼠下丘脑Aβ42与p-Tau免疫组织化学(×400)
表2示,M组、p-EA组、EA组、EA+b组、p-EA+b组、CSF组大鼠Aβ42、p-Tau的阳性表达明显高于N组(P<0.05或P<0.01); p-EA组、EA组大鼠Aβ42、p-Tau的阳性表达低于M组、EA+b组、CSF组(P<0.05或P<0.01); EA组与p-EA组大鼠之间Aβ42、p-Tau的阳性表达差异无统计学意义;p-EA+b组与CSF组大鼠Aβ42阳性表达差异无统计学意义。
表2 各组大鼠下丘脑Aβ42、p-Tau平均光密度比值及下丘脑GSK-3α、GSK-3β蛋白表达比较
2.3 各组大鼠下丘脑GSK-3α和GSK-3β蛋白表达比较
表2图3示,与N组比较,其他各组大鼠下丘脑GSK-3α、GSK-3β蛋白表达增加(P<0.05或P<0.01);与M组比较,p-EA、EA组和p-EA+b组大鼠下丘脑GSK-3α、GSK-3β蛋白表达减少(P<0.05或P<0.01),CSF组大鼠GSK-3α差异无统计学意义,GSK-3β蛋白表达减少(P<0.05);与EA组比较,p-EA组大鼠下丘脑GSK-3α、GSK-3β蛋白表达减少(P<0.05),EA+b组、p-EA+b组CSF组大鼠下丘脑GSK-3α、GSK-3β蛋白表达增加(P<0.05);与EA+b组比较,p-EA组大鼠下丘脑GSK-3α(P<0.05),p-EA+b组、CSF组大鼠下丘脑GSK-3β蛋白表达减少(P<0.05);与CSF组比较,EA+b组和p-EA+b组大鼠下丘脑GSK-3α、GSK-3β蛋白表达减少(P<0.05)。
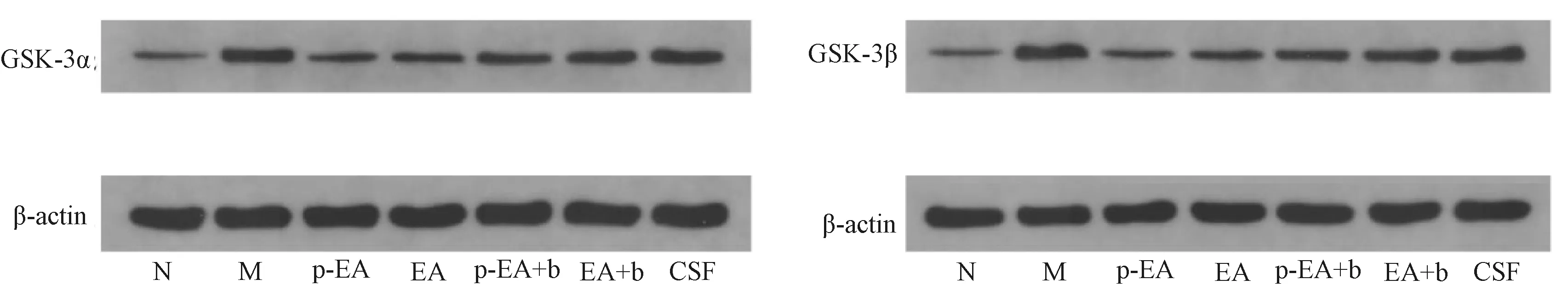
图3 各组大鼠下丘脑GSK-3α和GSK-3β蛋白表达电泳图
3 讨论
胰岛素与大脑的生物活性、神经结构和生理功能密切相关,对中枢神经系统认知功能有着重要影响,胰岛素相关信号分子传导异常是IR发生的关键[13]。IR时,由胰岛素介导的神经能量代谢出现异常引起神经元糖代谢紊乱,从而导致神经元功能障碍及中枢神经系统疾病的发生[14]。
本研究依据中医针灸“治未病”理论,以足三里、关元、丰隆与百会四穴配伍,旨在培补先天之本、后天气血生化之源的同时,祛痰消脂、疏通脑络。研究中预防组受试动物在造模的同时给予电针治疗,以期通过电针干预激发受试动物机体内在的抗病能力,预防IR与IR相关的认知功能损害,强调电针早期干预的预防效应。
GSK3是PI3K/Akt信号通路的生理底物,通过负反馈调节该通路的效应蛋白对IR的发生发展有重要影响。GSK-3α和GSK-3β是GSK3两种形式的异构体。活化的GSK-3a可以激活APPγ分泌酶使得Aβ沉积增加[15-16],GSK-3β会造成tau蛋白过度磷酸化并导致神经纤维缠结;此外,GSK-3β通过提高胰岛素受体底物的丝/苏氨酸磷酸化水平来抑制胰岛素受体对胰岛素受体底物的酪氨酸磷酸化,通过抑制胰岛素信号传导加重IR[17-18]。因此,GSK-3α与GSK-3β的活化是IR与认知功能损害共同的病理改变。
本研究中,M组、EA+b组和p-EA+b组大鼠下丘脑GSK-3α与GSK-3β蛋白表达增加,这与其下丘脑中Aβ42与p-Tau阳性表达聚集数量多、着色深的结果一致。同时,这3组受试动物外周血FPG、 FINS及IRI水平升高。电针治疗后,p-EA组、EA组外周胰岛素抵抗程度显著降低,下丘脑Aβ42与p-Tau阳性表达减少,GSK-3α与GSK-3β蛋白表达降低,且p-EA组治疗效果优于EA组, p-EA组与EA组p-Tau阳性表达结果无明显差异。在中枢微量注入PI3K抑制剂LY294002的条件下,电针防治效应被阻断,EA+b组、p-EA+b组大鼠的FPG、 FINS与IRI升高,Aβ42与p-Tau阳性表达聚集数量多、着色深,且GSK-3α与GSK-3β蛋白表达增加,说明电针对IR大鼠认知功能损伤的防治效应或可通过PI3K/Akt信号通路实现。这与我们前期研究中发现,电针调节PI3K/Akt信号通路相关分子活性,从而促进改善IR大鼠学习记忆能力的实验结果相一致。然而CSF组大鼠在经过电针治疗后,下丘脑GSK-3α与GSK-3β蛋白表达增加的同时,Aβ42与p-Tau阳性表达聚集数量减少、着色浅,且外周血FPG、 FINS及IRI水平降低。考虑PI3K/Akt信号通路不是参与针灸防治IR认知功能损害的唯一途径,因此电针防治胰岛素抵抗相关认知功能损伤的作用机制值得更进一步的研究。

