黄龙止咳颗粒对咳嗽变异性哮喘大鼠气道高反应、气道炎症及气道重塑的干预效应*
刘菊华,辜建伟,胡 泉,刘 磊,涂 翔,何成诗△
(1.成都中医药大学附属医院, 成都 610000; 2.川北医学院附属医院, 四川 南充 637000)
咳嗽变异型哮喘(cough variant asthma,CVA)是一种特殊类型的哮喘,临床表现以反复发作性、刺激性咳嗽为主,占我国慢性咳嗽患者的75%[1]。其发病机制复杂,国内外研究证实TH1/TH2 细胞免疫失衡是其病因之一[2-3],而气道高反应及气道重塑是其病理特征[4-5]。目前对CVA的治疗首选吸入性糖皮质激素、支气管舒张剂及白三烯受体拮抗剂,疗程8周以上。但是CVA的控制水平并不理想,54%的CVA最终进展为典型的支气管哮喘[6]。因此寻找新的安全有效的治疗方式对CVA的治疗有着深远影响。
中医在治疗CVA方面有着悠久历史,“风邪”被认为是CVA发生及演变的主要致病因素,因此CVA治疗以疏风宣肺、缓急解痉、利咽止咳为主。黄龙止咳颗粒(曾用名:敏咳煎、玄龙止咳颗粒。处方组成:麻黄、地龙、蝉蜕、五味子、防风、钩藤)是何成诗教授的经验方。本方重在滋阴宣肺、祛风止咳。在长达10余年的临床运用中,黄龙止咳颗粒对CVA疗效显著,临床前期研究表明,黄龙止咳颗粒能改善CVA患者的临床症状及小气道功能[7-8]。在此本文将以CVA大鼠为研究对象,进一步研究黄龙止咳颗粒对CVA大鼠气道高反应、气道慢性炎症、气道重塑的干预效应,及其对TH1/TH2细胞免疫失衡的调节作用。本研究已通过成都中医药大学附属医院实验动物伦理委员会审查(审查编号2019DL-007)。
1 材料与方法
1.1 动物
SPF级健康雄性SD大鼠50只,6 周龄,体质量 140~160 g,购自成都达硕实验动物有限公司,动物许可证号SCXK(川)2015-030。
1.2 药物
黄龙止咳颗粒处方组成:麻黄、五味子、防风、钩藤、地龙、蝉蜕,购自成都中医药大学附属医院中药房。地塞米松片(批号H44024469,规格0.75 mg×100片),中国广东华南药业集团有限公司;卵清蛋白(ovalbumin ,OVA,批号A5503),美国Sigma 公司;氢氧化铝(批号S30353),中国上海源叶生物科技有限公司;乙酰胆碱(Acetylcholine, Ach,批号RDD043),美国Sigma公司;过碘酸雪夫(Periodic Acid-Schiff ,PAS,批号WB1008),中国上海经科化学科技有限公司;Masson三色染色试剂盒(批号AG1345-8), 中国上海梵态生物科技有限公司。
1.3 主要试剂及仪器
白介素4(Interleukin-4,IL-4)试剂盒(批号M4000B), 美国R&D公司; γ干扰素(Interferon-γ,IFN-γ)试剂盒(批号MIF00),美国R&D公司;转化生长因子β(Transforming growth factor-β,TGF-β)试剂盒(批号MB100B),美国R&D公司;BA200Digital型数码三目摄像显微摄像系统,德国麦克奥迪实业集团有限公司;FOT100型大鼠肺功能仪,美国eSpira公司。
1.4 动物分组
大鼠喂养于成都中医药大学SPF级动物实验室,饲养环境:12~12 h昼夜交替,保持动物自由饮水、进食,保持室温23~25 ℃。适应性喂养一周后,将大鼠随机分为空白组、模型组,中药组,西药组,联合组,每组各10只大鼠。本实验已通过成都中医药大学附属医院实验动物伦理委员会审查(审查编号:2019DL-007)。
1.5 动物模型的建立及干预
图1示,适应性喂养1周后,将大鼠按随机数字表法分为空白组、模型组、中药组、西药组、联合组每组各10只。参考经典动物模型方法[9-10]做适当改良复制CVA模型:(1)基础致敏阶段:除空白组用生理盐水 1 mL外,其余各组按照每只大鼠1%卵清蛋白(ovalbumin,OVA)+氢氧化铝10 mg 1 mL,于 0、7天分别在两后足跖、腹股沟、腰、背、颈部共取10处,每处皮下注射0.05 mL,同时腹腔注射0.5 ml;(2)局部激发阶段:除空白组雾化吸入生理盐水外,其余各组从第15天开始雾化吸入1%OVA悬混液30 min/次,每日1次,连续激发21 d。激发后出现以下表现可初步认为模型成功,如烦躁不安、打喷嚏、喘息、呼吸加快等症状;(3)药物干预:从第21天开始每次激发前30 min灌胃。中药组参考本实验前期研究[11],根据《中药新药临床研究指导原则》,按照临床用药量的6倍给予黄龙止咳颗粒1.15 g/ml灌胃;西药组参考文献[10]地塞米松片 2.5 mg/kg;联合组给予黄龙止咳颗粒+地塞米松,剂量同前;模型组及空白组等量生理盐水灌胃,连续14 d。
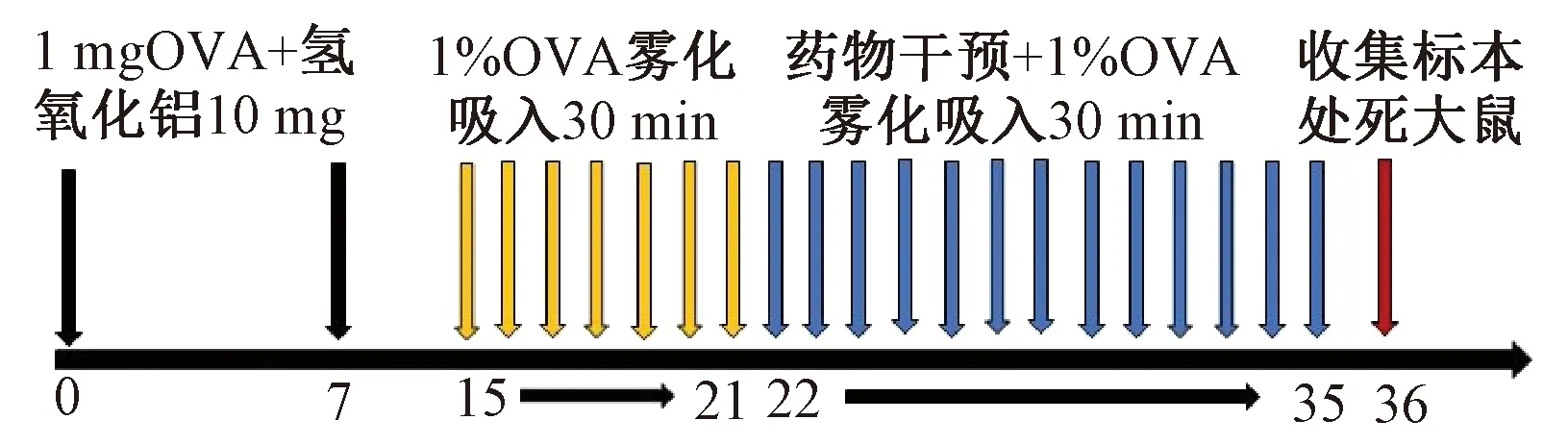
图1 OVA诱导CVA大鼠模型及黄龙止咳颗粒干预CVA大鼠流程示意图
1.6 取材
实验第36天,6%水合氯醛0.6 ml/kg腹腔注射麻醉大鼠后气管切开插管。按照以下顺序采集数据及标本:测量气道高反应测验;腹主动脉采血3~5 ml,3000 r/min离心 10 min 后取上清液;收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF);取肺组织10%多聚甲醛固定。
1.7 测量指标
1.7.1 气道阻力测定 将气管留置导管连接大鼠肺功能仪,通气平衡后测气道阻力(airway resistance, AR)作为基础值。依次按浓度梯度吸入10 μl乙酰胆碱(Acetylcholine, Ach)(0,3.125 mg/mL,6.25 mg/mL,12.5 mg/mL,25 mg/mL),记录AR值,以 Ach 浓度为横坐标,AR为纵坐标,绘制反应曲线则表示气道阻力值。
1.7.2 BALF中炎症细胞计数及分类 结扎右主支气管,生理盐水5 ml经气管导管灌洗左肺3次,回收BALF,离心后取上清液保存。沉淀细胞经1 ml PBS 混匀后取 20 μL 使用细胞计数仪对细胞总数进行计数。取细胞悬液,经瑞氏-吉姆萨染色后显微镜下进行细胞分类计数(分为2类:中性粒细胞、嗜酸性粒细胞)。每张切片于40倍下观察大体病变,在400视野下随机选取若干个不同视野,计数200个细胞中中性及嗜酸性细胞所占百分率。
1.7.3 肺组织形态学检查 新鲜肺组织10%多聚甲醛固定,石蜡包埋切片后行常规苏木精-伊红(hematoxylin-eosin, HE)染色,观察气道形态学改变、过碘酸雪夫(periodic acid-schiff,PAS)染色观察气道杯状细胞计数,Masson三色染色法观察肺组织纤维含量。采用BA200Digital数码三目摄像显微摄像系统对切片进行图像采集,每张切片先于40倍下观察全部组织大体病变,选择要观察的区域采集200或400倍图片保存观察具体病变。每张切片选取3个视野观察,杯状细胞计数每个视野计数后取均值作为该切片的平均细胞数;纤维含量采用Image-Pro Plus 6.0图像分析系统测定所采集图像的光密度和面积,计算平均光密度,再使用3张图像的平均光密度,计算平均数作为该样本组织中的纤维含量。
1.7.4 血清及BALF中IL-4, IFN-γ,TGF-β含量 采用双抗夹心酶联免疫吸附实验(Enzyme linked immunosorbent assay, ELISA),检测大鼠血清及BALF中 IL-4、IFN-γ、TGF-β含量,操作步骤参考试剂盒说明书,按照复温、加样、配液、洗涤、显色、终止、测定的顺序进行。
1.8 统计学方法

2 结果
2.1 各组大鼠一般情况观察
CVA模型组雾化吸入OVA激发后出现呼吸加快、咳嗽、打喷嚏、流涕、抓耳挠腮、躁动不安等表现。未激发时模型组活动较空白组减少,进食减少,毛色不如正常大鼠光滑。中药组、西药组及联合组也有不同程度上述表现,但症状较模型组轻微。
2.2 各组大鼠吸入不同浓度Ach后的气道阻力值及阻力曲线图
表1图2示,通过测量大鼠吸入不同浓度Ach后的气道阻力值来反映气道高反应。CVA大鼠气道阻力在基线水平时稍高于正常大鼠,但差异无统计学意义(P>0.05)。吸入不同浓度Ach后,各组大鼠的气道阻力均逐渐增加,CVA大鼠的气道阻力显著高于空白组(P<05)。在Ach浓度为3.125至12.5 mg/mL时,各治疗组气道阻力均低于模型组(P<0.05),联合组的气道阻力在各治疗组中最低(P<0.01),中药组及西药组的气道阻力比较差异无统计学意义(P>0.05)。在Ach浓度增加为25 mg/ml时,联合组、西药组、中药组及模型组气道阻力依次递增,组间比较差异有统计学意义(P<0.01)。

表1 各组大鼠吸入不同浓度Ach的气道阻力值

图2 各组大鼠吸入乙酰胆碱后的气道阻力曲线图
2.3 各组大鼠BALF中炎症细胞计数及分类结果
表2图3示。模型组BALF中炎症细胞总数、中性粒细胞百分率及嗜酸性细胞百分率均较空白组明显升高(P<0.01)。经药物治疗后,联合组、西药组及中药组BALF中炎症细胞均较模型组有不同程度减少(P<0.05或P<0.01),但仍高于空白组(P<0.05)。其中联合治疗组炎症细胞计数在各治疗组中最低(P<0.01),中药组稍高于西药组,但组间比较差异无统计学意义(P>0.05)。

表2 各组大鼠BALF中炎症细胞计数及分类

图3 瑞氏-吉姆萨染色显示各组大鼠BALF中嗜酸性粒细胞及中性粒细胞(标尺:10 μm;红色箭头:中性粒细胞; 蓝色箭头:嗜酸性粒细胞)
2.4 各组大鼠肺组织形态学改变
2.4.1 常规HE染色 图4示,空白组肺组织各级支气管分支结构正常,仅有少量炎性细胞浸润,气道壁薄,厚度均匀。模型组部分气道管壁增厚,管腔狭窄,管腔内黏液分泌增加,支气管周围、肺间质及肺泡腔可见大量炎性细胞浸润(箭头所指),局部区域肺泡被炎性细胞填充;各药物治疗组炎症细胞浸润较模型组均有不同程度减轻,其中联合用药组炎症细胞浸润改善最明显。

图4 HE染色显示各组大鼠肺组织形态学改变 (HE ×200)(箭头为炎症细胞)
2.4.2 PAS染色 图5示,大鼠气道黏膜中杯状细胞染色后呈紫红色。与空白组比较,模型组杯状细胞的数量明显增多(21.65±4.16 vs 63.76±7.92,P<0.01)。各治疗组均可不同程度地减少杯状细胞增生情况,杯状细胞计数从高至低依次为中药组(55.28±12.16)、西药组(51.82±6.60),联合组杯状细胞计数在治疗组中最低(P<0.01),但仍高于空白组(31.68±6.09 vs 21.65±4.16,P=0.01)。
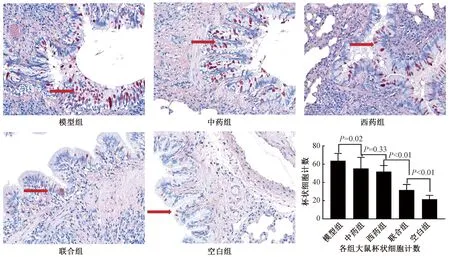
图5 PAS染色显示各组大鼠肺组织杯状细胞 (×400)(箭头所指为杯状细胞)
2.4.3 Masson三色染色法 图6示,大鼠气管上皮下胶原纤维染色后呈蓝色,肌纤维呈红色。与空白组比较,模型组存在明显的上皮下胶原纤维沉积,肌成纤维增生,其纤维组织光密度值高于空白组(39.44±4.76 vs 31.27±3.34,P<0.01)。各治疗组均可不同程度延缓上皮下胶原沉积,其纤维组织光密度值由高至低为中药组(39.11±3.66)、西药组(38.73±3.53)、联合组(35.73±3.29)。在观察时间内,仅联合组纤维组织光密度值较模型组显著降低(P=0.03),但仍高于空白组(P=0.01)。
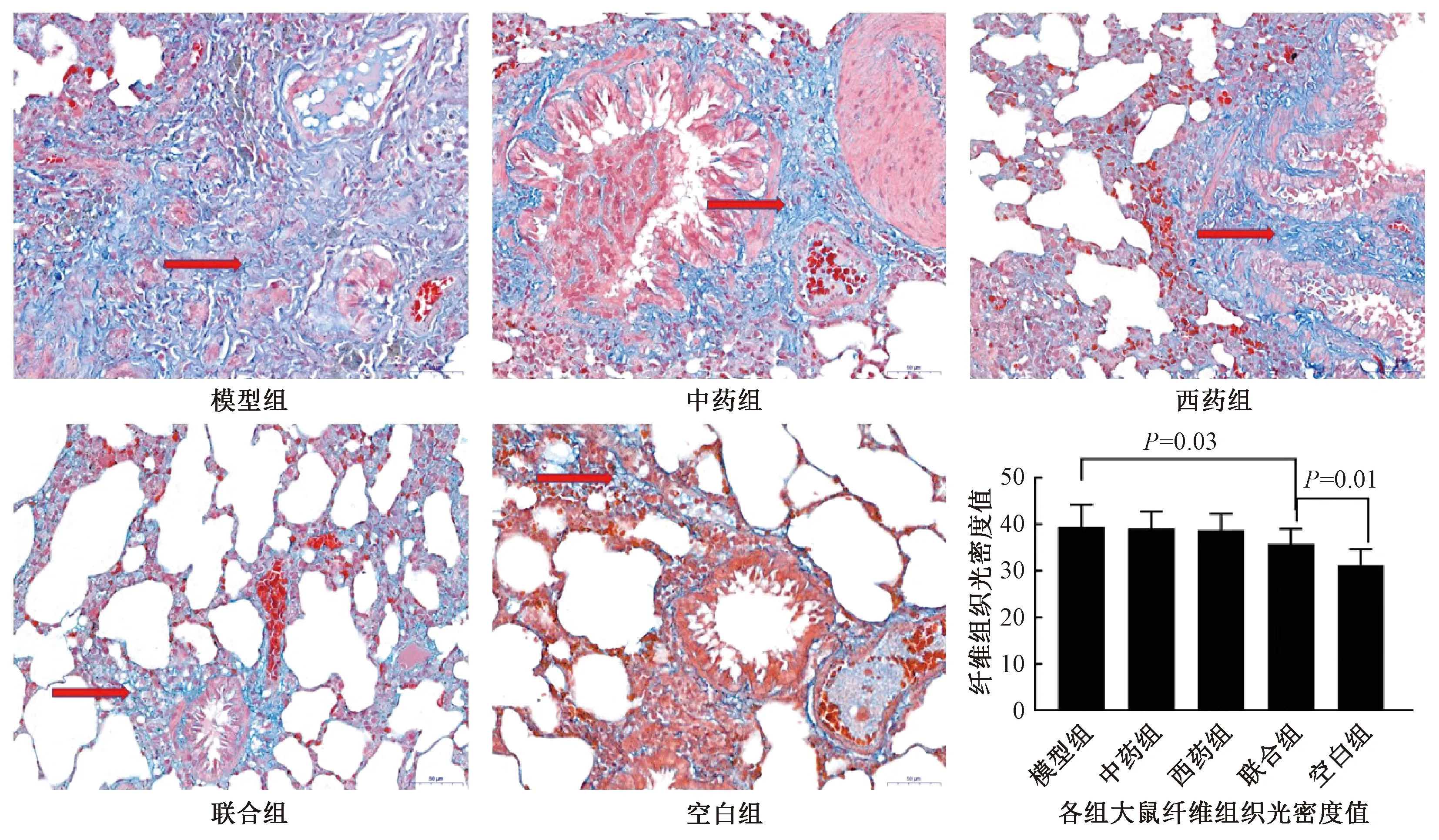
图6 Masson三色染色法显示各组大鼠纤维组织 (×400)(箭头所指为纤维组织)
2.5 各组大鼠BALF及血清中IL-4、IFN-γ及IGF-β含量比较
表3示,与空白组比较,模型组血清及BALF中IL-4和IGF-β含量明显增加(P<0.05),IFN-γ含量降低(P<0.01)。各治疗组均可不同程度地降低CVA大鼠血清及BALF中IL-4和IGF-β含量(P<0.05),增加IFN-γ含量(P<0.05)。各治疗组中,联合组血清及BALF中IL-4、TGF-β含量最低(P<0.05),IFN-γ含量最高(P<0.05),西药组及中药组次之。
表3 各组大鼠血清及支气管肺泡灌洗液中IL-4、IFN-γ及IGF-β含量比较
3 讨论
CVA作为一种特殊类型的哮喘,其主要的病理生理改变与典型哮喘一致,主要表现为气道高反应,气道慢性炎症反应及不同程度的气道重塑。CVA的发病机制目前尚不清楚,可能与遗传、免疫及神经反射等多方面因素相关。近年来研究发现,TH1/TH2 免疫失衡参与了该病的发生发展。THl细胞主要释放 IFN-γ、白介素-2(Interleukin-2, IL-2)、白介素3(Interleukin-3,IL-3)等细胞因子,其中以IFN-γ为代表,对CVA有保护作用;TH2细胞主要分泌IL-4、白介素-5(Interleukin-5,IL-5)、白介素-13(Interleukin-13,IL-13)等细胞因子,以IL-4为代表,可促进CVA发病和气道炎症形成[12-13]。在本实验中,CVA大鼠吸入Ach后气道阻力较空白组明显增加。同时BALF中炎症细胞总数、中性粒细胞百分比及嗜酸性粒细胞百分比均较正常大鼠明显增加,肺组织形态学检查提示,CVA大鼠肺组织存在明显炎症细胞浸润、杯状细胞增生、上皮下胶原纤维沉积,因此本实验所复制的CVA大鼠模型较为成功。
CVA的一线治疗药物吸入性糖皮质激素可通过降低CVA患者血清IL-4水平,调控TH1/TH2细胞免疫失衡,从而减轻气道炎症反应,缓解CVA临床症状[14]。何成诗认为,CVA的慢性咳嗽具有反复性、痉挛性、发作性的特点,结合中医理论“风者,善行而数变”“风为阳邪,易化燥伤阴”和国医大师晁恩祥“风盛挛急”的理论,故CVA的发病与“风”关系密切,治疗应从“风”论治,以祛风、恢复肺的宣降功能为主。此外还认为目前时疫流行改变、雾霾严重,肺司呼吸,肺阴易损,因此四季咳嗽多初起即有肺燥阴伤,且久咳伤津化燥、久病入络,易变生他病。肺为娇脏,喜润而恶燥,喜清肃而不耐寒热,故治咳应重在滋阴宣肺、祛风止咳,据此研制出“黄龙止咳颗粒”。在本实验中,中药组大鼠气道高反应、气道炎症细胞计数均较模型组减轻,因此黄龙止咳颗粒对CVA大鼠疗效确切。各治疗组大鼠血清及BALF中IL-4水平均有不同程度降低,IFN-γ水平有不同程度增加,中药组与西药组疗效无显著差异,联合治疗组疗效最为显著。因此黄龙止咳颗粒可通过调节INF-γ及IL-4水平调控TH1/TH2细胞免疫失衡,减轻气道炎症反应,达到治疗CVA的目的。对于其具体分子生物学机制可能与黄龙止咳颗粒处方中的麻黄、五味子及地龙具有免疫调节功能相关。麻黄浓缩液提取物麻黄-9905具有免疫抑制作用,一方面可以使免疫器官萎缩,减少T 淋巴细胞形成,另一方面可以调整T淋巴细胞亚群细胞比例[15]。五味子多糖具有免疫兴奋作用,可促进T淋巴细胞转化[16];地龙提取物可有效抑制OVA诱发的哮喘小鼠肺中核因子κB(nuclear factor kappa-B,NF-κB,NF-κB)信号激活,并减轻气道高反应和TH2型炎症反应[17]。
气道重塑是CVA进展为难治性哮喘的病理基础,其发病主要与气道慢性炎症损伤及异常修复相关。近年来研究证实,TGF-β参与气道重塑的发生及进展[18]。一些中药可通过抑制TGF-β的表达延缓气道重塑。如玉屏风散可通过降低TGF-β含量减少上皮间质转化,从而延缓粉尘刺激引起到气道重塑[19],苏黄止咳胶囊(处方组成:麻黄、紫苏叶、地龙、枇杷叶、紫苏子、蝉蜕、前胡、牛蒡子、五味子),也可通过减少OVA诱导CVA小鼠血清及BALF中TGF-β含量,减少肺组织TGF-β表达而减轻CVA小鼠气道杯状细胞增生及上皮下胶原沉积,延缓气道重塑[10]。黄龙止咳颗粒处方组成与苏黄止咳胶囊相似。在本实验中,黄龙止咳颗粒可减少CVA大鼠气道杯状细胞增生。但是本实验组中,各治疗组上皮下胶原沉积虽有不同程度降低,但仅联合组较模型组有显著降低,笔者推测与本实验观察时间较短相关。因此本实验在后续研究中,将延长观察时间继续研究黄龙止咳颗粒对CVA气道重塑的干预效应。此外,有关黄龙止咳颗粒调控TH1/TH2细胞免疫失衡的具体分子生物学机制及其所涉及的微观改变是否存在剂量-效应关系,在本实验的后续实验中也将进一步进行论证。
总之,黄龙止咳颗粒可通过调控TH1/TH2细胞免疫失衡,降低 CVA气道高反应,减轻气道炎症反应,延缓气道重塑。黄龙止咳颗粒对CVA的疗效与糖皮质激素相当,在CVA的治疗中可作为糖皮质激素的替代用药,若与糖皮质激素联合用药疗效更优。

