饥饿再投喂对花鲈幼鱼生理生化指标的影响
胡玲珠, 周宣羽, 张 顺, 徐善良,2*
饥饿再投喂对花鲈幼鱼生理生化指标的影响
胡玲珠1, 周宣羽1, 张 顺1, 徐善良1,2*
(1.宁波大学 海洋学院, 浙江 宁波 315832; 2.应用海洋生物技术教育部重点实验室, 浙江 宁波 315832)
为了研究饥饿再投喂对花鲈幼鱼生理生化指标(肝指数、摄食率、血液生理生化指标、肌肉成分)的影响, 设S5、S10、S15共3个实验组, 分别在饥饿5、10、15d后, 恢复投喂至第35天, 对照组S0持续正常喂食, 分别于饥饿结束时、恢复投喂5d及实验结束时取样. 结果表明: (1)肝指数在饥饿胁迫后严重下降, S15组下降至初始值的40%左右. (2)实验组恢复投喂时的摄食率较S0组下降了10.8%~24.0%, 恢复投喂后有所回升. (3)花鲈血液生理指数受到饥饿胁迫的影响显著, 3个饥饿实验组的白细胞、红细胞数目和血红蛋白含量均大幅度下降; 反之, 蛋白含量都有一定程度的增加; 恢复投喂后的各指标基本能恢复到正常水平. (4)饥饿胁迫对灰分无显著影响. 粗脂肪表现出下降趋势, 但实验结束时, 除S15组外都能恢复到正常水平. 粗蛋白在S15组才出现下降, 恢复投喂后能迅速恢复到对照组水平. 分析认为, 在花鲈饥饿过程中肌肉脂肪的调动先于肌肉蛋白, 而恢复投喂后, 肌肉蛋白的恢复先于肌肉脂肪.
花鲈; 饥饿; 再投喂; 肝指数; 血液指标; 肌肉成分
在鱼类养殖过程中, 经常会遇到因食物短缺而遭受饥饿胁迫的情况, 在自然野生环境中此状况更加常见. 饥饿胁迫对鱼类生理生态的影响涉及到多方面, 饥饿可以引起鱼类代谢、组织结构、繁殖、肌肉组成成分、体内酶活性和血液常规指标、鱼体能值等的变化[1-4]. 一旦恢复进食后, 某些鱼类有时能出现补偿生长现象, 而且与其饥饿胁迫时间和恢复摄食时间长短有关. 不同鱼类不同饥饿处理均会出现不同的补偿生长强度, 一般可分为部分补偿生长、完全补偿生长、超补偿生长[5-6]. 完全补偿生长的鱼类恢复摄食后, 其体重增加与持续充足摄食的鱼体重基本持平, 超补偿生长鱼类体重增加程度甚至比持续充足摄食的鱼类还要高, 有关这方面的研究已深入到各个层面[7-10].

1 材料与方法
1.1 实验材料
实验用花鲈幼鱼驯养在宁波大学曹光彪科技楼的鱼类养殖实验槽内, 体长12~17cm, 体质量62~96g. 驯养期间盐度22, 水温18~20℃.
1.2 实验设计
实验设S5、S10、S15共3个实验组, 分别为在饥饿5、10、15d后, 再恢复正常投喂, 各组总实验时间均为35d. S5组为饥饿处理5d后, 恢复饱食投喂30d; S10组为饥饿处理10d后, 恢复饱食投喂25d; S15组为饥饿15d后, 恢复饱食投喂20d. 并设对照组(持续饱食投喂), 每组均设3平行, 每个平行18尾幼鱼.
1.3 实验方法
实验在室内12个200L水槽中进行. 对照组及恢复投喂后于每天饱食投喂2次(7:00和17:00), 投喂山东产“升索”海水鱼7#浮性饲料. 每日吸污换水, 保持水质理化指标稳定. 试验盐度20, 水温18~20℃, pH 7.8~8.1, 溶解氧7mg·L-1以上, 氨氮0.5mg·L-1以下, 亚硝酸氮0.05mg·L-1以下.
实验组分别在饥饿结束、恢复投喂5d以及实验结束时取样, 对照组于实验开始和结束时取样. 取样时, 在每个平行桶随机取2尾, 先称鱼质量(精确至0.01g), 再于尾静脉处抽血, 然后置冰盘中解剖, 取其肝脏并准确称量(至0.001g), 肝脏与鱼体样品保存在-20℃冰箱中待测, 血液立即送检.
血液生理指标测定: 用抗凝管抽血1mL送医院, 采用SK9000全自动血细胞分析仪, 对血液常规指标(白细胞、红细胞和血红蛋白等)进行测定. 血液生化指标测定: 非抗凝血液于4℃放置12h后离心取血清, 采用日立H-7600全自动生化分析仪对总蛋白、白蛋白、球蛋白、甘油三酯等4项生化指标进行测定. 鱼体样品肌肉成分测定: 分别采用凯氏定氮法(GB/T 6432-1994)测定粗蛋白含量; 采用索氏乙醚抽提法(GB/T 6433-2006)测定粗脂肪含量; 采用连续灰分测定仪, 550℃灼烧6h (GB/T 6438-2007)测定灰分含量.
1.4 数据统计分析
所有数据均用平均值±标准差(±SD)表示, 利用SPSS 19.0对所有数据进行方差分析, 并用Duncan’s法进行组间差异显著性分析. 定义<0.05为差异显著. 相关计算公式如下:
式中:为肝指数, %;为肝质量, g;为体质量, g;为摄食率, %;d为日摄食量, g;j为体质量下降率, %;e为饥饿结束时体质量, g;s为实验初始体质量, g;h为体质量恢复率, %;f为恢复投喂5d时体质量, g;为增重率, %.
2 结果与分析
2.1 饥饿及再投喂对花鲈肝指数的影响
饥饿及再投喂下花鲈的体质量、肝质量、肝指数等数据见表1. 饥饿处理组体质量随饥饿时间延长而下降, 皆显著低于初始体质量(<0.05), 平均下降幅度6.25%~22.80%, S15组下降最显著(<0.05), 是S5组3倍以上; 在恢复投喂5d后, 体质量均有所增加, 恢复率4.52%~18.71%, 饥饿时间越长恢复率越大, S15组恢复水平最显著; 15d投喂结束时, 对照组增重显著, 增重率达到21.30%, 3个饥饿处理组体质量虽然均超过初始体质量, 但增重率显著低于对照组, 仅为对照组1/2~1/6. 肝质量和肝指数的变化规律相似, 饥饿5~15d后, 肝质量下降率达到43.3%~72.2%; 饥饿5d后, 肝指数就迅速减小, 下降率就达32.9%, 相较于体质量的下降幅度, 肝指数对饥饿反应较敏感; 饥饿10d后的下降率54.9%, 15d后的肝指数下降了68.9%, 下降水平最为显著; 恢复投喂5d后, S10和S15组的肝指数值恢复迅速, 恢复幅度显著达到61.1%~ 73.6%; 但投喂结束后, 仅S0对照组肝指数增长10%, 3个饥饿组均未恢复到起始水平, 且随饥饿时间延长恢复越差(<0.05).
注: 同行数据上标小写字母相同表示差异不显著(>0.05), 字母不同表示差异显著(<0.05); 同数据上标大写字母相同表示差异不显著(>0.05), 字母不同表示差异显著(<0.05).
2.2 饥饿再投喂对花鲈摄食率的影响
饥饿再投喂对花鲈的日摄食率影响如图1所示. 由图可见, 恢复投喂5d后, S15饥饿组的摄食率较S0有显著下降, 摄食率由1.67%降至1.37%, 约下降了18%, S5组下降了11%, 而S10组不降反升, 摄食率提高了10%. 实验结束时, 除S15组摄食率略低于对照组, S5和S10组恢复正常, 与对照组无显著性差异(>0.05).
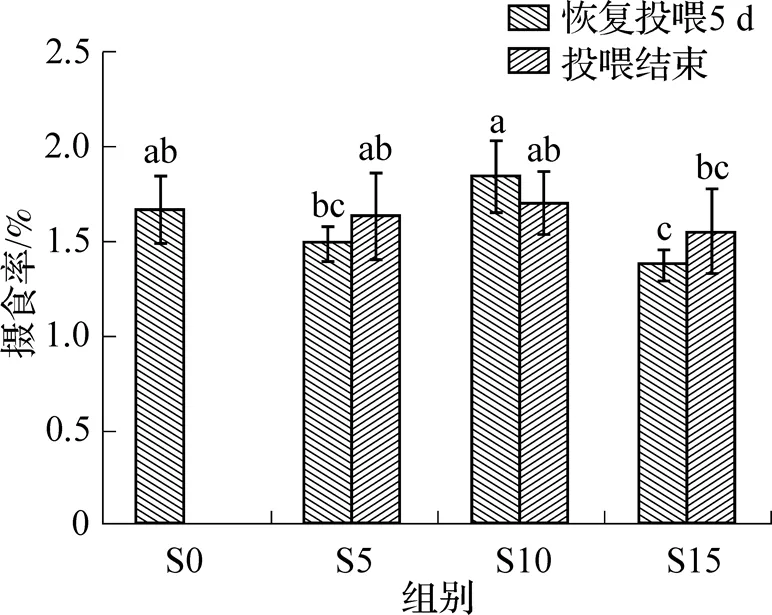
图1 花鲈幼鱼饥饿再投喂组与对照组的摄食率比较
2.3 饥饿再投喂对花鲈血液生理指标的影响
饥饿再投喂对花鲈血液生理指标影响见表2. 由表可见, 血液的白细胞对饥饿极其敏感, 饥饿5d后花鲈的白细胞数量急剧下降至正常的20.6%, 饥饿10d后仅为正常鱼的6.7%, 饥饿15d后降到约4.7%. 恢复投喂5d后, S5和S10组已迅速回归正常值, 但S15组仍显著低于正常值, 投喂结束时S15组也能基本恢复到正常值. 饥饿对红细胞数量也有显著影响, 数量变化趋势与白细胞相似. 饥饿5d后, 红细胞数量迅速下降为正常鱼的39.5%, 饥饿10d后降为12.9%, 饥饿15d后约为9.9%. 恢复投喂5d后, S5和S10组基本能恢复正常值, 而S15组仅恢复了约41%水平, 在投喂结束后, 3组都基本恢复到了正常值. 血红蛋白含量对饥饿胁迫响应也较显著, 饥饿5d后降为对照组的35.9%, 饥饿10d后则降到22.7%, 饥饿15d降至17.1%. 恢复投喂5d后, S5和S10组基本恢复到正常水平, 但S15仅恢复了43.8%, 但投喂结束后, 3组也均基本恢复正常. 虽然血红蛋白总量受饥饿胁迫影响, 含量会下降, 但平均红细胞血红蛋白量却随着饥饿而增长, 且随着天数的增长趋于稳定. 重新摄食后,都会逐渐恢复, 最终与对照组无明显差异.

表2 不同饥饿胁迫下及再投喂后花鲈血液生理指标变化
2.4 饥饿再投喂对花鲈血液生化指标的影响
饥饿再投喂对花鲈血液生化指标影响见表3. 由表可见, 血液中的总蛋白、球蛋白、白蛋白在饥饿5、10、15d后都有一定程度的增加, 在恢复投喂后均有下降. 在投喂结束后, S10和S15组的3项指标仍超越了初始值和S0组, 但与正常水平相差不多. 血液中甘油三酯在饥饿5d后略有下降, 但在饥饿10d后显著下降, 为初始值的68%, 饥饿15d后降到46%. 恢复投喂5d后, 甘油三酯含量均显著增加, 其中S15组恢复速度较快. 在投喂结束后, 甘油三酯都基本恢复.
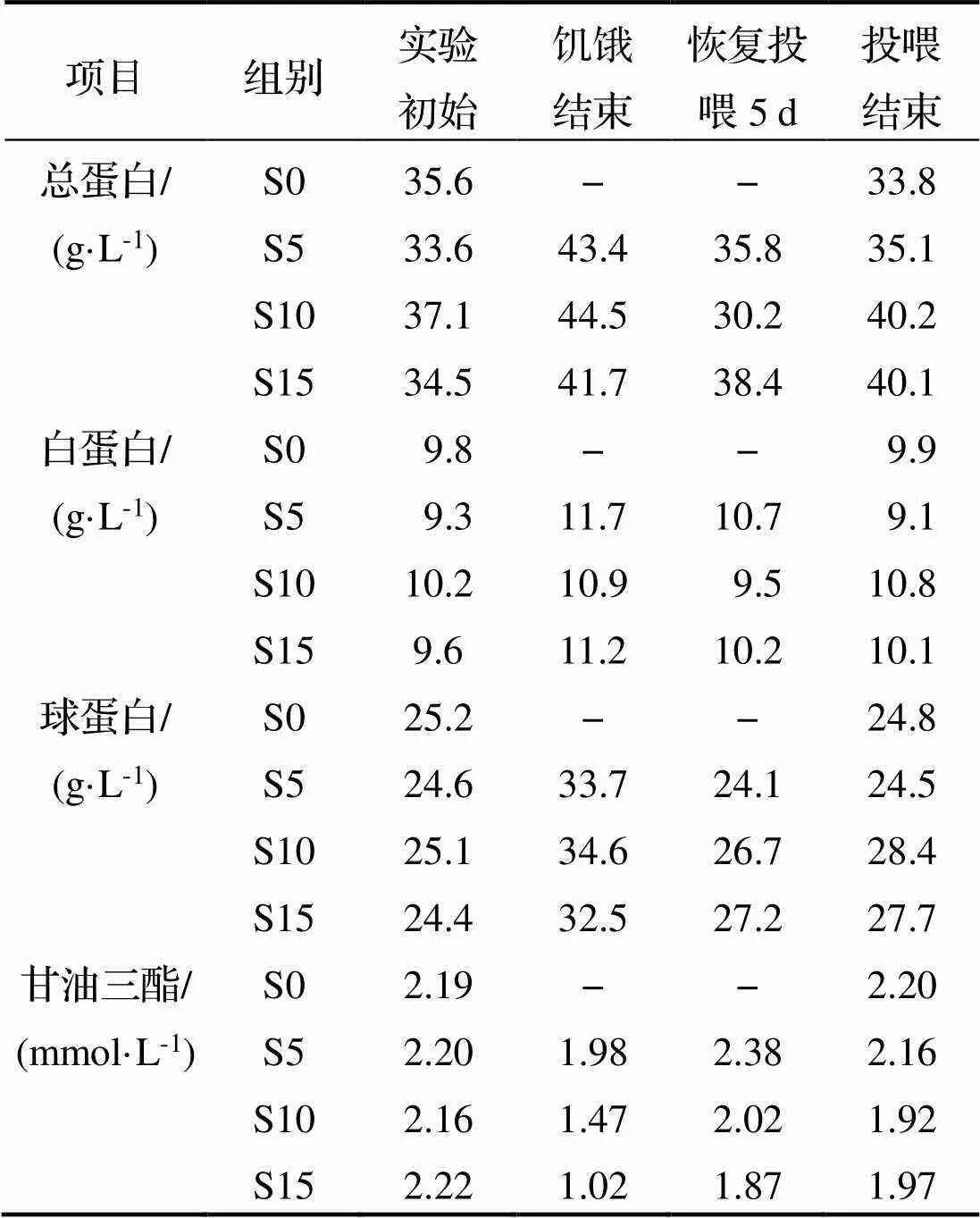
表3 不同饥饿胁迫下及再投喂后花鲈血液生化指标变化
2.5 饥饿再投喂对花鲈肌肉成分的影响
饥饿再投喂对花鲈肌肉成分影响见表4. 由表可见, 饥饿对粗蛋白含量的影响体现在饥饿15d后, 在恢复投喂的5d后均能迅速恢复, 结束投喂时与正常值无显著差异. 粗脂肪含量随饥饿天数的增加表现出持续下降趋势, S10和S15组脂肪含量在恢复投喂5d后继续下降. 投喂结束时, S5和S10组能基本恢复, 但仍显著低于正常水平(<0.05), 而S15与对照组有极显著差异(<0.01). 花鲈肌肉粗灰分在不同饥饿胁迫下无显著变化, 恢复投喂后的粗灰分值与对照组相差不大.
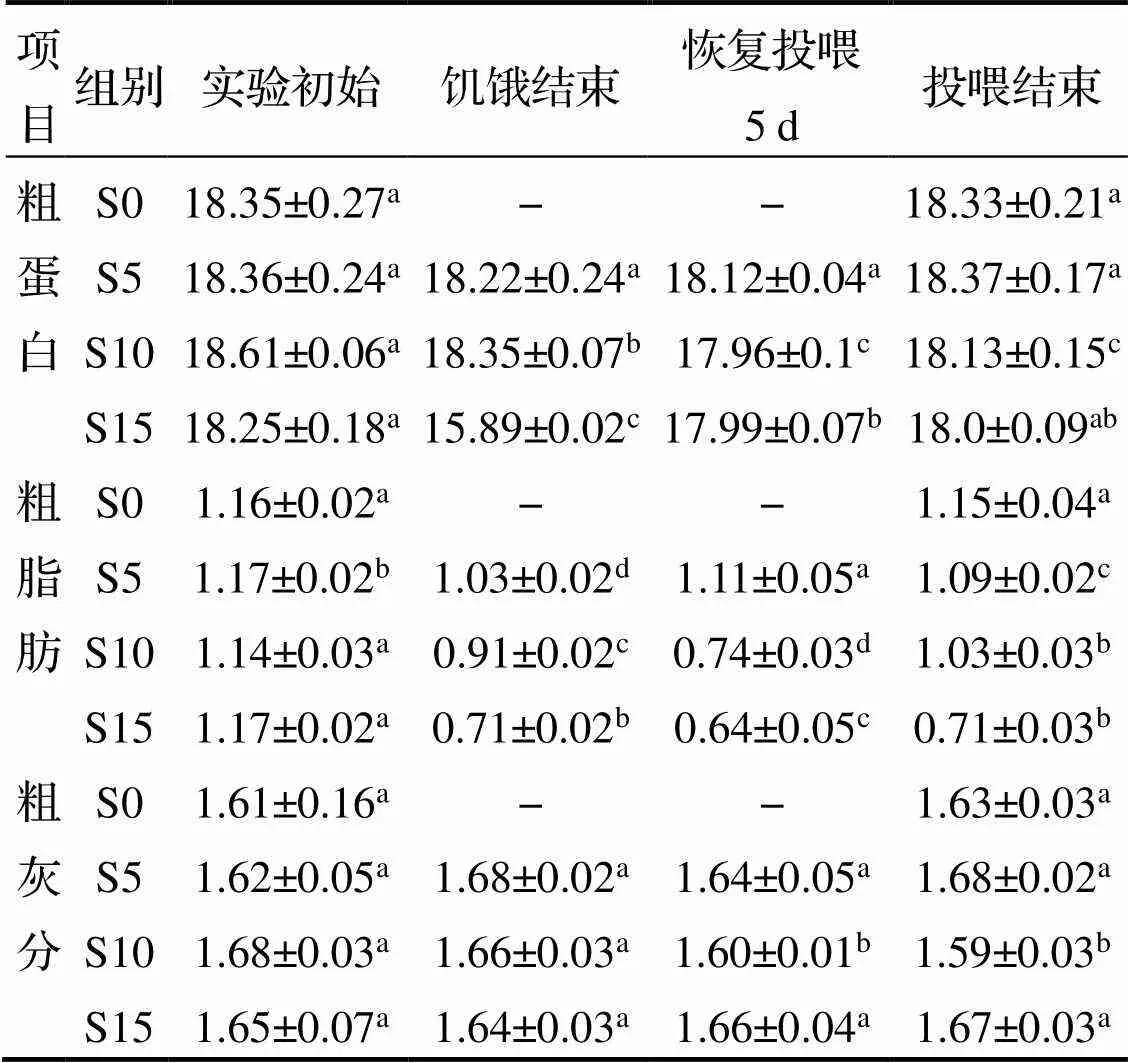
表4 不同饥饿胁迫下及再投喂后花鲈肌肉成分变化 %
注: 同行数据上标小写字母相同表示差异不显著(>0.05), 字母不同表示差异显著(<0.05).
3 讨论
3.1 饥饿再投喂对花鲈肝指数和摄食率的影响

相关研究表明, 摄食率的恢复与饥饿后的补偿生长有密切关系[18]. 在梁拥军等[19]对星斑川鲽()摄食率的研究中发现, 到恢复投喂5d之后, 摄食率开始下降, 随着时间的延长, 摄食率逐渐上升, 接近对照组摄食水平. 本实验发现, S5和S15组在恢复投喂5d后, 摄食率均小于对照组, 而S10组恢复5d的摄食率高于对照组, 这与李耕等[20]对西伯利亚鲟()的摄食率研究的结论相似, 投喂结束后, 实验鲈鱼的摄食率与对照组摄食率水平相近. 由此可见, S10实验组在恢复投喂5d时出现了补偿生长, 花鲈对饲料摄取大大增加, 但饥饿时间过长会对鱼体组织造成伤害, 从而导致摄食率明显降低. 从体质量增重率分析最终实验组均未表现补偿生长.
3.2 饥饿再投喂对花鲈血液指标的影响
在对银鲫()[21]和泥鳅()[22]的饥饿再投喂的实验中发现, 其白细胞数量受饥饿胁迫总体上升, 红细胞数量减少, 血红蛋白含量下降, 红细胞体积变大、脆性增加. 在本实验的饥饿过程中, 花鲈的白细胞数量迅速减少, 饥饿5d后的白细胞数量下降至正常的20.6%. 随着饥饿天数的增加, 白细胞数量持续降低, 这反映了花鲈幼鱼在饥饿状态下, 其免疫能力大大减弱, 与其他相关实验结论不同, 可能与花鲈本身对饥饿胁迫的特殊反应有关. 红细胞和血红蛋白也在饥饿5d后急速下降, 与多数研究结果一致[23-24]. 红细胞和血红蛋白的减少也就意味着氧运输能力的减弱, 而鱼类只能通过降低代谢强度来维持其生存. 而杨成辉等[24]得到了不同的结果, 他们对哲罗鱼()饥饿再投喂的研究中发现, 哲罗鱼在短期(7~14d)的饥饿胁迫下, 红细胞数量和血红蛋白含量呈上升趋势, 之后才有所回落.
有研究表明[11], 受饥饿胁迫后, 鱼体血液中的总蛋白、白蛋白和球蛋白会减少, 变化规律表现在其第1~2周内的含量有显著上升, 第3~4周内的含量下降. 根据楼宝等[14]报导, 花鲈饥饿及恢复投饵过程中的血清蛋白显示, 花鲈饥饿5d和10d后, 血清蛋白浓度没有下降, 直到饥饿15d后, 才发现血清蛋白浓度显著降低, 在恢复投饵5d后又有明显地回升. 本实验结果表明, 饥饿5、10、15d的花鲈总蛋白均有所上升, 饥饿恢复5d后都有回落. 实验结束后, 总蛋白都高于对照组. 对照组花鲈的白蛋白和球蛋白比为0.38, 而正常白斑狗鱼()的白球比为0.56, 淡水南方鲶()白球比为0.99, 鲤()白球比为2.1. 随着饥饿时间延长, 花鲈白球比还发生明显下降, 表明花鲈免疫力水平也随饥饿程度的加剧而下降.
3.3 饥饿再投喂对花鲈肌肉成分的影响

[1] Alvarez A, Garcia B, Garrido M D, et al. The influence of starvation time prior to slaughter on the quality of commercial-sized gilthead seabream () during ice storage[J]. Aquaculture, 2008, 284(1/2/3/4): 106-114.
[2] 李锐鑫, 刘泓宇, 谭北平, 等. 饥饿及再投喂处理对草鱼生长、葡萄糖代谢和转运蛋白1表达的影响[J]. 中国水产科学, 2018, 25(1):74-85.
[3] Paul A J, Paul J M, Smith R L. Compensatory growth in Alaska yellowfin sole,, following food deprivation[J]. Journal of Fish Biology, 2010, 46(3): 442-448.
[4] 张怡波, 吕慧明, 袁子, 等. 饥饿再投喂对黑鱾幼鱼消化酶活性与血液生理生化指标的影响[J]. 宁波大学学报(理工版), 2019, 32(5):12-16.
[5] 沈文英, 寿建昕. 鱼类补偿生长的研究进展[J]. 水利渔业, 2003, 23(4):40-42.
[6] 周凡, 线婷, 贝亦江, 等. 周期性“饥饿-再投喂”对大口黑鲈幼鱼补偿生长的影响[J]. 水产学杂志, 2019, 32(3):27-33.
[7] 王万良, 王建银, 周建设, 等. 饥饿和恢复投喂对亚东鲑幼鱼的补偿生长[J]. 水产科学, 2018, 37(1):100-104.

[9] Favero G C, Gimbo R Y, Montoya L N F, et al. Fasting and refeeding lead to more efficient growth in lean pacu ()[J]. Aquaculture Research, 2018, 49:359-366.
[10] Dar S A, Srivastava P P, Varghese T, et al. Effects of starvation and refeeding on expression of ghrelin and leptin gene with variations in metabolic parameters infingerlings[J]. Aquaculture, 2017, 484:219- 227.
[11] 钱云霞, 陈惠群, 孙江飞. 饥饿对养殖鲈鱼血液生理生化指标的影响[J]. 中国水产科学, 2002, 9(2):133-137.
[12] 曾庆民. 饥饿对花鲈生长效果的比较研究[J]. 集美大学学报(自然科学版), 2004, 9(2):122-126.
[13] 朱艺峰, 林霞, 吴望星, 等. 周期性饥饿下花鲈的形态变化与饥饿状态的相对判别分析[J]. 中国水产科学, 2006, 13(1):45-51.
[14] 楼宝, 史会来, 毛国民, 等. 饥饿及恢复投饵过程中花鲈肌肉组成及非特异免疫水平的变化[J]. 水产学报, 2008, 32(6):929-938.
[15] 潘艳艳, 顾晓英, 张德民, 等. 饥饿及恢复喂食对花鲈肠道菌群多样性的影响[J]. 水产学报, 2016, 40(5):776- 784.
[16] 高露姣, 陈立侨, 宋兵. 饥饿和补偿生长对史氏鲟幼鱼摄食、生长和体成分的影响[J]. 水产学报, 2004, 28(3): 279-284.

[18] 祁东风, 杨苏亮, 李海静, 等. 动物补偿生长研究进展[J]. 动物营养学报, 2016, 28(6):1655-1660.
[19] 梁拥军, 孙向军, 张升利, 等. 饥饿后再投喂对星斑川鲽生长、摄食的影响[J]. 水产科学, 2011, 30(3):125- 131.
[20] 李耕, 姜志强, 韩毅颖, 等. 饥饿和再投喂对西伯利亚鲟摄食和生长的影响[J]. 大连海洋大学学报, 2009, 24(S1):121-124.
[21] 董学兴, 吕林兰, 黄金田, 等. 饥饿后再投喂对异育银鲫血液生理和非特异性免疫指标的影响[J]. 中国农学通报, 2011, 27(23):76-79.
[22] 黄辨非, 童响波, 罗静波. 饥饿对泥鳅某些血液指标的影响[J]. 淡水渔业, 2006, 36(6):33-35.
[23] 黄权, 高峰, 孟繁伊, 等. 饥饿和再投喂对花羔红点鲑肌肉组分和血液指标的影响[J]. 吉林农业大学学报, 2009, 31(4):460-466; 475.
[24] 杨成辉, 蔡勋, 刘霞, 等. 饥饿和再投喂对哲罗鱼幼鱼血液生理生化指标的影响[J]. 淡水渔业, 2009, 39(1): 36-40.
[25] Navarro I. Fasting and starvation[J]. Biochemistry & Molecular Biology of Fishes, 1995, 17(4):393-434.
[26] Metón I, Fernández F, Baanante I V. Short- and long-term effects of refeeding on key enzyme activities in glycolysis-gluconeogenesis in the liver of gilthead seabream ()[J]. Aquaculture, 2003, 225 (1/2/3/4):99-107.
[27] 柴毅, 罗静波, 张远炯. 饥饿对奥尼罗非鱼能量物质消耗的影响[J]. 长江大学学报(自然科学版)农学卷, 2010, 7(4):41-43.
[28] 罗波, 冯健, 蒋步国, 等. 饥饿对太平洋鲑生长、机体组成及血浆相关生化指标变化研究[J]. 水生生物学报, 2010, 34(3):541-546.
[29] 姜志强, 贾泽梅, 韩延波. 美国红鱼继饥饿后的补偿生长及其机制[J]. 水产学报, 2002, 26(1):67-72.
[30] 沈文英, 金俊. 饥饿和再投喂对白鲫生物化学组分的影响[J]. 绍兴文理学院学报(自然科学版), 2002, 22(2): 49-51.
[31] 张波, 孙耀, 唐启升. 饥饿对真鲷生长及生化组成的影响[J]. 水产学报, 2000, 24(3):206-210.
[32] 吴立新, 蔡勋, 陈炜. 饥饿和再喂食对泥鳅生化组成的影响[J]. 生态学杂志, 2006, 25(1):101-104.
[33] 沈文英, 林浩然, 张为民. 饥饿和再投喂对草鱼鱼种生物化学组成的影响[J]. 动物学报, 1999, 45(4):404-412.

[35] Zhang B, Xie X J. Starvation metabolism in the southern catfish ()[J]. Oceanologia et Limno- logia Sinica, 2000, 31(5):480-484.
[36] Wilson P N, Osbourn D F. Compensatory growth after under nutrition in mammals and birds[J]. Biological Reviews, 1960, 35(3):324-361.
[37] Hayward R S, Noltie D B, Wang N. Use of compensatory growth to double hybrid sunfish growth rates[J]. Transactions of the American Fisheries Society, 1997, 126(2):316-322.
[38] Quinton J C, Blake R W. The effect of feed cycling and ration level on the compensatory growth response in rainbow trout,[J]. Journal of Fish Biology, 2010, 37(1):33-41.
Effects of starvation and refeeding on physiological and biochemical indices in juvenile of
HU Lingzhu1, ZHOU Xuanyu1, ZHANG Shun1, XU Shanliang1,2*
( 1.School of Marine Sciences, Ningbo University, Ningbo 315832, China; 2.Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Ningbo 315832, China )
To investigate the physiological and biochemical indices of refeeding on the starvingjuveniles, the regularly fedjuveniles were served as the control group S0. And S5, S10 and S15 groups were starved for 5d, 10d and 15d, respectively. All the juveniles were refed normally to the 35th day following starvation. Samples were collected at the end of the starvation, the fifth day and the last day of refeeding, respectively. Results are as follows: (1) The liver index of thewhich were fasted for 5 days was reduced to about 78% of the initial value. After fasting for 10 days, it was reduced to 50%. After 15 days, it was reduced to 40%. (2) Compared to S0 group, the feeding rate of the experimental groups reduced evidently by 10.8% to 24.0%. (3) WBC, RBC, hemoglobin of thewere all significantly affected by hunger stress, with all the indices dropped dramatically. On the contrary, TP, GLB, ALB in blood ofall increased after starving for 5, 10 and 15 days. And all the indices recovered to average levels after refeeding. At the end of the experiment, the indices all returned to the average level and the response of the S15 group was the slowest. (4) Hunger stress had no significant effect on crude ash content. Crude fat content showed a downward trend. At the end of the experiment, the protein level of S5 group and S10 group returned to normal levels, while there were still significant differences between S15 group and the control group. The protein content didn’t decrease following starvation for 5 and 10 days and it decreased following starvation for 15 days. However, after refeeding for 5 days, the content resumed quickly and showed insignificant difference compared to the control group. The results indicated that the fat in muscle was firstly utilized and protein was the second when suffering from starvation. After refeeding, the protein in muscle resumed first, which was followed by fat.
; starvation; refeeding; liver index; blood indices; muscle composition
S917.4
A
1001-5132(2021)04-0008-07
2020−07−23.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
国家自然科学基金(31872586); 浙江省自然科学基金(LY18C190008); 浙江省重大科技专项(2019C02059).
胡玲珠(1995-), 女, 安徽池州人, 在读硕士研究生, 主要研究方向: 鱼类繁殖与发育. E-mail: 1289729477@qq.com
徐善良(1962-), 男, 浙江舟山人, 教授, 主要研究方向: 水产动物繁育. E-mail: xushanliang@ nbu.edu.cn
(责任编辑 章践立)

