二氧化钛纳米管及其作为溶栓药物载体的研究
陈熔熔, 景春兰, 赵玲玲, 梁洪泽
二氧化钛纳米管及其作为溶栓药物载体的研究
陈熔熔, 景春兰, 赵玲玲*, 梁洪泽
(宁波大学 材料科学与化学工程学院, 浙江 宁波 315211)
为改善直接使用溶栓蛋白药物尿激酶(uPA)时容易形成全身性纤维原蛋白分解和大出血的问题, 设计并制备了负载溶栓药物的二氧化钛纳米管支架. 采用阳极氧化法合成排列整齐有序的二氧化钛纳米管阵列, 该纳米管可负载溶栓药物uPA, 通过酰胺键将壳聚糖(CS)连接到二氧化钛纳米管阵列上, 可对纳米管进行封端, 得到uPA缓控释放的溶栓支架Ti-TNTs-uPA-CS. 用扫描电子显微镜、红外光谱等方法对Ti-TNTs-uPA-CS的形貌和结构进行表征, 并模拟人体生理环境进行体外溶栓实验. 与空白组对比后的结果表明, Ti-TNTs-uPA-CS具有良好的溶栓效果, 并随着溶栓时间积累, 溶栓效果显现, 说明该溶栓支架对血栓的治疗具有积极意义.
二氧化钛纳米管; 药物载体; 尿激酶; 溶栓
血管血栓的形成是继发性心肌梗死、中风、肺栓塞以及其他血管阻塞的祸根. 尿激酶作为常用溶栓药物, 其通过激活蛋白纤溶酶原为纤溶酶, 进而发挥溶栓作用, 然而这类药物具有全身性副作用, 注射后易形成全身性纤维原蛋白分解和大出血[1-2]. 因此, 将药物载入支架材料中, 当血栓形成时, 可定点靶向缓慢释放药物, 不仅能达到治疗效果, 还可以缓解药物的副作用. 以钛片作为基底, 垂直有序排列的二氧化钛纳米管阵列(TNTs)作为医用载体和支架, 具有高表面积, 耐腐蚀性, 优异的载药能力, 良好的生物相容性, 目前已经被认为是药物输送体系中有前途的载体[3]. 虽然二氧化钛纳米管有其独特的优势, 但纳米管间的黏附性差, 易于从钛基底剥离, 使得二氧化钛纳米管阵列的应用受到极大影响. 为了提高二氧化钛纳米管阵列对基底的黏附性, 研究人员做出了很大的努力. 例如, Schmuki等[4-5]用乙炔处理将TNTs转化为半金属形式, 以增加二氧化钛纳米管微观结构中的碳来提高其机械强度. Xiong等[6]在空气中退火二氧化钛纳米管, 得到二氧化钛纳米管的黏附性随退火时间而改善的研究结果. 通过这些方法改善TNTs黏合度的效果还是有限, 因而亟需一种方法能够有效增加TNTs的黏附性.
为增加二氧化钛纳米管对基底的黏附性, 可以从其形成过程来了解, 并提出改善方案. 众所周知, 二氧化钛纳米管可以通过电化学阳极氧化的方法形成[7], 其电解液一般为含氟的电解液. 早在1979年, Kelly课题组研究了氟化物对钛氧化的影响, 发现低浓度氟化物可以促进多孔氧化物的形成[8]. 由此我们逐渐意识到, 在电解液中加入少量氟离子是形成二氧化钛纳米管的关键. 另一方面, 电解液中氟化物亦会影响阳极氧化过程, 这是因为氟化物会形成[TiF6]2-水溶性物质. [TiF6]2-会从两处产生, 一处是在氧化物-电解质界面上的Ti4+发生复合: Ti4++6F-→[TiF6]2-, 另一处是由阳极氧化得到的TiO2化学侵蚀而成: TiO2+6F-+4H+→[TiF6]2-+ 2H2O[9]. 所形成含有氟化物的TiO2层简称为FRL (Fluoride-rich TiO2Layer), FRL的存在被认为是界面之间黏附性差的主要原因. 因而, 消除FRL是提高TNTs黏附性的有效方法.
本文以分别含H3PO4和氟化铵的两种乙二醇电解液进行阳极氧化纯钛片, 制备具有良好黏附性的二氧化钛纳米管阵列. 以该纳米管阵列为载体, 负载溶栓药物尿激酶(uPA), 然后以壳聚糖为封端剂, 通过酰胺键结合到TiO2纳米管以改善其生物相容性, 制备尿激酶载体支架材料Ti-TNTs- uPA-CS. 在不同pH下, Ti-TNTs-uPA-CS能缓慢释放出uPA药物, 并显现出良好的溶栓效果.
1 实验部分
1.1 原料
乙二醇(EG), 上海麦克林生化科技有限公司, 体积分数>99%; 氟化铵(NH4F), 上海麦克林生化科技有限公司, 质量分数≥99.99%; 磷酸(H3PO4), 上海麦克林生化科技有限公司, AR, 质量分数≥85%; 钛片, 北京翠铂林有色金属技术开发中心有限公司; 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl), Sigma Aldrich(St. Louis, US); N-羟基琥珀酰亚胺(NHS), 衢州新腾化学有限公司; 吗啉乙磺酸(MES), Sigma Aldrich, 质量分数≥99.5%; 壳聚糖(CS), 宁波市海鑫生物科技有限公司友情提供; 磷酸氢二钠、磷酸二氢钠、酮, 国药集团化学试剂有限公司; 尿激酶(uPA), 丽珠医药集团股份有限公司.
1.2 二氧化钛纳米管阵列(TNTs)的制备
采用阳极氧化法制备二氧化钛纳米管. 具体实验步骤为: 将切割成3cm×3cm的钛片机械抛光, 在丙酮中超声清洗15min. 然后在含NH4F的乙二醇溶液中以60V的电解电压将钛片电化学阳极氧化30min, 通过超声除去表面氧化物; 再将钛片在含H3PO4的乙二醇溶液中以相同电压氧化3~4 min, 并用去离子水冲洗; 第3次在含NH4F的乙二醇溶液中氧化1h, 再用去离子水冲洗; 最后在含H3PO4的乙二醇溶液反应3~5min, 并用去离子水冲洗. 将制得的二氧化钛纳米管样品在空气中以2℃·min-1程序升温至450℃, 煅烧3h, 得到的样品为煅烧后的二氧化钛纳米管.
1.3 壳聚糖(CS)修饰TNTs
CS修饰TNTs的制备参考文献[10]方法, 并进行了适当的调整, 具体步骤如下: 将EDC·HCl (20 mmol, 0.0383g), NHS(50mmol 0.0575g)溶于10 mL 0.1mmol·mL-1MES(pH 6.0)中, 混合搅拌均匀, 然后加入壳聚糖(1.0g), 使壳聚糖溶液质量浓度为100mg·mL-1, 搅拌6h形成溶液; 将TNTs放入壳聚糖溶液中, 室温持续均匀震荡16h. 取出钛片, 用MES溶液冲洗, 再用去离子水冲洗, 得到样品Ti-TNTs-CS.
1.4 Ti-TNTs-CS负载uPA
将修饰过的钛片(TNTs-CS)裁剪成1cm×1cm, 加入uPA(5mg·mL-1)溶液, 在25℃摇床下避光缓慢震荡48h, 将载完药物的钛片冻干, 于-20℃下保存. 由uPA的上清液标准曲线测出, 在1cm× 1cm的钛片上, 载有1.4mg FITC-uPA.
1.5 产物结构表征
1.5.1 扫描电子显微镜(SEM)
扫描电镜(SEM)表征: 将煅烧前后的二氧化钛纳米管分别裁成小片, 黏在导电胶上, 真空镀金后, 用Hitachi S-4300场发射扫描电镜在15kV加速电压下观察二氧化钛纳米管样品的微观结构和尺寸.
1.5.2 红外光谱(FTIR)
采用Micro-FTIR显微红外光谱仪(美国安捷伦科技(中国)有限公司)对Ti-TNTs和Ti-TNTs-CS样品进行分析.
1.6 体外溶栓实验
2 结果与讨论
2.1 阳极氧化合成TNTs
通过SEM电镜表征二氧化钛纳米管在煅烧前后的形貌特征, 如图1所示, 上下图形分别为煅烧前和高温煅烧后的二氧化钛纳米管. 由图可见, 经450℃高温煅烧后, 其表面结构没有发生较大的变化, 且TNTs管之间依然保持整齐有序的排列, 从左图中可以看出, 制备出的二氧化钛纳米管排列密集, 其管内径平均在(70±10)nm, 厚度在7μm左右; 并且可以观察到Ti与TNTs之间形成了致密的氧化物层(ACOL, Additional Compact Oxide Layer), 由于这层致密氧化物层的存在, Ti与TNTs的黏附性大大提高. 图2进一步证实, TNTs在翻折下, 其纳米管膜没有剥落现象. 从右图中可以明显观察到二氧化钛纳米管的内壁增厚, 并且管内径约保持40nm不变. 并且在使用H3PO4乙二醇电解液阳极氧化钛片的过程中, 对二氧化钛纳米管的表面结构影响不大, 仍保持多孔结构.

图1 煅烧前后TNTs的SEM图

图2 TNTs图
2.2 红外分析(FTIR)
如图3所示, 红外光谱图上TNTs中的TiO2的谱带在400~700cm-1之间, 645cm-1处归属于二氧化钛的特征峰, 即TNTs中Ti-O的伸缩振动峰. TNTs-CCS中2926cm-1处为壳聚糖的C—H伸缩振动峰, 1645cm-1和1553cm-1处分别是仲酰胺I带中C O的伸缩振动峰和仲酰胺中II带中N—H的弯曲振动峰, 通过CS上的氨基和羧基形成酰胺键, 结果表明CS成功修饰到TNTs上.
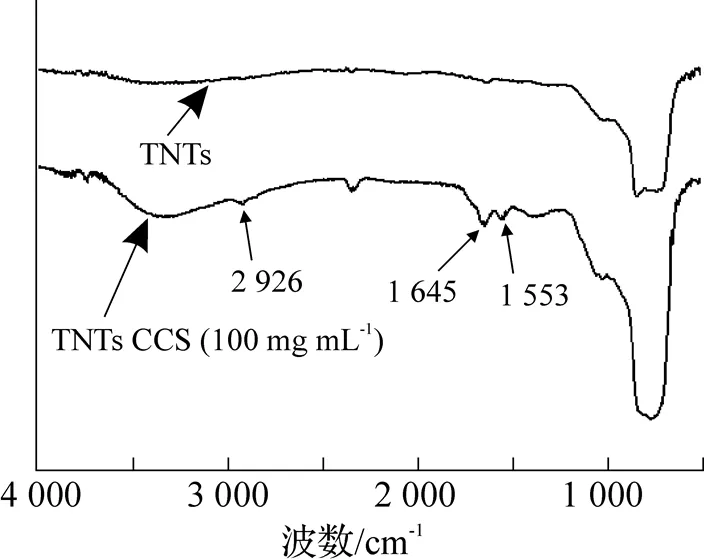
图3 TNTs和TNTs-CCS的红外谱图
2.3 Ti-TNTs-uPA-CS载药及体外溶栓实验
如图4所示, 通过溶栓实验考察Ti-TNTs-CCS- uPA在不同pH值的磷酸盐缓冲溶液中以及不同溶栓时间的体外溶栓效果, 并以磷酸盐缓冲溶液作为对照. 结果表明, 在本工作实验条件下, 经过4h, Ti-TNTs-uPA-CS缓慢释放出尿激酶, 具有一定溶栓效果, 且随着溶栓时间的增长, 溶栓效果显著增加. 当溶栓时间达到17h时, Ti-TNTs-uPA-CS+pBS 6.8组溶栓率为41.87%, 而Ti-TNTs-uPA-CS+pBS 7.4组溶栓率为52.67%, 整体来看, 不同pH的缓冲溶液下, Ti-TNTs-uPA-CS的溶栓效果差异不大. 该实验表明, 将尿激酶成功载入钛片后, 依旧能保持良好的溶栓能力, 为我们进一步的靶向研究提供了一定基础.
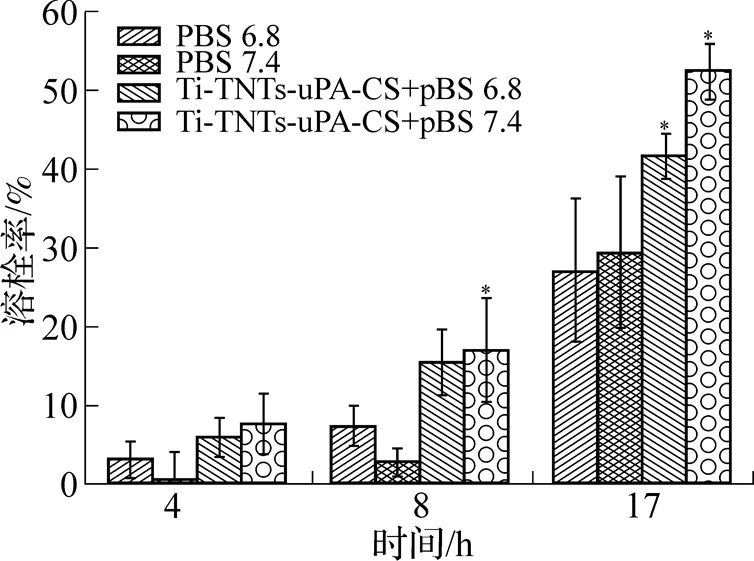
与pBS空白组相比(*P<0.05, n=3), Ti-TNTs-uPA-CS在不同pH下, 不同时间下对空白组的相对生物活性, 相对于pH 6.8和pH 7.4下生物活性进行标准化.
3 结论
本工作以钛片为基底, 通过电化学阳极氧化法制备二氧化钛纳米管阵列, 壳聚糖作为封端修饰TNTs, 制备溶栓药物载体材料. 用H3PO4乙二醇作为电解液制备二氧化钛纳米管阵列, 可生成致密的氧化层, 增加纳米管阵列与钛基底的黏附性, 使其不易从钛片上剥落. 合成的TNTs高度有序, 排列整齐,且煅烧后的TNTs结构依然保持不变. 通过红外证实壳聚糖成功修饰到TNTs上. 经摇床缓慢振荡, 溶栓药物uPA成功载入到Ti-TNTs上, 每片1cm×1cm的Ti-TNTs-CS载有1.4mg uPA. 体外溶栓实验表明, Ti-TNTs-uPA-CCS具有良好溶栓能力, 为我们进一步靶向溶栓治疗提供了研究基础, 在治疗血栓领域具有应用前景.
[1] Vaidya B, Nayak M K, Dash D, et al. Development and characterization of site specific target sensitive liposomes for the delivery of thrombolytic agents[J]. International Journal of Pharmaceutics, 2011, 403(1/2):254-261.
[2] Sakuragawa N, Shimizu K, Kondo K, et al. Studies on the effect of PEG-modified urokinase on coagulation-fibrino- lysis using beagles[J]. Thrombosis Research, 1986, 41(5): 627-635.
[3] Losic D, Simovic S. Self-ordered nanopore and nanotube platforms for drug delivery applications[J]. Expert Opinion on Drug Delivery, 2009, 6(12):1363-1381.
[4] Schmidt S F, Thiemann S, Berger S, et al. Mechanical properties of anatase and semi-metallic TiO2nanotubes [J]. Acta Materialia, 2010, 58(19):6317-6323.
[5] Hahn R, Schmidt S F, Salonen J, et al. Semimetallic TiO2Nanotubes[J]. Angewandte Chemie International Edition, 2009, 48(39):7236-7239.
[6] Xiong J Y, Wang X J, Li Y C, et al. Interfacial chemistry and adhesion between titanium dioxide nanotube layers and titanium substrates[J]. The Journal of Physical Chemistry C, 2011, 115(11):4768-4772.
[7] Masuda H, Fukuda K. Ordered metal nanohole arrays made by a two-step replication of honeycomb structures of anodic alumina[J]. Science, 1995, 268(5216):1466- 1468.
[8] Kelly J J. The influence of fluoride ions on the passive dissolution of titanium[J]. Electrochimica Acta, 1979, 24 (12):1273-1282.
[9] Roy P, Berger S, Schmuki P. TiO2nanotubes: Synthesis and applications[J]. Angewandte Chemie International Edition, 2011, 50(13):2904-2939.
[10] Shi Z L, Neoh K G, Kang E T, et al. Surface functionalization of titanium with carboxymethyl chitosan and immobilized bone morphogenetic protein-2 for enhanced osseointegration[J]. Biomacromolecules, 2009, 10(6):1603-1611.
Preparation of TiO2nanotubes and their application as carriers for thrombolytic drugs
CHEN Rongrong, JING Chunlan, ZHAO Lingling*, LIANG Hongze
( School of Material Science and Chemical Engineering, Ningbo University, Ningbo 315211, China )
In order to solve the problems of direct use of urokinase (uPA) (e.g. the risk of breakdown systemic fibrinogen and bleeding) and improve the thrombolytic effect, TiO2nanotube arrays were designed and prepared as thrombolytic drug scaffold. The TiO2nanotube arrays were synthesized by anodized electrochemical method. The thrombolytic drug uPA could be encapsulated into the TiO2nanotube arrays, and chitosan (CS) was used as capping agent to combine in the tubes through amide bonds. The morphology and structure of Ti-TNTs-uPA-CS were proved by scanning electron microscopy and infrared spectroscopy. In vitro thrombolytic experiments were performed to simulate human physiological environment. The results showed that Ti-TNTs-uPA-CS produced good thrombolytic ability, compared to PBS control group. It indicates the potential promise of the TiO2nanotube arrays for uPA encapsulation and thrombus treatment.
TiO2nanotubes;drug carrier; uPA;thrombolysis
TQ937
A
1001-5132(2021)04-0097-04
2019−12−23.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
国家自然科学基金(51403108); 宁波市自然科学基金(2018A610243).
陈熔熔(1994-), 女,浙江宁波人, 在读硕士研究生, 主要研究方向: 生物医用材料. E-mail: 1021769525@qq.com
赵玲玲(1986-), 女, 湖南会同人,副教授, 主要研究方向: 生物医用材料. E-mail: zhaolingling@nbu.edu.cn
(责任编辑 章践立)

