2株拮抗生防菌对油茶炭疽病多种病原菌的抑菌活性及防效
徐 睿,刘 闯,张潇月,周国英,刘君昂
(1.河南林业职业学院 森林保护系,河南 洛阳 471002;2.中南林业科技大学a.南方人工林病虫害防控国家林业局重点实验室;b.森林有害生物防控湖南省重点实验室;c.经济林培育与保护教育部重点实验室,湖南 长沙 410004)
油茶Camellia oleifera是山茶科Theaceae 山茶属Camellia常绿小乔木,为中国南方重要的木本油料树种,拥有重要的经济价值、食用价值和药用价值[1]。目前,中国的油茶种植面积约为367 万hm2,种质资源极为丰富,主要产区包括湖南、福建、江西、广东、广西、浙江等18 个省(区)。以油茶籽制备的山茶油含有丰富的油酸等不饱和脂肪酸,是一种理想的健康食用植物油,非常适于患有心脏病、血管硬化、高血压等病症的人群食用[2]。近年来油茶种植面积持续增长,在各大油茶产区普遍发生各种病害,炭疽病是较为重要的病害之一,严重影响了油茶的产量及品质[3]。炭疽属真菌是一类在全世界分布极其广泛的重要病原菌,属于半活体营养型真菌。油茶炭疽病的病原菌涵盖了炭疽属的多个种,由于不同种的形态特征十分相似,仅靠菌落、分生孢子和附着胞等的形态学特征难以区分炭疽属真菌的种类,因此,目前主要是采用综合形态学特征和多基因分子序列信息的方法来鉴定。根据研究报道,油茶炭疽病原菌有8 种,分别是油茶果生炭疽菌Colletotrichum fructicola、胶孢炭疽菌C.gloeosporioides、山茶炭疽菌C.camelliae、暹罗炭疽菌C.siamense、喀斯特炭疽菌C.karstii、哈锐炭疽菌C.horii、君子兰炭疽菌C.cliνiae和博宁炭疽菌C.boninense,其中油茶果生炭疽菌在我国多地油茶炭疽病的病原菌中均有发现,且分离率高,为油茶炭疽病的优势致病菌[4-8]。
目前,对于油茶病害的主要防治措施是化学防治。使用化学农药防治油茶炭疽病,虽然能快速降低损失,但由于油茶炭疽病病原菌具有较强的适应能力,容易引起油茶炭疽病病原菌抗药性的产生[9]。大剂量使用化学农药不仅会严重污染生态环境,还使茶油内的农药残留量增加,降低茶油的品质,影响油茶产业的健康发展[10]。随着人们绿色环保意识越来越强烈,世界各国对生物防治越来越关注,生物防治药剂的市场需求与日俱增,研究者不断开展研发工作,试图生产出安全环保、高效、可持续发展的生防制品。寻求安全、低毒、高效的油茶病害防治手段也受到普遍关注[11]。近年来,我国研究人员开始考虑从微生物或植物中寻找对油茶炭疽病有防治功能的生物农药,筛选和利用拮抗微生物可以成为防治油茶炭疽病研究的新方向[12]。周盈等[13]报道了1 种对胡萝卜软腐欧文氏菌具有抑菌活性的枯草芽孢杆菌BSn5 及其产生的抑菌蛋白APn5,但该菌仅能拮抗胡萝卜软腐欧文氏菌亚种,其生防范围较窄。宋光桃[14]发现短芽孢杆菌Z26 能有效抑制油茶炭疽病病菌、根腐病病菌、半边疯病菌等病原菌的生长,该生防菌剂对油茶炭疽病的最大抑制率达到83.4%。
为给油茶炭疽病防治提供更加准确的解决途径,本研究中分析了2 株生防菌对5 种油茶炭疽菌的抑菌活性。
1 材料与方法
1.1 材 料
生防菌:枯草芽孢杆菌Bacillus subtilisYL13,由油茶内生菌诱变获得,保存于微生物菌种保藏中心。球孢链霉菌球孢亚种St.globisporussubsp.globisporusF10,分离自攸县油茶示范基地土壤,保存于河南林业职业学院微生物菌种保藏中心。
病原菌:胶孢炭疽菌、果生炭疽菌、暹罗炭疽菌、山茶炭疽菌、哈锐炭疽菌由河南林业职业学院微生物菌种保藏中心提供。
培养基:NA 培养基配方为蛋白胨10 g、牛肉膏5 g、NaCl 5 g、琼脂18 g、水1 000 mL;NB 培养液配方为蛋白胨10 g、牛肉膏5 g、NaCl 5 g、水1 000 mL;PDA 培养基配方为土豆200 g、葡萄糖20 g、琼脂20 g;高氏1 号培养基配方为可溶性淀粉20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g,FeSO4·7H2O 0.01 g、琼脂20 g、水1 000 mL;YL13 培养基配方为蔗糖11 g、牛肉膏16 g、NaCl 4 g;F10 培养液配方为酵母粉5 g、葡萄糖10 g、KH2PO41 g、NaCl 1 g、CaCO33 g、水1 000 mL。
1.2 方 法
1.2.1 拮抗菌发酵滤液制作
YL13 发酵液:采用发酵法,将实验室保藏的YL13 菌种在NA 培养基上活化培养2 d 后,用接菌环移取1 环,置入装有20 mL NB 培养液的50 mL 三角瓶中,在摇床(30 ℃、160 r/min)上振荡培养36 h 制成种子液,按6%的接种量接种至装有50 mL YL13 培养基的250 mL 三角瓶中,在摇床(30 ℃、170 r/min)上振荡培养36 h,制成发酵液。
F10 发酵液:采用发酵法,将实验室保藏的F10 菌种在高氏1 号培养基上活化培养7 d 后,用接菌环移取直径为6 mm 的F10 菌饼,置入装有100 mL 高氏1 号培养液的300 mL 三角瓶中,在摇床(30 ℃、160 r/min)上振荡培养5 d制成种子液,按10%的接种量接种至装有100 mL F10 培养基的300 mL 三角瓶中,在摇床(30 ℃、140 r/min)上振荡培养7 d,制成发酵液[15]。
将2 种拮抗菌发酵液分别用0.22 μm 细菌过滤器过滤,得到拮抗菌发酵滤液。
1.2.2 拮抗菌发酵滤液对油茶炭疽菌的抑菌活性测定
将拮抗菌发酵滤液和约50 ℃的PDA 培养基按体积比1∶19 混匀后倒入培养皿中,冷却后在平板中央分别放入直径为6 mm 的5 种炭疽菌(胶孢炭疽菌、果生炭疽菌、暹罗炭疽菌、山茶炭疽菌、哈锐炭疽菌)菌饼。5 d 后测量病菌菌落直径,每处理3 个重复,以无菌水为空白对照。抑菌效果用抑菌率(R抑)表示。
R抑=[(d0-d)/(d0-6)]×100%。
式中:d0为对照菌落直径,d为处理菌落直径。
1.2.3 拮抗菌发酵滤液对油茶炭疽菌优势种的效价测定
将拮抗菌发酵滤液与约50 ℃的PDA 培养基按1∶19、1∶39、1∶99、1∶399、1∶999 的体积比混匀,倒入培养皿中,冷却后备用。用6 mm 的打孔器在已经培养好的果生炭疽菌、胶孢炭疽菌培养基上打取菌丝块,接种于放置1 d 的培养基上,5 d 后测量病菌菌落直径,每处理3 个重复,以无菌水为空白对照。抑菌效果用抑菌率(R抑)表示。
1.2.4 拮抗菌对离体叶片油茶炭疽菌的防治效果测定
选取健康且大小一致的2年生‘湘林1 号’油茶叶片作为接种对象,用75%酒精将叶片消毒30 s,再用无菌水将叶片清洗3 次后晾干,使用一次性注射器针头将叶片背面表皮挑破但不刺穿,每叶片挑破1处,置于铺有灭菌吸水纸的培养皿中。预防试验处理(处理1~5)为先喷叶接种拮抗菌,然后分别于接种1、2、3、4、5 d 后将果生炭疽菌的菌丝块接于叶片剌伤处;治疗试验处理(处理6~8)为先将果生炭疽菌的菌丝块接于叶片剌伤处,然后分别于接种2、3、4 d 后喷叶接种拮抗菌。
2 种拮抗菌各进行8 组处理,以仅接种果生炭疽菌菌丝的叶片作为对照(CK),每处理接种10片,置于28 ℃恒温培养箱内保湿培养,光照周期为12 h 光照、12 h 黑暗,逐天连续观察并记录叶片发病情况。
R病=[(N病-N总)/N总]×100%。
式中:R病为发病率,N病为发病叶片数,N总为总叶片数。
R防=[(R0-R1)/R0]×100%。
式中:R防表示防治效果,R0为对照发病率,R1为处理发病率。
1.3 数据统计分析
使用Excel 2003 软件对数据进行统计分析。
2 结果与分析
2.1 拮抗菌发酵滤液对油茶炭疽菌的抑制效果
拮抗菌发酵滤液处理下5 种油茶炭疽菌的菌落生长情况如图1所示。由图1可以看出,2 种拮抗菌发酵滤液对5 种炭疽菌的菌丝生长均有不同程度的抑制作用。拮抗菌发酵滤液对5 种油茶炭疽菌的具体抑制效果见表1。由表1可知,2 种拮抗菌发酵滤液对胶孢炭疽菌的抑制效果均为最好,抑制率分别为83.46%、62.20%,对山茶炭疽菌的抑制率均为最低,分别为49.15%、30.99%。经比较得出,在稀释20 倍时,YL13 发酵滤液对5 种炭疽菌的抑制效果由强到弱依次为胶孢炭疽菌、暹罗炭疽菌、果生炭疽菌、哈锐炭疽菌、山茶炭疽菌,F10 发酵滤液对5 种炭疽菌的抑制效果由强到弱依次为胶孢炭疽菌、果生炭疽菌、哈锐炭疽菌、暹罗炭疽菌、山茶炭疽菌。

图1 拮抗菌发酵滤液处理下5 种油茶炭疽菌菌落的生长情况Fig.1 The growth of five species of C.oleifera anthracis colonies under the treatment of antagonistic antibacterial fermentation filtrate

表1 拮抗菌发酵滤液对5 种油茶炭疽菌的抑制效果Table 1 Inhibitory effect of antagonistic antibacterial fermentation filtrate on five species of C.oleifera anthracis
2.2 拮抗菌发酵滤液对油茶炭疽菌优势种的效价
不同浓度拮抗菌发酵滤液对油茶炭疽菌优势种的抑菌率见表2。由表2可知,2 种拮抗菌对2种油茶炭疽菌优势种胶孢炭疽菌和果生炭疽菌的抑菌率均随着拮抗菌发酵滤液稀释倍数的增加而降低。

表2 不同浓度拮抗菌发酵滤液对油茶炭疽菌优势种的抑菌率Table 2 Inhibition rate of different concentrations of antagonistic antibacterial fermentation filtrate on dominant species of C. anthracis
当YL13 发酵滤液稀释至20 倍时,其对胶孢炭疽菌的抑菌率高达83.46%,对果生炭疽菌的抑菌率相对较低(66.33%),但当稀释倍数增大,YL13 对胶孢炭疽菌的拮抗效果下降速度要快于对果生炭疽菌的拮抗效果,当YL13 发酵滤液稀释至40 倍时,YL13 发酵滤液对果生炭疽菌的抑菌率便超过了其对胶孢炭疽菌的抑菌率。当YL13 发酵滤液稀释至100 倍时,其对胶孢炭疽菌的抑制率降低至49.21%。因此可推测YL13 发酵滤液对胶孢炭疽菌的效价约为100 倍。当YL13 发酵滤液稀释至400 倍时,其对果生炭疽菌的抑菌率为52.86%,当稀释至1 000 倍时,其对果生炭疽菌的抑菌率下降至49.07%。因此可推测,YL13 发酵滤液对果生炭疽菌的效价约为400 倍。不同浓度YL13 发酵滤液处理下油茶炭疽菌优势种菌落的生长情况如图2所示。
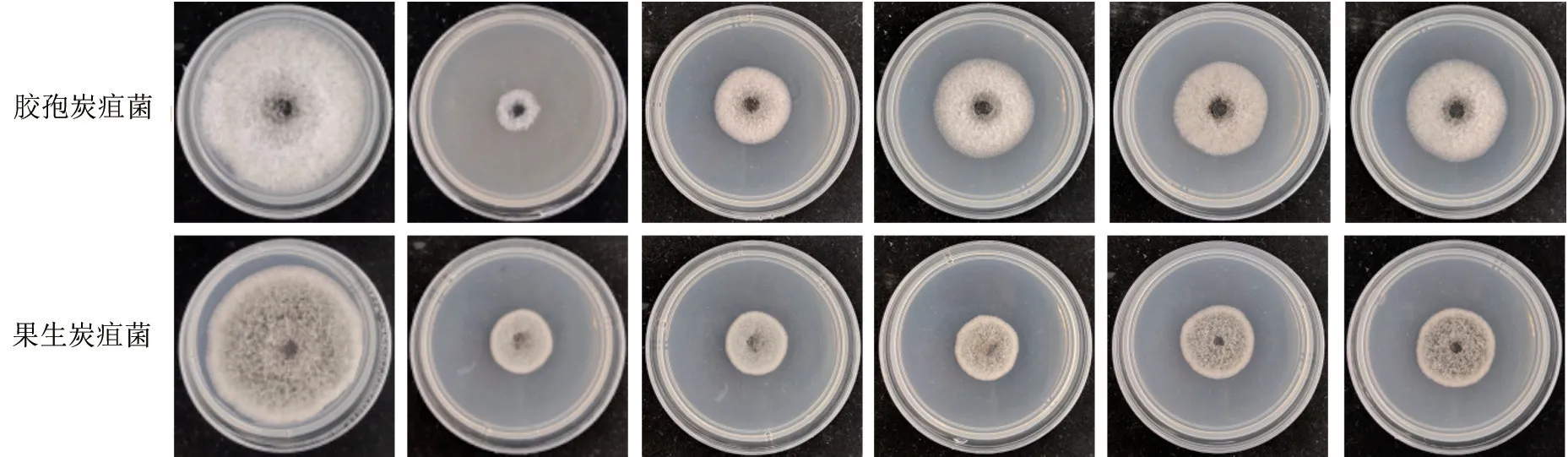
图2 不同浓度YL13 发酵滤液处理下油茶炭疽菌优势种菌落的生长情况Fig.2 Growth of dominant species of C.anthracis in different concentrations of YL13 fermentation filtrate
F10 发酵滤液对胶孢炭疽菌和果生炭疽菌的抑制率相差不大。当F10 发酵滤液稀释至20 倍时,其对胶孢炭疽菌、果生炭疽菌的抑菌率分别为62.20%、61.28%。当F10 发酵滤液稀释至40 倍时,对胶孢炭疽菌、果生炭疽菌的抑菌率下降幅度相似,抑菌率分别为52.76%、55.39%,同样当F10 发酵滤液稀释至100 倍时,其对胶孢炭疽菌、果生炭疽菌的抑菌率分别为39.76%、38.97%。因此可以得出,F10 发酵滤液对胶孢炭疽菌、果生炭疽菌的效价均约为40 倍。不同浓度F10 发酵滤液处理下油茶炭疽菌优势种菌落的生长情况如图3所示。

图3 不同浓度F10 发酵滤液处理下油茶炭疽菌优势种菌落的生长情况Fig.3 Growth of dominant species of C.anthracis in different concentrations of F10 fermentation filtrate
2.3 拮抗菌对离体叶片上油茶炭疽菌的防治效果
拮抗菌离体接种对油茶炭疽病的防治效果见表3。由表3可知,在离体叶片上拮抗菌株对油茶炭疽病均有一定的防治效果。在接种YL13 菌株2 d 后再接种病原菌的预防效果最好,达到了60%,F10 菌株对油茶炭疽病的预防和治疗均是拮抗菌与病原菌相隔1 d 接种效果最佳,防治效果均达到了70%。

表3 拮抗菌离体接种对油茶炭疽病的防治效果Table 3 Prevention and control of anthracnose of C.oleifera by inoculation of YL13/F10 %
3 结论与讨论
本研究结果表明,枯草芽孢杆菌YL13 的发酵滤液对5 种炭疽菌的抑制效果由强到弱依次为胶孢炭疽菌、暹罗炭疽菌、果生炭疽菌、哈锐炭疽菌、山茶炭疽菌,链霉菌F10 的发酵滤液对5 种炭疽菌的抑制效果由强到弱依次为胶孢炭疽菌、果生炭疽菌、哈锐炭疽菌、暹罗炭疽菌、山茶炭疽菌,YL13 和F10 对胶孢炭疽菌的抑制效果均为最佳,抑制率分别为83.46%、62.20%,对山茶炭疽菌抑制率均最低,分别为49.15%、30.99%。YL13 发酵滤液对胶孢炭疽菌的效价约为100 倍,对果生炭疽菌的效价约为400 倍,F10 发酵液对胶孢炭疽菌和果生炭疽菌的效价均约为40 倍。2 株拮抗菌对5 种炭疽菌均具有较为明显的抑制作用,其中YL13 表现出抑菌活性最高,其发酵滤液稀释20 倍后对胶孢炭疽菌的抑制率高达83.46%,当2种拮抗菌的发酵滤液稀释至一定浓度后,抑菌率均发生了不同程度的降低。随着稀释倍数的增大,YL13 的抑菌活性降低速率远超过F10。在离体叶片上拮抗菌株对油茶炭疽病均有一定的防治效果,在接种YL13 菌株2 d 后再接种病原菌的预防效果最好,达到了60%,F10 菌株对油茶炭疽病的预防和治疗均是拮抗菌与病原菌相隔1 d 接种效果最佳,防治效果均达到了70%。
自人类发现可以用微生物来防治植物病害,已有许多高效拮抗菌株被报道[16-17],各类生防菌剂也不断被开发。微生物主要通过产生拮抗物质及竞争、溶菌作用,在寄主植物上对病原菌作用,诱导植物产生抗性及促进植物生长。通过对拮抗菌产生的次级代谢产物进行深入分析,结果表明芽孢杆菌产生的拮抗物质主要有细菌素、酶类、活性蛋白类、脂肽类及多肽类物质等[18],链霉菌可以产生抗菌物质,还产生许多其他生物活性物质,如免疫调节物质、酶制剂、药理活性物质、植物生长调节剂等[19]。本研究中使用的2 株炭疽病拮抗菌分别为枯草芽孢杆菌YL13 和球孢链霉菌球孢亚种F10,YL13 是由健康油茶叶中分离出的拮抗菌Y13 诱变而来,F10 是从油茶根际土壤分离得到的,2 种菌均由中南林业科技大学森林保护和微生物研究团队进行过初步的拮抗试验,均具有良好的抑菌效果[20-23]。前期研究结果表明:枯草芽孢杆菌YL13 是通过分泌蛋白酶、脂肽类物质来影响病原菌菌丝的生长,还可通过分泌相关防御酶诱导植物产生抗性来防治油茶炭疽病;链霉菌F10 是通过分泌蛋白酶和纤维素酶来影响油茶炭疽菌细胞壁的形成,从而抑制其菌丝的生长[24]。此研究结果为开展2 株拮抗生防菌对油茶炭疽病多种病原的抑菌活性及防效研究提供了良好的理论基础。
除了从自然界分离筛选得到生防菌,还可通过与化学农药复配、与其他拮抗微生物相互协同使用、诱变或利用基因工程技术改良生防菌等方式,得到更为高效且稳定的菌株。其中,基因工程改良菌种主要通过诱变、DNA 重组、原生质体融合及准性生殖来实现,是目前研究的热点。张霞等[25]通过转座子Tn917 的转座诱变,构建了枯草芽孢杆菌B931 的突变体库,筛选得到了6 个对小麦全蚀病菌抑制能力丧失且产生生长素、赤霉素、细胞分裂素能力增加的突变体。朱海霞等[26]以对野麦有强致病力的菌株Fusarium oatroseGD-2和TrichodermaHZ-31 作为亲本,进行原生质体融合,得到融合子,盆栽致病力测定结果显示,融合子R1 对野燕麦的防效值高于亲本。将生防菌与其他互融的拮抗微生物共同施用,使之发挥相互协同作用,增强混合菌株的竞争力,也是目前改进生防菌剂效果的常用方式。此外,生防菌不仅可用于防治植物病害,还可在医药、环境保护等领域广泛应用,具有广阔的开发前景。
本研究中得出了2 种拮抗菌对2 种炭疽菌优势种的效价及其对5 种炭疽菌的拮抗能力,但是由于目前尚未深入了解2 种拮抗菌的具体抑菌机制,且不同炭疽菌的菌丝生长速率相差较大,在一定程度上影响了其相对抑菌率,因此,应更加深入地对其产生拮抗作用的抑菌物质、抑菌机制等进行探究。另外,可以对不同地区的炭疽菌优势种进行调查,有针对性地施用菌剂,达到精准施药的目的。目前,微生物防治在实际应用中仍存在许多问题。在田间施用时,由于受到生存环境如温度、湿度、光照、pH 等因素的影响,大多生防菌的效用不稳定,因此目前多数生防菌处于无法推广使用的状态,因此应进一步探究微生物菌剂的田间施用效果。

