Foretinib衍生物LWK-126在不同种属肝微粒体中的代谢稳定性研究
王忠元 杨华丽 崔杏 朱高峰 汤磊 廖伟科

中圖分类号 969.1;R917 文献标志码 A 文章编号 1001-0408(2021)11-1325-05
DOI 10.6039/j.issn.1001-0408.2021.11.08
摘 要 目的:建立测定肝微粒体中Foretinib衍生物LWK-126质量浓度的方法,研究其在大鼠、比格犬、人肝微粒体中的代谢稳定性。方法:采用体外肝微粒体孵育体系,将LWK-126分别溶于由还原型烟酰胺腺嘌呤二核苷酸磷酸溶液启动的大鼠、比格犬、人肝微粒体孵育体系中,于37 ℃水浴下分别孵育0、5、10、20、30、60 min时加入含内标(1 μg/mL甲苯磺丁脲)的乙腈终止反应,并采用超高效液相色谱-串联质谱法检测各孵育体系中LWK-126的质量浓度。以Waters BEH C18为色谱柱,以水(含0.01%甲酸)-乙腈(含0.01%甲酸)为流动相进行梯度洗脱,流速为0.4 mL/min,柱温为30 ℃,进样量为2 μL;离子源为电喷雾电离源,采用正离子模式采集,扫描范围为m/z 50→1 200。以孵育0 min时LWK-126的质量浓度为参照,计算其在不同孵育体系中的剩余百分率与酶动力学参数。结果:LWK-126检测质量浓度的线性范围为0.05~15 μg/mL(R 2=0.999 2),定量下限为0.05 μg/mL,最低检测限为0.01 μg/mL,精密度、准确度、提取回收率和基质效应均符合生物样品定量分析的要求。LWK-126在人、大鼠、比格犬肝微粒体中孵育60 min后的剩余百分率分别为(33.17±4.52)%、(3.14±6.73)%、(1.38±5.85)%,半衰期分别为33.15、11.76、5.62 min,清除率分别为38.45、118.81、245.76 μL/(min·mg)。结论:成功建立了肝微粒体中LWK-126质量浓度的测定方法。LWK-126在不同种属肝微粒体中的代谢稳定性排序依次为人>大鼠>比格犬。
关键词 LWK-126;超高效液相色谱-串联质谱法;肝微粒体;代谢稳定性
ABSTRACT OBJECTIVE: To establish the method for the concentration determination of foretinib derivative LWK-126 in liver microsomes, and to study its metabolism stability in liver microsomes of rats, Beagle dogs and human. METHODS: In the in vitro incubation system of liver microsomes, LWK-126 was dissolved in liver microsomal incubation systems of rats, Beagle dog and human initiated by reduced nicotinamide adenine dinucleotide phosphate solution. After incubation in water at 37 ℃ for 0,5,10,20,30 and 60 min, the reaction was terminated with acetonitrile containing internal standard (1 μg/mL tolbutamide). UPLC-MS/MS method was applied to determine the concentration of LWK-126 in the incubation systems. The determination was performed on Waters BEH C18 column with mobile phase consisted of water (containing 0.1% formic acid)-acetonitrile (containing 0.1% formic acid) by gradient elution at the flow rate of 0.4 mL/min. The column temperature was 30 ℃, and the sample size was 2 μL. The mass spectral analysis was performed in a positive electrospray ionization mode,and the full MS experiment was run with the selective reaction monitoring mode with a scanning range of m/z 50→1 200. Taking the concentration of LWK-126 at 0 min as reference,the remaining percentage and the enzyme kinetic parameters were calculated. RESULTS: The linear range of LWK-126 was 0.05-15 μg/mL (R 2=0.999 2); the lower limit of quantification was 0.05 μg/mL, and the lowest detection limit was 0.01 μg/mL. The precision, accuracy, extraction recovery and matrix effect all met the analysis requirements of biological samples. The remaining percentage of LWK-126 in liver microsomes of human, rats and Beagle dogs for 60 min were (33.17±4.52)%,(3.14±6.73)%,(1.38±5.85)%; t1/2 of them were 33.15, 11.76, 5.62 min; the clearance rates were 38.45, 118.81, 245.76 μL/(min·mg), respectively. CONCLUSIONS: The method for the content determination of LWK-126 in liver microsomes is established successfully. The order of metabolic stability of LWK-126 in liver microsomes of different species is human>rats>Beagle dogs.
KEYWORDS LWK-126; UPLC-MS/MS; Liver microsomes; Metabolic stability
c-Met是受体酪氨酸激酶(RTK)家族Ron亚族中一个原型成员,是唯一一个已知的肝细胞生长因子(HGF)的高亲和力受体(HGFR)[1]。已有研究表明,HGF/c-Met活性与肿瘤的发生、发展和肿瘤细胞的分裂、血管生成、侵袭、转移、耐药性等密切相关,并在多种肿瘤组织中呈现异常的高表达、突变及活性改变[1]。同时,c-Met编码基因的异常扩增、c-Met或HGF的过表达、c-Met编码基因的突变都与肿瘤患者的不良预后有关[2]。目前,已有4种小分子Met抑制剂获批在我国上市,但大部分仅用于治疗携带Met外显子14跳跃突变的非小细胞肺癌患者[3-5]。因此,开发新型、高效的小分子c-Met抑制剂是目前的一个重要研究方向。
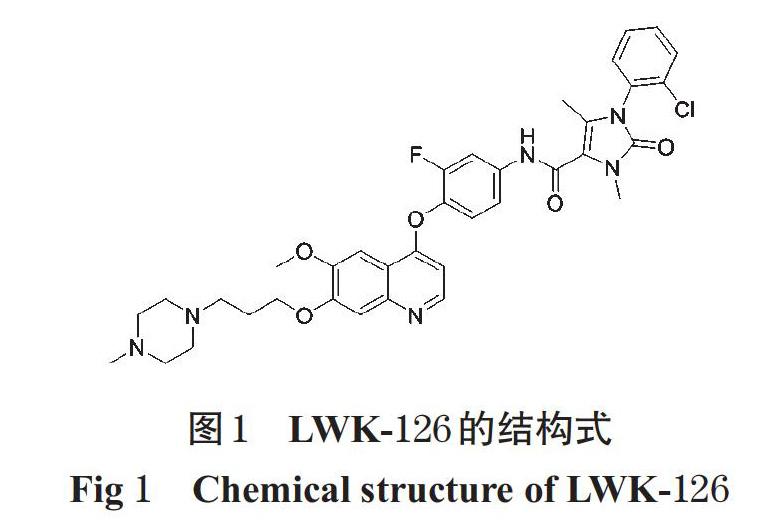
化合物LWK-126(结构式见图1)是一个通过对血管内皮生长因子(VEGF)和HGF受体抑制剂Foretinib的Linker部分进行结构修饰而得到的含咪唑酮酰胺片段的喹啉类衍生物;体外研究表明,LWK-126对c-Met、血管内皮生长因子受体(VEGFR)、干细胞生长因子受体(c-Kit)等多种激酶均表现出较好的抑制活性,半数抑制浓度(IC50)分别为1.42、92.6、38.2 nmol/L[6]。此外,LWK-126对c-Met依赖性肿瘤细胞的抑制活性优于Foretinib,具有一定的开发价值[7]。已有研究表明,在新药研发早期,对先导化合物在不同种属肝微粒体中的体外代谢稳定性进行研究,可有助于评价其代谢差异[8]。为此,本文参考文献[9-10],建立了肝微粒体中LWK-126质量浓度的超高效液相色谱-串联质谱法(UPLC-MS/MS),比较了LWK-126在比格犬、大鼠、人肝微粒体中的代谢稳定性,一方面为LWK-126的成药性评价提供参考,另一方面为其后续的体内药效及毒理学研究的动物选择提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括XevoG2-XS型UPLC-四极杆串联飞行时间质谱仪(配有MassLynx V4.1型质谱工作站、UNIFI 7.0 数据库,美国Waters公司)、DK-98-Ⅱ型电热恒湿水浴锅(天津市泰斯特仪器有限公司)、X1型高速离心机(香港基因有限公司)、JN300-2型氮气吹扫仪(苏州吉米诺仪器有限公司)、FA805N型十万分之一电子天平(上海菁海仪器有限公司)、KH-600E型超声波清洗器(昆山禾创超声仪器有限公司)、DW-86L486型超低温保存箱(青岛海尔股份有限公司)等。
1.2 主要药品与试剂
LWK-126原料药(批号20150216,纯度>98%)由沈阳药科大学提供;甲苯磺丁脲对照品(内标,批号M26M7L15275,纯度>98%)购自上海源叶生物科技有限公司;烟酰胺腺嘌呤二核苷酸磷酸二钠(NADP-Na2,批号718B0225)、葡萄糖-6-磷酸-二钠(G-6-P-Na2,批号116B039)、葡萄糖-6-磷酸脱氢酶(G-6-P-DH,批号20160725)均购自北京索莱宝科技有限公司;甲醇、乙腈均为色谱纯,氯化镁、柠檬酸钠等均为分析纯,其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 肝微粒体
雄性SD大鼠肝微粒体(批号MIC254034)、雄性比格犬肝微粒體(批号MIC257015)均购自上海斯信生物科技有限公司,男女混合人肝微粒体(批号38292)购自美国Corning Costar公司,质量浓度均为20 mg/mL(以蛋白计)。
2 方法与结果
2.1 溶液的制备
2.1.1 LWK-126贮备液 精密称取LWK-126原料药适量,用甲醇溶解并定容于10 mL量瓶中,制成质量浓度为1 mg/mL的LWK-126贮备液。
2.1.2 内标溶液和终止液 精密称取甲苯磺丁脲对照品适量,按“2.1.1”项下方法制备质量浓度为1 mg/mL的甲苯磺丁脲内标溶液。使用前,取上述内标溶液,用乙腈稀释成甲苯磺丁脲质量浓度为1 μg/mL的终止液。
2.1.3 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅酶溶液 称取NADP-Na2 200 mg、G-6-P-Na2 200 mg、氯化镁133 mg,用水溶解并定容至同一10 mL量瓶中,于-20 ℃下保存,记为A液。称取柠檬酸钠44 mg、G-6-P-DH 1 000 U,用水溶解并定容至同一25 mL量瓶中,于-20 ℃下保存,记为B液。使用前,将A液和B液按体积比5 ∶ 1混合均匀,即得NADPH辅酶溶液,其最终浓度为1 mmol/L(以反应产物NADPH计)。
2.2 孵育体系的建立与处理
取大鼠、比格犬、人肝微粒体各0.1 mg,分别用100 mmol/L的磷酸盐缓冲液(PBS,pH=7.4)稀释至0.5 g/L,随即加入LWK-126贮备液适量,使最终孵育体系中LWK-126的质量浓度为5 μg/mL。将上述溶液于37 ℃水浴中预孵育5 min后,立即加入NADPH辅酶溶液启动反应。该孵育体系的总体积为200 μL,其中NADPH的终浓度为1 mmol/L,甲醇的体积分数不超过1%,LWK- 126的终质量浓度为5 μg/mL,肝微粒体的终质量浓度为0.5 μg/mL。将上述各种属孵育体系放置在37 ℃恒温水浴中,分别于孵育0、5、10、20、30、60 min时加入“2.1.2”项下含内标的终止液400 μL终止反应;涡旋均匀,于4 ℃下以16 000 r/min离心10 min,取上清液,用氮气流吹干;残渣用甲醇200 μL复溶,再次以16 000 r/min离心10 min,取上清液适量进样分析,考察各个时间点LWK-126的质量浓度。每个孵育体系平行操作3次。
2.3 LWK-126质量浓度的测定方法
2.3.1 色谱条件与质谱条件 以Waters BEH C18(50 mm×2.1 mm,1.7 μm)为色谱柱,Waters VanGuard BEH C18(5 mm×2.1 mm,1.7 μm)为保护柱;以水(含0.01%甲酸)为流动相A、乙腈(含0.01%甲酸)为流动相A进行梯度洗脱(0~0.5 min,5%A;0.5~4.5 min,5%A→98%A;4.5~5 min,98%A→5%A);流速为0.4 mL/min;柱温为30 ℃;进样量为2 μL。离子源为电喷雾电离源(ESI),离子源温度为100 ℃;毛细管电压为1.5 kV,锥孔电压为30 V,脱溶剂气温度为400 ℃,锥孔气流量为50 L/h,脱溶剂气流量为800 L/h;采用选择反应检测(SRM),采集正离子,扫描范围为m/z 50→1 200;数据采集分析软件为Masslynx V4.1,采集时间为5 min。
2.3.2 专属性考察 分别取适量空白孵育样品(不含待测物和内标,以高温灭活的大鼠肝微粒体为介质,其余按“2.2”项下方法制得)、LWK-126对照样品(含待测物5 μg/mL和内标1 μg/mL,以高温灭活的大鼠肝微粒为介质,按“2.2”项下方法制得)和孵育15 min时的LWK-126样品(大鼠肝微粒体,按“2.2”项下方法制得)各适量,按“2.3.1”项下条件进样分析,记录色谱图。结果,LWK-126的色谱峰峰形良好,保留时间约为2.08 min,孵育体系中内源性物质不干扰LWK-126的测定,表明该方法专属性良好,详见图2。
2.3.3 线性关系、定量下限与最低检测限考察 取“2.1.1”项下LWK-126贮备液适量,加入至经高温灭活的大鼠肝微粒体孵育体系中,制成LWK-126质量浓度分别为0.05、0.1、0.5、1、2.5、5、10、15 μg/mL的系列孵育样品溶液,按“2.2”项下方法处理后,取上清液按“2.3.1”项下条件进样分析,记录峰面积。以LWK-126质量浓度(x, μg/mL)为横坐标、LWK-126与内标的峰面积比值(y)为纵坐标进行回归分析,得回归方程为y=11.16x+0.5 (R 2=0.999 2),结果表明LWK-126检测质量浓度的线性范围为0.05~15 μg/mL,定量下限为0.05 μg/mL,最低检测限为0.01 μg/mL(按信噪比3 ∶ 1计)。
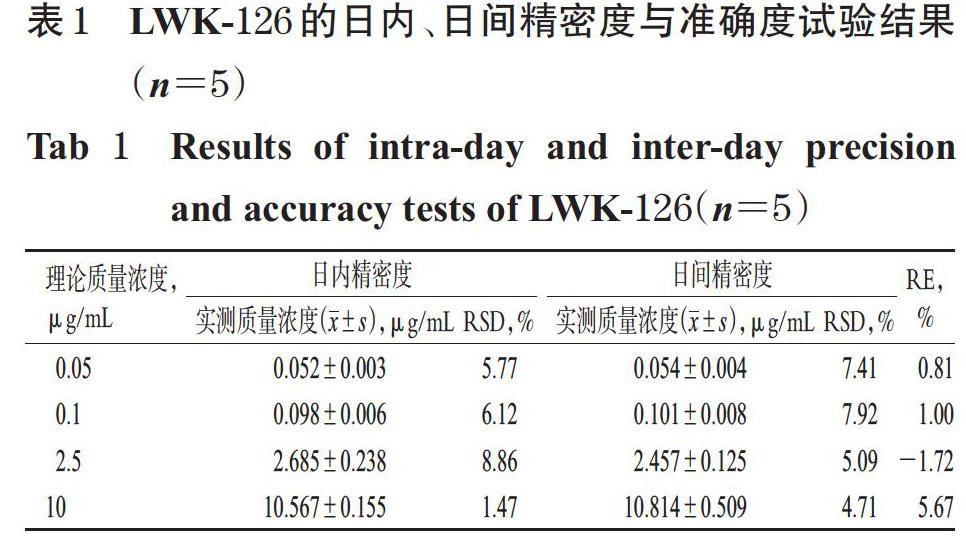
2.3.4 准确度与精密度试验 取“2.1.1”项下LWK-126贮备液适量,加入至经高温灭活的大鼠肝微粒体孵育体系中,制成定量下限质量浓度(0.05 μg/mL)的孵育样品溶液和低、中、高质量浓度(0.1、2.5、10 μg/mL)的質控样品溶液,各5份。各样品按“2.2”项下方法处理后,取上清液按“2.3.1”项下条件进样分析,记录峰面积,考察日内精密度;连续测定3天,考察日间精密度。以实测质量浓度与理论质量浓度进行比较以评价准确度,结果以相对误差(RE)表示。结果,定量下限质量浓度孵育样品与各质控样品的日内、日间RSD均小于10%,RE均在±6%之内,表明方法准确度和精密度良好,详见表1。
2.3.5 提取回收率与基质效应试验 取“2.1.1”项下LWK-126贮备液适量,加入至经高温灭活的大鼠肝微粒体孵育体系中,制成低、中、高质量浓度(0.1、2.5、10 μg/mL)的质控样品溶液,按“2.2”项下方法处理后,取上清液按“2.3.1”项下条件进样分析,记录峰面积(A1)。将经高温灭活的大鼠肝微粒体孵育体系按“2.2”项下方法处理后,加入LWK-126贮备液适量,制成与上述低、中、高质量浓度一致的样品溶液,按“2.3.1”项下条件进样分析,记录峰面积(A2)。以甲醇配制与上述低、中、高质量浓度一致的LWK-126溶液,按“2.3.1”项下条件进样分析,记录峰面积(A3)。每种样品平行操作5次,计算提取回收率和基质效应:提取回收率(%)=(A1/A2)×100%,基质效应(%)=(A2/A3)×100%,结果见表2。
2.3.6 稳定性试验 取“2.1.1”项下LWK-126贮备液适量,加入至经高温灭活的大鼠肝微粒体孵育体系中,制成低、中、高质量浓度的孵育样品溶液(0.1、2.5、10 μg/mL),各5份。各样品按“2.2”项下方法处理后,分别在室温放置24 h、4 ℃冰箱中冷藏24 h、常温至-80 ℃反复冻融3次后,按“2.3.1”项下条件进样分析,记录峰面积,代入回归方程计算质量浓度。结果,各孵育样品溶液质量浓度的RSD均小于10%,表明LWK-126孵育样品溶液在上述条件下稳定性良好,详见表3。
2.4 LWK-126在肝微粒体中的代谢稳定性
2.4.1 肝微粒体孵育体系建立的验证 为考察待测物是否受到非酶催化降解的影响,本研究按“2.2”项下方法设立空白组(即肝微粒体孵育体系中加入经高温灭活的肝微粒体)和阴性对照组(即肝微粒体孵育体系中不加入启动因子NADPH辅酶溶液)人、大鼠、比格犬肝微粒体孵育体系,分别于孵育0、5、10、20、30、60 min时按“2.3.1”项下条件进样分析,并按标准曲线法计算体系中LWK-126的质量浓度。以孵育0 min时LWK-126的质量浓度为参照,以其余各时间点LWK-126的质量浓度与参照的比值计算剩余百分率。实验平行操作3次。结果,LWK-126在空白组和阴性对照组孵育体系中孵育60 min时的剩余百分率在101.3%~108.8%(以平均值表示)范围内,表明可用本研究所创建的肝微粒体孵育体系对LWK-126的代谢特征进行探究,详见表4。
2.4.2 LWK-126在不同种属肝微粒体中的剩余百分率测定 按“2.2”项下方法建立人、大鼠、比格犬肝微粒体孵育体系,分别于孵育0、5、10、20、30、60 min时按“2.3.1”项下条件进样分析,并按标准曲线法计算体系中LWK-126的质量浓度,再按“2.4.1”项下方法计算各时间点LWK-126的剩余百分率。实验平行操作3次。结果,LWK-126在人、大鼠肝微粒体孵育体系中在5~10 min时消除最快,而在比格犬肝微粒体孵育体系中则是0~5 min时消除最快。LWK-126在人、大鼠、比格犬肝微粒体中孵育60 min时的剩余百分率分别为(33.17±4.52)%、(3.14±6.73)%、(1.38±5.85)%,详见表5。
2.4.3 LWK-126在肝微粒体中的酶动力学参数计算 在人、大鼠、比格犬肝微粒体中,以LWK-126剩余百分率的自然对数(y)与孵育时间(x)进行线性回归分析,得LWK-126在人、大鼠、比格犬肝微粒体中的回归方程分别为y人=-0.019 3x人+4.557 1(R 2=0.994 3)、y鼠= -0.059 2x鼠+4.590 0(R 2=0.998 7)、y犬=-0.123 7x犬+4.602 6(R 2=0.992 6)。根据各线性回归方程的斜率计算体外代谢的半衰期(t1/2)与清除率(CLint):t1/2=-0.693/k(k是消除速率常数)、CLint=[(0.693/t1/2)×孵育体积(mL)]/肝微粒体质量(mg)[11]。结果显示,LWK-126在人、大鼠、比格犬肝微粒体中的t1/2分别为33.15、11.76、5.62 min,CLint分别为38.45、118.81、245.76 μL/(min·mg)。
3 讨论
本研究成功建立了LWK-126的UPLC-MS/MS定量分析方法,方法的专属性、线性关系、定量下限、精密度、准确度、提取回收率和基质效应均符合生物样品定量分析的相关要求[12]。为防止溶解药物的有机溶剂对肝微粒体起灭活作用,在实验操作中保证了孵育总体系中有机溶剂(甲醇)的体积分数不超过1%,以确保实验结果的可信度[11]。在本研究中,LWK-126加入到孵育体系中的终质量浓度为5 μg/mL、加入到孵育体系的肝微粒体的终质量浓度为0.5 μg/mL较为合适,因LWK-126的质量浓度过高,可能导致肝微粒体中酶系饱和,而质量浓度过低又不利于检测[11]。
为进一步确认本实验中肝微粒体孵育体系的可靠性,本研究还设置了空白组与阴性对照组。结果显示,在高温使酶灭活的空白组以及不加入NADPH辅酶溶液的阴性对照组中LWK-126的剩余百分率在101.3%~108.8%之间,表明本实验所建立的肝微粒体孵育体系可靠,可用于对待测物LWK-126的代谢特征探究。
根据t1/2可判断化合物是否稳定,参照标准如下:t1/2<30 min,表明受试物代谢不稳定;t1/2在30~90 min之间,表明受试物代谢稳定性中等;t1/2>90 min,表明受试物代谢稳定性良好[13]。本研究结果显示,LWK-126在大鼠肝微粒体(t1/2=11.76 min)、比格犬肝微粒体(t1/2= 5.62 min)中的代谢速率相近且代谢不稳定,而在人肝微粒体(t1/2=36.15 min)中的代谢速率相对于前两种肝微粒体较慢,属于中等稳定。这表明LWK-126在不同种属肝微粒体中的代谢速率存在种属差异,推测其体内代谢稳定性不理想,易被细胞色素P450酶所代谢[8,11],需进一步对其结构进行修饰以提高代谢稳定性。
综上所述,本研究成功建立了测定肝微粒体中LWK-126质量浓度的UPLC-MS/MS法;LWK-126在不同种属肝微粒体中的代谢稳定性排序依次为人>大鼠>比格犬。后期应借助高分辨质谱及核磁共振等波谱手段对肝微粒体代谢产物进行结构确证,明确其体外代谢特征,为设计出代谢稳定、成药性好的c-Met抑制剂提供理论依据。
参考文献
[ 1 ] BIRCHMEIER C,BIRCHMEIER W,GHERARDI E,et al. Met metastasis,motility and more[J]. Nat Rev Mol Cell Bio,2003,4(12):915-925.
[ 2 ] ENGELMAN J A,ZEJNULLAHU K,MITSUDOMI T,et al. Met amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling[J]. Science,2007,316(5827):1039-1043.
[ 3 ] ZHANG Y Z,XIA M F,JIN K,et al. Function of the c-Met receptor tyrosine kinase in carcinogenesis and associated therapeutic opportunities[J]. Mol Cancer,2018,17(1):45-59.
[ 4 ] BRADLEY C A,SALTO-TELLEZ M,BARDELLI A,et al. Targeting c-MET in gastrointestinal tumours:rationale,opportunities and challenges[J]. Nat Rev Clin Oncol,2017,14(9):562-576.
[ 5 ] HUGHES V S,SIEMANN D W. Have clinical trials pro- perly assessed c-Met inhibitors[J]. Trends Cancer,2018,4(2):94-97.
[ 6 ] LIAO W K,HU G,GUO Z,et al. Design and biological evaluation of novel 4-(2-fluorophenoxy)quinoline derivatives bearing an imidazolone moiety as c-Met kinase inhibitors[J]. Bioorg Med Chem,2015,23(15):4410-4422.
[ 7 ] 宫平,刘亚婧,赵燕芳,等.含咪唑酮的4-苯氧基取代喹啉类化合物及其应用:中国,201510259084.5[P]. 2015- 09-23.
[ 8 ] WRING S A,SILVER I S,SERABJIT C J. Automated quantitative and qualitative analysis of metabolic stability:a process for compound selection during drug disco- very[J]. Method Enzymol,2002,357:285-296.
[ 9 ] 饒静,刘剑敏,吴鹏飞,等.新型他克林衍生物ST09与ST10的体外代谢研究[J].中国药学杂志,2017,52(11):965-970.
[10] 邓星,罗莉娅,苟立平,等.采用UPLC-MS/MS法研究辣薄荷基厚朴酚在不同种属肝微粒体中的代谢特征[J].中国药房,2019,30(2):170-175.
[11] 张丽,蔡进,班玉娟,等.采用UPLC-MS/MS法研究树豆酮酸A在不同种属肝微粒体中的代谢差异[J].中国药房,2019,30(18):2497-2502.
[12] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-472.
[13] WATERBEEMD H V,GIFFORD E. ADMET in silico modelling:towards prediction paradise?[J]. Nat Rev Drug Discov,2003,2(3):192-204.
(收稿日期:2021-01-15 修回日期:2021-03-16)
(编辑:邹丽娟)

