人血浆中安罗替尼质量浓度测定方法的建立及其应用
周利娟 武正华 汪硕闻 缪文清 包婺平 包爱华 范国荣


摘 要 目的:建立测定人血浆中安罗替尼质量浓度的方法并应用于临床。方法:以醋酸铵为盐析助剂,以乙腈为溶剂,采用盐析辅助液液萃取对血浆样品进行前处理;以伏立康唑为内标,采用液相色谱-串联质谱法(LC-MS/MS)测定。色谱柱为Waters X Bridge C18,流动相为0.2%甲酸水溶液-乙腈(梯度洗脱),流速为1 mL/min,柱温为40 ℃,进样量为10 μL,分流比为3 ∶ 7;离子源为电喷雾离子源,以多反应监测模式进行正离子扫描,用于定量分析的离子对分别为m/z 408.3→339.3(安罗替尼)、m/z 350.2→281.3(内标)。结果:安罗替尼检测质量浓度的线性范围为0.2~200 ng/mL(R2=0.996 7);定量下限为0.2 ng/mL;日内、日间精密度试验的RSD均小于12%(n=6或n=3);准确度为90.92%~108.00%(n=6或n=3);平均提取回收率为87.51%~100.00%(RSD<8%,n=6);平均基质效应为96.66%~99.93%(RSD<5%,n=6)。3例使用安罗替尼治疗的非小细胞肺癌患者体内的血药浓度为8.74~65.60 ng/mL。结论:该方法操作简单、准确度高、专属性强,可用于非小细胞癌患者体内安罗替尼的血药浓度监测。
关键词 安罗替尼;液相色谱-串联质谱技术;盐析辅助液液萃取;治疗药物监测
ABSTRACT OBJECTIVE: To establish a method for concentration determination of anlotinib in human plasma and apply it in the clinic. METHODS: The plasma samples were pretreated by salting-out assisted with liquid-liquid extraction with ammonium acetate as salting out assistant and acetonitrile as solvent. Using voriconazole as internal standard, LC-MS/MS method was adopted. The separation was performed on Waters X Bridge C18 column with mobile phase consisting of 0.2% formic acid solution- acetonitrile (gradient elution) at the flow rate of 1 mL/min. The column temperature was set at 40 ℃, and sample size was 10 μL. The split ratio was 3 ∶ 7. The electrospray ion source and multiple reaction monitoring mode were used for the analysis. The ion pair of anlotinib and internal standard under positive ion mode were m/z 408.3→339.3 and m/z 350.2→281.3, respectively. RESULTS: Anlotinib showed a good linear relationship in the concentration range of 0.2-200 ng/mL (R2>0.996 7). The lowest limit of quantitation was 0.2 ng/mL. Intra-day and inter-day RSDs were no more than 12% (n=6 or n=3). Accuracies were 90.92%-108.00% (n=6 or n=3). The average extraction recoveries were 87.51%-100.00%(RSD<8%,n=6). The average matrix effects were 96.66%-99.93%(RSD<5%,n=6). The plasma concentration of 3 patients with NSCLC treated with anlotinib was 8.74-65.60 ng/mL. CONCLUSIONS: The method is simple, accurate and specific, and is suitable for the plasma concentration monitoring of anlotinib in NSCLC patients.
KEYWORDS Anlotinib; LC-MS/MS; Salting-out assisted liquid-liquid extraction; Therapeutic drug monitoring
鹽酸安罗替尼是我国自主研发的一种新型口服酪氨酸激酶抑制剂,能够有效抑制血管内皮生长因子受体、血小板衍生生长因子受体、纤维母细胞生长因子受体、干细胞因子受体(c-Kit)等激酶,具有抗肿瘤血管生成、抑制肿瘤生长的双重作用[1-2]。基于ALTER 0303研究(安罗替尼治疗晚期非小细胞肺癌患者的Ⅲ期临床研究)的良好结果,国家食品药品监督管理局于2018年5月8日正式批准安罗替尼单药用于晚期非小细胞肺癌患者的三线及以上治疗。有研究表明,安罗替尼的药动学特征与其他酪氨酸激酶抑制剂类似,即经肝药酶代谢,其血浆蛋白结合率较高、消除半衰期较长,长期连续使用后药物在体内有明显的蓄积,且个体间表现出较大的药动学差异[3-4];此外,该药在我国上市时间短,临床用药经验有限,且其对细胞色素P450酶(包括CYP2D1、CYP3A1、CYP3A2)有显著诱导作用,在长期使用过程中,可能与食物、配伍药物发生相互作用[5]。关于安罗替尼致不良反应已经有大量文献报道[6-7],但目前尚未有研究探索安罗替尼血浆浓度与疗效之间的相关性,且缺乏稳定、可靠的血药浓度定量检测方法。因此,为对肿瘤患者进行安罗替尼治疗药物监测(TDM)、为浓度-效应等相关性研究提供检测技术支持、保证药物使用的安全性和有效性,有必要建立相关的定量分析方法。
目前,关于安罗替尼的分析检测方法,国内外文献报道有限,且在现有的大多数安罗替尼疗效及安全性评价研究中均未进行相关定量分析[3,8-10],仅有少数国内学者建立了测定人血浆中安罗替尼浓度的液相色谱-串联质谱法(LC-MS/MS),并将其用于研究安罗替尼胶囊在我国成年肿瘤患者体内的药动学特征[11]。该法虽然操作简单,但由于血浆内源性物质较复杂,随着进样次数的增多会造成检测系统压力过高、分析重现性差、色谱柱损坏、灵敏度降低等现象,故应用受限[12]。Zhong等[3]在测定安罗替尼含量时,使用乙酸乙酯进行液液萃取,需要用氮气流吹干并复溶,步骤繁琐且耗时。盐析辅助液液萃取是利用盐析作用将水溶性有机溶剂(如乙腈)从血浆或水相中分离出来,可用于提取药物和代谢物,尤其适用于亲水性化合物的分析[13]。在进行盐析辅助液液萃取时,仅需要向样品中加入高浓度的盐和水溶性有机试剂,经过涡旋离心后即可取上清液进样分析,与传统的液液萃取和固相萃取相比,不仅步骤少、耗时短,而且环保、经济;与直接蛋白沉淀相比,可获得基质成分更为单一的提取物[13]。基于此,本研究首次建立了基于盐析辅助液液萃取联合LC-MS/MS技术测定肿瘤患者血浆中安罗替尼浓度的方法,旨在为该药的TDM及临床个体化应用提供技术支持。
1 材料
1.1 主要仪器
本文所用主要仪器包括LC-20A型液相色谱系统及配备的LC-20AD型二元泵、DGU-20A3型脱气机、SIL-20A型自动进样器、CTO-20AC型柱温箱(日本Shimadzu公司),API 4000型三重四极杆串联质谱仪及配备的电喷雾电离源(ESI)和Analyst Software 1.6工作站(美国AB Sciex公司),SCILOGEX MX-S型涡旋混合器(美国Scilogex公司),Sorvall Legend Micro 21R型冷冻离心机(美国Thermo Fisher Scientific公司),SK5200H型超声仪(上海科导超声仪器有限公司),TD4型低速台式离心机(长沙湘仪离心机仪器有限公司),XS205 Dual Range型电子分析天平(瑞士Mettler Toledo公司),Hi-Tech型水纯化系统(上海和泰仪器有限公司)等。
1.2 主要药品与试剂
本文所用主要药品和试剂包括安罗替尼对照品(加拿大TRC公司,批号6-RTU-81-1,纯度95%)、伏立康唑对照品(大连美仑生物技术有限公司,批号J1211AS,纯度>99%)等;乙腈为色谱纯,醋酸、甲酸等为分析纯,水为自制的去离子超纯水(18.2 MΩ)。
1.3 血浆样品来源
1.3.1 空白血浆 选择上海市第一人民医院作体检的健康体检者,在其开展血常规等检查时征得其知情同意后采集静脉血。上述血样经处理后作为空白血浆,用于定量分析的方法学考察。
1.3.2 患者血浆 患者血浆样本由上海市第一人民医院呼吸科提供,分别为3例使用安罗替尼的患者服药前后的血浆样品。患者的安罗替尼用药剂量为12 mg/d,连续服用2周,停药1周,即3周(21天)为1个疗程。本研究已经通过了医院医学伦理委员会的批准(编号为2019-N-021),患者均已知情同意。
2 方法与结果
2.1 溶液的配制
2.1.1 贮备液 精密称取安罗替尼对照品10.0 mg、伏立康唑(内标)对照品10.0 mg,分别置于10 mL量瓶中,用甲醇溶解并稀释成质量浓度均为1.0 mg/mL的安罗替尼贮备液和内标贮备液,于-40 ℃冰箱保存,备用。
2.1.2 工作液 将“2.1.1”项下安罗替尼贮备液用80%甲醇逐级稀释,配制成安罗替尼质量浓度分别为4 000、2 000、400、80、40、8、4 ng/mL的系列工作溶液;同法配制安罗替尼质量浓度分别为3 200、160、8、4 ng/mL的系列質控工作液。将“2.1.1”项下伏立康唑贮备液用乙腈稀释,配制成质量浓度为200 ng/mL的内标溶液。上述溶液均置于4 ℃冰箱中保存,备用。
2.1.3 标准曲线溶液和质控样品溶液 精密量取“2.1.2”项下各系列工作液和质控工作液适量,用空白血浆稀释20倍,制成安罗替尼质量浓度分别为200、100、20、4、2、0.4、0.2 ng/mL的标准曲线溶液和质量浓度分别为160、8、0.4、0.2 ng/mL的高、中、低质量浓度质控样品溶液和定量下限(LLOQ)质量浓度血浆样品溶液。
2.2 待测血浆样品前处理
精密吸取待测血浆样品50 μL,置于1.5 mL离心管中,加入内标溶液(200 ng/mL)5 μL,涡旋混匀;加入醋酸铵溶液(5 mol/L)50 μL,涡旋混匀1 min;加入乙腈100 μL,再涡旋混匀3 min,于4 ℃下以12 000 r/min离心10 min,取上层清液进样分析。
2.3 色谱条件与质谱条件
2.3.1 色谱条件 色谱柱为Waters X Bridge C18(4.6 mm×100 mm,3.5 μm);以0.2%甲酸水溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~0.5 min,20%B→80%B;0.5~3 min,80%B;3~3.1 min,80%B→20%B;3.1~5.0 min,20%B);流速为1 mL/min;柱温为40 ℃;进样量为10 μL;柱后用三通3 ∶ 7分流,3/10进入质谱检测。
2.3.2 质谱条件 离子源为ESI,检测模式为正离子模式,选择多反应监测方式(MRM)进行一/二级质谱检测。气帘气为25 psi,碰撞气为10 psi,雾化气为50 psi,辅助气为45 psi,喷雾电压为5 500 V,离子源温度为500 ℃;用于定量分析的离子对分别为m/z 408.3→339.3(安罗替尼,去簇电压90 V,入口电压10 V,碰撞电压33 V,出口电压15 V)、m/z 350.2→281.3(内标,去簇电压90 V,入口电压10 V,碰撞电压27 V,出口电压15 V),驻留时间均为200 ms。
2.4 專属性考察
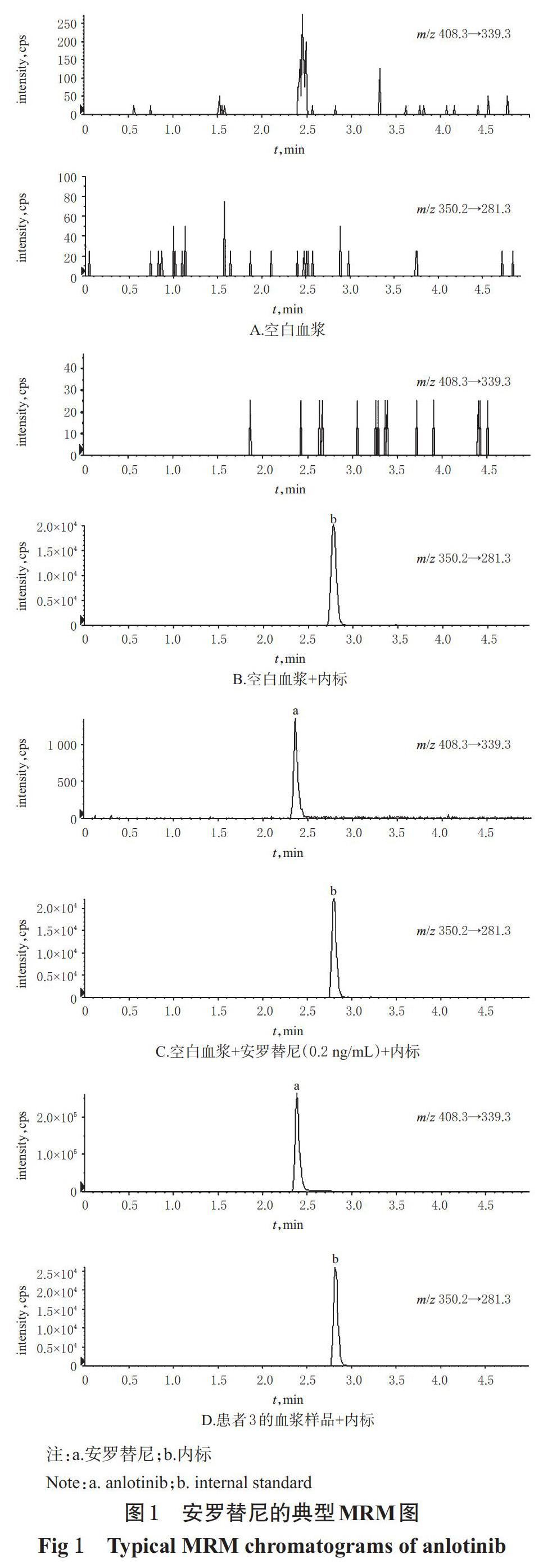
取空白血浆、空白血浆+安罗替尼(0.2 ng/mL)、患者3服药前0.5 h的血浆样品各适量,按“2.2”项下方法处理后,再按“2.3”项下条件进样分析;同时,设置不加内标且同法处理的空白血浆为参照,考察方法的专属性。结果,血浆样品中安罗替尼和内标的保留时间分别约为2.4、2.8 min;色谱峰峰形良好,血浆样品中的内源性物质和其他物质均不干扰安罗替尼和内标的测定,表明该方法专属性较好。安罗替尼的典型MRM图见图1。
2.5 残留评估
取“2.1.3”项下质量浓度为200 ng/mL的安罗替尼标准曲线溶液,按“2.2”项下方法处理后,再按“2.3”项下条件进样分析;随后,取空白血浆适量,按“2.2”项下方法处理后,再按“2.3”项下条件进样分析以评估残留。结果,在该分析条件下,血浆样品中安罗替尼及内标伏立康唑均无残留。
2.6 线性关系和定量下限考察
取“2.1.3”项下质量浓度分别为200、100、20、4、2、0.4、0.2 ng/mL的安罗替尼标准曲线溶液,按“2.2”项下方法处理后,再按“2.3”项下条件进样分析,记录峰面积。以安罗替尼的质量浓度(x)为横坐标、安罗替尼与内标伏立康唑的峰面积比值(y)为纵坐标,采用最小加权二乘法以1/x2为权重因子进行标准曲线拟合,得安罗替尼回归方程为y=0.081 8x+0.014 2(R2=0.996 7),其检测质量浓度的线性范围为0.2~200 ng/mL,定量下限为0.2 ng/mL。
2.7 精密度和准确度试验
取“2.1.3”项下低、中、高质量浓度质控样品溶液和定量下限质量浓度血浆样品溶液适量,按“2.2”项下方法处理后,再按“2.3”项下条件连续进样测定6次,考察日内精密度;连续测定3天,考察日间精密度。以实测质量浓度与理论质量浓度的比值来表示准确度。结果,安罗替尼各质量浓度样品的日内RSD为0.81%~10.27%(n=6),日间RSD为3.91%~8.64%(n=3),准确度为90.92%~108.00%(n=6或n=3),表明该方法的精密度和准确度均良好,详见表1。
2.8 提取回收率试验
取“2.1.3”项下低、中、高质量浓度质控样品溶液,各平行6份,按“2.2”项下方法处理后,再按“2.3”项下条件进样分析,记录待测成分峰面积(A1);另取空白血浆,按“2.2”项下方法处理后,加入“2.1.2”项下低、中、高质量浓度质控工作液适量(使最终质量浓度与质控样品溶液对应),按“2.3”项下条件进样分析,记录待测成分峰面积(A2);按A1/A2×100%计算提取回收率。结果,安罗替尼各质量浓度样品的平均提取回收率为87.51%~100.00%(RSD<8%,n=6),表明提取方法对样品定量分析的影响较小,详见表2。
2.9 基质效应试验
分别取6份不同来源的空白血浆各50 μL,按“2.2”项下方法处理,取上清液,即得空白基质。向此空白基质中加入“2.1.2”项下低、高质量浓度质控工作液适量(使最终质量浓度与“2.7”项下低、高质量浓度质控样品溶液对应),各平行6份,按“2.3”项下条件进样分析,记录待测成分峰面积(B1)。另取“2.1.2”项下低、高质量浓度质控工作液,用乙腈稀释,制成与上述质量浓度对应的安罗替尼对照品溶液,各平行6份,按“2.3”项下条件进样分析,记录待测成分峰面积(B2)。以B1/B2×100%计算基质效应。结果,安罗替尼各质量浓度样品的平均基质效应为96.66%~99.93%(RSD<5%,n=6),表明在该检测条件下,基质对待测物定量分析的影响可以忽略,详见表3。
2.10 稳定性考察
取“2.1.3”项下低、中、高质量浓度质控样品溶液,各平行6份,考察其在室温放置12 h、按“2.2”项下方法处理后在进样器放置24 h、反复冻融3次(-40~24 ℃)和-40 ℃放置30天的稳定性。结果,安罗替尼各质量浓度质控样品在上述条件下放置的准确度为88.83%~106.19%,RSD为2.60%~11.24%(n=6),表明各样品在上述条件下稳定性良好。
2.11 非小细胞肺癌患者体内安罗替尼血药浓度的检测
采用上述盐析辅助液液萃取结合LC-MS/MS技术检测3例非小细胞肺癌患者体内安罗替尼的血药浓度。其中,女性2例、男性1例,年龄56~62岁。本研究已通过医院伦理委员会的批准,患者及家属均知情且签署知情同意书。取患者血浆样品50 μL,平行2份,按“2.2”项下方法处理后,再按“2.3”项下条件进样分析,记录峰面积。根据当日随行标准曲线计算血浆中安罗替尼的质量浓度,结果以平均值表示。其中,患者1为接受安罗替尼治疗的第1个疗程,抽血时间为该疗程的第3天;患者2和患者3均为接受安罗替尼治疗的第3个疗程,抽血时间分别为该疗程的第3天和第7天。结果,3例患者血药浓度检测结果与文献[4]报道基本一致,详见表4。
3 讨论
3.1 LC-MS/MS 条件的优化
本研究前期考察了乙腈、甲醇作为有机相以及不同浓度甲酸水溶液作为水相对待测成分色谱峰峰形和响应值的影响。结果,当以乙腈作为有机相时,待测成分的响应值明显高于以甲醇作为有机相时;在水相中加入甲酸可以提高安罗替尼的响应值,并可以使出峰时间提前;且当在水相中加入体积分数为0.2%的甲酸时,待测成分的色谱峰峰形较好且响应较强。
本课题组选取了两种不同的色谱分析柱,分别是Waters X Bridge C18(100 mm×4.6 mm,3.5 μm)和Agilent Zorbax SB AQ(150 mm×4.6 mm,5 μm)。虽然Agilent Zorbax SB AQ也可以获得较好的色谱峰峰形和响应值,但是所用分析时间较长,因此本研究选择了峰形好且分析时间更短(共5 min)的Waters X Bridge C18作为分析柱。
此外,本課题组还考察了柱温(25、30、35、40、45 ℃)对待测成分色谱峰峰形和响应值的影响。结果,当柱温为40 ℃时,待测成分的响应值高且峰形好,故最终确定柱温为40 ℃。
3.2 内标物的选择
文献中报道的酪氨酸激酶抑制剂的定量检测方法大多以同位素作为内标,但是同位素价格昂贵且不易获得[10-11]。伏立康唑是在肿瘤患者中较少使用的抗真菌药物,不仅在本研究所建的检测条件下与待测成分有相似的色谱行为,而且也不会与待测成分检测通道产生串扰现象,因此本研究选择伏立康唑作为内标。
3.3 血浆样品前处理方法的选择
关于小分子酪氨酸激酶抑制剂生物样品的前处理方法,学者大多采用蛋白沉淀、液液萃取等[11,14]。但是血浆中含有大量的磷脂和蛋白质等杂质,若仅经简单的蛋白沉淀处理,残余的磷脂和蛋白会随着进样次数的增加而对色谱柱造成损伤,从而使检测的灵敏度降低;然而以液液萃取作为生物样品前处理方法,存在操作繁琐、耗时长、人力和试剂消耗量较大等不足,其实际应用较为受限[13]。本研究基于医院临床监测样本量大和时效性要求高等特点,采用盐析辅助液液萃取的方法对血浆样品进行前处理,该方法步骤和蛋白沉淀一样简单,仅需要在乙腈蛋白沉淀的基础上向血浆样品中加入5 mol/L的醋酸铵溶液,无需氮气流吹干,仅通过涡旋离心便可获得基质成分相对更为单一的样品;同时,由于乙腈与血浆分相,既实现了对样品的浓缩,又提高了检测的灵敏度[13]。此外,本研究前处理过程中单个样品的乙腈使用量仅为100 μL,相较于传统的液液萃取减少了有机溶剂的使用量,故此法是一种经济、环保的前处理方法。在盐析助剂的选择上,本研究选择了醋酸铵。相较于氯化钠等其他无机盐,醋酸铵具有挥发性,对质谱的影响更小。同时,笔者在研究过程中发现,当醋酸铵溶液浓度为5 mol/L、体积为50 μL时,乙腈与血浆分层更加明显,故最终确定了“2.2”项下的血浆样品前处理方法。
3.4 方法建立的必要性及结果分析
酪氨酸激酶抑制剂口服给药的方式使这类药物的药动学特征较为复杂。个体间药动学及疗效的差异易受到药物靶点遗传异质性、肝药酶及转运蛋白编码基因多态性、患者治疗依从性、配伍药物相互作用等因素的影响,已经有多项研究发现酪氨酸激酶抑制剂血药浓度与疗效或毒性之间存在关联[15-19]。
TDM可通过测定患者血浆中药物的浓度,并将结果与临床指南或目标水平进行比较,以实现个体化给药,达到药物疗效与毒性之间的平衡[20]。2017年美国药师协会对大量的临床数据进行总结,汇编了《肿瘤治疗中激酶抑制剂治疗药物监测实践指南》,推动了酪氨酸激酶抑制剂TDM的临床实践[21]。
安罗替尼上市时间短,临床用药经验不足,尚未有研究报道其血药浓度与效应之间的关联。虽然,其现有治疗方案为服药2周、停药1周,抗肿瘤效果好且毒性可控,但长期安全性及疗效数据有限[4]。本研究将所建方法应用于3例服用安罗替尼患者的血药浓度的检测,同时在其治疗过程中均未发现相关不良反应的发生。由于安罗替尼为非小细胞肺癌患者的三线用药方案,临床使用时间较短,因此本课题组收集到的临床样本量有限,加之抽血时间点不一致,故无法评价药物的效果并明确其有效治疗窗。因此,未来尚需进一步进行试验设计及实践,收集一定量的患者样本后,进行血药浓度-效果关联性分析,为今后安罗替尼的TDM提供依据。
4 结语
综上所述,本研究建立了基于盐析辅助液液萃取结合LC-MS/MS技术测定肿瘤患者血浆中安罗替尼浓度的分析方法;该方法所用血浆量少,不仅操作简单,还可以获得成分相对的单一的基质,且灵敏度高、精密度和准确度良好、专属性强,符合生物样品中药物定量分析方法学验证的基本要求[22],可用于临床开展安罗替尼的TDM。
参考文献
[ 1 ] XIE C Y,WAN X Z,QUAN H,et al. Preclinical characte- rization of anlotinib,a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci,2018,109(4):1207-1219.
[ 2 ] TAURIN S,YANG C H,REYES M,et al. Endometrial cancers harboring mutated fibroblast growth factor receptor 2 protein are successfully treated with a new small tyrosine kinase inhibitor in an orthotopic mouse model[J]. Int J Gynecol Cancer,2018,28(1):152-160.
[ 3 ] ZHONG C C,CHEN F,YANG J L,et al. Pharmacokine- tics and disposition of anlotinib,an oral tyrosine kinase inhibitor,in experimental animal species[J]. Acta Pharmacol Sin,2018,39(6):1048-1063.
[ 4 ] SUN Y K,NIU W,DU F,et al. Safety,pharmacokinetics,and antitumor properties of anlotinib,an oral multi-target tyrosine kinase inhibitor,in patients with advanced refractory solid tumors[J]. J Hematol Oncol,2016,9(1):105.
[ 5 ] SUN W,WANG Z,CHEN R,et al. Influences of anlotinib on cytochrome P450 enzymes in rats using a cocktail method [J]. Biomed Res Int,2017,2017:3619723.
[ 6 ] 徐伟佳,高勇,吴雪.临床药师对3例安罗替尼治疗晚期肺癌致不良反应的药学监护[J].中国药房,2019,30(19):2727-2731.
[ 7 ] 蒋中秀,崔国元,张晓晔.安罗替尼治疗晚期非小细胞肺癌的疗效与安全性的Meta分析[J].现代肿瘤医学,2021,29(2):242-248.
[ 8 ] DU P,GUAN Y,AN Z L,et al. A selective and robust UPLC-MS/MS method for the simultaneous quantitative determination of anlotinib,ceritinib and ibrutinib in rat plasma and its application to a pharmacokinetic study[J]. Analyst,2019,144(18):5462-5471.
[ 9 ] WANG Z,LIAN L J,DONG Y Y,et al. Determination of anlotinib,a tyrosine kinase inhibitor,in rat plasma by UHPLC-MS/MS and its application to a pharmacokinetic study[J]. J Anal Methods Chem,2019,2019:5016757.
[10] MA Z Y,LU S G,ZHOU H,et al. Determination of intracellular anlotinib,osimertinib,afatinib and gefitinib accumulations in human brain microvascular endothelial cells by liquid chromatography/tandem mass spectrometry [J]. Rapid Commun Mass Spectrom,2021,35(1):e8955.
[11] 陆璐,徐宏江,卢琴,等.高效液相色谱-质谱联用法测定人血浆中安罗替尼浓度[J].中国临床药理学杂志,2019,35 (21):113-117.
[12] XU R N,FAN L,RIESER M J,et al. Recent advances in high-throughput quantitative bioanalysis by LC-MS/MS[J]. J Pharm Biomed Anal,2007,44(2):342-355.
[13] TANG Y Q,WENG N D. Salting-out assisted liquid- liquid extraction for bioanalysis[J]. Bioanalysis,2013,5(12):1583-1598.
[14] 唐原君,汪硕闻,孙涛,等. HPLC法同时检测肺癌患者血浆中奥希替尼与吉非替尼的药物浓度[J].中国药师,2020,23(9):83-88.
[15] ZHAO Y Y,LI S,ZHANG Y,et al. The relationship between drug exposure and clinical outcomes of non-small cell lung cancer patients treated with gefitinib[J]. Med Oncol,2011,28(3):697-702.
[16] BOUCHET S,POULETTE S,TITIER K,et al. Relationship between imatinib trough concentration and outcomes in the treatment of advanced gastrointestinal stromal tumours in a real-life setting[J]. Eur J Cancer,2016,57:31- 38.
[17] XIA Y,CHEN S,LUO M,et al. Correlations between imatinib plasma trough concentration and adverse reactions in Chinese patients with gastrointestinal stromal tumors[J]. Cancer,2020,126(Suppl 9):S2054-S2061.
[18] WIND S,SCHNELL D,EBNER T ,et al. Clinical pharmacokinetics and pharmacodynamics of afatinib[J]. Clin Pharmacokinet,2017,56(3):235-250.
[19] NODA S,HIRA D,OSAKI R,et al. Sorafenib exposure and its correlation with response and safety in advanced hepatocellular carcinoma:results from an observational retrospective study[J]. Cancer Chemother Pharmacol,2020,86(1):129-139.
[20] YU H,STEEGHS N,NIJENHUIS C M,et al. Practical guidelines for therapeutic drug monitoring of anticancer tyrosine kinase inhibitors:focus on the pharmacokinetic targets[J]. Clin Pharmacokinet,2014,53(4):305-325.
[21] VERHEIJEN R B,YU H,SCHELLENS J H M,et al. Practical recommendations for therapeutic drug monito- ring of kinase inhibitors in oncology[J]. Clin Pharmacol Ther,2017,102(5):765-776.
[22] 國家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:466-468.
(收稿日期:2021-01-11 修回日期:2021-04-08)
(编辑:张元媛)

