基于NLRP3炎症小体探讨葛根素对缺氧致肺动脉平滑肌细胞焦亡的影响
张晓丹 李文娣 张茹 盛洁静 张佳男 刘慧宇 李松林

摘 要 目的:探討葛根素(Pue)对缺氧诱导的肺动脉平滑肌细胞(PASMCs)焦亡的影响及其调控机制。方法:以大鼠PASMCs为对象,将其随机分为常氧组、缺氧组和缺氧+Pue组(0.2 mmol/L),除常氧组外,其余各组均于37 ℃、5%CO2、3%O2条件下培养24 h以建立缺氧模型。采用Western blot法检测细胞中焦亡相关蛋白[NOD样受体蛋白3(NLRP3)、胱天蛋白酶1、白细胞介素1β、凋亡相关斑点样蛋白]的表达水平;采用乳酸脱氢酶(LDH)释放实验检测细胞中LDH的释放量;采用Hoechst 33342/PI双染色法检测焦亡阳性细胞比例。另将PASMCs随机分为常氧+对照质粒组、缺氧+对照质粒组、缺氧+过表达质粒组和缺氧+过表达质粒+Pue组,除常氧+对照质粒组外,其余各组均同法建立缺氧模型;在分别转染对照质粒或NLRP3过表达质粒后,采用Western blot法、LDH释放实验和Hoechst 33342/PI双染色法检测Pue是否通过干扰NLRP3炎症小体来发挥对缺氧致PASMCs焦亡的影响。结果:与常氧组比较,缺氧组细胞中焦亡相关蛋白的表达水平、LDH释放量和焦亡阳性细胞比例均显著升高(P<0.05或P<0.01);而Pue可逆转上述指标(P<0.05或P<0.01)。当NLRP3炎症小体过表达时,细胞中焦亡相关蛋白的表达水平、LDH释放量和焦亡阳性细胞比例均显著升高(P<0.05或P<0.01);且Pue可通过调控NLRP3炎症小体而抑制上述现象(P<0.05或P<0.01)。结论:Pue可通过下调焦亡相关蛋白的表达、减少LDH的释放、降低焦亡阳性细胞比例,从而发挥对缺氧致PASMCs焦亡的抑制作用,其机制可能与抑制NLRP3炎症小体的活性有关。
关键词 葛根素;肺动脉平滑肌细胞;焦亡;NOD样受体蛋白3炎症小体
ABSTRACT OBJECTIVE: To investigate the effects and mechanism of puerarin (Pue) on hypoxia-induced pyroptosis of pulmonary artery smooth muscle cells (PASMCs). METHODS: PASMCs of rats as research objects were randomly divided into normoxia group, hypoxia group and hypoxia+Pue group (0.2 mmol/L). Except for normoxia group, other groups were cultured with 5% CO2 and 3% O2 at 37 ℃ for 24 hours to establish hypoxia model. Western blot assay was used to detect the expression of pyroptosis related proteins [NOD-like receptor protein-3 (NLPR3), caspase-1, interleukin-1β (IL-1β), apoptosis-associated speck-like protein (ASC)]. Lactate dehydrogenase (LDH) release assay was used to detect the release of LDH in cells; Hoechst 33342/PI double staining test was adopted to detect the proportion of pyroptosis positive cells. PASMCs was randomly divided into normoxia group+control plasmid group, hypoxia+control plasmid group, hypoxia+over-expression plasmid group and hypoxia+over-expression plasmid+Pue group. Except for the normoxia+control plasmid group, the other groups were established hypoxia model by the same method. After transfection of control plasmid or NLRP3 over-expression plasmid, Western blot, LDH release test and Hoechst 33342/PI double staining test were used to investigate whether Pue could inhibit hypoxia-induced PASMCs pyroptosis by interfering with the activity of NLRP3 inflammasomes. RESULTS: Compared with normoxia group, the expression of pyroptosis related proteins, the release of LDH and the proportion of pyroptosis positive cells were increased significantly in hypoxia group (P<0.05 or P<0.01). Pue had the effect of reversing the above indexes (P<0.05 or P<0.01). When the NLRP3 inflammasome was over-expressed, the expression of pyroptosis related proteins, the release of LDH and the proportion of pyroptosis positive cells were increased significantly (P<0.05 or P<0.01). Pue could inhibit the above phenomenon through regulating NLRP3 inflammasome (P<0.05 or P<0.01). CONCLUSIONS: Pue can significantly inhibit the hypoxia-induced pyroptosis of PASMCs by down-regulating the expression of pyroptosis related proteins, reducing the release of LDH and proportion of pyroptosis positive cells. The mechanism is related to the activity inhibition of NLRP3 inflammasome.
KEYWORDS Puerarin; Pulmonary artery smooth muscle cells; Pyroptosis; NLRP3 inflammasome
肺动脉高压(PAH)是一种以肺血管壁增厚为主要特征的心肺疾病[1-2]。自从Tuder等[3]学者首次在PAH患者的肺血管周围发现炎性细胞浸润后,越来越多的学者证实了炎症与PAH密切相关[4-6]。目前,炎症已经作为一项新的指标用来评价患者PAH的严重程度,因此抑制炎症反应是缓解PAH症状、减少肺血管重构的有效途径[7-8]。在细胞焦亡中发挥关键作用的NOD样受体蛋白3(NLPR3)炎症小体,是由NLRP3、凋亡相关斑点样蛋白(ASC)和胱天蛋白酶1前体(pro-caspase-1)组成[9]。当NLRP3炎症小体活化时,pro-caspase-1会生成具有活性的胱天蛋白酶1(caspase-1),释放白细胞介素1β(IL-1β)和IL-18[10-11]。当PAH发生时,上述炎症因子会促进肺动脉平滑肌细胞(PASMCs)的迁移和增殖,使管腔变窄,从而加速PAH的进展[12]。此外,最新研究表明,缺氧诱导的PASMCs中有异常细胞焦亡的存在,但具体的机制尚未阐明[13]。可见,从抗炎角度出发关注PAH与细胞焦亡之间的关系十分重要。
葛根素(Pue)是从中药野葛Pueraria lobata (Willd.) Ohwi的干燥根中提取出的活性成分,其自分离鉴定起就引起了中外学者的广泛关注。现代药理研究表明,Pue可通过调节多种与炎症疾病相关的炎性细胞、炎症因子及其复杂的信号通路来发挥抗炎作用[14-15]。因此,笔者推测Pue可能通过焦亡相关信号通路来发挥保护PASMCs的作用,但该化合物对上述通路的调控作用以及具体机制尚未有文献报道。本课题组前期研究发现,0.2 mmol/L的Pue作用24 h即可通过自噬抑制PASMCs的增殖[16]。而在PAH中,细胞焦亡释放出的炎症因子最终也会导致PASMCs增殖[13]。基于此,本文以PASMCs为研究对象,探讨Pue(0.2 mmol/L)对缺氧诱导的PASMCs焦亡的影响,并拟验证这种影响是否与NLRP3炎症小体有关,以期为阐明Pue对PAH的影响提供新的思路。
1 材料
1.1 主要仪器
本研究所用主要仪器包括DYY6B型电泳及转膜装置、Gel Doc XR+型化学发光成像系统(美国Bio-Rad公司),IX71型荧光显微镜(日本Olympus公司),HF100型三氣培养箱(上海力申科学仪器有限公司),BB150 CO2型细胞培养箱、MK3型酶标仪(美国Thermo Fisher Scientific公司),3K15型低温高速离心机(德国Sigma公司)等。
1.2 主要药品与试剂
葛根素对照品(批号J1003A5,纯度>98%)购自大连美仑生物技术有限公司,以二甲基亚砜(DMSO)为溶剂配制成200 mmol/L的无菌溶液进行实验,现用现配。
DMEM培养液(批号AF29498408)购自美国HyClone公司;胎牛血清(批号FB25015)购自美国Clark Bioscience公司;胰酶消化液、青-链霉素双抗、RIPA细胞裂解液、Hoechst 33342/PI双染检测试剂盒(批号C0201、C0222、P0013B、C1056)均购自上海碧云天生物技术有限公司;兔抗大鼠ASC多克隆抗体、兔抗大鼠caspase-1多克隆抗体(批号分别为PA5-85810、PA5-87536)均购自美国CST公司;兔抗大鼠NLRP3单克隆抗体、小鼠抗大鼠β-肌动蛋白(β-actin)单克隆抗体(批号分别为ab263899、ab8226)均购自英国Abcam公司;兔抗大鼠IL-1β多克隆抗体(批号bs-20448R)购自北京博奥森生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗、HRP标记的山羊抗大鼠IgG二抗(批号分别为E030120、E030110)均购自美国EarthOx LLC公司;对照质粒、NLRP3过表达质粒(批号均为00043118)均购自上海吉凯基因科技有限公司;乳酸脱氢酶(LDH)检测试剂盒、ECL超敏化学发光液(批号分别为MAK066、WBULS0100)均购自美国Sigma-Aldrich公司;X-treme转染载体(批号65453)购自瑞士Roche公司;BCA蛋白定量试剂盒(批号23227)购自美国Thermo Fisher Scientific公司;脱脂奶粉、DMSO(批号分别为1172、1084)购自德国Biofroxx公司;其余试剂为分析纯或实验室常用规格,水为去离子水。
1.3 实验动物
实验用动物为SPF级成年雄性SD大鼠,8周龄,体质量(230±20) g,由长春市亿斯实验动物技术有限责任公司提供,动物生产许可证号为SCXK(吉)2018-0007。所有动物均在温度(22±2) ℃、相对湿度(50±10)%的条件下饲养。本研究方案取得哈尔滨医科大学动物实验伦理委员会批准。
2 方法
2.1 PASMCs的分离与体外培养
取大鼠3只,经常规麻醉后,转至无菌操作台上。打开其胸腔,取出完整的肺,分离远端血管动脉并除去外膜后剪成小块,用胰酶消化后以3 000 r/min离心5 min。收集细胞沉淀,加入含有20%胎牛血清和1%青-链霉素双抗的DMEM培养液,混匀后培养,传至第2代后用于后续研究。
2.2 Pue对缺氧PASMCs中焦亡相关蛋白表达的影响考察
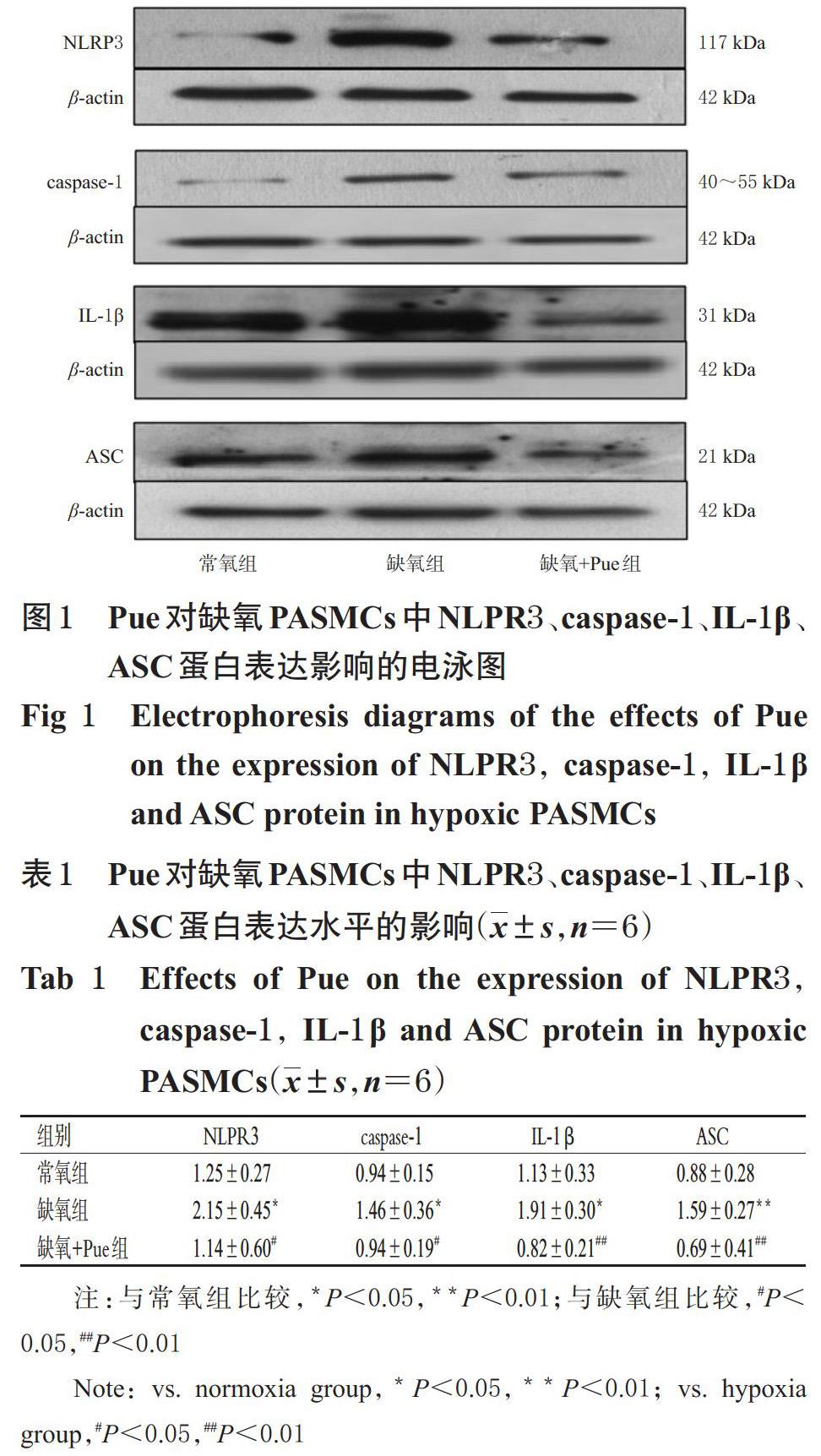
采用Western blot法进行检测。取对数生长期PASMCs,按3×108 mL-1的密度接种于培养瓶内,每瓶3 mL。实验设常氧组、缺氧组和缺氧+Pue组(Pue终浓度为0.2 mmol/L,参考文献[15]并结合前期预实验结果设置),每组设复孔6个。常氧组和缺氧组细胞加入等体积DMSO(体积分数为0.1%),缺氧+Pue组细胞按1 μL/mL加入相应药液(Pue终浓度为0.2 mmol/L)。随后,常氧组细胞于37 ℃、5%CO2条件下培养24 h,其余各组细胞均于37 ℃、5%CO2、3%O2条件下培养24 h以建立缺氧模型。取出细胞,用pH 7.3的磷酸盐缓冲液(PBS)冲洗后匀浆,加入细胞裂解液适量,于冰上裂解;刮取细胞,收集裂解后的细胞液,于4 ℃下以13 500 r/min离心20 min;取上清液,采用BCA法测定蛋白含量后,于100 ℃下加热变性5 min。取变性后蛋白样品适量,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离(浓缩胶电泳80 V,分离胶电泳120 V),随后以湿转法将蛋白转移至硝酸纤维素膜上,再以10%脱脂奶粉室温封闭1 h;然后分别加入NLRP3、caspase-1、IL-1β、ASC、β-actin一抗(稀释比例分别为1 ∶ 1 000、1 ∶ 1 000、1 ∶ 1 000、1 ∶ 500、1 ∶ 2 000),4 ℃孵育过夜;次日用TBST溶液洗膜,加入相应二抗(NLRP3、caspase-1、IL-1β、ASC一抗加入HRP标记的山羊抗兔IgG二抗,稀释比例分别为1 ∶ 4 000、1 ∶ 6 000、1 ∶ 8 000、 1 ∶ 8 000;β-actin一抗加入HRP标记的山羊抗大鼠二抗,稀释比例为1 ∶ 4 000),室温孵育1 h;用TBST溶液洗膜,以ECL发光显影后,置于化学发光成像系统中成像。使用Quantity One 6.0软件分析,以目标蛋白与内参条带的灰度值的比值作为目标蛋白的表达水平。实验重复4次。
2.3 Pue对缺氧PASMCs中LDH释放的影响考察
采用LDH释放实验进行检测。取对数生长期PASMCs,按1×104 mL-1的密度接种于96孔板中,每孔150 μL,按“2.2”项下方法分组、造模、给药,每组设置复孔6个。细胞培养24 h后,按相应试剂盒说明书方法操作,使用酶标仪于490 nm波长处检测各孔吸光度并计算细胞中LDH的释放量:LDH释放量(%)=(样品吸光度-对照孔吸光度)/(细胞最大酶活性的吸光度-对照孔吸光度)×100%。实验重复4次。
2.4 Pue对缺氧PASMCs中焦亡阳性细胞比例的影响考察
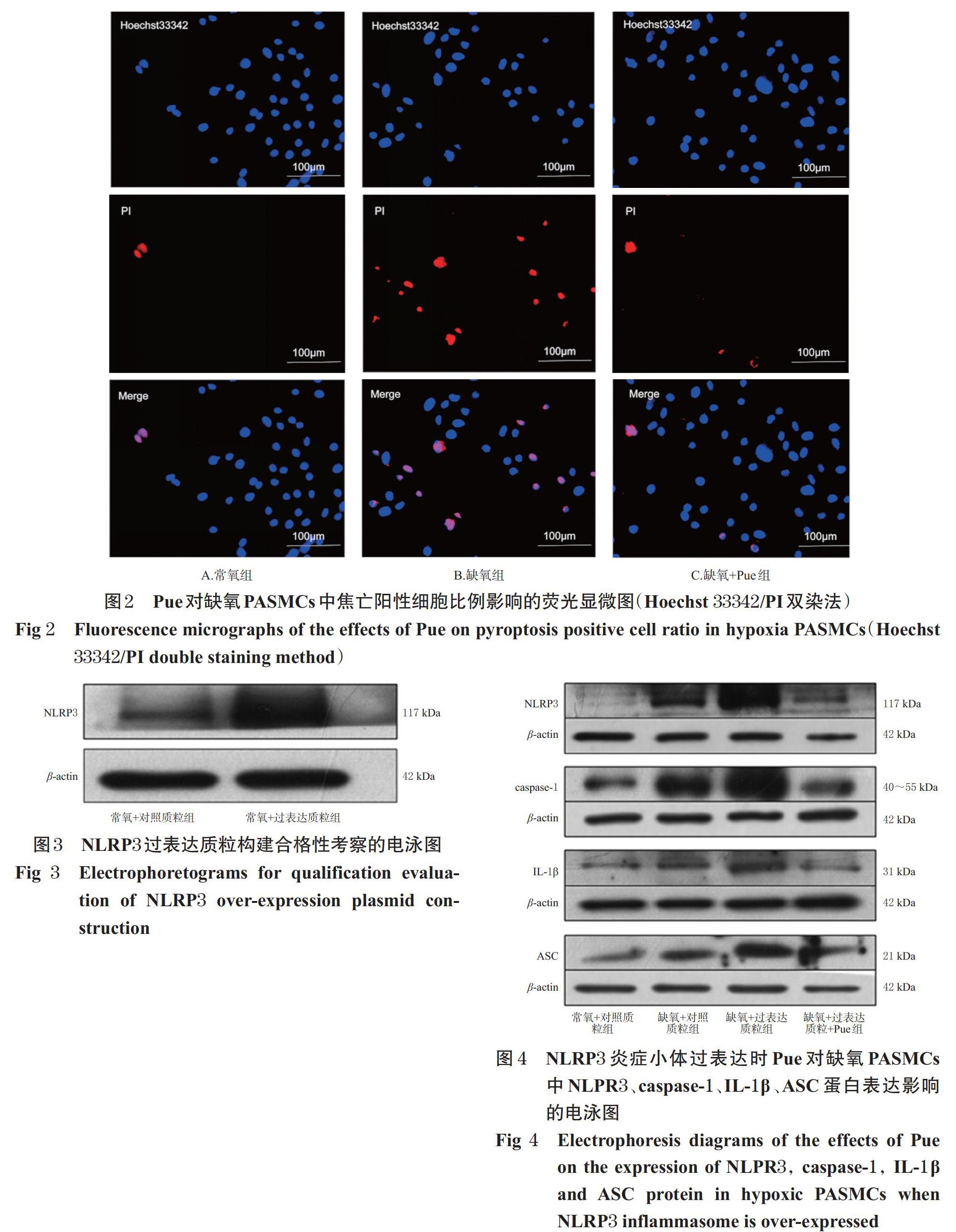
采用Hoechst 33342/PI双染法进行检测。取对数生长期PASMCs,按2×104 mL-1的密度接种于24孔板中,每孔300 μL,按“2.2”项下方法分组、造模、给药,每组设置复孔6个。细胞培养24 h后,按相应试剂盒说明书进行染色处理后在荧光显微镜下观察,用Image J 6.0软件处理分析并计算焦亡阳性细胞比例:焦亡阳性细胞比例=焦亡阳性细胞数/细胞总数×100%(Hoechst 33342染料可将活细胞的细胞核染成蓝色,而PI染料只能将细胞膜破裂的焦亡细胞的细胞核染成红色)。实验重复4次。
2.5 NLRP3过表达质粒构建合格性考察
采用Western blot法进行检测。取对数生长期PASMCs,按3×108 mL-1的密度接种至培养瓶内,每瓶3 mL。试验设常氧+对照质粒组和常氧+过表达质粒组,每组设置复孔6个。细胞培养至融合度达70%时,以X-treme为转染载体对常氧+过表达质粒组细胞进行转染:首先,弃去瓶内培养液,将DMEM培养液(100 μL)分别与X-treme(7.5 μL)、对照质粒(3 mg)、NLRP3过表达质粒(3 mg)混合5 min;然后,再将含X-treme的DMEM培养液分别与含对照质粒和NLRP3过表达质粒的DMEM培養液混合15 min;最后,加至含有DMEM培养液2.8 mL的培养瓶内转染6 h,转染结束后,弃去培养液,加入“2.1”项下含血清、青-链霉素双抗的DMEM培养液适量。细胞培养24 h后取出,按“2.2”项下Western blot实验操作检测细胞中NLRP3蛋白的表达水平,并以P<0.05(常氧+过表达质粒组与常氧+对照质粒组相比)表示此过表达质粒构建合格。实验重复4次。
2.6 NLRP3炎症小体过表达时Pue对缺氧PASMCs中焦亡相关蛋白表达的影响考察
采用Western blot法进行检测。取对数生长期PASMCs,设常氧+对照质粒组、缺氧+对照质粒组、缺氧+过表达质粒组、缺氧+过表达质粒+Pue组,每组设置复孔6个。细胞按“2.2”项下方法接种、造模、给药,按“2.5”项下方法转染并培养24 h后,再按“2.2”项下Wes- tern blot实验操作检测细胞中NLRP3、caspase-1、IL-1β、ASC蛋白的表达水平。实验重复4次。
2.7 NLRP3炎症小体过表达时Pue对缺氧PASMCs中LDH释放的影响考察
采用LDH释放实验进行检测。取对数生长期PASMCs,按“2.3”项下方法接种,按“2.6”项下方法分组,再按“2.2”项下方法造模、给药,每组设置复孔6个。细胞按“2.5”项下方法转染并培养24 h后,再按“2.3”项下方法检测和计算细胞中LDH释放量。实验重复4次。
2.8 NLRP3炎症小体过表达时Pue对PASMCs中焦亡阳性细胞比例的影响考察
采用Hoechst 33342/PI双染法进行检测。取对数生长期PASMCs,按“2.4”项下方法接种,按“2.6”项下方法分组,再按“2.2”项下方法造模、给药,每组设置复孔6个。细胞按“2.5”项下方法转染并培养24 h后,再按“2.4”项下方法检测焦亡阳性细胞比例。实验重复4次。
2.9 统计学方法
采用GraphPad Prism 6.01软件进行统计分析。结果数据均以x±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 Pue对缺氧PASMCs中焦亡相关蛋白表达水平的影响
与常氧组比较,缺氧组细胞中NLRP3、caspase-1、IL-1β、ASC蛋白的表达水平均显著升高(P<0.05或P<0.01);与缺氧组比较,缺氧+Pue组细胞中上述蛋白的表达水平均显著降低(P<0.05或P<0.01),详见图1、表1。
3.2 Pue对缺氧PASMCs中LDH释放量的影响
与常氧组比较,缺氧组细胞中LDH的释放量显著升高(P<0.01);与缺氧组比较,缺氧+Pue组细胞中LDH的释放量显著降低(P<0.01),详见表2。
3.3 Pue对缺氧PASMCs中焦亡阳性细胞比例的影响
与常氧组比较,缺氧组细胞红色荧光增强,其焦亡阳性细胞比例显著升高(P<0.01);与缺氧组比较,缺氧+Pue组细胞红色荧光减弱,其焦亡阳性细胞比例显著降低(P<0.01),详见图2、表2(图2中,Hosechst 33342表示视野内所有能被染色的活细胞图,PI表示发生焦亡的细胞图,Merge为两者合并图,下同)。
3.4 NLRP3过表达质粒构建的合格性
常氧+过表达质粒组细胞中NLRP3蛋白的表达水平显著高于常氧+对照质粒组[(1.79±0.45) vs. (1.21±0.14),P<0.05],提示此NLRP3过表达质粒构建成功,可用作后续研究,详见图3。
3.5 NLRP3过表达时Pue对缺氧PASMCs中NLRP3、caspase-1、IL-1β、ASC表达水平的影响
与常氧+对照质粒组比较,缺氧+对照质粒组细胞中NLPR3、caspase-1、IL-1β、ASC蛋白的表达水平均显著升高(P<0.05或P<0.01);与缺氧+对照质粒组比较,缺氧+过表达质粒组细胞中上述4种蛋白的表达水平均显著升高(P<0.05或P<0.01);与缺氧+过表达质粒组比较,缺氧+过表达质粒+Pue组细胞中上述4种蛋白的表达水平均显著降低(P<0.05或P<0.01),详见图4、表3。
3.6 NLRP3过表达时Pue对缺氧PASMCs中LDH释放量的影响
与常氧+对照质粒组比较,缺氧+对照质粒组细胞中LDH的释放量显著升高(P<0.01);与缺氧+对照质粒组比较,缺氧+过表达质粒组细胞中LDH的释放量显著升高(P<0.05);与缺氧+过表达质粒组比较,缺氧+过表达质粒+Pue组细胞中LDH的释放量显著降低(P<0.05),详见表4。
3.7 NLRP3过表达时Pue对缺氧PASMCs中焦亡阳性细胞比例的影响
与常氧+对照质粒组比较,缺氧+对照质粒组细胞中多见红色荧光,其焦亡阳性细胞比例显著升高(P<0.01);与缺氧+对照质粒组比较,缺氧+过表达质粒组细胞中红色荧光有所增强,其焦亡阳性细胞比例显著升高(P<0.05);与缺氧+过表达质粒组比较,缺氧+过表达质粒+Pue组细胞中的红色荧光有所减少,其焦亡阳性细胞比例显著降低(P<0.01),详见图5、表4。
4 讨论
在PAH中,炎症反应是其关键的致病因素:在正常情况下,免疫炎症的发生有利于病原体的清除;但在PAH中,炎性细胞释放出的炎症因子会促进PASMCs的增殖和肺血管的异常收缩,进而加速肺血管的重构[17]。无论是在体外培养的PASMCs还是在缺氧或野百合碱诱导的PAH模型中,均有研究证实肿瘤坏死因子α(TNF-α)、核因子κB(NF-κB)、IL-6、IL-1β、IL-18等炎症因子的存在[18-20];同时,本课题组早期研究中也发现,PAH模型大鼠体内细胞间黏附分子1(ICAM-1)和血管细胞黏附分子1表达增加,炎症反应和PAH进程加剧[21]。可见,炎症因子在PAH中的作用不容忽视。
随着细胞焦亡相关研究的开展,已有学者开始关注这种促炎形式的细胞程序性死亡与PAH之间的关系[22-23]。当细胞发生焦亡时,细胞膜会先形成直径10~20 nm的孔道,迫使钾离子外流,使得细胞因吸水过多而发生物理破裂,最终导致胞内LDH和炎症因子的渗出;同时,当细胞膜的完整性被破坏时,Hoechest33342/PI等荧光染料就可以嵌入这些细胞的双链DNA中,使焦亡阳性被染色[24-25]。正常生理状态下,焦亡可使机体免受异常损伤和炎症刺激;而其异常活跃则会导致病理性炎症的发生[26]。Zhang等[16]的研究表明,由缺氧激活的程序性死亡配体1可触发PASMCs焦亡和肺血管纤维化,同时caspase-1抑制剂可逆转上述现象。本研究也发现,与常氧组比较,缺氧组细胞中的焦亡相关蛋白NLRP3、caspase-1、IL-1β、ASC的表达水平均显著升高,同时其LDH的释放量以及焦亡阳性细胞比例亦显著升高。上述结果均提示缺氧诱导PASMCs焦亡是符合已有理论的。
Pue是从中药野葛的干燥根中提取出的化合物,现已被广泛应用于多种炎性疾病的治疗。张程美等[27]的研究表明,低、高剂量(10、100 μg/mL)的Pue均能下调THP-1巨噬细胞中炎症因子IL-6、TNF-α、IL-1β的mRNA表达水平;除此之外,Pue不仅可以影响炎症因子的表达,而且还可通过降低基质金属蛋白酶2(MMP-2)、MMP-9等炎症介质,ICAM-1等细胞黏附分子,单核细胞趋化蛋白1、转化生长因子β等炎症趋化因子的水平,从而发挥抗炎作用[28]。因此,在综合细胞焦亡机制的基础上,笔者推测Pue可能具有减少炎症因子释放、缓解PAH的作用。同时,为减少因药物纯度不足或储存不当所造成的实验误差,本研究在高度随机和前期多次检测的基础上选用了Pue对照品并现用现配。本研究结果显示,对于缺氧24 h的PASMCs,0.2 mmol/L的Pue即可下调由缺氧引起的焦亡相关蛋白表达的升高,可减少LDH的释放并降低焦亡阳性细胞比例,提示Pue在体外具有保护細胞膜完整性、减少炎症因子释放和下调焦亡阳性细胞比例的作用。
NLRP3炎性小体是巨噬细胞介导的免疫应答和炎症反应中的关键调节因子,在长期低氧环境的刺激下会触发缺氧诱导分子1α(HIF-1α)的分泌,大量HIF-1α的累积使得肺动脉细胞的有氧代谢平衡失调,继而升高的NF-κB又进一步上调NLRP3的表达,后者又可通过增加caspase-1的分泌而加重炎症反应[29-31]。以上研究提示,NLRP3炎症小体可能是治疗PAH的潜在靶点之一。虽有文献曾报道过Pue与PAH之间的关系,但未有研究从细胞焦亡角度入手探讨Pue与NLRP3炎症小体的关系以及二者在PAH中的作用。因此,笔者构建了NLRP3过表达质粒,在NLRP3炎症小体异常活化的条件下初步探讨了Pue对PASMCs焦亡的影响。结果显示,NLRP3过表达质粒组中NLRP3、caspase-1、IL-1β、ASC的表达水平均较缺氧+对照质粒组显著上调。这一方面表明NLRP3过表达质粒构建成功,另一方面也提示NLRP3的异常活化可加剧炎症因子的释放。加入0.2 mmol/L Pue进行干预后,焦亡相关蛋白的表达水平均显著下调,LDH的释放量和焦亡阳性细胞比例均显著降低,提示Pue可通过调控NLRP3炎症小体抑制PASMCs的焦亡。
综上所述,本研究证实了缺氧可诱导PASMCs焦亡并且激活NLRP3炎症小体,而Pue可通过下调NLRP3、caspase-1、IL-1β、ASC蛋白的表达、减少LDH的释放、降低焦亡阳性细胞比例,从而发挥对缺氧致PASMCs焦亡的抑制作用,其机制可能与其抑制NLRP3炎症小体的活性有关,提示Pue在PAH疾病预防及治疗中存在潜在的应用价值。为了更加全面地掌握焦亡与PAH之间的联系以及Pue的调控机制,后期研究可从量-效、时-效关系入手深入探讨,为临床治疗PAH奠定研究基础。
参考文献
[ 1 ] HAO X W,MA C,CHEN S,et al. Reverse the down regulation of miR-92b-3p by hypoxia can suppress the prolife- ration of pulmonary artery smooth muscle cells by targe- ting USP28[J]. Biochem Biophys Res Commun,2018,503(4):3064-3077.
[ 2 ] MALLORY G B,ABMAN S H. The many challenges to the field of pediatric pulmonology posed by pediatric pulmonary hypertension and the path forward[J]. Pediatr Pulmonol,2021,56(3):583-586.
[ 3 ] TUDER R M,GROVE B,BADESCH D B,et al. Exuberant endothelial cell growth and elements of inflammation are present in plexiform lesions of pulmonary hypertension[J]. Am J Pathol,1994,144(2):275-285.
[ 4 ] MASTON L D,JONES D T,GIERMAKOWSKA W,et al. Central role of T helper 17 cells in chronic hypoxia-induced pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol,2017,312(5):L609-L624.
[ 5 ] FIORENTIN J,COPPIN E,VASAMSETTI S B,et al. Inflammatory macrophage expansion in pulmonary hypertension depends upon mobilization of blood-borne monocytes[J]. J Immunol,2018,200(10):3612-3625.
[ 6 ] 范志茹,倪欣,单莉娅,等.肺动脉高压大鼠肺部炎症与CD4+T淋巴细胞上Cx40、Cx43的相关性研究[J].中国免疫学杂志,2019,35(9):1031-1035,1041.
[ 7 ] 陈迪,袁天翊,陈俞材,等. DL0805-2防治野百合碱诱导的大鼠肺动脉高压的药效评价[J].药学学报,2021,56(1):208-216.
[ 8 ] TAMOSIUNIENE R,MANOUVAKHOVA O,MESANGE P,et al. Dominant role for regulatory T cells in protecting females against pulmonary hypertension[J]. Circ Res,2018,122(12):1689-1702.
[ 9 ] EREN E,?Z?REN N. The NLRP3 inflammasome:a new player in neurological diseases[J]. Turk J Biol,2019,43(6):349-359.
[10] 靳胜男,安鼎杰,康元环,等.细胞焦亡的研究进展[J].中国免疫学杂志,2019,35(23):2919-2924,2931.
[11] 董娜,邵峰.细胞焦亡的机制和功能[J].中国科学(生命科学),2019,49(12):1606-1634.
[12] 罗杰,刘维佳. IL-6、GATA6在大鼠肺动脉平滑肌细胞中的表达及对细胞增殖的影响[J].天津医药,2020,48(11):1025-1030,1137.
[13] ZHANG M,XIN W,YU Y,et al. Programmed death-ligand 1 triggers PASMCs pyroptosis and pulmonary vascular fibrosis in pulmonary hypertension[J]. J Mol Cell Cardiol,2020,138:23-33.
[14] 曾祥偉,冯倩,张莹莹,等.葛根素对炎症相关疾病研究进展[J].中国药理学通报,2018,34(1):8-11.
[15] 李恒华,周飞,杨炀,等.葛根素联合丹参酮Ⅱ A对糖尿病血管病变大鼠炎症相关因子的影响[J].中药药理与临床,2019,35(5):77-83.
[16] ZHANG X D,LIU Q,ZHANG C,et al. Puerarin prevents progression of experimental hypoxia-induced pulmonary hypertension via inhibition of autophagy[J]. J Pharm Sci,2019,141(2):97-105.
[17] FANG M,HUANG Y,ZHANG Y,et al. Interleukin-6- 572C/G polymorphism is associated with serum interleukin-6 levels and risk of idiopathic pulmonary arterial hypertension[J]. J Am Soc Hypertens,2017,11(3):171-177.
[18] 张婷,蔡海鉴,杨林,等.积雪草苷通过抑制NF-κB/p38通路减轻小鼠低氧性肺动脉高压[J].中国病理生理杂志,2019,35(9):1600-1607.
[19] BERGHAUSEN E M,FEIK L,ZIERDEN M,et al. Key inflammatory pathways underlying vascular remodeling in pulmonary hypertension[J]. Herz,2019,44(2):130- 137.
[20] 吴苏玲,毕立清,孔辉,等.鲁斯可皂苷元对野百合碱诱导的肺动脉高压大鼠炎症反应的影响[J].中国药理学通报,2013,29(6):823-827.
[21] 张晓丹,赵书雅,李蕴琳,等.牛磺酸通过p38通路对缺氧内皮细胞ICAM-1、VCAM-1表达的影响[J].中国中药杂志,2017,42(12):2350-2354.
[22] UDJUS C,CERO F T,HALVORSEN B,et al. Caspase-1 induces smooth muscle cell growth in hypoxia-induced pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol,2019,316(6):L999-L1012.
[23] HE S,MA C,ZHANG L,et al. GLI1-mediated pulmonary artery smooth muscle cell pyroptosis contributes to hypoxia- induced pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol,2020,318(3):L472-L482.
[24] 伊宏煜,王涛,谷孙泽栋,等.细胞焦亡与临床疾病及其相关信号通路[J].中国免疫学杂志,2019,35(16):2038- 2042.
[25] WANG Y,SHI P,CHEN Q,et al. Mitochondrial ROS promote macrophage pyroptosis by inducing GSDMD oxidation[J]. Mol Biol Cell,2019,11(12):1069-1082.
[26] 劉志新,陈要臻,徐金梅,等.血红素激活含pyrin结构域NOD样受体家族蛋白3(NLRP3)炎性体诱导肾小管上皮细胞焦亡[J].细胞与分子免疫学杂志,2020,36(9):809-814.
[27] 张程美,王高频.葛根素对oxLDL诱导的THP-1巨噬细胞TLR4-NF-κB信号转导通路的影响[J].中国免疫学杂志,2019,35(22):2705-2710.
[28] 邢志华,马誉畅,李新萍,等.葛根素及其衍生物抗炎、抗痛风作用研究进展[J].中国中药杂志,2017,42(19):3703-3708.
[29] 卜宝英,徐喜媛,韩俊萍,等.低氧对人肺动脉平滑肌和人肺动脉内皮细胞中HMGB1及相关炎症因子表达的影响[J].中国应用生理学杂志,2019,35(5):406-410.
[30] SIDDIQUE M A H,SATOH K,KUROSAWA R,et al. Identification of emetine as a therapeutic agent for pulmonary arterial hypertension:novel effects of an old drug[J]. Arterioscler Thromb Vasc Biol,2019,39(11):2367-2385.
[31] MA C,LIU S,ZHANG S,et al. Evidence and perspective for the role of the NLRP3 inflammasome signaling pathway in ischemic stroke and its therapeutic potential:review[J]. Biochem Biophys Res Commun,2018,42(6):2979-2990.
(收稿日期:2021-01-18 修回日期:2021-04-20)
(编辑:张元媛)

