硫脲浸金电化学行为研究
陶媛媛,项朋志,周小华,叶国华
(1. 昆明理工大学 国土资源工程学院,昆明 650093;2. 云南开放大学 化学工程学院,昆明 650022;3. 昆明学院 昆明滇池(湖泊)污染防治合作研究中心,昆明 650214)
由于环境因素的考虑,氰化法作为传统提取黄金的手段备受挑战,在非氰化法中,硫脲浸金受到了广泛的关注,已经成为非氰浸金中的热门研究对象[1-2]。硫脲(H2NCSNH2,简写Tu)是一种具有还原性质的有机配合剂[3],可与许多金属离子形成稳定的配合物。硫脲易溶于水,在酸性溶液中可被氧化为二硫甲脒(RSSR),在有氧化剂(Fe3+)存在时硫脲浸金是利用金和硫脲配位形成较稳定的配位离子,可以应用于金矿石中提取黄金。该法的优点是高效,能处理一些难浸金矿石,硫脲已有较多的研究和工业应用[4]。陈亮等[5]通过一定的硫脲和亚硫酸钠溶液浓度得到了最佳的溶金效果。
金与硫脲络合的标准电势为0.38 V,相比硫代硫酸盐和氰化物高。研究表明当氧化剂电极电势大于 0.38 V,硫脲浸金反应即可进行[6]。浸金过程中氧化剂主要是用来调节浸出液的氧化电势,当氧化剂的电势高于金溶解形成硫脲配离子所需要的电势,就可能实现浸出。理论上氧化剂的电势愈高,氧化能力越强,金溶解的能力也越大。但是氧化剂氧化能力太强,会使更多的硫脲分解成元素硫、硫酸根等产物,使其消耗加剧[7]。采用温和的氧化剂可使溶液的氧化电势维持在适宜的范围内,可以保证金的正常浸出,也不会导致更多的硫脲消耗。Fe3+/Fe2+标准电极电势为0.771 V,可以满足硫脲浸金的要求,且氧化性不至于太强。pH过高(碱性条件)会导致Fe3+沉淀,因此Fe3+氧化剂在酸性范围才能稳存在,硫脲在碱性溶液中易分解,因此硫脲法浸金要在酸性条件下进行。
本文先采用电化学方法对硫脲浸金液中硫脲浓度、Fe3+浓度、温度进行分析;在电化学分析的基础上,用硫脲对老挝某金矿石进行浸出试验,为硫脲浸金理论和实践提供参考。
1 实验
1.1 实验材料及仪器
实验用硫酸铁、硫脲等试剂均为市售分析纯试剂,实验用水为二次蒸馏水。
模拟浸金溶液:由不同浓度的硫酸铁、硫脲、硫酸组成。该浸金体系中硫脲为配位剂,Fe3+为氧化剂,用硫酸调节溶液pH=1.0。
电化学分析采用 CHI630E电化学工作站(上海辰华仪器有限公司),金含量测定采用AA320型原子吸收分光光度计;溶液酸度用 pH计(PHS-3C)测定;实验中用恒温电动搅拌器进行搅拌。
1.2 电化学分析
采用 Tafel曲线,差示脉冲伏安和循环伏安对模拟浸金溶液进行分析。分析用三电极体系中以纯金片(金质量分数>99.99%,测量面积为 1.0 cm2)为工作电极;铂丝为对电极;Ag/AgCl为参比电极。分析前首先用金相砂纸把金片打磨成光亮后待用。
1.3 验证实验
浸出在锥形瓶中进行,矿样来自于老挝某地金矿,含金量为3.11 g/t,矿石经破磨磨矿至-75 μm占95%以上。在含有适宜的硫酸铁、硫脲浓度浸金液(pH=1.0)中浸出,浸出温度为35℃,固液比为1:5,浸出10 h后过滤,对浸出渣进行烘干,分析浸出渣金的含量,计算浸出率。其浸出反应如下:

2 结果与讨论
2.1 硫脲浓度的影响
考察了硫脲浓度范围为0.005~0.04 mol/L金电极的腐蚀电位和腐蚀电流的变化,所得 Tafel曲线如图1所示。
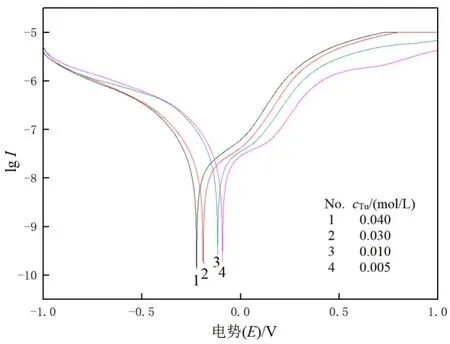
图1 不同浓度硫脲的Tafel曲线Fig.1 Tafel curves of thiourea at different concentrations
从图1可以看出,随着硫脲浓度的增加,金电极的腐蚀电位负移,当硫脲浓度为0.04 mol/L时金的腐蚀电位最小,说明硫脲浓度增大有利于金的浸出,其腐蚀电流稍有增大,这说明硫脲浓度的增大有利于金的阳极氧化。文献也表明硫脲浓度对金电极的阳极氧化有影响,随着硫脲浓度的增加,可以提高金的阳极氧化速率,当硫脲浓度增至 0.25 mol/L以后,这种影响不明显[8]。
2.2 Fe3+浓度的影响
2.2.1 循环伏安曲线
在硫脲浓度为0.01 mol/L,pH=1的溶液中,考察Fe3+浓度改变时电化学行为,结果如图2。把Fe3+加入硫脲溶液中,开始为棕红色,10 min后变成了无色,再逐渐变浑浊,这一现象与文献[9]一致。Fe3+与硫脲混合后,生成[FeSO4(Tu)]+,而[FeSO4(Tu)]+会继续与硫脲作用,Fe3+被硫脲还原成Fe2+:

图2 不同浓度Fe3+溶液的循环伏安曲线Fig.2 Cyclic voltammetry curves of Fe3+ solutions with different concentrations

从图2可以看出,Fe3+在0.25 V左右开始发生还原反应,在﹣0.1~﹣0.2 V之间出现一个还原峰,在 0.4~0.5 V之间出现了Fe2+氧化峰[10],还原峰峰电流与Fe3+呈良好的线性关系。还原峰电位比Fe3+/Fe2+标准电极电势负移较多,原因可能是 Fe3+浓度较小,再加上Fe3+与硫脲生成[FeSO4(Tu)]+从而导致电势负移。从图2还可以看出氧化峰变化的不是太明显,原因可能是(3)式化学反应速率较小,导致溶液中的Fe2+浓度变化较小,所以氧化峰变化较小。
2.2.2 腐蚀性能
以金电极作为工作电极,考察了Fe3+浓度对金的腐蚀影响,如图3所示。从图3可以看出,在Fe3+浓度为0.01~0.08 mol/L范围内,随着Fe3+浓度的增大,金腐蚀电位负移,腐蚀电流变大,这说明Fe3+浓度增大有利于金的腐蚀。

图3 不同浓度Fe3+溶液中金的腐蚀电流和电势Fig.3 Corrosion current and potential of gold in Fe3+ solutions of different concentrations
综合文献分析,在硫脲浸金体系中,Fe3+对金的浸出影响很大。白建峰等[10]利用硫脲法对废旧手机电路板进行金的浸出,Fe2(SO4)3的最佳加入量为0.3%,当加入量超过0.3%时,金浸出率反而下降。储春利等[11]对黔西南某卡琳型金矿进行硫脲浸出,Fe3+最佳浓度为 24 g/L,实际浸出时 Fe3+浓度通常较大,超过了电化学分析最佳的分析范围,所以Fe3+浓度选择,除了采用电化学分析方法作理论分析外,应以实际浸出来选择合适的铁浓度。
从以上分析可以看出Fe3+浓度对硫脲浸金影响较大,这是因为硫脲浸金属于氧化还原反应,Fe3+的用量直接决定了溶液的氧化还原电位,浓度越大,氧化还原电位越高,氧化能力越强,浸金速率越快;但氧化性太强,硫脲容易被氧化成二硫甲醚,从而造成浸出剂消耗过多[12]。
2.3 温度的影响
在硫脲浓度为 0.01 mol/L,Fe3+浓度为 0.08 mol/L,pH为1的溶液中,考察了温度对金的腐蚀的影响,结果如图4所示。
从图4可以看出,随着温度升高,金的腐蚀电位负移,且金的腐蚀电流先增加后下降,这一结果与文献一致[13]。这说明适度提高温度可以提高金的腐蚀。从实际浸出来看,升高浸出温度可以增加金的浸出率。温度超过 50℃后金的浸出率反而下降,原因可能是过高的温度使硫脲氧化速率加快。硫脲消耗加快一方面使浸出液中硫脲浓度下降,另一方面生成的产物会导致金表明产生了钝化,从而使金的浸出率下降。虽然升高温度可以提高金的浸出率,但为了减小实际消耗,实际浸出温度通常为 35℃~40℃,通过延长浸出时间来提高金浸出率[14-15]。

图4 不同温度下金的腐蚀电流和电势Fig.4 Corrosion current and potential of gold at different temperatures
2.4 模拟浸金液电化学行为
在pH=1、硫脲浓度为0.01 mol/L、Fe3+浓度为0.08 mol/L的浸金液中,搅拌速度为200 r/min。将纯金片悬挂于溶液中作为工作电极,每隔一段时间后采用差分脉冲伏安法(DPV)对硫脲模拟浸金液进行电化学分析,得到的DPV曲线如图5所示。

图5 模拟浸金液DPV曲线Fig.5 DPV curve of simulated gold immersion solution
图5中a峰为Fe2+氧化峰,随着时间的增加,氧化峰电流增加。在浸金液中,根据方程式(3)可知,Fe3+被还原成Fe2+[16],随着时间的推移,Fe2+浓度越来越大,所以其氧化峰也愈来愈大。b峰为硫脲第一个氧化峰,对应硫脲氧化分解的反应:

c峰为硫脲第二个氧化峰,对应亚硫酸钠氧化的反应[17-18]:

d峰对应为金的氧化溶出峰,对应金溶解与硫脲络合的反应[19]:

上述DPV峰中,以b峰最为突出,随时间的增加,b峰峰电流下降,说明溶液中硫脲浓度下降。b峰下降的原因是一部分硫脲与Fe3+和金进行了络合,另一部分的硫脲被氧化。反应120 min时峰电流下降了一半,说明硫脲浓度也下降了一半,据此可以采用DPV监测出硫脲的浓度变化。d峰变化不太明显,且随时间的推进,金的氧化溶出峰稍有下降,其原因可能是金表面产生了钝化。钝化的原因是硫脲被氧化和分解的产物覆盖在金电极表面所致,这可从试验结束后金表面有沉淀物可以印证。图5中最左边峰电位约为﹣0.8 V,该峰归属有待于进一步确认。
2.5 矿石浸出验证试验
为验证电化学实验结果,采用硫脲法对某金矿石进行实际浸出。重点考察了硫脲浓度和Fe3+浓度对金浸出率的影响,其结果如图6所示。
从图6(a)可以看出,当Fe3+浓度0.02~0.08 mol/L,金的浸出率随 Fe3+浓度增大而增大,最高达到了53.2%。从图6(b)可以看出,当硫脲浓度0.005~0.05 mol/L,金的浸出率随硫脲浓度增大而增大,最高达到78.7%。

图6 硫脲浓度(a)和Fe3+浓度(b)对矿物中金浸出影响(pH=1.0)Fig.6 Effect of thiourea (a) and iron ions (b) concentration on gold leaching from the ore (pH=1.0)
矿物浸出验证试验结果与电化学分析结论基本一致,说明采用电化学分析方法可以为实际浸出作出指导和预测,对浸出过程进行定性和定量分析。下一步可以从更大的浓度范围内考查浸出体系中各因素对浸出的影响,建立数学模型。但电化学分析方法也有自身的限制,如电化学分析浓度较低,这与实际浸出过程中各物料实际浓度不一致;再如在分析过程中电极表面容易被污染,导致电极钝化,从而影响到后续的分析。
3 结论
1) Tafel曲线表明硫脲浓度范围为 0.005~0.04 mol/L,随着硫脲浓度的增加,金的腐蚀电位负移,说明硫脲浓度增大有利于金的浸;在 Fe3+浓度为0.01~0.08 mol/L范围内,随着Fe3+浓度的增大,金腐蚀电位负移,腐蚀电流变大,说明Fe3+浓度增大有利于金的腐蚀;随着温度升高金的腐蚀电位负移,且金的腐蚀电流先增加后下降,说明适度升温可以提高金的腐蚀。
2) 循环伏安曲线显示在(-0.1)~(-0.2) V之间出现一个还原峰,在 0.4~0.5 V之间出现了 Fe2+氧化峰,还原峰峰电流与Fe3+浓度呈良好的线性关系。对模拟浸金液进行差分脉冲伏安法(DPV)分析,得到了浸出过程中各步骤反应的电化学峰信号。
3) 实际矿物浸出验证试验表明,Fe3+浓度范围为0.02~0.08 mol/L,金的浸出率随Fe3+浓度增大而增大,最高达到了 53.2%;硫脲浓度范围为0.005~0.05 mol/L,金的浸出率随硫脲浓度增大而增大,最高达到了 78.7%。浸出率变化趋势与电化学分析所得规律基本一致。

