运动干预睡眠障碍成年人的睡眠结构的Meta分析
龚明俊 谭思洁 孙亚麒 吴旸 胡晓飞
摘 要:目的:評价运动干预睡眠障碍成年人的睡眠结构的效果,为制定改善睡眠障碍的运动干预方案提供依据。方法:确定文献纳入与排除标准,检索中英文数据库。运用Revman 5.3和stata14.0对所纳入10篇文献的670名受试者的结局指标进行分析。结果:1)运动干预能缩短睡眠潜伏期(d=-0.44)、总睡眠时间(d=-0.29)、入睡后觉醒时长(d=-0.29),p值均<0.05。2)运动干预对睡眠效率、N1期、N2期、N3期睡眠比例的效应量分别是0.1、-0.3、-0.04、0.3,p值均>0.05。3)缩短睡眠潜伏期效应量最显著的要素是有氧运动(d=-0.61)、45~60 min(d=-0.66)、24~48周(d=-0.35),p值均>0.05;缩短入睡后觉醒时长最显著的要素是身心运动(d=-0.19,p>0.05),45~60 min(d=-0.34,p<0.05),12~16周(d=-0.21,p<0.05)。结论:运动干预能缩短睡眠潜伏期、总睡眠时间、入睡后觉醒时长,具有提高睡眠效率、缩短N1期、N2期睡眠,延长N3期睡眠的趋势。有氧运动在缩短睡眠潜伏期的趋势比身心运动显著,身心运动在减少入睡后觉醒时长的趋势比有氧运动显著。单次运动45~60 min、持续12周以上的运动干预方案改善效果更好。
关键词:运动干预;睡眠质量;睡眠结构;效果评价
中图分类号:G 804.55 学科代码:040302 文献标识码:A
Abstract:Objective: To evaluate the effect of exercise intervention on the sleep structure of adults with sleep disorders, and to provide the basis for the formulation of exercise intervention program for the improvement of sleep disorders. Methods: The inclusion and exclusion criteria were established, and Chinese and English databases were searched. Results of 670 participants in 10 included literatures were analyzed using RevMan 5.3 and Stata 14.0. Results: 1) Exercise intervention can shorten sleep onset latency (d=-0.44), total sleep time (d=-0.29), and wake after sleep onset(d=-0.29), p<0.05. 2) The effect sizes of exercise intervention on sleep efficiency, N1, N2 and N3 sleep ratio were 0.1, -0.3, -0.04, 0.3, p>0.05, respectively. 3) The most obvious moderators for shortening the effect of sleep onset latency are aerobic exercise (d=-0.61), 45-60 min (d=-0.66), 24-48 weeks(d=-0.35), p>0.05, respectively. The most significantly moderators for shortening the wake after sleep onset are mind-body exercise (d=-0.19, p>0.05), 45-60 min (d=-0.34, p<0.05), and 12-16 weeks (d=-0.21, p<0.05). Conclusions: Exercise intervention can significantly shorten the sleep onset latency, total sleep time, and wake after sleep onset. It has a tendency to improve sleep efficiency, shorten the proportion of N1 and N2 sleep, and extend the proportion of N3 sleep. The tendency of aerobic exercise to shorten the SOL is more obvious than mind-body exercise, and the tendency of mind-body exercise to reduce the WASO is more obvious than aerobic exercise. A single exercise for 45-60 minutes, lasting for more than 12 weeks, the improvement effect is more obvious.
Keywords: exercise intervention; sleep quality; sleep structure; effect evaluation
近年来,随着经济社会的发展,睡眠障碍已成为现代人常见疾病之一。2020年3月发布的《中国睡眠指数报告》中显示,有高达40.5%的人存在不同程度的睡眠障碍。目前对睡眠障碍的治疗包括药物治疗和非药物治疗两种手段,长期药物治疗会减少患者的非快动眼睡眠(NREM)和慢波睡眠(SWS)时长,改变睡眠结构,增加抑郁、焦虑、认知障碍等风险,故不推荐长期使用[1]。运动干预是非药物疗法的一种[2],具有很好的推广性、普适性和可接受性,在正向影响睡眠质量的同时,能有效提升人的整体健康水平。
睡眠结构包括的非快动眼睡眠(NREM)和快动眼睡眠(REM)两个时相中各期睡眠的时长和比例、整夜非快动眼睡眠-快动眼睡眠(NREM-REM)循环的周期次数,反映睡眠的整体特征,其合理与否是决定睡眠质量高低的重要因素[3]。睡眠结构一般通过多导睡眠监测仪(PSG)记录的总睡眠时间(TST)、睡眠潜伏期(SOL)、睡眠效率(SE)、入睡后觉醒时长(WASO)、各期睡眠时长和比例等参数体现。
梳理目前运动干预睡眠障碍的元分析发现,其研究的重点在不同类型的运动干预方案[4 - 7]改善不同人群[8 - 11]的主观睡眠质量方面。但是,运动干预方案中各要素对睡眠结构各项指标是否有影响,以及影响程度的大小等规律,并没有得到深入揭示。这些规律是睡眠障碍运动处方研制的基本理论前提,其缺失将导致运动方案对成年人睡眠障碍干预的有效性不足。基于此,本文运用Meta分析法对已发表的有关运动干预睡眠障碍成年人的睡眠结构的相关实验数据进行元分析。通过计算运动干预前后TST、SE、SOL、WASO和NREM各期睡眠比例的效应量,把握运动干预睡眠结构的总体特征,并进一步研究运动干预方案的各要素对睡眠结构各项指标的影响,为研制睡眠障碍成年人的精准运动处方提供循证依据。
1 研究方法
1.1 文献检索策略
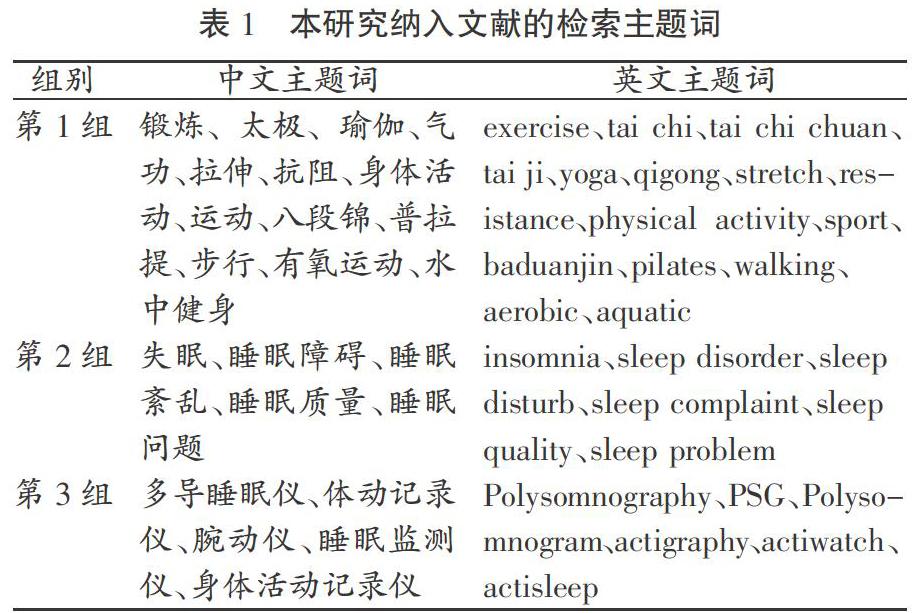
研究人员于2020年3月10日对中英文数据库进行检索,中文数据库包括中国知网、万方、维普、中国生物医学数据库,文献来源限定为中国社会科学引文索引、中国科学引文数据库、中文核心期刊要目总览的收录期刊。英文数据库包括Web of science、Pubmed、Cochrane、Embase等。检索主题词见表1,检索范围为建库至检索日,每组检索主题词内部用“OR”连接,各组主题词之间用“AND”连接,使用布尔运算符进行逻辑运算。经过初步筛查获取中文文献98篇,英文文献905篇。
1.2 文献的纳入与排除标准
依据循证医学的研究范式,从研究对象、干预措施、对照/比较措施、结局指标和研究设计5个部分设置文献纳入标准。具体为:1)随机对照实验;2)研究对象为睡眠障碍成年人(≥18岁);3)干预措施为每次进行不少于30 min的运动干预,且持续一定周期;4)对照组为非运动干预或睡眠卫生教育再或保持之前的生活方式;5)睡眠结构的各项参数通过多导睡眠仪、体动记录仪等仪器获取,且文献中有运动干预前后完整的数据。
文献排除标准为:1)非中英文文献、学位论文等;2)因疾病导致的睡眠障碍(例如:阻塞性睡眠呼吸暂停、不宁腿综合症等);3)研究对象为倒班制工作人员或从事规律性运动的人员;4)文献中的数据不完整。
1.3 文献筛选和数据提取
利用参考文献管理软件(Note Express)去除不同数据库中重复的文献。本文第一作者根据标题、摘要、全文进行独立筛选后,本文另一作者依据文献纳入与排除标准对筛选结果进行评审。如遇分歧,由本文第3位作者裁决。两名研究人员依据数据提取表对所纳入的文献进行数据提取。提取的主要字段包括:第1作者,发表年份,国家(或地区),练习形式,实验组和对照组的人数、性别、年龄、干预措施,运动干预的时间、频率和周期,主要结局指标等。纳入文献过程中,对缺失的数据通过电子邮件联系作者本人。如果第1次联系后未回复,1周后再次发送邮件,如果2次仍未回复,则不纳入该篇文献。
1.4 文献质量评价
采用“PEDro”量表对纳入的文献进行质量评价。该量表于1999年6月在Delphi清单的基础上修订形成,包括受试者的纳入条件、随机分配,分配隐藏,基线相似,受试者、干预实施者、结局指标测量者的盲法设计,意向治疗分析,组间统计报告等11个评判题目。第1题不计入总分,其余各题均算入总分。结果表明,在本文纳入的所有文献中,PEDro得分≥6分的论文有8篇,平均得分为6.1分,英文文献的平均得分相对中文文献略高。
1.5 数据分析
数据处理采用“Revman5.3”软件Intervention review中的“Data and analyses”模块和Stata14.0 Meta-Analysis中的“Influence Analysis,metan-based”模块对多导睡眠仪、体动记录仪等仪器测量的睡眠时长指标(TST、SOL、WASO、SE)和多导睡眠仪测量的非快动眼睡眠各期比例(N1、N2、N3)分别进行分析。选用标准均数差SMD作为效应量指标,SMD<0.2为微小效应量,0.2≤SMD<0.5为小效应量,0.5≤SMD<0.8为中等效应量,SMD≥0.8为大效应量[12]。I2代表研究的异质性,当I2<50%时采用固定效应模型合并效應量,I2≥50%时,采用随机效应模型合并效应量。
2 研究结果
2.1 纳入文献的基本特征
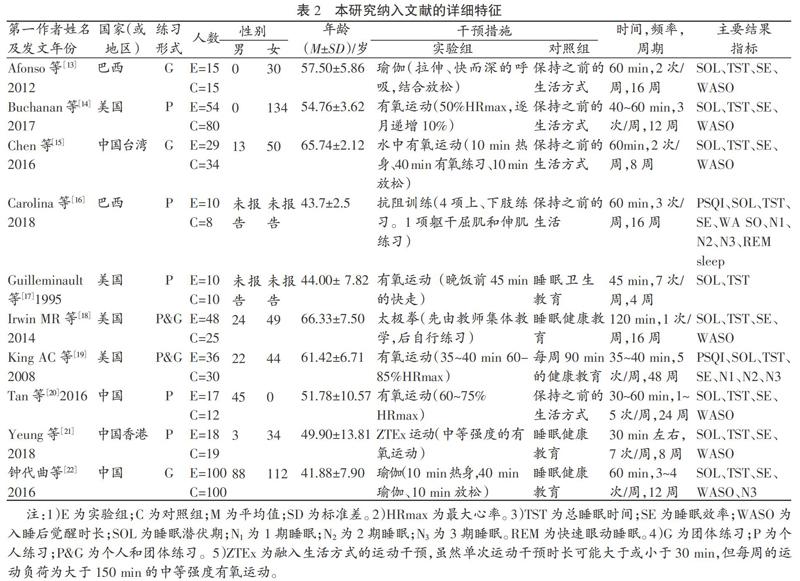
本文共纳入10项随机对照实验,其中包括:中国4项,美国4项,巴西2项。1项研究只纳入男性,2项研究只纳入女性,其余5项研究包括男性和女性,有2篇文献未显示性别和人数。共纳入670名研究对象,其中:195名男性,453名女性。受试者的年龄范围为40~66岁。
运动干预形式主要为:中等强度的有氧运动(心率范围为60%~75%的最大心率,练习形式包括慢跑、骑固定自行车、水中健身等)、身心运动(瑜伽、太极拳)、抗阻运动、融入日常生活方式的运动(ZTEx)。运动时间范围为30~120 min,多集中在50 min左右。每周运动干预频次为1~7次,3次/周居多。运动干预周期为4~48周,12~16周居多。练习形式包括个人练习、团体练习、个人和团体相结合练习。对照组采用保持之前的生活方式、接受睡眠健康教育等。睡眠结构包括反映睡眠时长的各项指标和非快动眼各期睡眠的比例,纳入研究文献的详细特征见表2。
2.2 发表偏倚检验
漏斗图最初是用以观察论文发表偏倚情况的。通常当系统评价纳入的研究数量在10个以上时进行发表偏倚检测[23]。结果显示,本研究纳入的全部文献分布在漏斗图中轴线附近位置,且中轴线左右文献的数量基本均匀,表明不存在明显的发表偏倚。
2.3 敏感性分析
敏感性分析是用于评价研究结果是否稳定和可靠的方法。主要通过逐篇去除文献对所纳入的文献进行分析,并重新计算置信区间。逐篇去除文献后发现,所有结果均处于原来95%置信区间的上下限值范围内,除了Chen 等[15]的分析结果接近置信区间的上限值,Buchanan等[14]的分析结果趋向置信区间的下限值,其他分析结果变化并不明显。敏感性分析表明,本研究分析结果的稳定性较高。
2.4 运动干预对TST、SE、SOL、WASO的影响
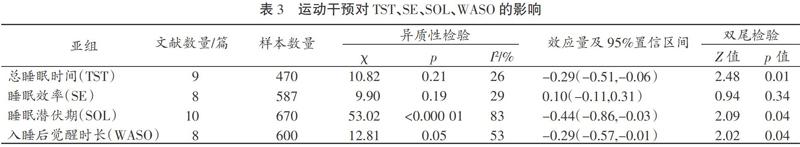
在反映睡眠时长的客观指标方面通常使用总睡眠时间(TST)、睡眠效率(SE)、睡眠潜伏期(SOL)、入睡后觉醒时长(WASO)4项连续性指标[24](见表3)。
1)总睡眠时间。该组纳入9篇文献、共纳入样本数量为470例。9篇文献的合并效应量具有低异质性(I2=26%)。运动干预对总睡眠时间的效应量为d=-0.29,(p=0.01),95%的置信区间为(-0.51,-0.06),结果具有统计学意义,表明运动干预能够在一定程度上缩短总睡眠时间。
2)睡眠效率。该组纳入8篇文献、共纳入样本数量为587例。8篇文献的合并效应量具有低异质性(I2=29%)。运动干预对睡眠效率的效应量为d=0.10(p=0.34),95%的置信区间为(-0.11,0.31),结果不具有显著性差异(p>0.05),说明运动干预具有提高睡眠效率的作用。
3)睡眠潜伏期。该组纳入10篇文献、共纳入样本数量为670例。10篇文献的合并效应量具有高度异质性(I2=83%)。运动干预对睡眠潜伏期的效应量为d=-0.44(p=0.04),95%的置信区间为(-0.86,-0.03),结果具有统计学意义,表明运动干预能够缩短睡眠潜伏期。
4)入睡后觉醒时长。该组纳入8篇文献、共纳入样本数量为600例。8篇文献的合并效应量具有中度异质性(I2=53%)。运动干预对入睡后觉醒时长的效应量为d=-0.29(p=0.04),95%的置信区间为(-0.57,-0.01)结果具有统计学意义,表明运动干预能缩短入睡后觉醒时长。
2.5 运动干预对非快动眼各期睡眠比例的影响
1)N1期睡眠。该组纳入2篇文献,共纳入样本数量为84例。2篇文献的合并效应量为低异质性(I2=0),運动干预对N1期睡眠的影响具有小效应量趋势,(d=-0.30,p=0.17),95%的置信区间为(-0.74,0.13),可见,运动干预后,实验组的N1期睡眠比例具有减少趋势(p>0.05)(见表4)。
2)N2期睡眠。该组纳入2篇文献,共纳入样本数量为84例。2篇文献的合并效应量为中度异质性(I2=57%),运动干预对N2期睡眠的影响具有微小效应量趋势(d=-0.04,p=0.93),95%的置信区间为(-0.83,0.76)。由此可见,运动干预后,实验组的N2期睡眠比例具有减少趋势(p>0.05)。
3)N3期睡眠。该组纳入2篇文献,共纳入样本数量为84例。2篇文献的合并效应量为低异质性(I2=0%),运动干预对N3期睡眠的影响具有小效应量趋势(d=0.30,p=0.17),95%的置信区间为(-0.13,0.73)。与N1期睡眠和N2期睡眠变化不同的是,实验组的N3期睡眠比例出现了提高的趋势(p>0.05)。
2.6 运动干预方案实施要素对SOL和WASO的影响
因运动干预睡眠障碍成年人的睡眠结构的文献数量少,本研究对具有显著性差异的睡眠潜伏期(SOL)和入睡后觉醒时长(WASO)两项指标展开亚组分析,以此探讨相对较好的运动干预类型、运动干预时长、运动干预周期。各实施要素的亚组、文献量、样本量、效应量等见表5。
1)运动干预类型。有氧运动对SOL的效应量为d=-0.61(p=0.103),身心运动对SOL的效应量为d=-0.15(p=0.546),95%的置信区间分别为(-1.34,0.12) (-0.64,
0.34)。有氧运动对WASO的效应量为d=-0.14(p=0.699),身心运动对WASO的效应量为d=-0.19(p=0.139),95%的置信区间分别为(-0.85,0.57) (-0.44,0.06)。可见,有氧运动在缩短SOL的趋势比身心运动显著(p>0.05),身心运动在减少WASO的趋势比有氧运动显著(p>0.05)。
2)运动干预时长。45 min以下组对SOL的效应量为d=-0.19(p=0.297),45~60 min组对SOL的效应量为d=-0.66(p=0.059),95%的置信区间分别为(-0.55,0.17)(-1.34,0.03)。45~60 min组对WASO的效应量为d=-0.34(p=0.04),95%的置信区间为(-0.67,-0.01)。以上表明,45~60 min组在缩短SOL的趋势比45 min以下组显著(p> 0.05)。45~60 min组能有效缩短WASO,且这种效果具有统计学意义(p<0.05)。
3)运动干预周期。8周以下组、12~16周组、24~48周组对SOL的效应量和p值分别是-0.17(p=0.342)、-0.22(p=0.155)、-0.35(p=0.092),95%的置信区间分别为(-0.53,0.19)(-0.53,0.08)(-0.76,0.06);8周以下组、12~16周组对WASO的效应量和p值分别是-0.15(p=0.866)、-0.21(p=0.027),95%的置信区间分别为(-2.04,1.72) (-0.40,-0.02)。以上表明,24~48周组在缩短SOL的趋势最显著(p>0.05)。12~16周组能有效缩短WASO,且这种效果具有统计学意义(p<0.05)。
3 讨论
3.1 运动干预对睡眠时长的影响
总体上看,运动干预能够一定程度缩短睡眠潜伏期和减少入睡后觉醒时长(效应量分别为-0.44、-0.29),这两项指标均达到了小效应量水平,这与Kubitz等[25]的研究结果基本一致。运动干预组的总睡眠时长比非运动干预组短,这与通过主观量表评价运动对睡眠时长影响的结论不一致[26]。其原因一方面可能与纳入文献运动干预周期较短有关:从短期效果看,运动干预能提高练习者的体温[27]、改变心率变异性、改善中枢神经系统的疲劳度,抑制抑郁和焦虑[28 -29]。从中期效果来看,运动干预能改变大脑神经递质和免疫细胞因子水平[30 - 31],提高神经免疫力[32 -33]。从长期效果来看,运动干预能改善人体身体成分、提高心肺机能和健康水平[ 34]、恢复人体紊乱的生物节律[35]。本研究纳入文献的方案中,4~8周的4篇,12~16周的4篇,24~48周的2篇,平均为16.4周。通常较短的运动干预周期(16周左右)多影响主观睡眠质量(例如匹兹堡睡眠质量得分)[36],尚不足以改变睡眠障碍患者的睡眠结构。另一方面,可能与非干预组采用睡眠卫生教育等有关。目前所纳入文献的干预方案中非干预组采用了保持之前的生活方式或定期开展睡眠卫生教育两类。睡眠卫生教育能帮助练习者正确认识睡眠问题,可在一定程度上缓解患者的紧张焦虑,有助于改善睡眠质量。再一方面,可能与纳入文献单次运动干预的时长较短有关。有研究者[37]发现单次运动干预持续60 min以上更有可能增加总睡眠时长。在本文纳入的10篇文献中,单次运动干预时长明确低于45 min以下的有3篇,45~60 min的有6篇,大于60 min的仅有一篇。这可能是导致运动干预组睡眠时长较短的又一原因。
3.2 运动干预对非快动眼各期睡眠比例的影响
运动干预对非快动眼各期睡眠比例影响的主要趋势是减少N1期和N2期的睡眠比例,增加N3期睡眠的比例。其原因首先可能与运动干预降低了睡眠障碍患者的过度觉醒状态,进而调整各期睡眠比例有关。Bonnet等 [38]的研究表明,睡眠障碍与生理、认知和躯体的过度觉醒状态有关。例如,脑电活动增强、基础代谢率增加、睡眠时心率加快、交感神经系统激活等,这种过度觉醒状态可导致睡眠潜伏期延长、深睡眠比例减少等睡眠结构紊乱问题。Tworoger 等[39]通过对绝经期有睡眠障碍的妇女实施有氧运动和拉伸运动干预后发现,运动干预能够调节交感神经和副交感神经的活性,改善患者的睡眠质量。中国也有研究证实了通过增加體育运动能够减轻失眠患者的过度觉醒状态[40]。其次,可能与运动干预后启动了体温调节机制有关。运动能引起人体的中枢、皮肤、大脑的温度在运动期和恢复期升高,进而人体启动了与外周血管舒张相对应的散热机制,导致更多的血液流向外周皮肤,远端和近端皮肤的温度差异对启动睡眠至关重要[41]。Murphy等[42]通过连续记录受试者脑电图和身体体温的变化曲线,将体温下降最大斜率出现的时间与睡眠启动时间、各项睡眠参数进行比较后发现,体温快速下降增加了睡眠启动的可能性,并有助于进入深睡眠阶段(即增加N3期睡眠比例)[43- 44]。
应该注意的是,运动干预对非快动眼各期睡眠比例的影响仅为小效应量和微小效应量,且尚不具有统计学意义(p值均>0.05)。其原因一方面可能与纳入的文献量少有关。相对主观测量工具,使用客观仪器采集数据时存在人员操作误差和仪器使用误差等,且在使用仪器过程中,存在连接复杂、测试时间过长等诸多限制,导致目前国内外使用客观仪器监测运动干预睡眠障碍患者的睡眠结构的文献数量偏少。另一方面可能与运动干预形式有关,不同运动类型调用人体的生理和心理系统不同,改善睡眠障碍的机制和路径也存在差异。Trinder等[45]研究了长跑运动员、有氧和无氧混合训练的运动员、举重运动员和久坐者的睡眠情况,结果显示:与力量运动员相比,耐力运动员的慢波睡眠水平和比例较高,睡眠时间较长,睡眠潜伏期较短。在纳入的2篇文献中,Carolina等[16]采取了抗阻练习,这也可能是造成效应量偏小的原因之一。
3.3 运动干预对睡眠结构的影响机制分析
运动干预对睡眠结构的影响一方面可能与人体的昼夜节律有关。人体昼夜节律系统主要集中在下丘脑的视交叉上核(SCN)及其邻近部位。昼夜节律信号可由SCN传递到多个睡眠和觉醒脑区,进而调控睡眠各阶段的位相转换以及睡眠觉醒周期的转换。人体昼夜节律紊乱和振幅变化是导致睡眠结构异常的主要原因[46]。同时,SCN自身节律也受到多种因素的调控,概括起来包括外界环境因素和机体内源性因素。有研究表明,运动干预是一种重要的外源性授时因子。定期运动干预可显著延迟人体昼夜节律起搏器,有助于恢复生物钟的睡眠—觉醒周期和睡眠结构[47]。Beersma等[48]研究了运动干预在人体昼夜节律时长(tau)中的作用。受试者在13.5 h的觉醒期间完成了久坐(例如:看视频、阅读)、低强度或中等强度的活动,结果显示,与非活动状态(tau=24.3 h)相比,低强度和中等强度运动干预后的tau值分别是24.17 h、23.98 h,尽管这一结果还不具有统计学意义(p>0.05),但表明运动干预增加了人体内部时钟与环境时钟的匹配度。
另一方面可能與运动干预影响了人体的表观遗传机制,进而改变了睡眠结构有关。表观遗传是在环境因素或外界刺激的作用下引起分子或细胞发生变化,这些因素或刺激会影响基因表达。与传统遗传现象不同的是,表观遗传是在不改变基因序列的前提下,染色体区域发生的结构适应性变化。运动干预引起骨骼肌细胞结构和功能的变化是以相关基因表达为基础的[49]。有研究表明,物质与能量代谢的动态平衡是由生物钟驱动的组织特异性节律调节的,急性失眠或慢性睡眠剥夺均会导致生物钟基因的组织特异性转录和DNA甲基化水平发生变化[50-51]。与稳定的基因序列不同,基于表观遗传机制的基因表达变化是相对动态的,更重要的是,这种表达也相对是可逆的[52]。由此可以推测,运动干预诱发的骨骼肌和脂肪等外周组织细胞的变化会反作用于物质能量的合成和分解代谢,进而反向调控时钟基因的表达来改善睡眠结构。
需要指出的是,在整个睡眠结构中,各期睡眠均具有一定的生理作用和功能,例如,快动眼睡眠有助于认知和记忆巩固,深睡眠有助于身体各项机能的恢复。高质量的睡眠并非某部分的睡眠比例越多越好,而是各部分睡眠所占比例趋近于正常的范围。因运动干预对睡眠障碍患者睡眠结构的影响是全面的和综合的,即将紊乱的睡眠结构逐渐调整趋向正常的睡眠结构,从这个意义上也再次显示出运动干预的优势。此外,因睡眠结构和主观睡眠质量都可以作为健康状况的预测因子[53],最佳的睡眠障碍治疗方式应该是一方面改善紊乱的睡眠结构,使睡眠结构的每个部分趋近正常范围,另一方面还应注重改善睡眠障碍患者的主观睡眠感受。
3.4 研究的局限与展望
本文作为元分析研究,所纳入的原始研究文献的数量和质量是Meta分析质量高低的前提。目前所纳入的文献总体偏少,这与该方面研究的论文数量较少和纳入标准有关。例如,在运动干预非快动眼各期睡眠比例的研究中,研究N1、N2、N3期睡眠的仅有2篇文献。在运动干预方案各实施要素对睡眠时长各项指标的影响研究中,限于纳入文献数量和指标是否具有显著性差异等原因,也仅对睡眠潜伏期和入睡后觉醒时长的效应量进行了分析。
根据当前多导睡眠仪、体动记录仪等在临床实际使用的情况,在今后运动干预睡眠障碍的系统评价中,可以考虑适当放宽文献纳入标准,例如,可将运动干预不宁腿综合症、睡眠呼吸暂停综合症、癌症、糖尿病、骨关节疾病等伴有睡眠障碍的相关文献纳入研究中,以期在运动干预睡眠结构方面获得更多数据,为不同运动干预形式、运动强度、运动量、运动干预时间段等要素对睡眠结构的影响研究提供参考。此外,根据当前纳入的文献数据,本研究认为运动干预会缩短睡眠障碍成年人的总睡眠时长,这一点还有待纳入更多随机对照实验予以进一步分析。
4 结论
1)运动干预能改变睡眠障碍成年人的睡眠结构,主要体现在:缩短睡眠潜伏期、总睡眠时长、入睡后觉醒时长,降低N1期睡眠和N2期睡眠的比例、增加N3期睡眠的比例。
2)有氧运动在缩短睡眠潜伏期的趋势比身心运动显著,身心运动在减少入睡后觉醒时长的趋势比有氧运动显著。
3)单次运动45~60 min、持续12周以上的运动干预方案改善睡眠障碍成年人的睡眠结构的效果更好。
参考文献:
[1] DIMSDALE J E, NORMAN D, DEJARDIN D, et al. The effect of opioids on sleep architecture[J]. Journal of Clinical Sleep Medicine, 2007, 3(1): 33.
[2] 胡永善. 运动疗法应用研究进展[M]. 北京: 人民卫生出版社,2010: 5.
[3] 高和,王莞尔,段莹,等. 睡眠医学基础[M]. 北京: 人民军医出版社, 2014: 74-77.
[4] ZOU L, YEUNG A, QUAN X, et al. A systematic review and meta-analysis of mindfulness-based (baduanjin) exercise for alleviating musculoskeletal pain and improving sleep quality in people with chronic diseases[J]. International Journal of Environmental Research and Public Health, 2018, 15(2): 206.
[5] DU S, DONG J, ZHANG H, et al. Taichi exercise for self-rated sleep quality in older people: a systematic review and meta-analysis[J]. International Journal of Nursing Studies, 2015, 52(1): 368.
[6] KOVACEVIC A, MAVROS Y, HEISZ J J, et al. The effect of resistance exercise on sleep: a systematic review of randomized controlled trials[J]. Sleep Medicine Reviews, 2018, 39(5):53.
[7] TANG M, CHIU H, XU X, et al. Walking is more effective than yoga at reducing sleep disturbance in cancer patients: a systematic review and meta-analysis of randomized controlled trials[J]. Sleep Medicine Reviews, 2019, 47(3): 2.
[8] LOWE H, HADDOCK G, MULLIGAN L D, et al. Does exercise improve sleep for adults with insomnia? a systematic review with quality appraisal[J]. Clinical Psychology Review, 2019, 68(6): 3.
[9] YANG P, HO K, CHEN H, et al. Exercise training improves sleep quality in middle-aged and older adults with sleep problems: a systematic review[J]. Journal of Physiotherapy, 2012, 58(3): 57.
[10] LEDERMAN O, WARD P B, FIRTH J, et al. Does exercise improve sleep quality in individuals with mental illness? a systematic review and meta-analysis[J]. Journal of Psychiatric Research, 2019, 109(2): 96.
[11] RUBIO-ARIAS J , MARN-CASCALES E, RAMOS-CAMPO D J, et al. Effect of exercise on sleep quality and insomnia in middle-aged women: a systematic review and meta-analysis of randomized controlled trials[J]. Maturitas, 2017, 100(4): 50.
[12] COHEN J. Statistical power analysis for the behavioral sciences[M]. Hillsdale: Erlbaum, 1988: 133-147.
[13] AFONSO R F, HACHUL H, KOZASA E H, et al. Yoga decreases insomnia in postmenopausal women[J]. Menopause-The Journal of the North American Menopause Society, 2012, 19(2): 190.
[14] BUCHANAN D T, LANDIS C A, HOHENSEE C, et al. Effects of yoga and aerobic exercise on actigraphic sleep parameters in menopausal women with hot flashes[J]. Journal of Clinical Sleep Medicine, 2017, 13(1): 15.
[15] CHEN L, FOX K R, KU P, et al. Effects of a quatic exercise on sleep in older adults with mild sleep impairment: a randomized controlled trial[J]. International Journal of Behavioral Medicine, 2016, 23(4): 501.
[16] CAROLINA V R, DAUREA D P, GISELLE S P, et al. Effects of resistance exercise training and stretching on chronic insomnia[J]. Revista Brasileira De Psiquiatria, 2019, 41(1): 53.
[17] GUILLEMINAULT C, CLERK A, BLACK J, et al. Nondrug treatment trials in psychophysiologic insomnia[J]. Archives of Internal Medicine, 1995, 155(8): 838.
[18] IRWIN M R, OLMSTEAD R, CARRILLO C, et al. Cognitive behavioral therapy vs. tai chi for late life insomnia and inflammatory risk: a randomized controlled comparative efficacy trial[J]. Sleep, 2014, 37(9): 1543.
[19] KING A C, PUITT L A, WOO S, et al. Effects of moderate-intensity exercise on polysomnographic and subjective sleep quality in older adults with mild to moderate sleep complaints[J]. The Journals of Gerontology Series A - Biological Sciences and Medical Sciences, 2008, 63(9): 997.
[20] TAN X, AL?魪N M, WIKLUND P, et al. Effects of aerobic exercise on home-based sleep among overweight and obese men with chronic insomnia symptoms: a randomized controlled trial[J]. Sleep Medicine, 2016, 25(2): 113.
[21] YEUNG W, LAI A Y, HO F Y, et al. Effects of zero-time exercise on inactive adults with insomnia disorder: a pilot randomized controlled trial[J]. Sleep Medicine, 2018, 52(5): 121.
[22] 钟代曲,于瑞英,蒋晓江,等. 睡眠瑜伽训练对慢性失眠症患者远期疗效的影响[J]. 重庆医学,2016,45(1): 107.
[23] 刘鸣. 系统评价、Meta-分析设计与实施方法[M]. 北京:人民卫生出版社,2011: 100.
[24] MA Z, SHI L, DENG M. Efficacy of cognitive behavioral therapy in children and adolescents with insomnia: a systematic review and meta-analysis[J]. Brazilian Journal of Medical and Biological Research, 2018, 51(6): 5.
[25] KUBITZ K A, LANDERS D M, PETRUZZELLO S J, et al. The effects of acute and chronic exercise on sleep. a meta-analytic review[J]. Sports Medicine, 1996, 21(1): 277.
[26] 吳炜炜, 兰秀燕,邝惠容, 等. 传统健身运动对老年人睡眠质量影响的Meta分析[J]. 中华护理杂志,2016,51(2): 217.
[27] VAN S E. More than a marker: interaction between the circadian regulation of temperature and sleep, agerelated changes, and treatment possibilities[J].Chronobiology International, 2000, 17(6): 313.
[28] YOUNGSTEDT S D. Effects of exercise on sleep[J]. Clinics in Sports Medicine, 2005, 24(2): 355.
[29] BUMAN M P, HEKLER E B, BLIWISE D L, et al. Moderators and mediators of exercise-induced objective sleep improvements in midlife and older adults with sleep complaints[J]. Health Psychology, 2011, 30(5): 579.
[30] MELANCON M O, LORRAIN D, DIONNE I J. Exercise and sleep in aging:emphasis on serotonin[J]. Pathologie Biologie, 2014, 62(5): 283.
[31] CHAOULOFF F. Effects of acute physical exercise on central serotonergic systems [J]. Medicine and Science in Sports and Exercise, 1997, 29(1): 58.
[32] KRUEGER J M, FANG J, HANSEN M K, et al. Humoral regulation of sleep[J]. News in Physiological Sciences, 2008, 35(13): 189.
[33] KLARLUND P B, LAURIE H G. Exercise and the mmune sytem: regulation, intergration, and adapation[J]. Physologial Review, 2000, 80(3): 1055.
[34] PEDERSEN B K, SALTIN B. Evidence for prescribing exercise as therapy in chronic disease[J]. Scandinavian Journal of Medicine & Science in Sports, 2006, 16(1): 63.
[35] EDWARDS B J, REILLY T, WATERHOUSE J. Zeitgeber-effects of exercise on human circadian rhythms: what are alternative approaches to investigating the existence of a phase-response curve to exercise?[J]. Biolgical Rhythm Reserch, 2009, 40(6): 53.
[36] KING A C, OMAN R F, BRASSINGTON G S, et al. Moderate intensity exercise and self-rated quality of sleep in older adults a randomized controlled trial[J]. Journal of the American Medical Association, 1997, 277(2): 33.
[37] YOUNGSTEDT S D, OCONNOR P J, DISHMAN R K. The effects of acute exercise on sleep: a quantitative synthesis[J]. Sleep, 1997, 20(5): 203.
[38] BONNET M H, ARAND D L. Hyperarousal and insomnia: state of the science[J]. Sleep Medicine Reviews, 2010, 14(1): 9.
[39] TWOROGER S S, YASUI Y, VITIELLO M V, et al. Effects of a yearlong moderate-intensity exercise and a stretching intervention on sleep quality in postmenopausal women[J]. Sleep, 2003, 26(7): 830.
[40] 王继辉, 韩自力,李冠英,等. 增加体育运动对原发性失眠患者过度觉醒的影响[J]. 中山大学学报(医学科学版), 2015,36(5): 795.
[41] RAYMANN R J, SWAAB D F, VAN SOMEREN E J. Skin deep: enhanced sleep depth by cutaneous temperature manipulation[J]. Brain, 2008, 131(1): 509.
[42] MURPHY P J, CAMPBELL S S. Nighttime drop in body temperature: a physiological trigger for sleep onset?[J]. Sleep, 1997, 20(7): 505.
[43] GILBERT S S, VAN DEN HEUVEL C J, FERGUSON S A, et al. Thermoregulation as a sleep signalling system[J]. Sleep Medicine Reviews, 2004, 8(2): 93.
[44] LACK L C, GRADISAR M, VAN SOMEREN E J, et al. The relationship between insomnia and body temperatures[J]. Sleep Medicine Reviews, 2008, 12(5): 309.
[45] TRINDER J, PAXTON S J, MONTGOMERY I, et al. Endurance as opposed to power training: their effect on sleep[J]. Psychophysiology, 1985, 22(2): 673.
[46] MORGENTHALER T I, LEE-CHIONG T, ALESSI C, et al. Practice parameters for the clinical evaluation and treatment of circadian rhythm sleep disorders: an american academy of sleep medicine report[J]. Sleep, 2007, 30(11): 1445.
[47] RICHARDSON C E, GRADISA R M, SHORT M A, et al. Can exercise regulate the circadian system of adolescents? novel implications for the treatment of delayed sleep-wake phase disorder[J]. Sleep Medicine Reviews, 2017, 34(6): 123.
[48] BEERSMA D, HIDDINGA A. No impact of physical activity on the period of the orcadian pacemaker in humans[J]. Chronobiology International, 1998, 15(1): 49.
[49] 牛燕媚,袁海瑞, 傅力. 規律运动引起机体产生表观遗传学适应性改变研究进展[J]. 中国运动医学杂志,2014,33(9): 930.
[50] BASS J, LAZAR M A. Circadian time signatures of fitness and disease[J]. Science , 2016, 354(6315): 995.
[51] CEDERNAES J, SCHONKE M, WESTHOLM J O, et al. Acute sleep loss results in tissue-specific alterations in genome-wide DNA methylation state and metabolic fuel utilization in humans[J]. Science Advances, 2018, 4(8): 859.
[52] PALAGINI L, BIBER K, RIEMANN D. The genetics of insomnia-evidence for epigenetic mechanisms?[J]. Sleep Med-icine Reviews, 2014, 18(3): 225.
[53] MANABE K, MATSUI T, YAMAYA M, et al. Sleep patterns and mortality among elderly patients in a geriatric hospital[J]. Gerontology, 2000, 46(2): 318.

