肝病超声诊断指南
中华医学会超声医学分会, 中国研究型医院学会肿瘤介入专业委员会,国家卫生和健康委员会能力建设和继续教育中心超声医学专家委员会
超声检查无创、实时显像、价廉,无辐射、便于反复进行,我国各种肝脏疾病发病率高,超声是我国不同层级医院目前最常用的肝脏影像学检查方法。超声可以观察肝脏的大小、形态、实质回声、占位特征及肝内血管、胆管情况,对于早期、精准诊断肝脏弥漫性和局灶性病变至关重要。近年来,超声检查新技术如超声造影、弹性成像技术发展迅速,可有效鉴别肝内占位性病变性质、评估肝纤维化和门静脉高压程度以及监测肝病治疗效果,已广泛应用于临床。本指南旨在通过规范化肝病超声检查流程和诊断标准,提高超声医师在常见肝脏疾病的诊断中做出准确判定的能力。
1 通用检查规范
1.1 仪器选择 选用具有高分辨力(包括图像空间、时间分辨力及显示器分辨力)和高灰阶(256 灰阶) 的腹部实时彩色多普勒超声诊断仪。在应用超声造影成像和超声弹性成像检查时,仪器还应具备相应的定量分析功能。
1.2 探头选择 根据年龄、体型、体质量选择合适的探头和检查模式。多采用凸阵探头,成人常用频率为1.0~5.0 MHz,儿童或需要了解肝脏近表面结构时可选用频率更高的微凸阵探头(4.0~9.0 MHz)或者线阵探头(3.0~9.0 MHz)。
1.3 仪器调节
显示器调节:根据诊室的光线强度,调节合适的显示屏亮度和对比度。
灰阶超声:通过选择和调节适宜的声波输出功率、频率、增益、深度、扫描范围、扫描密度、动态范围、时间增益补偿(time gain compensation,TGC)、侧向增益补偿(lateral gain control,LGC)、斑点噪声控制、空间复合成像、焦点数量、焦点位置、缩放、帧相关、伪彩等参数,以获得高分辨力、高清晰度的肝脏灰阶声像图。
1.3.1 二维成像模式(B 模式) 要求“图像居中、大小适当、结构清晰、远近均匀”。
声波输出功率(output power):声波输出功率越大,穿透力越强,回波信号越强,但机械指数(mechanical index,MI)与热力指数(thermal index,TIS)也会提高,可能带来组织细胞的机械效应损伤和热效应损伤,因此临床应用时必须遵循“辐射防护最优化(as low as reasonably achievable,ALARA) ”声功率原则,根据实际情况选择适当的声输出功率。在肝脏检查中一般使用90%~100% 的声输出功率发射,MI:1.0~1.2。
频率(frequency,F):基波/谐波,根据探测深度的需要和组织特征进行选择。基波频率低,穿透力强,分辨力差;比如对于肥胖或有脂肪肝的患者,可将默认谐波调整为基波,同时将频率调节到最低状态,增加超声扫查的穿透力。
谐波(hamonic,H)成像是利用回声的二次谐波进行成像以优化图像,谐波成像能增强近场分辨力,减少频率低振幅大的噪声,从而改善图像成像。比如胆囊的扫查,可将基波调节为谐波,抑制囊内的噪声,提高胆囊壁微小病变的显示能力。
深度(depth):通常情况下靶目标图像应占据整幅图像的三分之二,图像居中显示,以能有效显示靶目标图像区域的最浅深度为宜。
扫描密度(line density):代表每幅图像扫描线的密度,大多数超声设备设置低、中、高三个档位,扫描密度增高,图像信息量增多,帧率降低。根据实际情况选择适当的扫描密度。比如标准体型或体型偏瘦[体质量指数(body mass index,BMI)<24],肝脏透声好的患者,通常采用中密度或高密度的档位;体型偏胖(BMI≥24),肝脏透声不好的患者,通常采用低密度或中密度的档位。
动态范围(dynamic range,DR):反映了设备接收信号强信号和弱信号的能力。降低动态范围,可以提高图像的对比度,但图像的信息量降低;提高动态范围,可以提高图像的信息量,但图像的对比度会降低。
增益(gain):以能清晰显示肝实质为宜,肝实质呈中等强度的细小点状回声(等回声),肝静脉、门静脉、肝管及胆囊等结构清晰显示。
时间补偿增益(TGC):以能使二维图像纵向(声束方向)回声均匀一致为宜。通常呈从近到远补偿逐渐平缓增加的补偿方式。
侧向补偿增益(LGC):以能使二维图像横向(垂直声束方向)回声均匀一致为宜。
缩放(zoom):根据靶目标的大小进行缩小或放大,必要时可采用局部放大,使较小目标的精细结构显示更清晰,同时便于精准测量。
焦点(focus)数量和位置:焦点数量可选择单个或多个,但以1~2个为佳,过多会降低帧频,影响图像的时间分辨力;焦点位置对齐靶目标区域;另外有一些设备具有全域动态聚焦的功能,无焦点,无需调节,系统自动全程聚焦。
斑点噪声抑制(iClear/SRI/XRes):对于噪声较多的图像,适当提高噪声抑制的档位,以降低图像噪声,增强图像信噪比。
空间复合成像(iBeam/CrossXBeam/SonoCT):能提高图像的空间分辨力,需根据图像观察需求合理使用。
帧相关(persistence):通过将相邻帧二维图像的叠加平均进行图像优化。帧相关档位越高,图像越细腻,连续性越好,实时性越低。
伪彩图谱(tint map):用彩色差别代替灰度差别来成像,从而更直观地区分图像的灰度级差异。适当的应用,有助于提高组织对比度。
1.3.2 彩色多普勒成像模式(C 模式) 彩色多普勒检查时,应注意调节彩色信号阈值、壁滤波范围、彩色取样框位置和大小、血流速度标尺、彩色总增益、余辉等,以达到能敏感显示肝内血流而没有明显的“彩色溢出”等伪像,同时保持一定的帧频使图像具有良好的实时性。彩色多普勒成像模式(C 模式)要求“图像居中、大小适中、血流充盈、不溢不亏”。
频率(F):根据靶目标图像的深浅,选择适当的频率。
Color 速度标尺:根据血流速度大小调节,通常调低至10~20 cm/s,以有效显示肝血管内的血流。
增益(gain):彩色总增益根据血流速度的大小调节,以显示取样框内血管的血流充盈饱满、无彩色溢出为佳。
壁滤波(wall filter,WF):根据实际情况选择适当的低通滤波或高通滤波。
取样框(region of interesting,ROI):取决于取样区域的大小,以选调至略大于观察目标的区域为最佳。
余辉(persistence) :通过调节余辉,可以消除或减低斑点噪声,增加图像的连续性和平滑。余辉设置越高,图像连续性越好,边界越平滑,实时性越低。肝脏血流流速相对不高,为了便于观察,余辉设置可以适当增高。
1.3.3 频谱多普勒成像模式(PW模式) 频谱多普勒为临床提供了量化的血流动力学参数信息,使用时应注意调节频率、增益、壁滤波、取样容积大小、取样线角度、速度标尺、基线等参数,以达到能敏感显示肝内血流信息而没有明显的“PW 溢出和折返”等伪像。频谱多普勒成像要求:“定位准确、量程适中、增益无噪、角度不超”(图1)。

图1 频谱多普勒成像相关参数
频率(F):根据靶目标图像的深浅,选择适当的频率,表浅图像用高频,深部图像用低频。
增益(gain):根据信号强度的大小适中调节,以清晰显示频谱波形、背景无噪声信号为佳。
PW 速度标尺(scale):根据血流速度大小适中调节,在量程允许的范围内尽可能的显示更大的PW 图像波形。
滤波(WF):根据实际情况选择适当的低通滤波或高通滤波。低通滤波的调节以频谱波形不脱离基线为佳。
取样容积(sampling volume,SV):一般设为2~4 mm,若检测的血管较粗大,取样容积可适当调大,通常为血管内径的1/3~1/2,以增加检测的血流信息。
取样线角度(angle):血流方向和声束夹角应尽量减小,最大不可超过±60°。
基线(baseline):根据实际情况适当调整基线位置,使PW 波形图像完整地显示在屏幕上。
动态范围(DR):调节原则同二维模式。
1.3.4 超声造影成像(contrast-enhanced ultrasound) 超声造影自1969 年开始在临床使用,至今已在肝脏超声诊断和超声介入诊疗中广泛应用。欧洲医学生物学超声联合会(European Federation of Societies in Ultrasound and Medicine,EFSUMB)于2004 年发布了第一部肝脏超声造影应用指南。该指南于2008 年进行了修订,并开始在亚洲发行[1-2]。2013 年世界医学生物学超声联合会(World Federation of Ultrasound in Medicine and Biology,WFUMB)发布肝脏超声造影指南[3],并于2020 年更新,更新版指南对超声造影以下应用进行了强推荐:超声造影在成人、儿童、腔内使用都是安全的;对于电子计算机断层扫描(CT)或动态增强磁共振成像(magnetic resonance imaging,MRI)结果不明确的患者,建议使用超声造影;超声造影应作为肾功能不全患者的首选造影方式;在无恶性肿瘤病史、无疑似恶性肿瘤病史的非肝硬化患者中,对于偶然发现、超声无法鉴别的肝占位,超声造影为一线成像技术;除肿瘤诊断外,对于超声引导的消融手术之前、术中和术后也推荐使用超声造影,作为治疗计划中超声、CT 和 MRI的补充并评判残癌;但不推荐常规使用超声造影监测有肝癌风险的患者和不推荐常规使用超声造影进行肝癌分期。
目前全球市场上可临床使用的超声造影剂有四种。三种为磷脂外壳(definity,商品有:声诺维,示卓安),一种为白蛋白外壳[optison,通用电气药业(上海)有限公司,GE 药业]。目前通过中国国家食品药品监督管理总局(China Food and Drug Administration,CFDA)批准临床使用的超声造影剂包括SonoVue(商品名:声诺维,意大利Bracco 公司)、Sonazoid(商品名:示卓安,美国GE药业)和Optison 的仿制品(商品名:雪瑞欣,湖南康润药业有限公司;信苏,扬子江药业集团)。Definity(LANTHEUS,华润双鹤药业股份有限公司)已完成中国注册临床试验。中国临床应用主要以声诺维和示卓安为主,安全性好[1-2]。示卓安对声压的抵抗力稳定性以及使其微泡可以被网状内皮系统吞噬的特性,使其在肝脏可被枯否细胞吞噬摄取,使其具备长达1 h 的独特血管后相成像(也称枯否相)[4-6]。在临床工作中可根据不同的使用目的对造影剂的种类进行合理的选择,同时亦需要对仪器参数、使用剂量进行相应的调整。
肝脏超声造影要求:合适的参数设置、规范的操作流程、合理的造影剂类型、剂量和推注方式的选择。
参数设置:MI,依据选择的造影剂进行调节,比如造影剂SonoVue 为低机械指数,MI 在0.07~0.10;造影剂Sonazoid 为高机械指数,MI 在0.18~0.22。其他造影剂请详见厂家造影剂使用说明。
焦点(focus)位置:造影条件下将焦点位置调到最深区域(图像的底部),如果机器是采用的全域动态聚焦技术则无需调节焦点。
增益(gain):造影增益以隐约可见肝包膜和大血管结构为宜,组织增益可以适当调高,以清晰辨识病灶结构为最佳。
操作流程:(1)二维模式下找到目标病灶,调节二维参数,使病灶在近场区域,且保证病灶在观察期间不容易脱靶为宜;(2)启动造影双幅模式,助手推注造影剂并冲管后开始计时,并实时向后存储电影文件,存储时间不少于60 s。后续可采用间断扫查存储形式,分别于间隔每30 s 存储10 s 门静脉相、静脉相、延迟相或枯否相造影表现。(3)造影动态文件的回顾浏览:选择存储的电影文件,回放浏览,观察造影剂开始增强的时间、增强的类型、消退的时间、消退的类型等声像图征象。可以使用混合模式帮助观察造影剂增强的类型,使用微血管成像模式观察肿瘤的血管架构。
定量分析-时间强度曲线(time-intensity curve,TIC):选择造影视频文件,启动定量分析,选择感兴趣区域(描记或者椭圆均可以),复制ROI 取样框,放在相同深度正常肝组织区域,点击确认,对定量分析的曲线图进行拟合处理及相关参数显示。TIC 分析的常见参数包括:峰值强度(peak intensity,PI),最大信号强度;达峰时间(time to peak,TTP),从曲线的起点到PI 的时间;上升时间,TTP 减去最大斜率切线与X 轴相交的时间;最大幅度的一半,TIC 中最大强度一半的两个时间点之间的持续时间;灌注率,TIC 上升部分的最大斜率切线;廓清率,曲线下降部分的最大斜率切线;曲线下面积(area under curve,AUC),包括灌注时的AUC(wash-in AUC,WiAUC)、廓清时的AUC(wash-out AUC,WoAUC)以及WiAUC加 WoAUC。
造影剂给药方法:造影剂混悬液配置方法为Sonovue(SF6 气体59 mg,冻干粉25 mg)粉末与5 ml 生理盐水、Sonazoid 粉末(16 μl)与2 ml 蒸馏水混合制成,通过肘前静脉推注,然后用生理盐水5 ml 推注冲洗。推荐肝脏的Sonovue 剂量为2.4 ml 混悬液/次,Sonazoid 剂量为0.015 ml 混悬液·kg-1·次-1。
1.3.5 超声弹性成像 超声弹性成像具有无创、简便、快速、易于操作、可重复性、安全性和耐受性好的特点,在无创诊断肝纤维化中发挥重要作用。临床上用于肝脏检测的弹性成像主要分为4 大类:(1)剪切波弹性成像(shear wave elastography,SWE);(2)应变式弹性成像(strain elastography,SE);(3)瞬时弹性成像(transient elastography,TE);(4)联合弹性成像(combi-elasto)。检测时可根据检测目的和需求进行适时参数调整,其中包括参数单位(m/s、kPa)、取样ROI 大小、测量区域、弹性量程等,以保证获取准确弹性测值和最佳图像[7-10]。
SWE:利用声辐射力(ARFI)技术激励组织产生剪切波,通过测量其速度来判断组织硬度。包括点式剪切波测量(p-SWE)和二维剪切波弹性成像(2D-SWE)。(1)p-SWE可获取取样范围内多点剪切波声传播速度(Vs),用于组织密度(硬度)测量,也可通过设备内设置好的公式将剪切波声速转换为弹性模量,获取取样范围内弹性绝对值(kPa)。代表厂家及技术名称为:西门子VTQ、迈瑞STQ、日立SWM 等。取样框大小、形状一般由制造商设定好,无法自行调整,一般大小约为1.5 cm×1.0 cm,检测时仅需要获得最佳基础灰阶图像,需要尽量避开管道结构,在肝实质中测量,以确保测量值的准确。检测时取样框应置于肝右叶(S5、7、8 段),肝包膜下1 ~ 2 cm 及2 ~ 3 cm,避免因为深部组织的声学衰减、混响、阴影等因素造成的测量误差。推荐进行10 次有效测量并以中位值作为最终参考值。(2)2D-SWE:一般采用取样范围内多点激励的方式进行剪切波二维面成像,不同厂家采用不同的激励方式。此方法可实现取样面积内剪切波平均声传播速度(Vs)、弹性模量绝对值(kPa)并根据不同组织密度(硬度)进行彩色编码,以二维的形式呈现。代表厂家及技术名称为:飞利浦ElastoQ、迈瑞STE、声科SWE 等。相对于P-SWE,2D-SWE 可获得更大的取样范围,感兴趣区域可以自行调节,一般设定的ROI 大小约4 cm×3 cm或3 cm×3 cm,建议将ROI 放置于超声图像中央以减少检测误差。ROI 上缘置于肝右叶包膜下1~2 cm,最深不超过5~6 cm。当检测图像质量可靠(ROI彩色填充完整)时重复3 次或5 次。
剪切波频散成像(shear wave dispersion,SWD):基于不同频率脉冲波形成的剪切波在肝脏组织内传播的频散系数来评估肝脏组织黏性,可间接反映肝脏的炎症活动度。代表厂家及技术名称为:佳能SWD。与2D-SWE 同时测量,在测量时取样框设定为3 cm×3 cm 为宜,置于肝包膜下1.0 cm,最深不超过6 cm,ROI 圆形,直径1.0 cm。重复5 次有效测量取中位数[7-8]。
SE:虽然应变弹性是应用最广泛的弹性成像方法,但在慢性肝病的应用中相对较少。其原理是通过患者生理运动形成的组织轴向位移,连续采集组织压缩前、后的射频信号,利用互相关方法对信号进行分析,计算感兴趣区域内组织形变分布数据,并进行彩色编码。SE 只能获得肝脏组织相对弹性应变信息,无法得到弹性模量绝对值。代表厂家及技术名称为:日立RTE-Strain Histogram。其通过弹性应变数据、 数据分布特征、弹性应变纹理这三方面共11 个特征数据的信息来综合分析组织的弹性及弥散分布情况ROI 取样时应尽量放置在超声图像中上部,与剪切波弹性检查类似,ROI 上缘置于距肝包膜1.0 cm以下,最深不超过6 cm,ROI 推荐大小2.5 cm×2.5 cm(设备已预设定好,无需调整)。在成像困难时可调整帧抑制(frame rejection)与噪声抑制(noise rejection)以得到稳定性好重复性高的弹性图像, 5 次有效测量后会自动得出LFI(liver fibrosis index)值作为诊断参考。
TE:是基于超声原理,利用探头振动控制的技术产生剪切波并向深层组织传播,从而获取肝脏剪切波的声传播速度,用于肝硬度测量。代表厂家及技术名称为:法国Echosens 公司FibroScan TE。检测时,需要根据患者特征选择合适的探头,大多数患者适用M 型探头。对超体质量、中心型肥胖、14 岁以下或胸围≤ 75 cm 的患者,可酌情选用XL 型或S1、S2 型探头,以增加检查的成功率。探头置于至少6 cm 厚的肝右叶组织区域并避开大血管。根据制造商的建议,当获得10 次有效数据且IQR/M(四分位间距/中位数)≤ 30 时,取中位值作为诊断参考。其优势是操作简便、快速、易于操作,广泛被临床科室使用;缺点是在检查过程中无法获取二维图像,只是一维呈现。
联合弹性成像(combi-elasto):是弹性成像发展过程中新出现的一类超声弹性技术。其基本原理是结合了剪切波弹性与应变弹性两种技术优势而形成的多因素、多参数综合定量分析技术。检测结果中可同时得到与纤维化分级相关的F Index(fibrosis index)和炎症活动相关的A Index(activity index)进行定量。代表厂家及技术名称为:日立Combi-Elasto。Combi-Elasto 设定的ROI 大小为3.0 cm×2.5 cm,检查时需将ROI 上缘放置在距肝包膜1 cm 以下的图像中央,最深不超过5 cm,并且需要避开较大的管道结构。推荐连续进行5 次有效测量取中位数作为诊断参考。
无论是采用哪种弹性成像技术进行肝硬度测量,需严格按照各厂家给出的质控参数和要求进行检测,才能获得相对可靠的结果。肝脏炎症程度、胆汁淤积、肝内血容量增加、饮酒史都是影响剪切波测值的因素,需在检查中注意。另外各厂家设备弹性成像原理不同,所以诊断界值不能够相互参考和混用。
1.3.6 声衰减测量 超声在人体组织中传播时会发生能量损耗,而脂肪是一种衰减介质,随肝脏脂肪含量的增高,超声衰减系数也会随之增加,计算超声反向射频信号的衰减特性来实现定量检测。通常以dB/m 或dB/cm/MHz 为单位,声衰减系数测值会随脂肪变性程度加重而增加。代表厂家及技术名称为:FibroScan CAP、日立ATT、佳能ATI。测量时应避开较大的管道结构,选取尽量均匀的肝脏组织,进行5~10 次有效测量,选取中位值作为诊断参考。与弹性成像检查类似,不同厂家设备因为技术原理与发射频率不同,诊断界值不能相互参考和混用。
1.4 检查前准备 常规肝脏超声检查一般患者无需特殊准备。如需同时检查胆管系统,检查前应禁食8~12 h,如需确定肝脏明显缩小或腹腔气体明显时,可饮水500~800 ml 后检查。
超声造影检查:(1)建议左上肢建立静脉通路,优先选择粗、直、静脉窦少的血管(如头静脉、肘正中静脉、贵要静脉、前臂正中静脉),选择20G、22G 留置针,中心静脉导管和耐高压经外周静脉置入中心静脉导管术(PICC)也可注药。(2)了解受检者临床资料(病史、实验室及其他影像学检查)和检查目的,判断是否适合超声造影检查,排除过敏风险等禁忌证,并获得知情同意。(3)医护熟知造影剂配置、注射和过敏反应救治要求,如蛋白类过敏等。(4)造影剂应在造影前抽取并上下混匀。(5)剂量选择如前述[11]。
超声弹性成像:(1)受检者检查前空腹2~3 h,避免饮食、饮酒或饮料(尤其咖啡因) 及吸烟后测量。检查前平静休息至少10~20 min。(2)检查时患者应避免Valsalva动作,操作者的手应绝对禁止抖动(持握探头的手肘部应轻靠于患者或床沿固定,避免探头滑动或不自觉的抖动),使弹性图像稳定3 s 以上。对于肝前脂肪较厚的患者,可以适当加压。(3)建议操作者需具备一定数量病例检测经验(检测TE 人次>100 例,检测SWE 人次>50 例)[8-9]。
1.5 检查体位
(1)仰卧位:为常规检查体位。患者仰卧,平静呼吸,充分暴露乳头到脐之间的腹部,双手上举置于枕后。这种体位可使肋间隙增宽,便于探头从左肋下、剑突下、右肋下和右肋间等处扫查。
(2)左侧卧位:患者左侧卧位,右臂上举置于头后。这种体位可进行右肋间扫查,主要可显示肝右前叶、右后叶及膈顶区;深吸气时也可从右肋下扫查。
(3)右侧卧位:患者右侧卧位,左臂上举置于头后。探头从左肋间扫查,可显示脾脏、左外叶(尤其在胃胀气时)。
(4)坐位或半卧位:患者坐起,双手后撑,或将床摇起使患者半卧。这种体位可使肝下移,探头从剑突下扫查,对显示肝左叶外侧角和被肋骨所遮盖的肝浅表部结构有一定帮助。
1.6 扫查方法
(1) 扫查顺序:超声扫查全肝需要从多角度、多切面、多体位、有顺序地进行,避开肋骨、气体的遮挡和解剖结构上的盲区,以获得可靠的立体信息。一般建议按照如下方法自左向右作连续的断层扫查:左肋缘下斜切扫查、左上腹及剑突下纵切扫查、剑突下横切扫查、右肋缘下斜切扫查、右肋间斜切扫查和肝右叶冠状切扫查。
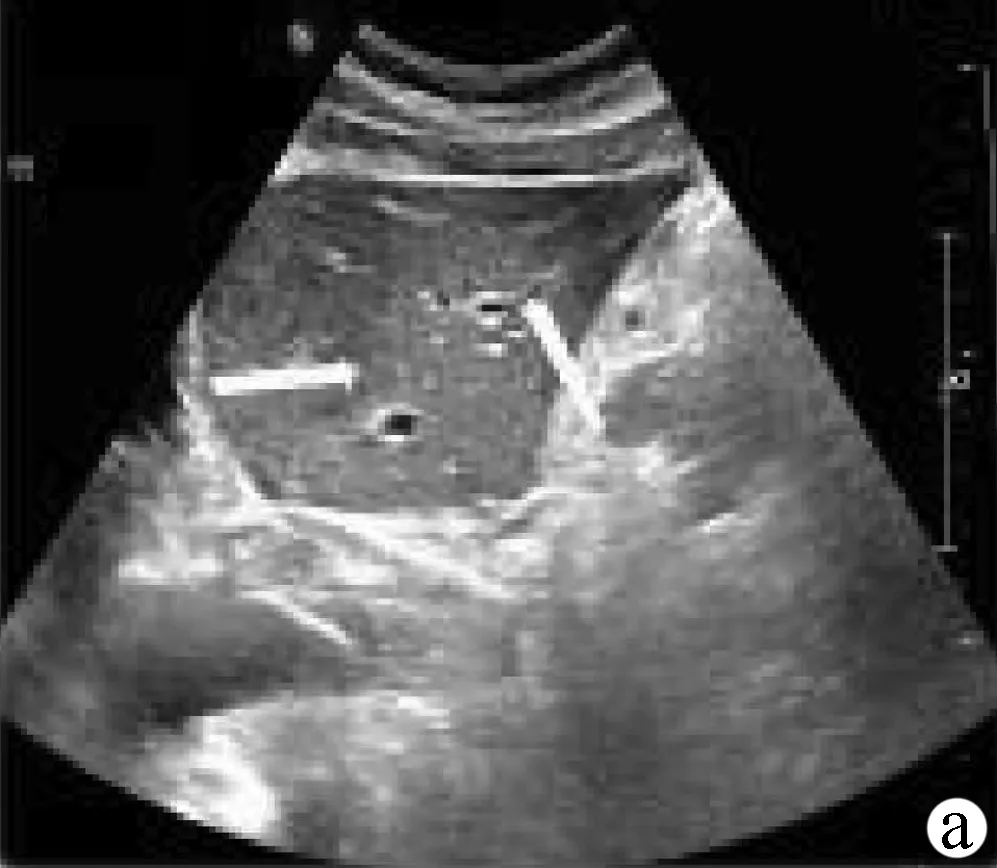
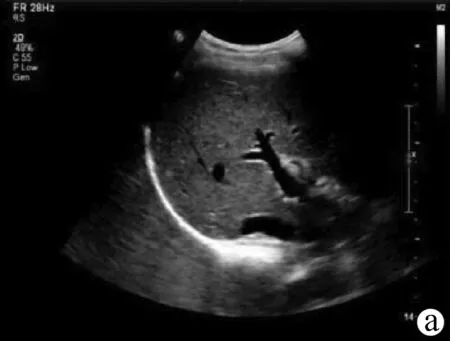
(2)标准切面。肝左叶斜断面(图2a):探头置于左肋缘下,紧压腹部侧动探头,使声束通过肝下缘到达肝膈面。扫查时嘱受检者深吸气后屏气,重点显示肝左叶结构,获得以门静脉左支及矢状段的“工”字形结构为特征的肝左叶斜断面图,显示左外叶上段、左外叶下段、门静脉左支矢状部等。
经腹主动脉和经下腔静脉矢状切面(图2b、c):探头置于剑突下与腹壁垂直,自左外侧向内移动至右正中旁线,观察肝左叶的连续矢状断面以及其后方的腹主动脉和下腔静脉,获得经腹主动脉和经下腔静脉矢状切面图。经腹主动脉矢状切面显示左肝、胃、胰体以及腹主动脉长轴等结构,是超声测量肝左叶厚度和长径的标准切面,测量方法:左叶厚度测量点分别置于肝左叶前、后缘最宽处的肝包膜处(包括尾状叶),测量其最大前后距离;左叶长径测量点分别置于肝左叶的上、下缘包膜处。
右肋缘下斜切面(图2d):探头置于右侧肋缘下,与肋弓平行,使声束由垂直朝向被检查者右肩横膈方向缓慢扫查,可显示肝膈顶区、肝右静脉、肝中静脉、门静脉左支和门静脉右支等,观察肝脏外形、肝实质、特别观察膈顶是否有病变。以肝右静脉和肝中静脉汇入下腔静脉的右肋缘下肝脏斜切面为标准测量切面,可以测量肝右叶最大斜径,测量方法:测量点分别置于肝右叶前、后缘包膜处,测量其最大垂直距离。
经第二肝门斜断面图(图2e):受检者仰卧或左侧卧位,探头置于右肋缘下,声束朝向受检者右肩方向缓慢扫查,探头可与肋缘平行或垂直,直至显示膈肌回声;嘱受检者深吸气后屏气,缓慢侧动探头连续扫查,可观察大部分肝内结构。其中经第二肝门斜断面图,显示放射状排列的3 支肝静脉,肝左静脉、肝中静脉和肝右静脉向下腔静脉集中汇流,亦即第二肝门。
肝右叶肋间斜切面(图2f):受检者仰卧或左侧卧位,探头置于右侧肋间,自第4 肋间开始向下逐个肋间扫查,声束垂直于胸壁并侧动探头连续扫查。主要可显示肝右叶的所有叶段,以及尾状叶和方叶的膈顶部分、第一肝门、第二肝门、肝右前叶内的门静脉及其分支、肝中静脉和肝右静脉及其分支等结构。其中经第一肝门右肝斜切面图以显示门静脉主干及右支长轴为特征,胆囊和下腔静脉的斜断面分别位于门静脉两侧,似“飞鸟征”。
肝-右肾矢状切面(图2g):受检者左侧卧位或仰卧位,探头垂直于胸腹壁向右侧滑动扫查,可获得沿右侧腋前线、腋中线的矢状切面,获得肝-右肾矢状切面图。此断面上肝右后叶与右肾相邻,肝肾之间的腹腔间隙称肝肾隐窝,少量腹水可使这一间隙增宽,声像图上显示为无回声区;也可显示肝右后叶和膈肌顶部,观察膈肌上下有无胸腔积液和腹水。


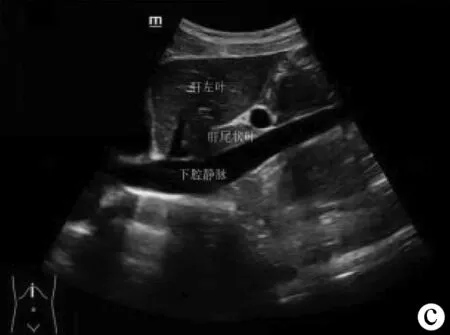
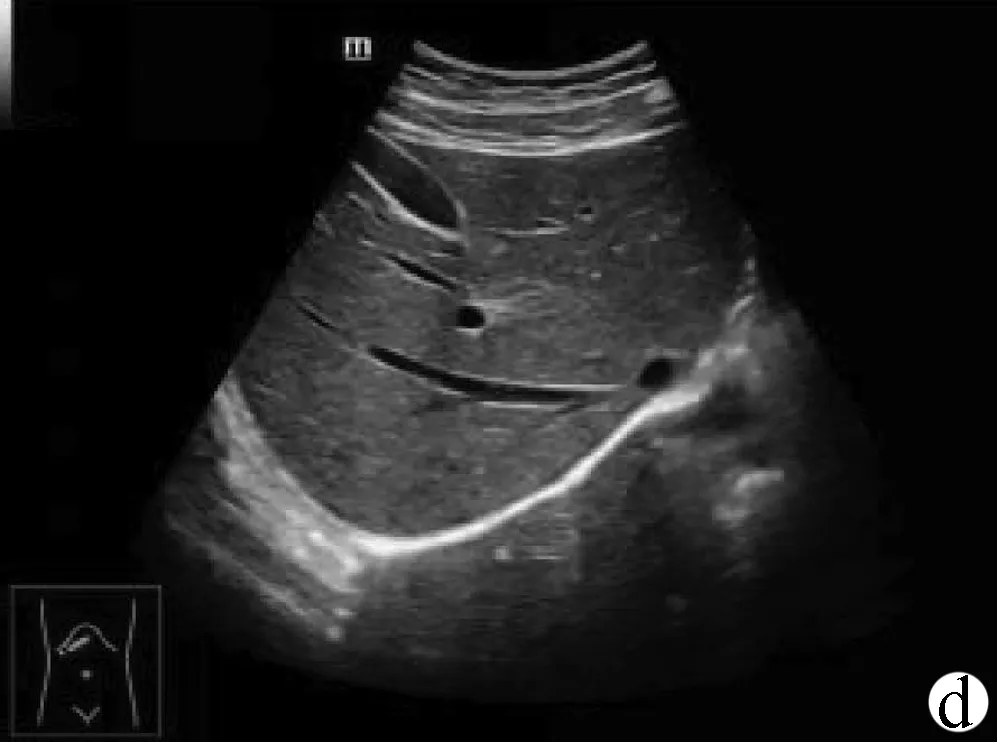
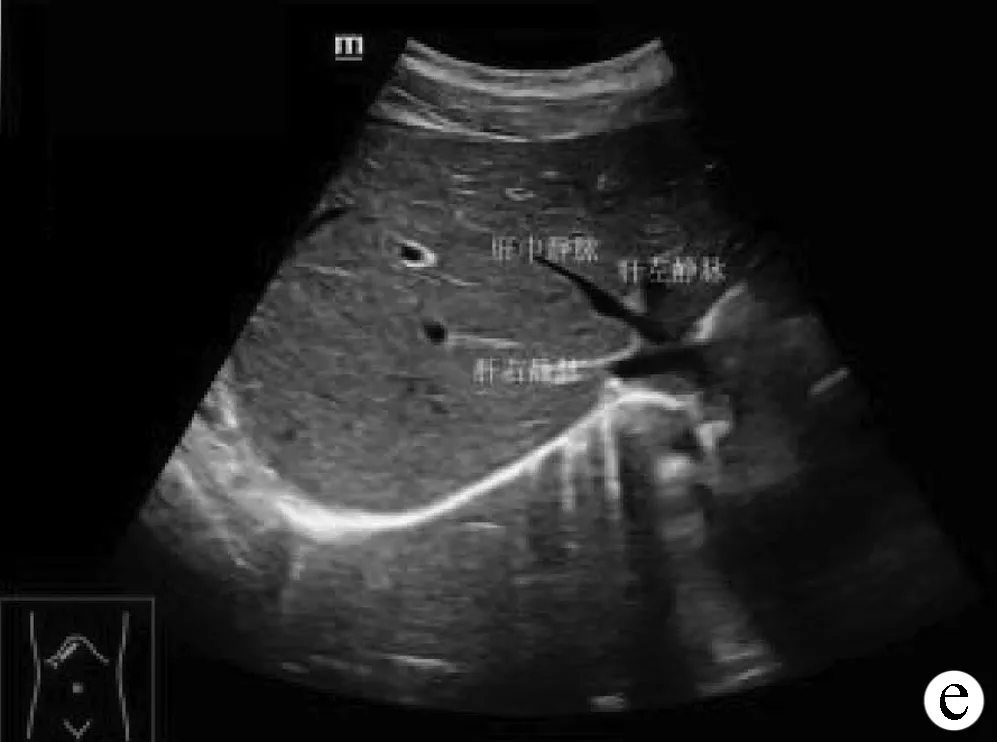


注:a,肝左叶斜断面;b,经腹主动脉矢状切面;c,经下腔静脉矢状切面;d,右肋缘下斜切面;e,经第二肝门斜断面图;f,肝右叶肋间斜切面;g,肝-右肾矢状切面。
(3)肝脏及血管胆管正常界值[10]。
肝右叶:最大斜径12~14 cm,前后径8~10 cm,横径不超过10 cm。
肝左叶:肝左叶前后径≤6 cm,肝左叶上下径≤ 9 cm。
门静脉主干内径:1.0~1.2 cm,最高流速15~25 cm/s。
肝固有动脉:内径0.2~0.6 cm,峰值流速46~66 cm/s。
阻力指数RI:0.5~0.7。
肝静脉:0.6~0.9 cm。
胆管:肝内胆管内径≤0.2 cm。肝总管内径0.4~0.6 cm。胆总管长4~8 cm,直径0.6~0.8 cm,管壁厚0.2~0.3 cm。
2 肝脏炎性病变
2.1 定义及分类 肝脏炎症是指肝脏因病毒、自身免疫性肝病、药物、乙醇或代谢异常等损伤引起的炎症,几乎见于各种肝病[12]。肝脏具有清除血液中毒素和病原体的功能,并形成独特的免疫监控机制,为了避免不必要的免疫系统激活,肝脏存在局部的免疫反应,诱导对抗原的耐受性。当病原体或环境伤害等长期危害肝脏,且无法消除时,就会引发炎症[13]。肝脏炎症是肝病进展的主要病理学基础,肝纤维化和肝硬化通常伴随慢性炎症,且常贯穿病程始终。
如果肝炎在少于6 个月内消退为急性肝炎,如果病程持续超过6 个月以上的肝脏坏死和炎症,则为慢性肝炎[14]。病毒性肝炎中甲型、戊型肝炎通常为急性肝炎,不发展为慢性肝炎;乙型和丙型肝炎可由急性肝炎演变为慢性肝炎。其他病毒性感染导致的肝炎中巨细胞病毒、单纯疱疹病毒、EB病毒、腺病毒,通常为急性肝炎;自身免疫性肝炎可为急性和慢性肝炎。对于脂肪性肝病,酒精性脂肪性肝病可表现为急性和慢性肝炎;非酒精性脂肪性肝病通常为慢性肝炎。代谢性肝病通常为慢性肝炎[15]。急性肝炎以肝小叶内的肝细胞损伤、炎症和肝细胞再生为特征,可以是弥漫性的也可以是局部性的,通常不存在纤维化。部分慢性肝炎,尤其是由病毒感染引起的慢性肝炎,可能导致永久性肝损伤,包括肝纤维化、肝硬化等[14]。本小节将主要介绍急性肝炎超声表现。
2.2 超声诊断标准
2.2.1 灰阶超声 轻度慢性肝炎肝脏超声检查通常无特异性,应结合临床资料综合诊断。对于慢性肝炎通常更关注于肝脏纤维化进程。
急性病毒性肝炎,轻度急性肝炎声像图可无明显异常,中、重度急性肝炎肝脏可增大、增厚,形态饱满,肝包膜光滑,边缘较锐利;肝实质回声密集、减低,肝内门静脉分支管壁回声增强,肝内许多小血管断面异常清晰,称为“满天星”征。若进一步发展,肝脏实质内回声逐渐增高、增粗,高低回声分布不均匀。门静脉管道回声增高、边界不清[10](图3)。
自身免疫性肝病发病常是隐匿性的,急性发病者很少见。急性起病者可出现急性肝衰竭、重度黄疸和凝血酶原时间延长等。超声表现与急性病毒性肝炎酷似。诊断基于临床表现、生化检查、血清免疫学和组织学表现的综合诊断[16]。


注:a、b,灰阶超声示肝实质回声密集、稍减低,肝内门静脉分支管壁回声增强;c,胆囊缩小,囊壁增厚,黏膜水肿呈低回声。
药物性肝病早期肝实质回声如同病毒性肝炎早期,肝脏体积无明显变化,由于肝细胞变性,出现小片低回声,若肝细胞内脂肪增多,则肝内回声细密、增多、增强,类似脂肪肝声像图;如损害长期存在,肝脏损害进一步加重,肝细胞脂肪变性、坏死,并可出现淤胆及毛细胆栓形成,肝血窦扩张等改变,声像图可见肝大,肝回声增粗、增强,回声分布均匀或欠均匀,深部回声减弱[17]。
轻型酒精性肝病超声声像图显示肝脏大小及内部回声基本正常。随着肝内脂肪增多,肝细胞中存在脂滴空泡,超声表现类似脂肪肝,肝脏体积一般无明显增大。当发展至酒精性肝炎,肝内脂肪明显增多,超声表现为肝脏增大、实质回声增粗、增强,分布不均匀,管道结构和彩色血流无明显改变[18]。酒精性肝损害导致的脂肪肝,戒酒可使肝细胞中脂肪量减少,如果继续饮酒,中央静脉周围发生纤维化,可引起肝硬化[19]。
当肝炎急性期肝细胞充血、肿胀、变性坏死,肝内胆汁生成减少及一过性门静脉高压致胆囊静脉压增高,囊壁浆膜下水肿、出血及炎细胞浸润,而胆汁引流尚通畅,胆囊腔内压力小于胆囊浆膜张力,胆囊壁呈向心性水肿增厚,囊腔缩小或消失,黏膜皱缩但连续。超声检查可见胆囊缩小,囊壁增厚,黏膜水肿呈低回声,胆囊充盈不佳或囊内透声差,内充满弱至中等的点状回声[20]。大部分急性病毒性肝炎患者胆囊会不同程度受累,受累程度与肝损害程度相关,随患者病情好转,胆囊壁水肿可迅速消退,提示预后良好。
部分病例可见肝门处椭圆形肿大淋巴结。腹水多出现于重型肝炎病例[18]。
2.2.2 超声造影 超声造影对肝脏炎性病变诊断缺乏特异性,肝脏发生严重弥漫性炎症反应时,亦可形成门静脉和肝静脉间分流,可能发生类似肝硬化时“肝动脉- 静脉通过时间”缩短的表现,但该特征尚未得到充分论证,不作为临床常规诊断推荐[21]。
超声引导下肝脏穿刺活组织学检查(活检)得到病理学肝损害程度的评估是诊断金标准,有助于确定急性肝炎的病因。在具备有经验的病理团队情况下,取材以16G 或18G穿刺针获取长度15~20 mm 肝组织即可明确诊断。 活检标本包括的汇管区的数量应满足至少6~8 个,如果汇管区数量不足,应在病理报告中注明,并说明样本量不足可能导致诊断、分级和分期不准确。但由于肝实质性异常的分布是不规则的,样本的差异性几乎不可避免。虽然从不同的肝叶取活检组织可使样本误差最小化,但难以常规应用。因此,最实际的方式是获得足够大的活检标本以尽量减少样本误差[22]。
2.2.3 弹性成像 肝脏弹性成像进行肝硬度测量已被证明是量化慢性肝病中肝纤维化和肝硬化的有效方法,被欧洲肝病学会(European Association for the Study of the Liver,EASL)、亚太肝病学会(Asian Pacific Association for the Study of the Liver,APASL)、美国肝病研究学会(American Association for the Study of Liver Diseases,AASLD)、中华医学会肝病学分会等推荐。中华医学会超声医学分会、EFSUMB、WFUMB、美国超声放射协会(Society of Radiologists in Ultrasound)等先后发表了弹性成像临床应用指南或专家共识,肯定了超声弹性成像在肝纤维化评估中的价值。
目前在各指南推荐中,剪切波弹性成像被评价为超声一线评估慢性肝病可靠的检查方法。然而剪切波弹性成像的测值也会受到一些因素的影响,除可控的因素外,最为主要的是慢性肝病进程中炎症、坏死及合并脂肪变的影响。在不同的指南中都有提出,当丙氨酸转氨酶(alanine aminotransferase,ALT)水平过高(超过2 ~ 5 倍正常值)时,剪切波的测量值会被高估,并不能准确表达纤维化程度,因此必须要考虑到炎症对剪切波测量的影响,尤其是在急性炎症期时要慎重使用[23]。随着超声新技术的发展,个别厂家也开发出针对评估炎症活动度的新技术,从而校正剪切波对慢性肝病的诊断效能[24]。多项研究已经证明了这类技术的有用性。目前超声弹性成像对无创评估慢性肝病新的发展趋势为:采用多参数、多指标综合评估的方式,不仅可以准确定量评估纤维化程度,而且还可以评估炎症活动度以及脂肪变性程度。这些新的技术势必会对慢性肝病诊断、治疗、疗效监测提供新的有价值的诊断信息。
由于各类肝脏炎症的临床表现非常复杂,对于急性肝炎获取详细的历史记录至关重要。因此切忌主观片面地只依靠某一项或某一次检查即作出诊断。应根据流行病学史、临床症状和体征、实验室及影像学检查结果,并结合患者疾病具体情况及动态变化进行综合分析,通过全面的辅助检查对肝脏炎性损伤的程度进行评估。对于病毒性肝炎患者还需根据血清学及病原学检测结果作出病原学诊断,同时对于黄疸患者超声可排除胆管性梗阻,以达到最后确诊的目的。
2.3 检查频次 急性肝炎在大多数情况下,如果患者症状轻微,肝酶轻度升高,并且肝功能正常,则可以在大约3 个月内进行重复超声检查。如果肝功能急剧恶化[血清总胆红素(total bilirubin,TBil)超过171 μmol/L,或每日上升大于17 μmol/L],凝血功能异常,国际标准化比值(international normalized ratio,INR)≥1.5,既往无明显肝病患者出现不同程度的神经精神改变(肝性脑病),且病程<26 周的急性肝衰竭的症状则需要进一步检查和更积极的监测[25]。
2.4 实验室辅助检查 急性肝炎实验室测试通常显示氨基转移酶升高和胆红素升高。大多数肝炎患者血清ALT 和天冬氨酸转氨酶(aspartate aminotransferase,AST)升高的水平与肝细胞损伤程度呈正相关,ALT 是肝损害最敏感的检测指标。ALT 轻度增高(≤3 倍正常值)或反复波动为疾病进展的重要标志。急性、亚急性或慢加急性肝衰竭时,患者短期内黄疸进行性加深,血清TBil≥10倍正常值上限(international unit,ULN)或每日上升≥ 17.1 μmol/L;有出血倾向,凝血酶原活动度(prothrombin activity,PTA)≤ 40%,或INR≥1.5。由于肝细胞大量坏死,可出现ALT 明显下降甚至正常,而TBil 进行性上升,呈“酶胆分离”现象[26]。
3 肝纤维化
3.1 定义 肝纤维化是肝脏受到各种损伤后细胞外基质(即胶原、糖蛋白和蛋白多糖等)的弥漫性过度沉积与异常分布的修复反应,是肝脏对慢性损伤的病理性修复反应,是各种慢性肝病向肝硬化发展过程中的关键步骤和影响慢性肝病预后的重要环节[10]。肝纤维化进一步发展可引起肝小叶结构紊乱,肝细胞结节性再生,形成假小叶结构即肝硬化。肝纤维化在组织学上是可逆的,而肝硬化逆转则较为困难。
肝纤维化最常见病因是慢性乙型和慢性丙型肝炎所致的病毒感染及酒精性肝损伤,此外随着肥胖率的增加,非酒精性脂肪性肝病也增加了肝损伤的风险;其他慢性肝损伤的病因包括药物毒副作用、肝脏感染(血吸虫)、免疫学肝病(自身免疫性肝病)、代谢紊乱(脂质、糖原和金属元素存储紊乱)及胆汁淤积性肝病[10,27]。
肝活检仍是肝纤维化诊断的“金标准”:实施肝穿刺活检术,取材组织长度须>1.5 cm,包含至少10个完整汇管区,将肝组织破碎标本(S4期除外)排除在外。石蜡包埋组织样本后,连续切片,常规HE 染色和Masson 染色,按Scheuer 标准进行肝纤维化分期诊断;S0期:无纤维化;S1期:汇管区纤维化扩大,局限窦周和小叶内纤维化;S2期:可见纤维间隔形成,汇管区周围纤维化,小叶结构仍保留;S3期:可见大量纤维间隔,同时伴随小叶结构紊乱;S4期:有假小叶形成,肝硬化。按Metavir 标准进行肝纤维化分期诊断;F0:无纤维化;F1:汇管区纤维化,无纤维间隔;F2:汇管区纤维化,有少量纤维间隔;F3:大量纤维间隔,无肝硬化;F4:肝硬化。
3.2 超声诊断标准
3.2.1 灰阶超声 肝脏形态变化:肝纤维化肝脏形态改变不明显或无改变。传统二维超声通常通过肝脏表面和边缘形态、肝包膜厚度、肝实质回声、肝右叶最大斜径10 ~ 14 cm、门静脉主干径1.2 ~ 1.4 cm、脾长径12 cm 和厚度4 cm、脾静脉内径1.0 cm和门静脉血流速度15 ~ 25 cm/s、胆囊壁厚度0.3 ~ 0.5 cm, 等指标参数评估肝纤维化程度。部分微细结构的量化测量可提高肝纤维化及肝硬化的诊断能力。其中改量肝尾状叶/右叶比值和肝静脉直径可能是2个较为准确的指标:以门静脉主干为分界,计算肝尾状叶/右叶横径比值(crl-m)量化肝右叶萎缩和左叶肥大,发现其对肝硬化的检测有较高的价值,敏感度、特异度和准确度分别为84%、100%和94%[28]。
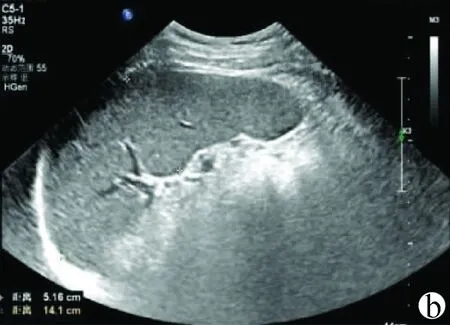
肝实质回声变化:肝实质弥漫性增粗、增强,分布不均匀,可见增粗增亮的线状结构,即“条索样”(图4)。二维超声诊断主观性强,不同医生对图像理解和分析有差别,经验依赖度高。
慢性乙型肝炎肝纤维化超声表现与病理Scheuer 标准进行肝纤维化分期诊断的对应关系见表1。

表1 慢性乙型肝炎肝纤维化超声表现与病理Scheuer标准进行肝纤维化分期诊断的对应
3.2.2 CDFI 肝静脉:血流频谱呈三相型(测量中以肝静脉距第二门部1.5 cm 处为标准),肝静脉血流呈低矮三相型。
门静脉:远端走行显示清晰,主支内径<1.3 cm(以第一肝门部门静脉主支与下腔静脉平行为标准),血流频谱呈连续性低速频谱且随呼吸动度而起伏,门静脉右支血流速度>14 cm/s。
肝动脉:在肝动脉起始部进行测量(以腹腔动脉分出肝动脉处为标准),要求测量血流时超声声束经过血管长轴且保持血管夹角<60°。肝动脉血流频谱呈低阻低速型,RI<0.6。
3.2.3 超声造影 为研究肝纤维化提供了新的思路,可直观反映肝脏血流动力学变化,从而间接反映肝脏病理学改变。随着肝纤维化加重,肝内血流阻力增加,门静脉血流量和肝实质灌注量均减少,而肝动脉血流量代偿性增加,导致超声造影参数发生变化,且此变化与肝纤维化程度相关。超声造影参数正常肝脏、显著肝纤维化和肝硬化之间鉴别诊断仍有一定困难。另外,超声造影技术还受造影剂种类、推注方式及剂量、不同采样部位的影响, 诊断能力和价值尚需进一步研究。


注:a,肝实质回声增粗,肝脏下缘角锐利,血管走向清晰(S1期);b,肝实质回声明显增粗、增强,分布不均匀,可见增粗增亮的线状结构,即“条索样”(箭头所示)(S2期);c,肝实质回声明显增粗、增强不均匀(箭头所示),伴或不伴结节(S3期);d,肝实质回声明显增粗增强不均匀、斑片状、伴结节(箭头所示)(S4期)。
3.2.4 弹性成像 超声弹性成像在无创诊断肝纤维化中发挥了重要作用,在临床应用中,需考虑不同病因、不同弹性成像技术及设备的差异。如前所述,目前临床上用于肝硬度检测的SWE包括TE、p-SWE 和2D-SWE,通过肝硬度测量(liver stiffness measurement,LSM),从而反映肝纤维化程度。
TE:参考我国《瞬时弹性成像技术诊断肝纤维化专家共识(2018 年更新版)》的建议[8]:(1)慢性乙型肝炎(chronic hepatitis B,CHB):胆红素正常、ALT<5×ULN 的CHB 患者,LSM≥12.4 kPa(当ALT水平>1~<2×ULN,LSM≥10.6 kPa)考虑进展期肝纤维化,LSM≥9.4 kPa 考虑显著肝纤维化,LSM<7.4 kPa排除进展期肝纤维化;LSM 在7.4~9.4 kPa 患者如无法确定临床决策,考虑肝活检;LSM<6.0 kPa排除进展期肝纤维化;LSM:6.0~9.0 kPa 者无法决定临床决策,考虑肝活检。(2)慢性丙型肝炎(chronic hepatitis C,CHC):CHC 患者LSM<7.3 kPa 考虑排除进展期肝纤维化。(3)成人非酒精性脂肪性肝病患者LSM≥11.0 kPa 考虑进展期肝纤维化,LSM<8.0 kPa考虑排除进展期纤维化。(4)酒精性肝病患者LSM<9.5 kPa考虑排除进展期肝纤维化。(5)自身免疫性肝炎肝纤维化界值参照ALT<2×ULN的CHB 标准。
SWE[29-31]:(1)根据我国《二维剪切波弹性成像评估慢性乙型肝炎肝纤维化临床应用指南》推荐,2D-SWE 正常人肝硬度正常值范围2.6~6.2 kPa,诊断慢性乙型肝炎肝纤维化效能优于血清学指标,与TE 相比甚至更高。诊断肝纤维化F2 阈值建议为7.1~7.6 kPa ;F4 阈值建议为10.1~11.7 kPa。对于ALT 正常的慢性HBV 感染者,2D-SWE 测值<8.5 kPa 可排除肝硬化诊断,>11.0 kPa 可确定肝硬化诊断,介于8.5~11.0 kPa 需肝活检等进一步评估。(2)《2017 年欧洲超声医学和生物学联合会肝脏弹性超声临床应用指南和建议》[7]推荐:对于CHC患者,2D-SWE 可作为一线评估肝纤维化的方法,其排除肝硬化的效果最好。
3.3 检查频次 肝纤维化患者如无需内科处理,建议每6个月行1次腹部超声检查;需要内科进行干预治疗,可随时根据临床治疗需求行腹部超声检查。
3.4 实验室辅助检查 肝纤维化血清学标志物有直接和间接标志物,前者反映了肝纤维化的病理生理过程,与肝纤维化分期有良好的相关性,有助于肝纤维化早期的诊断,后者反映了肝纤维化对机体的影响,往往出现在已经是晚期肝纤维化的患者中。临床诊断肝纤维化最常用的直接指标:包括透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、Ⅳ型胶原(type Ⅳ collagen,Ⅳ-C)和Ⅲ型前胶原等,肝脏在发生炎症肝纤维化时,肝组织内细胞外基质(extracellular matrix,ECM)的合成与降解之间的平衡遭到破坏,致使ECM 的过度增生和异常沉积,ECM 的成分及其裂解产物即以上四种,被称为经典的“肝纤四项”,而这四项指标并不能很好判断各级肝纤维化程度。临床诊断肝纤维化最常用的间接指标:包括肝功能、凝血酶原时间(prothrombin time,PT)、血常规等,具体有反映肝功能的ALT、AST、碱性磷酸酶(alkaline hosphatase,ALP)、乳酸脱氢酶(lactate dehydrogenase,LDH)和γ-谷氨酸转移酶(γ-glutamate transferase,GGT)等,其中最重要的为ALT 及AST,它们能敏感地反映肝脏细胞的损伤程度。另外,肝功能损害时,合成血清白蛋白功能下降,体现在血清白蛋白减低,另外肝脏代谢减少导致球蛋白增多,故白/球比值下降。预测肝硬化早期诊断指标有:PT 延长,血小板减少,但对肝脏纤维化早期的诊断不敏感。PT 是由肝脏合成的凝血因子水平决定的,是反映肝脏储备、合成、病变严重程度及评估预后的一个重要指标。
目前尚缺乏血清特异性肝纤维化诊断指标[32-33];依单一血液指标对肝纤维化评估作用有限,联合检测和评估可提高诊断价值。目前已对数个以血液学检查结果为参数的肝纤维化无创诊断模型进行了评价,大多来自CHB 和CHC,且只对无纤维化或有极重度纤维化的患者有价值,对中间程度肝纤维化和其他原因所致的肝纤维化分期的预测价值尚不尽人意。目前,较简单且有临床应用价值的主要有AST 与血小板比率指数(aspartate aminotransferase to platelet ratio index)APRI 指数(APRI = AST×100/血小板)和基于4 因子的纤维化指数(fibrosis 4 score,FIB-4),FIB-4=[年龄(岁)×AST(U/L)]/[血小板(109/L)×ALT(U/L)]。APRI 和FIB-4 APRI 指数的构建源于CHC 患者, 成人APRI≥2 预示发生肝硬化,APRI < 1 用于排除肝硬化,近年的研究结果显示该指数对CHB 诊断价值并不高。FIB-4可用于CHB 患者,≥3.25 用于诊断F3 级以上肝纤维化,FIB-4<1.45 用于排除F3 级以下肝纤维化的诊断效能较高。
4 肝硬化
4.1 定义 肝硬化(hepatic cirrhosis)是各种慢性肝病进展至以肝脏弥漫性纤维化、假小叶形成、肝内外血管增殖为特征的病理阶段,代偿期无明显临床症状,失代偿期以门静脉高压和肝功能严重损失为特征,患者常因并发腹水、消化道出血、脓毒症、肝性脑病、肝肾综合征和癌变等导致多脏器功能衰竭而死亡。在我国,多为肝炎后肝硬化。
4.2 超声诊断标准
4.2.1 灰阶超声 肝脏形态变化:肝硬化早期肝脏可正常或轻度增大。典型的肝硬化由于纤维组织的增生使肝脏形态发生改变,多为左右叶比例失调,主要是右叶和左内叶萎缩,而尾状叶及左外叶增大。肝表面呈凹凸不平或锯齿状改变,边缘角变钝或不规则。
肝实质回声变化:肝实质弥漫性增粗、增强,分布不均匀,可见增粗增亮的线状结构,典型肝硬化的肝实质可呈颗粒状、结节状改变,表现为低回声或高回声结节,为肝再生结节,大小多在0.5~2.0 cm,形态规则,呈圆形或椭圆形。
肝内管道结构变化:早期肝硬化肝内管道结构无明显变化。后期可出现以下情况:(1)肝静脉,管径变细,管腔粗细不一,走向不清晰。甚至部分肝静脉分支闭塞,小的分支回声可消失。(2)门静脉,肝内门静脉1~2 级分支管径扩张,严重时发生血管扭曲和走向失常;门静脉主干内径>1.2 cm,部分病例发生门静脉海绵样变,在门静脉周围出现许多扭曲的管道回声,形成“蜂窝”状结构。(3)肝动脉,与门静脉主干、左支和右支伴行的肝动脉增宽,内径可达0.5~0.6 cm。(4)肝内胆管,各型肝硬化不论患者有否黄疸以及黄疸严重程度如何,一般都不会出现肝内胆管扩张的征象。肝硬化如果合并肝外胆管梗阻性病变时,可出现肝内胆管扩张。
门静脉高压征象:(1)脾大,正常脾脏最大长度8~12 cm,厚度不超过4 cm。肝硬化合并门静脉高压时,多为中度或重度肿大,脾门部脾静脉扩张、走形迂曲。脾实质回声无明显变化。(2)门静脉侧支循环建立,胃左静脉增宽(≥0.5 cm),结合门静脉内径>1.2 cm,脾静脉内径>0.8 cm,提示有门静脉高压,并合并食管静脉曲张可能。脐静脉重新开放:正常人脐静脉已闭塞,形成纤维条索状结构(肝圆韧带),脐静脉开放可作为诊断门静脉高压的重要依据。自发性脾肾静脉分流:在脾与左肾间可见迂曲扩张的血管丛,多提示脾门区静脉与左肾静脉间形成交通支。脐周及腹壁静脉曲张:在脐周腹壁显示扩张静脉,粗细不均,与其他侧支相吻合。(3)腹水,腹水的发生是肝硬化自然病史中的一个重要标志,75%以上的失代偿期肝硬化患者伴有腹水。平卧位扫查腹盆腔,少量腹水可在盆腔发现少许无回声区;中量腹水时,于肝肾间隙处显示无回声区;大量腹水时,在肝周、脾周及侧腹部、盆腔均可见到大范围无回声区,内可见漂浮肠管及大网膜。若腹水合并感染,腹水无回声内可出现细小低弱回声或分隔。
其他:因低蛋白血症、腹水和门静脉高压,淋巴液回流受阻等原因,胆囊可出现均匀性水肿样增厚[10]。
4.2.2 CDFI 肝静脉:血流多明显变细、扭曲,灰阶超声甚至不易显示,彩色多普勒能显示肝静脉血流信号及走形。脉冲多普勒显示肝静脉频谱呈连续频谱或反向波消失的门静脉样频谱。
门静脉内血流颜色变暗或呈反向血流。脉冲多普勒显示血流速度降低,部分呈双向甚至反向的离肝血流,频谱受呼吸因素影响减弱或消失,有侧支循环者门静脉流速降低更为明显。当门静脉海绵样变形成时,彩色多普勒可在阻塞的门静脉周围见细小的彩色血流扭曲绕行。
肝动脉:由于门静脉循环障碍,肝动脉代偿性扩张和增生,使肝动脉血流量增加,血流信号增多。声像图表现为与门静脉主干、右支和左支伴行的肝动脉内径增宽,流速增高,阻力指数亦增高(RI≥0.70)。
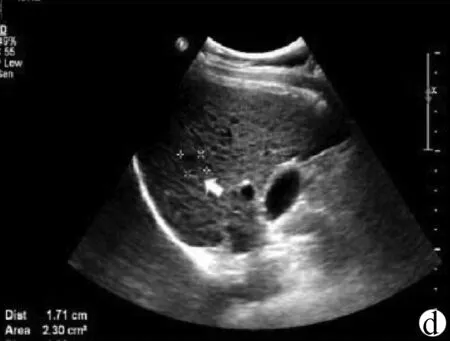
发生侧支循环时,彩色多普勒可显示侧支血管内血流信号和血流方向,为诊断门静脉高压提供有力佐证(图5)。
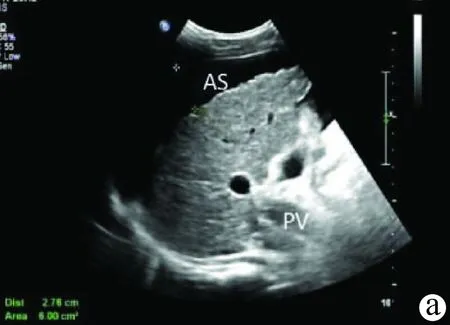

注:a,灰阶超声示肝脏体积缩小,形态不规则,肝表面呈凹凸不平,边缘角变钝;肝实质回声弥漫性增粗,门静脉主干扩张(PV),肝周见腹水(AS);b,脾脏明显增大;c,彩色多普勒显示侧支循环开放,提示门静脉高压。
4.2.3 弹性成像 目前临床上用于肝硬度检测的SWE包括TE、p-SWE 和2D-SWE,其中TE 技术临床应用最为广泛,2D-SWE作为较新的弹性成像技术,具有适用范围广、检测成功率高、取样范围大、二维可视化取样等优势,具有较好的临床应用前景。
瞬时弹性成像技术FibroScan:参考我国《瞬时弹性成像技术诊断肝纤维化专家共识(2018 年更新版)》的建议:(1)慢性乙型肝炎:胆红素正常、ALT<5×ULN 的CHB 患者,LSM 17.0 kPa 考虑肝硬化,LSM<10.6 kPa排除肝硬化可能;胆红素、ALT 正常的CHB 患者LSM 12.0 kPa 考虑肝硬化。(2)慢性丙型肝炎:CHC 患者LSM 14.6 kPa 考虑肝硬化,LSM<10.0 kPa 可排除肝硬化。(3)非酒精性脂肪性肝病患者LSM 15.0 kPa 考虑肝硬化,LSM<10.0 kPa 考虑排除肝硬化。(4)酒精性肝病患者LSM≥20.0 kPa 考虑肝硬化,LSM<12.5 kPa 排除肝硬化。(5)自身免疫性肝炎肝纤维化界值参照ALT<2×ULN的CHB 标准,目前缺乏原发性胆汁性胆管炎可靠诊断界值。(6)无单一LSM界值预测高风险食管静脉曲张(high risk esophageal varies,HREV),LSM<20 kPa 且血小板>150×109/L 可排除HREV[8]。
SWE:(1)根据我国《二维剪切波弹性成像评估慢性乙型肝炎肝纤维化临床应用指南》推荐,2D-SWE 诊断慢性乙型肝炎肝硬化阈值建议为10.1~11.7 kPa;对于ALT 正常的慢性HBV 感染者,2D-SWE 测值<8.5 kPa 可排除肝硬化诊断,>11.0 kPa 可确定肝硬化诊断,介于8.5~11.0 kPa需肝活检等进一步评估[29]。(2)《肝脏超声弹性成像:2018 年世界超声医学和生物学联合会指南更新》推荐:SWE 诊断肝硬化准确度高,且排除肝硬化的有效性(阴性预测值>90%)优于诊断肝硬化;对于未接受治疗的丙型肝炎患者,SWE时诊断肝纤维化严重程度的一线检查手段,有助于筛查病情严重者;对于评估非酒精性脂肪性肝病患者的肝硬度,诊断严重纤维化和肝硬化,2D-SWE 和p-SWE 两者的准确度相似;对于酒精性肝病,2D-SWE 应用的研究较少,p-SWE的肝硬化诊断界值尚未统一;应用SWE 评估自身免疫性肝病肝纤维化程度的证据尚不充分[31]。(3)《2017 年欧洲超声医学和生物学联合会肝脏弹性超声临床应用指南和建议》推荐:对于CHC 患者,2D-SWE 可作为一线评估肝纤维化的方法,其排除肝硬化的效果最好,已达成广泛共识;p-SWE界值1.55~2 m/s 提示肝硬化,其预测CHC 患者肝硬化精确度高(AUC 0.93),可以与TE 媲美。对于CHB患者,2D-SWE可确定有无肝硬化,诊断肝硬化的AUC 0.92~0.98,诊断界值10.1~11.7 kPa;p-SWE 可用于确定有无肝硬化,诊断肝硬化的界值为1.87 m/s[7]。
预测门静脉高压等并发症方面,《肝脏超声弹性成像:2018 年世界超声医学和生物学联合会指南更新》推荐:(1)TE 检测时LSM 值>20 kPa 可作为判断患者是否为临床显著门静脉高压(clinically significant portal hypertension,CSPH)(肝静脉压力梯度hepatic venous pressure gradient,HVPG≥10 mm Hg) 的参照标准。(2)TE 检测时LSM 值<20~25 kPa、血小板计数>100×106/ml ~ 150×106/ml,提示患者无需接受出血干预治疗。(3)LSM 值有助于评估代偿期肝硬化患者预后,LSM值越高,发生肝硬化并发症的风险越高[31]。《2017 年欧洲超声医学和生物学联合会肝脏弹性超声临床应用指南和建议》推荐:TE 有助于鉴别有临床显著门静脉高压症(HVPG≥10 mm Hg)患者[7]。《美国放射医师学会肝脏超声弹性成像共识》推荐:肝硬度值>17 kPa(2.4 m/s)提示临床显著门静脉高压[33]。
4.2.4 其他超声检查 研究显示,超声造影可通过肝脏血流灌注相关参数如肝静脉渡越时间(HVAT)、肝动脉- 肝静脉渡越时间(HA-HVTT)和门静脉-肝静脉渡越时间等[29],对肝硬化程度进行评价,但研究结果缺乏一致性,且肝硬化的超声造影无明确特征性表现,目前难以通过超声造影来诊断肝硬化,尚未被国内外指南推荐。
4.3 检查频次 肝硬化患者如无需内科处理,建议每6个月行1次腹部超声检查;如果出现腹水等合并症,需要内科进行干预治疗,可随时根据临床治疗需求行腹部超声检查。建议每年行1 次超声造影或增强CT/MRI 以早期发现肝细胞癌[32]。
4.4 实验室辅助检查 如果超声检查肝硬化特征不够典型,当出现以下实验室检查4 条中2 条以上异常时,可以做出肝硬化诊断:血小板<100×109/L,且无其他原因可以解释;血清白蛋白<35 g/L,排除营养不良或肾脏疾病等其他原因;INR>1.3或PT延长(停用溶栓或抗凝药7 d 以上);AST/血小板比率指数(APRI):成人APRI评分>2[34]。
5 肝脏占位性病变
5.1 定义及分类 肝脏占位性病变由于涉及疾病种类繁多,是目前临床上最为常见且复杂的疾病之一,包括囊性病变(如非寄生虫性肝囊肿、先天性多囊肝、肝脓肿,肝包虫病等)、良性局灶性实质性病变(常见如肝血管瘤、局灶性增生结节和肝腺瘤等)和恶性局灶性实质性病变(常见如肝细胞癌、胆管细胞癌和转移性肝癌等)等数十种,现将超声诊断特征相对明显病变总结如下,其他少见占位病变仍需结合穿刺活检明确诊断[18,35-38]。
5.2 超声诊断标准
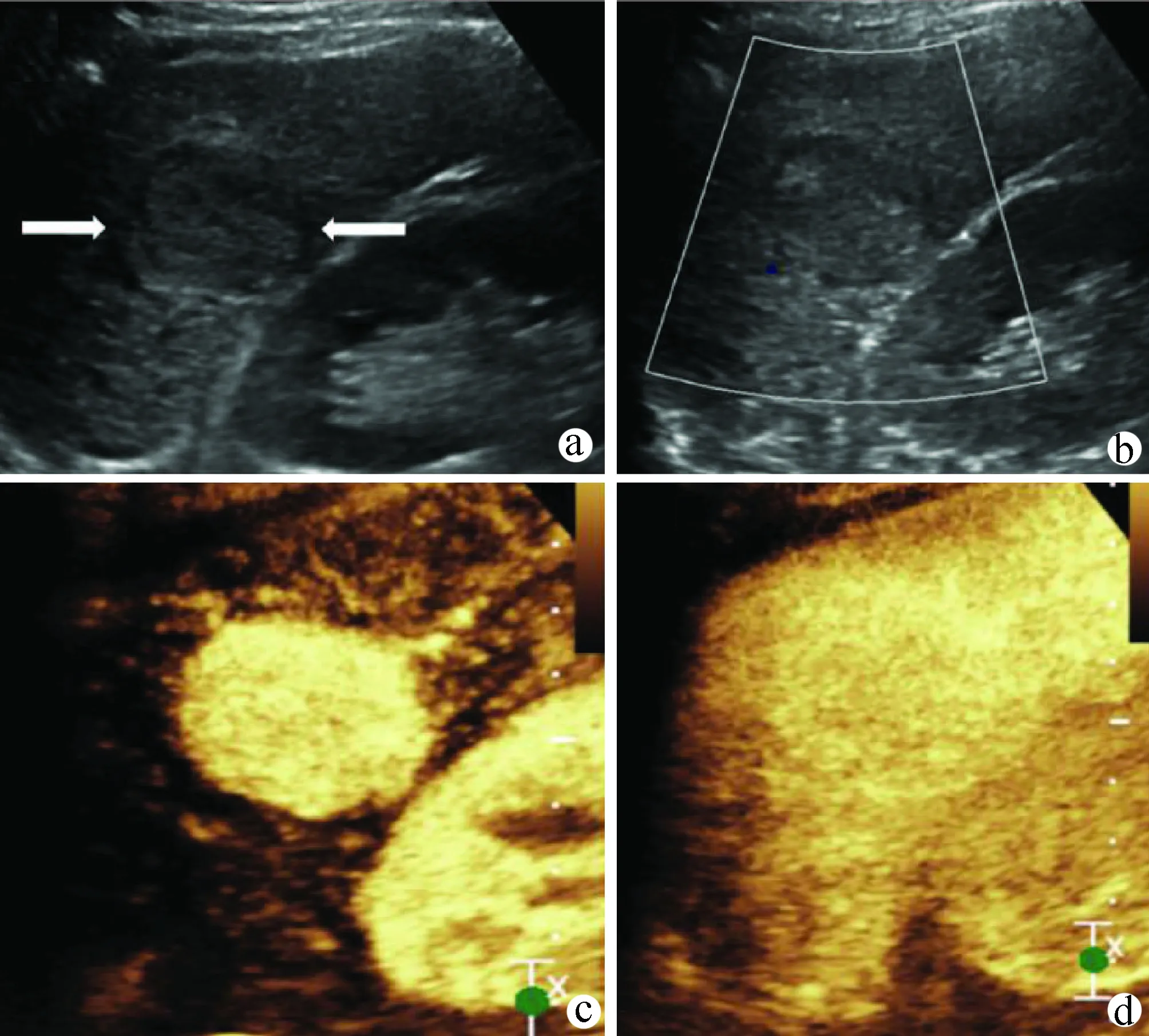
5.2.1 肝血管瘤(hemangiomas) 最常见的肝脏良性肿瘤,大多为海绵状血管瘤。通常被认为系胚胎发育过程中血管过度发育或分化异常导致的血管畸形。可发生于肝脏的任何部位,但常见于血管邻近和包膜附近。超声表现:(1)多为圆形或椭圆形、边界清晰的高回声结节,呈低回声者多有网状结构;(2)<2.0 cm的血管瘤大多内部回声均匀,>2.0 cm 的血管瘤内部混有低回声,但周边可见高回声环(hyperechoicrim);(3)血管腔的多重反射可引起后方回声增强;(4)随时间、改变体位、压迫等引起内部回声变化;(5)周边无晕环(halo);(6)彩色多普勒超声检查常为周边型血流信号,较大血管瘤内部以低速静脉血流为主,低阻力指数动脉频谱少见;(7)典型的血管瘤CEUS 表现为动脉期周边结节状或环状强化,随时间延长,增强范围逐渐向中心扩展,病灶在门静脉期及延迟期仍处于增强状态,回声高于邻近正常肝组织,呈“快进慢出”增强特征(图6)。部分非典型肝血管瘤超声造影动脉期表现为低增强模式[18,35-38]。原则上每年复查1次腹部超声。
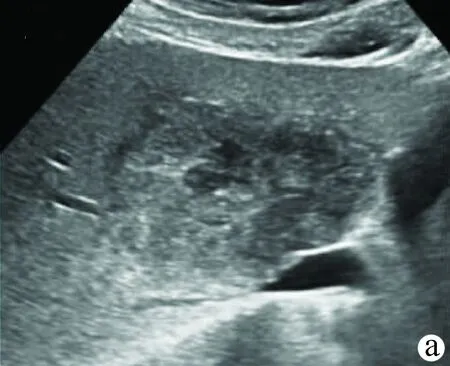
5.2.2 局灶性增生结节(focal hyperplastic nodule,FNH) (1)为良性非肿瘤性病变,发病率仅次于海绵状血管瘤;(2)多为单发,偶多发,形态多呈圆形、类圆形或不规则形,边界清晰;(3)无明显包膜回声;(4)周边无声晕;(5)内部回声可稍低或稍高于周围组织,回声分布不均匀;有时病变中央可见多条粗线状高回声呈放射状分布,伸向病变边缘;(6)彩色多普勒超声示血流较丰富,病变中央有时可见放射状或星芒状血流信号向边缘延伸;(7)典型的CEUS 表现为病变中央血流伸向周边。动脉期、门静脉相和延迟相以“高-高-高”或“高-等-等”增强模式为主,部分FNH 动脉期存在低增强模式(图7)。原则上每年复查1次腹部超声[18,35-38]。



注:a,灰阶超声示肝左右叶交界处混合回声肿物,内呈筛网状;b,超声造影动脉期呈结节状增强;c、d,超声造影门静脉期及延迟期造影剂向心性填充。
注:a、b,灰阶超声示肝左内叶等回声结节,中心可见放射状细窄低回声,CDFI 示低回声区可见血流信号;c、d、e,超声造影动脉期从中心部分开始离心性增强,达峰期呈均匀高增强;f,延迟期呈等增强。
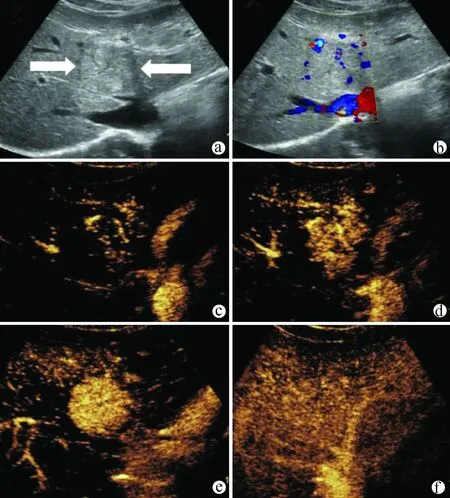
5.2.3 肝腺瘤(hepatocellular adenoma,HCA) (1)较为少见的一种良性肿瘤,按细胞来源可分为肝细胞性腺瘤、胆管细胞性腺瘤和肝细胞胆管细胞性腺瘤3 种,其中肝细胞腺瘤较为多见;(2)多发生在中年女性,与长期口服避孕药有关;(3)多数为单发,少数为多结节型;(4)多呈圆形或椭圆形,肿瘤边界清楚、光滑整齐;(5)多无明显完整的包膜回声;(6)小的腺瘤多呈低回声,较大腺瘤可呈较高回声,间以不规则低回声区,与肝癌难鉴别;(7)腺瘤多无后方回声增强效应;(8)彩色多普勒超声示病变周边血流信号较丰富,内部散在点状血流信号;(9)典型的肝腺瘤CEUS 表现为动脉期快速向心性增强,呈高增强模式,门静脉期表现为等增强或略高于肝实质的增强,延迟期为低增强[18,35-38](图8)。原则上每年复查1次腹部超声。
注:a、b,灰阶超声示肝右后叶下段等回声结节,周边可见包膜,CDFI示周边血流;c,超声造影动脉期呈均匀高增强;d,延迟期呈等增强。
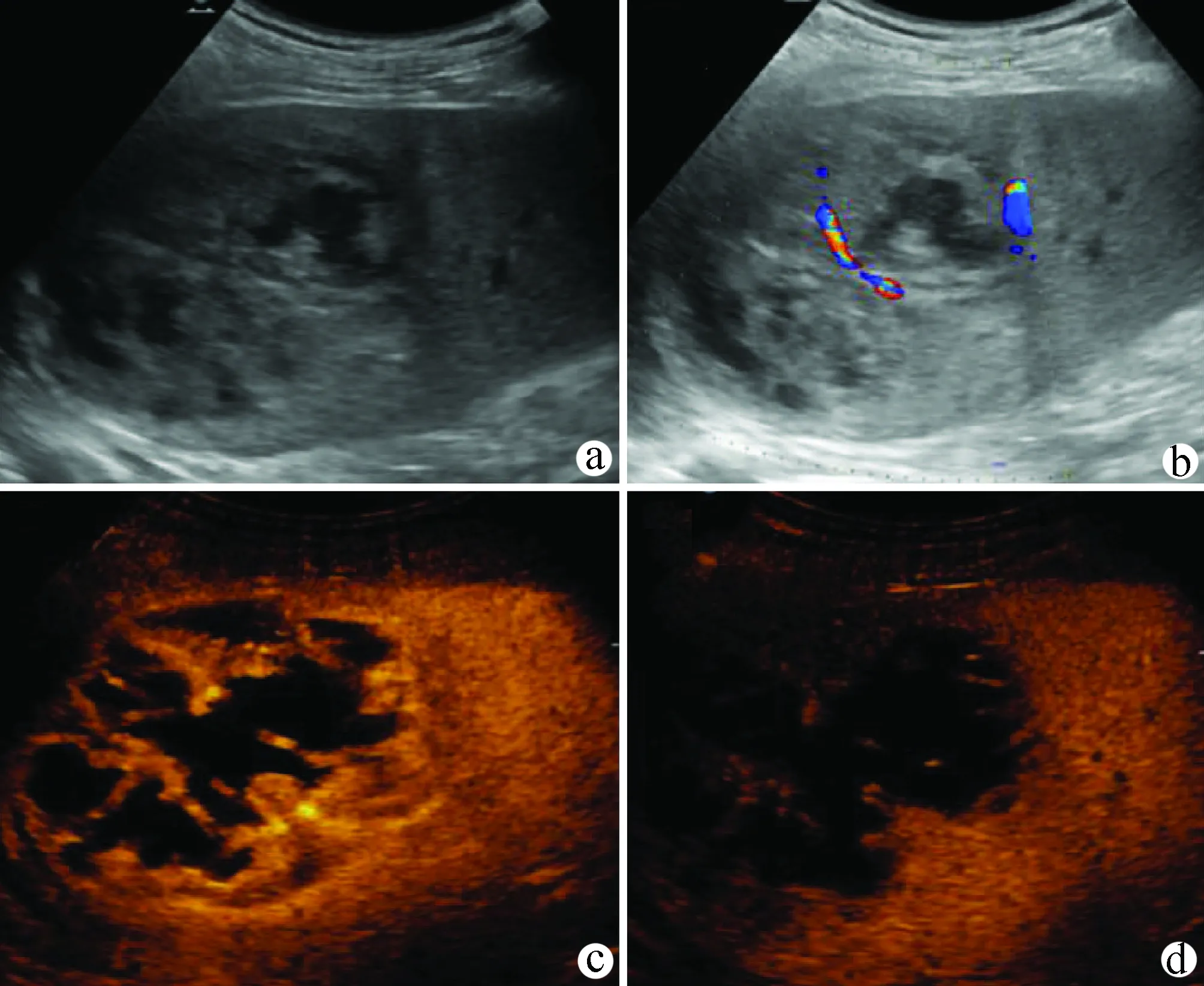
5.2.4 肝细胞癌 多合并慢性肝炎病史,组织学上分为结节型、巨块型和弥漫型。超声表现:(1)肝脏多伴有肝硬化、脾大、门静脉高压等;(2)可单发,呈局灶性,也可多发,散在分布于左右叶;(3)肿瘤回声多种多样,可呈低回声,也可为混合回声或高回声,结节较小时多数呈低回声,边界清晰,可见周边低回声晕,随结节增大,内部坏死和纤维化呈不均匀混合回声,边缘不规则,典型者呈“结中结”表现;(4)弥漫型肝癌,此型少见,肝实质回声弥漫增粗、紊乱,呈结节样和不规则斑块状,与肝硬化较难鉴别,门静脉癌栓形成有助于诊断;(5)CDFI 可探及瘤周血管绕行,瘤内血流信号杂乱,呈斑点状或短条状,频谱呈高速动脉血流;(6)典型CEUS 表现为动脉期高增强、门静脉期及延迟期低增强特征,部分分化较好者延迟期可呈等增强(图9)[18,35-38]。治疗后每3~6个月复查1次腹部超声。
5.2.5 肝内胆管细胞癌 可分为肿块形成型,管周浸润型和管内生长型。其中肿块型与肝细胞癌超声表现类似,表现为肝内较大的不均质实性肿块,多数边界不清,呈低回声或等回声,也可呈高回声,胆管细胞癌合并肝内胆管扩张的更常见。CEUS 与肝细胞癌鉴别较困难,文献报道胆管细胞癌造影剂退出更快(60 s 以内),退出更显著(图10)。治疗后每3~6个月复查1次腹部超声。

注:a,灰阶超声示肝右后叶一不均质回声肿物;b,CDFI 示肿物内短棒状血流信号;c,超声造影动脉期期呈不均匀高增强;d,超声造影延迟期呈低增强。

注:a,灰阶超声示肝左右叶交界处等回声肿物,边界不清(细箭头),周边胆管扩张(粗箭头);b,CDFI 示肿物内点状血流信号;c,超声造影动脉期呈不均匀等增强;d,超声造影延迟期呈不均匀低增强。
5.2.6 肝转移癌 多数有明确的原发肿瘤病史,常不伴有肝硬化。超声表现:(1)典型表现为多发结节,大小相近,呈散在分布;(2)回声多种多样,与原发肿瘤的类型有关,胃肠等消化道来源者多呈高回声,乳腺、肺、胰腺等来源者、淋巴瘤多呈低回声;(3)典型者表现为肿瘤周边呈较宽低回声,中心呈高回声,即“牛眼”征;(4)肿瘤内不易探及血流信号,少数肿瘤内可见点状或细条状血流信号;(5)CEUS 病灶动脉期常呈环状高增强,富血供肿瘤也可呈整体增强,门静脉期及延迟期退出,呈典型的“黑洞征”,门静脉期以后更容易检出(图11)。治疗后每3~6个月复查1次腹部超声。

注:a,灰阶超声示肝右前叶结节,中心呈强回声,周边呈低回声,呈“靶环征”;b,CDFI 示肿物周边可见血流信号;c,超声造影动脉周边呈环状增强,中心呈低增强;d,超声造影延迟期造影剂廓清。
5.2.7 肝囊肿 典型的声像图表现为圆形或卵圆形的无回声区,壁薄光滑,后方回声增强。可单发,也可多发,囊肿以单房多见,多房性囊肿的声像图表现为腔内有纤细的分隔。囊肿合并感染或出血时腔内可见弥漫性点状回声漂浮。较大囊肿壁上可检测到少量点状、细条状血流信号。CEUS 表现为三期无增强,边界清楚。
5.2.8 肝脓肿 根据病因分为细菌性、阿米巴和真菌性。以细菌性肝脓肿多见,患者多伴有寒战、高热、肝区疼痛、外周白细胞增高等症状。超声表现随脓肿各个阶段的病理变化特征不同复杂多样[10,39]。(1)肝脓肿早期:酷似肝癌超声表现,为边界欠清均匀低回声区,需结合病史和超声连续随访鉴别诊断;病灶内和边缘可测及点状或条状血流。(2)脓肿形成期:边界较清晰囊性病灶,可有不规则间隔,壁厚粗糙,内缘不平整,呈“虫蚀”状,脓液回声表现为无回声至低回声不等。脓肿周壁、间隔以及邻近组织探及较丰富低阻血流信号。(3)脓肿吸收期:脓肿壁和残留物呈杂乱高回声病灶区。此期血流信号明显较前减少,或无血流信号。(4)慢性肝脓肿:杂乱高回声团块,可伴有钙化。病灶内可检测到血流信号。CEUS 表现[36,38]:早期病灶区域动脉期呈边界模糊高增强,实质期无异常退出;脓肿液化后则病灶呈周边环状增强,内部蜂窝样高增强和无增强,可伴有门静脉期和延迟期退出(图12)。早期建议2~3 d 复查脓肿液化情况,后期根据情况定期随访。
注:a,灰阶超声示肝右后叶囊实混合回声肿物;b,CDFI 示肿物实性部分可见血流信号;c,超声造影动脉期“蜂窝状”增强;d,超声造影延迟期实性部分造影剂廓清。
5.2.9 肝包虫病 根据病原学人体肝包虫病主要有2 种类型[40],即囊型包虫病和泡型包虫病。以前者多见,后者较少见。超声是诊断和随访肝包虫病的首选方法(图13),诊断要点如下:(1)多有牧区生活史,牛、羊、犬接触史。(2)囊型肝包虫病各型超声表现。囊型病灶(CL):无特异性超声特征表现,与单纯性肝囊肿无法鉴别。单囊型(CE1):包虫囊后壁呈明显增强效应,囊腔可见“囊沙”。 多子囊型(CE2): “囊中囊”影像特征,呈花瓣形分隔的“车轮征“或者“蜂房征”。内囊塌陷型(CE3):内囊易脱落、塌陷、收缩内卷,出现“飘带征”或“水中百合花”。实变型(CE4):典型表现为“脑回征”。钙化型(CE5):有典型“蛋壳样”或不规则钙化,伴宽大声影。(3)泡型肝包虫病超声表现为不规则混合回声肿块,与周围界限不清,可伴有液化坏死区和多发各种类型钙化。病灶内部基本无血流信号,周边区可探及条状或短棒状的血流信号,进入病灶边缘处呈“截断状”。CEUS 泡型肝包虫病主要表现为病灶各时相内部和周边无增强;或病灶边缘处虫蚀样等增强或环状高增强,内部各时相无增强。囊型肝包虫病灶则各时相均无增强[41-43]。条件允许者建议每6 个月复查超声。
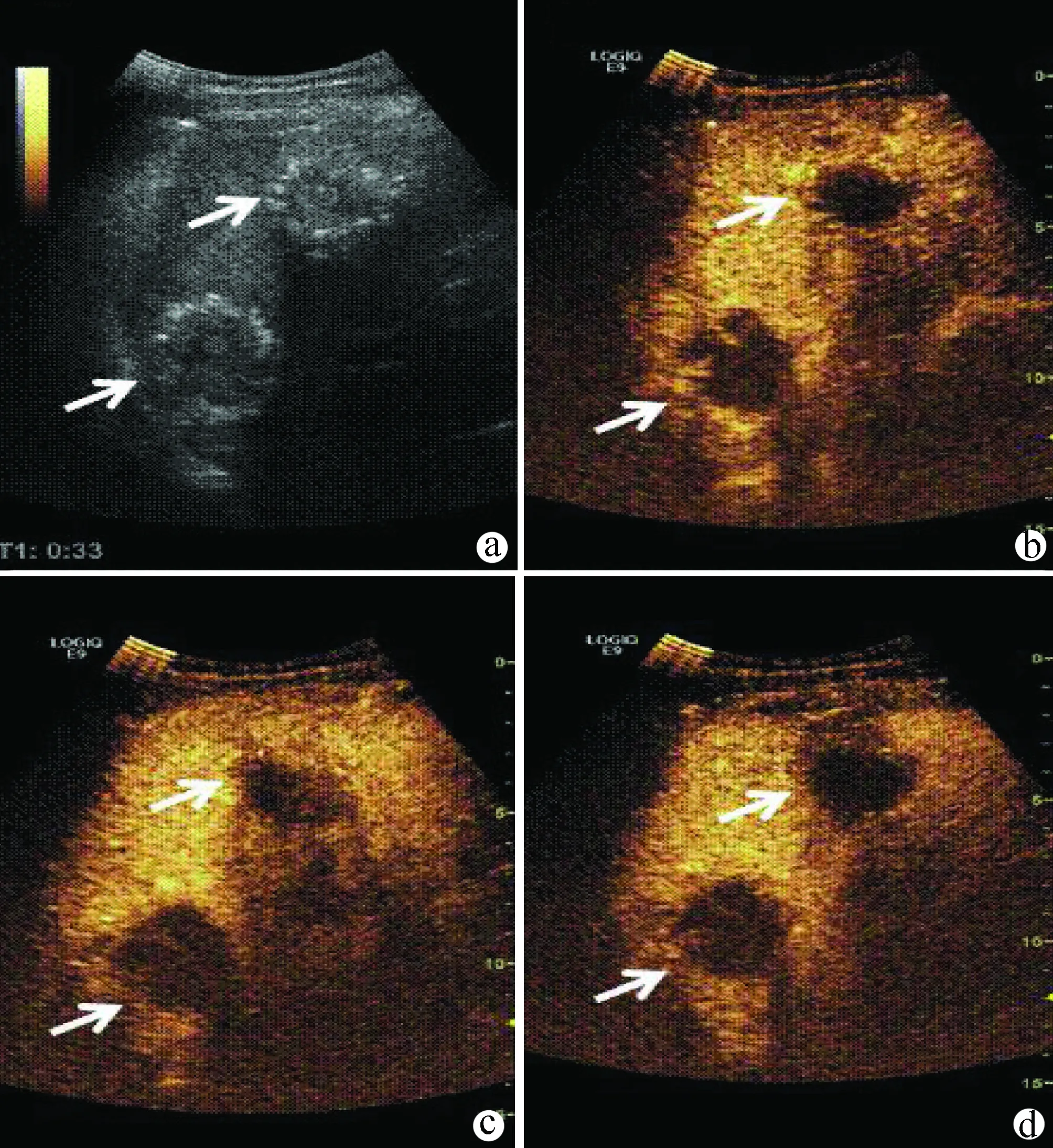
注:a,灰阶超声示肝右后叶含钙化混合回声肿物;b,动脉期(20 s)结节周边明显增强,内部大部分区域无增强;c,门静脉期(39s)结节周边等增强,内部无增强;d,延迟期(112s)结节周边低增强,内部无增强。
5.2.10 肝脏结核 为结核病全身性播散之局部表现,患者常同时患肺结核或肠结核。本病较为少见,由于缺乏特异的症状和体征,临床和影像诊断困难,误诊漏诊率高。(1)肝脏形态正常或轻度增大;(2)超声表现多样,与其不同时期病理特点有关[10,44]。椭圆形或不规则,早期呈强弱相间混合回声结节。继发干酪样坏死、液化时内部出现低回声区或无回声。纤维期呈强回声。病灶内沙粒状或斑片状钙化为肝结核特征表现。(3)病灶内和周边少量血流信号或无血流信号;(4)CEUS:呈快进快退,典型表现为动脉期周边高增强,增强范围增大。门静脉期和延迟期呈低增强,中心区始终无明显增强[11,38](图14)。治愈后建议每6 个月复查超声,1 年后每年复查超声。

注:a,灰阶超声示肝右后叶混合回声肿物;b,CDFI 边缘可见少许血流信号;c,超声造影动脉期环状高增强;d,门静脉期后增强区域呈低增强,中心区始终无明显增强。
5.3 实验室辅助检查 发现肝占位性病变时,应明确有无肝炎病史,需行肝炎病毒筛查,肝功能检查。疑诊为肝脓肿时,需行血常规及感染性指标的检查。肝脏结核血沉加快,血清抗结核抗体测定阳性、结核菌素或结核菌素纯蛋白衍生物皮肤试验阳性结果可辅助诊断肝脏结核性病变。肝包虫病检测方法有酶联免疫吸附试验、间接血凝法、 点免疫胶体金渗滤法(DIGFA)等,纯化自然抗原Em2-酶联免疫吸咐法(ELISA)可确定为泡型肝包虫病免疫诊断的参照比。
血清甲胎蛋白(alpha fetoprotein,AFP)是当前诊断肝癌和疗效监测常用且重要的指标。2019 版《原发性肝癌诊疗规范》推荐血清AFP≥400 μg/L,排除妊娠、慢性或活动性肝病、生殖腺胚胎源性肿瘤以及消化道肿瘤后,高度提示肝癌。血清AFP 轻度升高者,应作动态观察,并与肝功能变化对比分析,有助于诊断。血清甲胎蛋白异质体也可作为肝癌早期诊断标志物,特别是对血清AFP 阴性人群。
肝脏病灶疑诊为转移者,癌胚抗原(carcinoembryonic antigen,CEA),CA19-9 等其他肿瘤标志物有助于提示原发部位。
6 肝脏疾病介入诊疗相关超声诊断
肝脏疾病介入诊疗操作包括实质、肿瘤穿刺活检;胆道、脓肿、囊肿置管引流;囊肿和良恶性实体肿瘤、包虫、炎性病变的消融、栓塞治疗。灰阶超声、彩色多普勒超声及超声造影对介入疗效和并发症具有良好的判断能力。
6.1 引导和评价精准穿刺 超声及造影通过清晰显示靶目标,均可实现精准引导活检或消融。同时通过观察穿刺针道与肿瘤的位置关系可判断穿刺精准性,穿刺针在声束平面表现为强回声细线,与声束垂直平面表现为强回声斑点,通过具有引导功能的超声穿刺支架穿刺,可实时观察到强回声穿刺针到达靶目标位置,否则需要调整探头位置使针尖和针杆清晰可见(图15)。

注:a,灰阶超声显示穿刺针道强回声细线;b,灰阶超声显示不清肿瘤,超声造影下穿刺,门静脉期显示肿瘤(粗箭头)及消融穿刺针道(细箭头)。
6.2 诊断引流管位置 灰阶超声显示引流管为等号样强回声,当难以判断引流管位置及与病变引流效果的关系时,可通过向引流管内注射1∶1000 稀释的造影剂10 ml,通过肝内造影剂弥散范围确定引流管位置和引流效果(图16)。

注:a,灰阶超声示肝左叶混合回声肿物;b,置入引流管2 d 后肿物范围明显缩小,箭头所示等号样强回声为引流管;c,引流管注入造影剂显示弥散范围确定引流效果。
6.3 评价肿瘤治疗效果 肝肿瘤消融或栓塞后,坏死组织通常表现为不均匀高回声,CDFI 显示无血流信号,超声造影表现为持续无增强;存在活性组织通常表现为坏死组织周边的低回声结节或区域,CDFI 可见血流信号,超声造影表现为结节样或片状高增强且快速廓清,与常规超声相比,超声造影具有更敏感的诊断能力,因而肿瘤介入治疗效果推荐使用超声造影评判(图17)。
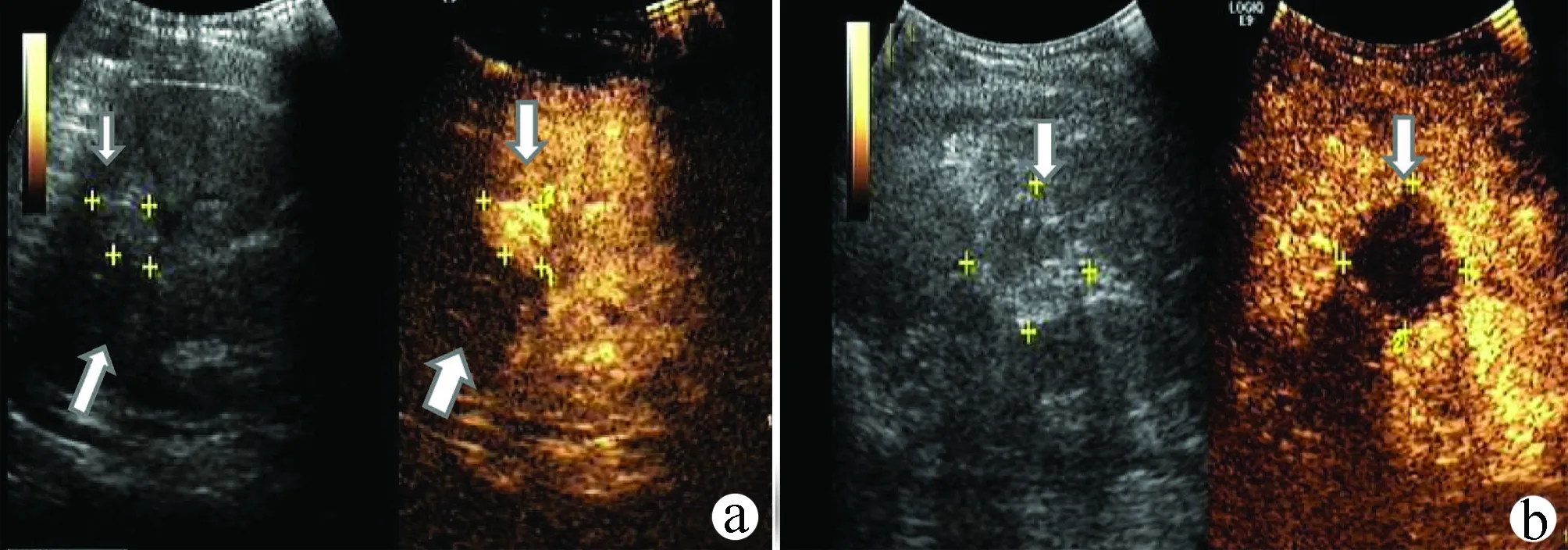
注:a,灰阶超声示肝右叶稍高回声区,消融术后治疗区(左下箭头所示),治疗区周边残癌超声造影呈结节状高增强(上箭头所示);b,治疗区完全消融后超声造影呈三期无灌注(箭头所示处为病灶)。
6.4 诊断介入出血及治疗效果 穿刺或消融后针道出血时,灰阶超声难以判断,CDFI 显示肝实质内朝向探头的束状彩色血流信号延伸至肝包膜,可为动脉或静脉频谱,超声造影表现为束状增强特征并可见造影剂溢出至肝包膜外,如出血仍有活动性,在肝周胸腹腔形成大量血性液体,其内可见造影剂微泡增强。当对出血针道进行注射止血药物或消融后,超声造影显示肝包膜出血处灌注缺损,肝周无造影剂外溢(图18)。

注:a,二维超声提示肝周游离液体(箭头);b,超声造影提示消融区内线样增强提示活动性出血(箭头);c,超声引导下局部凝血酶注射治疗(箭头示PTC 针);d,术后超声造影提示消融区内出血停止,止血治疗成功。
6.5 诊断介入感染 同肝脓肿诊断。
7 肝脏疾病超声报告书写规范
7.1 患者信息 临床医生应在超声申请单上标注患者年龄、性别、检查目的、肝占位高危因素(如HBV/HCV 感染史、过度饮酒史、肝癌家族史等)、肿瘤血清学分子标志物等信息。
7.2 肝脏总体声像图描述 观察肝脏大小(正常、增大或缩小)、形态(规则或不规则)、实质回声(正常、增粗增强、细腻均匀回声增强、远场衰减明显)、包膜(光滑/不光滑)、肝内管道样结构(肝内动静脉及胆管)变化。
7.3 病灶的声像图描述 记录病灶大小(以mm 为单位)、数量(单发/多发)、位置(Couinaud 肝脏分段法)、形态(圆形/椭圆形/不规则形)、内部回声(高回声/低回声/等回声/无回声/混合回声)、内部回声分布(均匀/不均匀)、周边低回声晕(有/无)、后方回声(正常/增强/衰减)、卫星灶(无/有)、与血管和胆管的关系、血流(周边血流/内部血流/周边及内部均可见血流信号;以静脉为主血流信号/以动脉为主血流信号)及频谱(低阻型/高阻型)。
7.4 超声声像图结论 标注病灶数量、位置、病灶回声及可能诊断。
7.5 图像存储 需留取病灶最大切面不带测量marker 1张;病灶最大切面带测量marker 1 张;病灶血流最丰富切面 1 张;肝左叶纵切显示腹主动脉1 张;肝左叶横切显示门静脉矢状部1 张;肝右叶显示胆囊切面1 张;肝右叶显示门静脉主干1 张;肝肾切面 1 张。
7.6 报告书写范例
7.6.1 肝脏炎性病变 超声所见:肝脏体积正常/增大,形态规则/饱满,肝表面光滑,边缘角锐利/变钝;肝实质回声正常/增粗/增强/稍减低,肝内管壁回声增厚、增强。门静脉主干内径约____mm,CDFI:血流通畅,为入肝血流。肝内外胆管不扩张。
胆囊大小形态正常,壁厚约____mm,呈“双边”征,腔内透声好/差,未见明显异常回声。
脾脏大小正常,厚径约____mm,长径约____mm,实质回声均匀,CDFI:未见异常血流信号。脾门处脾静脉内径约____mm。
腹盆腔未见/可见游离液性无回声:肝周液深约____mm,脾周液深约____mm,盆腔液深约____mm。
超声提示:
肝体积增大、回声增粗(结合病史考虑急性肝损伤),腹水胆囊壁水肿
7.6.2 肝纤维化 超声所见:肝脏大小正常,形态尚规则,肝表面欠光滑;肝实质回声增粗,呈“条索”样改变。门静脉主干内径约____mm,CDFI:血流通畅,为入肝血流。肝内外胆管不扩张。
胆囊大小形态正常,壁不厚,毛糙,腔内透声尚可,未见明显异常回声。
脾脏大小、形态正常,实质回声均匀,CDFI:未见异常血流信号。
腹盆腔未见液性无回声。
超声提示:
肝实质弥漫性病变
胆囊壁毛糙
7.6.3 肝硬化 超声所见:肝脏体积缩小,形态不规则,右叶缩小、左叶增大,肝表面不光滑,呈“锯齿状”,边缘角变钝;肝实质回声弥漫性增粗增强、不均匀,呈“结节”样改变,肝内可见多发不均质偏低及偏高回声结节,大者位于肝S5 段,大小约( )mm×( )mm,边界清楚,形态规则,CDFI:结节内部及周边未见明显血流信号。门静脉增宽,主干内径约____mm,CDFI:血流通畅,为入肝血流。肝内外胆管不扩张。
胆囊大小形态正常,壁厚约____mm,呈“双边”征,腔内透声尚可,未见明显异常回声。
脾脏增大,厚径约____mm,长径约____mm,实质回声均匀,CDFI:未见异常血流信号。脾门处脾静脉内径约____mm,脾与左肾间可见迂曲扩张的无回声区,CDFI:血流充盈。
腹盆腔可见游离液性无回声:肝周液深约____mm,脾周液深约____mm,盆腔液深约____mm。
超声提示:
肝硬化,脾大,腹水
肝内多发不均质回声结节:增生结节可能,建议增强影像学检查
门静脉高压,脾肾分流形成
胆囊壁水肿
7.6.4 肝脏良性占位 超声所见:肝脏大小形态正常,肝表面光滑,实质回声分布均匀,CDFI:未见异常血流信号。于肝内可见多发高回声结节,大者位于肝S5 段近肝中静脉,大小约( )mm×( )mm×( )mm,边界清楚,形态规则,内部局部回声呈筛网状,周边未见低回声晕,后方回声未见增强,CDFI:结节周边可见少许静脉血流信号。肝内管道样结构回声正常,管道未见扩张。
胆囊大小形态正常,壁光滑、不厚,腔内透声可,未见明显异常回声。
脾脏大小形态正常,厚径约____mm,长径约____mm,实质回声分布均匀,CDFI:未见异常血流信号。
超声提示:
肝内多发高回声结节,符合血管瘤特征/血管瘤可能性大/血管瘤不除外/建议结合增强影像
7.6.5 肝脏恶性占位 超声所见:肝脏大小形态失常,表面不光滑,实质回声粗糙、不均匀。肝S8 段肝中静脉旁可见一低回声结节,大小约( )mm×( )mm×( )mm,边界不清楚,形态不规则,内部回声分布不均匀,后方回声轻度增强,CDFI:结节内部可见血流信号,频谱呈高速低阻动脉血流。肝内外胆管未见明显扩张。门静脉宽约____mm,为入肝血流,血流通畅。
胆囊大小形态正常,壁光滑、不厚,腔内透声可,未见明显异常回声。
脾脏大小形态正常,厚径约____mm,长径约____mm,实质回声分布均匀,CDFI:未见异常血流信号。
超声提示:
肝内低回声结节:符合肝细胞癌特征/肝细胞癌可能性大/肝细胞癌不除外/肝占位,建议结合增强影像)
肝硬化,门静脉高压,脾大
7.6.6 肝占位超声造影 超声造影所见:肝S6 段常规超声所示低/高/不均质回声结节在注入造影剂后____s 开始增强,增强早期(开始增强后____s 内)呈仅周边高增强(规则抱球状血管/不规则多处/外周不连续球形/外周不连续环形)、中心或内部高增强、周边无或低增强、周边及内部同时整体高增强/等增强/均无增强。动脉期呈(整体高/部分高/非环状高/外周不连续球形/外周不连续环形/环状高/等/均匀低/不均匀低/无/蜂窝状)增强,(逐渐向心/轮辐状)填充,大小约( )mm×( ) mm×( ) mm,中心处可见低增强区/无增强区,大小约( )mm×( )mm×( )mm。100 s开始廓清,廓清速度(快速/缓慢),呈(显著/非显著/凿孔样)廓清。门静脉期呈(高/低/等/无)增强。延迟期(边缘/中心/内部/整体)呈(高/等/偏低/低/无)增强。枯否期(边缘/中心/内部/整体)呈(高/等/偏低/低/无)增强。(肿瘤周边可见1条滋养动脉)。(邻近病灶xx 静脉/动脉可见中等到显著扩张的管腔,管壁不清晰或连续性中断,动脉期可见管腔内软组织增强,随后出现廓清/门静脉、肝静脉内未见造影剂充盈缺损)。余肝实质造影剂灌注均匀/不均匀,延迟期肝内扫查未见其他明确低增强结节。
超声造影提示:
肝S6 段动脉期整体高/部分高/非环状高/外周不连续球形/外周不连续环形/环状高/等/低)增强结节,LI-RADS 5 类,造影考虑(肝囊肿、血管瘤、肝癌、肝转移癌、胆管细胞癌等)。 血管内动脉期高增强实性/三期无增强/动脉期高增强与无增强混合实性回声,考虑癌栓/血栓/癌栓血栓混合
7.6.7 弹性成像检测肝硬度 肝硬度测量:患者取水平仰卧位( 当图像的质量较差时,可以尝试左侧卧位进行检查),操作者将探头垂直于肝包膜置于右侧肋间,避开大血管,选取测量深度__cm(建议1~2 cm,最深不宜超过5 cm),将取样框(已提前设定,无需更改) 置于肝右叶Sx 段(S5段最佳、8 或7 段)。下腔静脉居于图像中心。患者平静呼吸下屏气3~5 s 后测量。使用设备(包括机器制造商及探头频率);检测次数n 次(表2)。

表2 超声弹性成像检查报告
参与指南撰写及讨论的专家
组长:
梁 萍(中国人民解放军总医院)
于 杰(中国人民解放军总医院)
专家组成员(按姓氏笔画排序):
于晓玲(中国人民解放军总医院)
卢 漫(四川省肿瘤医院四川省第二人民医院)
刘方义(中国人民解放军总医院)
红 华(内蒙古自治区人民医院)
严 昆(北京大学临床肿瘤医院)
杜联芳(上海市第一人民医院)
张玉英(青海省人民医院)
张连仲(河南省人民医院)
陆荫英(中国人民解放军总医院)
罗 燕(四川大学华西医院)
周 平(中南大学湘雅三医院)
郑元义(上海市第六人民医院)
郑荣琴(中山大学附属第三医院)
经 翔(天津市第三中心医院)
徐 栋(中国科学院大学附属肿瘤医院)
徐辉雄(上海市第十人民医院)
郭 佳(中国人民解放军海军军医大学第三附属医院)
蒋天安(浙江大学医学院附属第一医院)
韩治宇(中国人民解放军总医院)
程 文(哈尔滨医科大学附属肿瘤医院)
程志刚(中国人民解放军总医院)
谢晓燕(中山大学附属第一医院)
薛改琴(山西省肿瘤医院)
编写秘书:
李 猛(中国人民解放军总医院)
陈 敏(中国人民解放军总医院)
陈 曦(中国人民解放军总医院)
刘 静(中国人民解放军总医院)
蔡文佳(中国人民解放军总医院)
窦建萍(中国人民解放军总医院)
志谢:解放军总医院第八医学中心曹兵生副主任医师提供本指南图14 肝结核声像图片。
利益冲突声明:所有作者均声明不存在利益冲突。

