藏药中有效成分与功能蛋白的相互作用与相互识别
冀 旭 孙芳云 赵 勤 张晓英 李岩松
1.西藏民族大学基础医学院,陕西 咸阳 712082;2.西藏民族大学藏药检测技术教育部工程研究中心,陕西 咸阳 712082
在生物学中,分子间相互作用与识别是形成高度专一性识别、反应及调控等过程的基础,诸如底物与受体的结合识别、酶反应及抗体-抗原的结合识别等。而在药学,尤其是民族药的开发研究领域,分子间相互作用也是一个重要的研究内容,它在基于传统药物的新药筛选开发、药物药效学及药动学研究中均得到广泛应用。藏药在我国有着悠久的应用历史、深厚的民众基础及丰富的藏民族文化内涵。近年来,藏药以其独特的功效受到越来越多研究者的关注,对其的现代化研究与应用也日益得到重视。而关于藏药当中有效成分与离子通道、膜蛋白等药物受体、功能蛋白的相互作用与识别研究还未见报道。
秦艽为龙胆科植物秦艽GentianamacrophyllaPall.,麻花秦艽GentianastramineaMaxim.,粗茎秦艽GentianacrassicaulisDuthie ex Burk.或小秦艽GentianadahuricaFisch.的干燥根[1],属于常用藏药[2-4],藏文名为吉解嘎保、吉解那保等[5]。该药物为藏族人民的繁衍生息做出了重要的贡献,如《四部医典》中记载:“吉解嘎保可治六腑热和胆热”;《如意宝树》中记载:“吉解嘎保可止血,炮制后外敷消肿、愈伤。吉解那保可消炎,治四肢关节红肿,喉蛾,咽喉嘶哑”;《晶珠本草》中记载:“吉解那可用于消肿、喉蛾、干黄水”等[5]。栎瘿酸为一种五环三萜类化合物,是2015版《中国药典》中规定秦艽药材的药材鉴别成分[1],其药理临床作用如抗炎也常见报道[6]。
本研究以藏药秦艽为代表,选用秦艽中有效成分栎瘿酸,利用光谱学方法研究了栎瘿酸与以运载蛋白牛血清白蛋白(BSA)为代表的功能蛋白之间的相互作用与识别过程,旨在进一步理解传统藏药有效成分的作用机制。并以此为例,建立一套可用于表征其它藏药有效成分与功能蛋白如受体、离子通道等之间相互作用与识别的实验方法,进而为传统藏药作用机制的现代化分析研究,以及基于传统藏药的药物开发提供实验依据及理论支撑。
1 仪器与试剂
1.1 仪器 PerkinElmer LS55荧光光谱仪及PTP-1 Peltier system控温控件,Perkin Elmer Lambda 25紫外-可见分光光度仪器光度计,Millipore Milli-Q超纯水系统。
1.2 主要试剂 栎瘿酸(中国食品药品检定研究院,98%),用二甲基亚砜(DMSO,Sigma-Aldrich,≥99.9%)配置成浓度为4.0×10-2mol/L的储备溶液。BSA(Amresco,>98%)用0.01mol/L的PBS配置成1×10-6mol/L的储备溶液。华法林(中国食品药品检定研究院,98%),布洛芬(大连美仑生物技术有限公司,>98%),实验用水为二次去离子水。
2 实验方法
2.1 荧光猝灭实验 移取1×10-6mol/L的BSA溶液 2 mL置于石英比色皿中并分别于288K、298K和308K实验温度下测定样品的荧光发射光谱。测定完成后,用微量注射器分别向其中注入不同体积的4.0×10-2mol/L的栎瘿酸储备液进行混合,使得栎瘿酸终浓度分别为5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、35×10-6mol/L,混合完成后分别于相应温度下反应至稳定后再次测定其荧光发射光谱。相关仪器参数如下:激发波长278 nm,激发狭缝和发射狭缝宽度均为3 nm,扫描速度1200 nm/min,扫描范围300~400 nm。
2.2 结合位点竞争实验 移取1×10-6mol/L的BSA 溶液2 mL置于石英比色皿中,分别注入华法林/布洛芬储备液,使对应药品终浓度均分别为1×10-6mol/L,在298 K温度下进行相互作用30 min。反应完成后,用微量进样器分别向其中加入不同体积的栎瘿酸储备液,使得栎瘿酸终浓度分别为5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、35×10-6mol/L,混合完成至反应稳定后再次测定其荧光发射光谱。相关仪器参数如2.1。
2.3 同步荧光 于298K下移取1×10-6mol/L的BSA 溶液2 mL置于石英比色皿中,测定样品同步荧光光谱。测定完成后,用微量注射器分别向其中加入不同体积的栎瘿酸储备液进行混合,使得栎瘿酸终浓度分别为5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、35×10-6mol/L,反应稳定后于298 K温度下分别测定其同步荧光光谱。相关仪器参数如下:当测定Δλ=60 nm的同步荧光光谱时,激发狭缝和发射狭缝宽度均为3 nm。当测定Δλ=15 nm的同步荧光光谱时,激发狭缝和发射狭缝宽度均为8 nm。扫描速度均为1200 nm/min,扫描范围220~320 nm。
2.4 Rees红边激发荧光位移的测定 分别在激发波长为266、272、278、284、290和296 nm下,测定1×10-6mol/L的BSA溶液在298 K温度下的荧光发射光谱,之后在BSA溶液中分别加入不同体积的栎瘿酸储备液,使得栎瘿酸终浓度分别为0×10-6、5×10-6、15×10-6、20×10-6、25×10-6mol/L,并测定其在不同激发波长下对应荧光发射光谱。相关仪器参数如下:激发狭缝和发射狭缝宽度均为3 nm,扫描速度1200 nm/min,扫描范围300~400 nm。
3 结果与讨论
3.1 BSA与栎瘿酸结合过程的荧光发射光谱分析 图1所示为BSA与栎瘿酸在298 K温度下作用过程的荧光发射光谱,可以看出,伴随着栎瘿酸浓度的上升,样品体系发生了荧光猝灭现象,荧光强度由754.3下降至487.9,同时最大荧光发射峰位从341 nm轻微的蓝移至335.5 nm。这一现象表明BSA与栎瘿酸之间发生了相互作用,荧光发射峰位轻微蓝移表明蛋白结构发生了细微的改变,蛋白结构的疏水性有了轻微的增加[7]。

图1 BSA与栎瘿酸作用的荧光发射光谱注:从上至下栎瘿酸浓度分别为0×10-6、5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、35×10-6 mol/L
3.2 BSA与栎瘿酸相互作用的荧光猝灭类型判断 为证实BSA与栎瘿酸相互作用时产生的荧光猝灭的特性,本研究利用Stern-Volmer方程进行判断,方程如下所示:
F0/F=1+KSV·[Q]=1+Kq·τ0[Q]
(1)
式中F0和F分别表示在加入荧光猝灭剂前后的内源荧光发射强度;KSV为荧光基团Stern-Volmer常量;[Q]为荧光猝灭剂浓度;Kq为荧光猝灭过程的猝灭速率常量,动态猝灭最大速率常量约等于2.0×1010L/mol/s[8];τ0为荧光物质中荧光基团的平均荧光寿命,对蛋白质分子来说约为10-8s[9]。取不同温度下BSA自身荧光发射强度F0及加入不同浓度栎瘿酸后BSA的最大荧光发射强度F,以F0/F对栎瘿酸浓度[Q]做线性拟合,结果如图2所示。由所得直线的斜率获得不同温度下的猝灭常数KSV以及猝灭速率常数Kq,结果汇总于表1。

图2 不同温度下栎瘿酸对BSA荧光猝灭的Stern-Volmer曲线
从表1中可以看出,伴随着反应温度的上升,BSA与栎瘿酸结合过程中KSV持续下降,说明温度升高并不利于二者的结合,因为温度升高有利于动态猝灭的发生与发展,所以该猝灭过程不是由扩散和碰撞所引起的动态猝灭。同时该反应Kq均大于最大动态猝灭速率常量2×1010L·mol-1·s-1,所以BSA与栎瘿酸结合过程所产生的荧光猝灭是由于BSA与栎瘿酸生成了基态络合物所引起的静态猝灭。

表1 不同温度下栎瘿酸对BSA的荧光猝灭常数KSV和猝灭速率常数Kq
3.3 BSA与栎瘿酸相互作用的结合常数和结合位点数 对于静态猝灭过程来说,荧光体的荧光强度与猝灭剂浓度之间符合以下公式[10]:
lg[(F0-F)/F)=lgKa+nlg[Q]
(2)
式中F0、F仍分别代表猝灭剂不存在以及存在时样品体系的荧光强度;Ka指蛋白质分子与小分子物质之间的结合常数;n是蛋白质分子与小分子物质的结合位点数。在不同温度下,以lg[(F0-F)/F]对lg[Q]做线性拟合,结果如图3所示。由所得直线的斜率及截距即可获得不同温度下的结合常数Ka以及结合位点数n,结果汇总于表2。
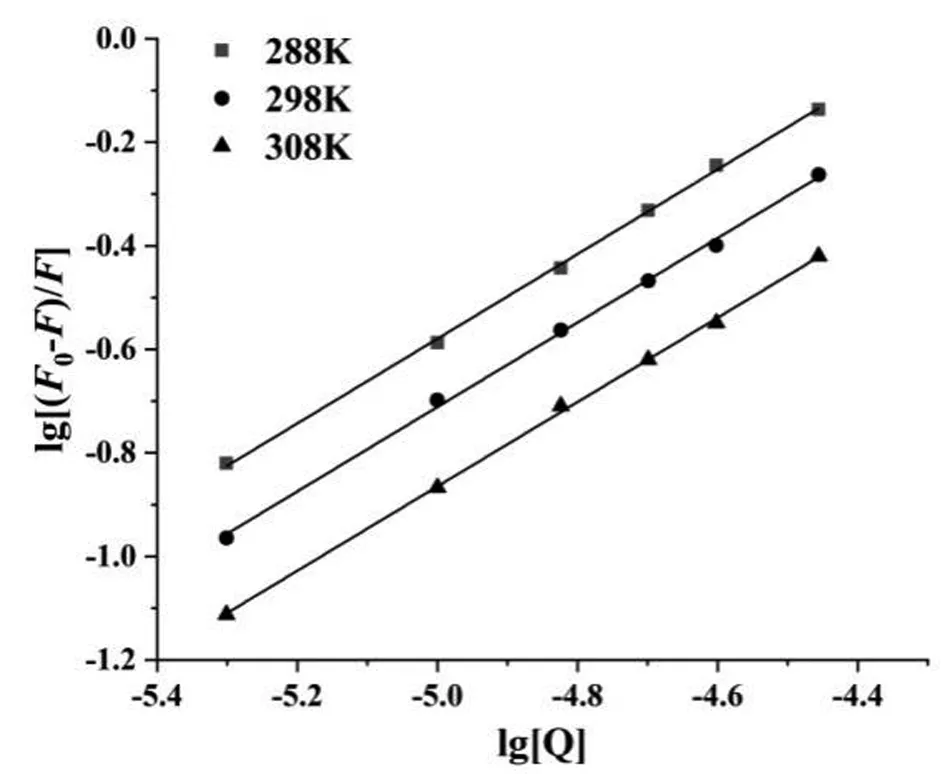
图3 不同温度下栎瘿酸猝灭BSA的lg[(F0-F)/F]对lg[Q]图■:288K,●:298K,▲:308K
从表2中可以看出,栎瘿酸对BSA荧光猝灭过程的结合位点数介于0.8181~0.8149近乎于1,表明理论上每个BSA分子能够结合一个栎瘿酸分子。同时伴随反应温度的上升,BSA与栎瘿酸的结合常数由最初的3.242×103L·mol-1下降至1.620×103L·mol-1,同时结合位点数由0.8181下降至0.8149,可以看出温度升高并不利于结合的进行,这也从另一方面说明BSA与栎瘿酸的结合过程中形成了不稳定的复合物,随着实验温度的增加,复合物的稳定性下降,二者之间发生的荧光猝灭现象属于静态猝灭过程。

表2 栎瘿酸对BSA荧光猝灭的结合常数Ka以及结合位点数n
3.4 BSA与栎瘿酸相互作用的热力学参数和作用力类型 根据Ross定律,本研究可利用蛋白质与小分子配体反应过程热力学参数的变化即可确定蛋白质分子与小分子配体之间的作用力类型:若反应过程焓变ΔH>0,熵变ΔS>0,则二者之间作用力主要为为疏水作用力;若反应过程ΔH<0,ΔS>0,则二者之间作用力主要为静电作用力;若反应过程ΔH<0,ΔS<0,则二者之间作用力主要为氢键和范德华力[11]。对于蛋白质分子与小分子配体结合过程,其热力学参数之间符合以下关系[12]:
lnKa=-ΔH/RT+ΔS/R,ΔG=ΔH-TΔS
(3)
式中Ka为不同温度下二者之间的结合常数;气体常数R=8.314 J/(K·mol);T为反应绝对温度。以栎瘿酸与BSA在不同温度下相互作用过程的lnKa对1/T作图,由斜率与截距即可分别计算出二者结合过程的焓变ΔH以及熵变ΔS,进一步即可得出结合反应过程的吉布斯自由能变ΔG,结果汇总于表3。通过表中结果可以看出,不同温度下吉布斯自由能变ΔG均小于零,说明BSA与栎瘿酸的相互作用是自发进行的;ΔH<0和ΔS<0时,说明BSA与栎瘿酸之间相互作用力主要为氢键和范德华力,且整个过程是焓驱动占主导的。另外,ΔH<0说明二者的相互作用是一个放热的过程。

表3 BSA与栎瘿酸结合过程的热力学参数
3.5 BSA与栎瘿酸相互作用的能量转移机制以及结合距离 Foster非辐射能量转移理论认为[13-14],当供能体可发射荧光,且与受能体的结合距离小于等于7 nm,同时供能体荧光发射光谱与受能体吸收光谱有重叠时,能量可以非辐射能量转移形式从供能体激发态转移到能量受体。且非辐射能量转移效率E、供能体与受能体之间的距离r及能量转移效率为50%的临界能量转移距离R0之间存在以下关系[15]:
(4)
式中,K2为偶极空间取向因子2/3;N为介质折射指数1.336;φ为荧光供体的荧光量子产率0.118;J为荧光供体的荧光发射光谱与荧光受体的吸收光谱重叠积分,可由以下关系式获得:
J=∑[(λ)ε(λ)λ4Δλ]/∑F(λ)Δλ,A=lg(1/D)=εbc
(5)
式(5)中F(λ)是荧光供体在波长λ处的荧光发射强度;ε(λ)是荧光受体在波长λ处的紫外摩尔吸光系数;A为荧光供体的紫外吸光度;D为其透射比;ε为紫外摩尔吸光系数;c为吸光物质的浓度;b为吸光介质的厚度。
图4所示为BSA与栎瘿酸的光谱图,由图中可以看到,BSA的荧光发射光谱与栎瘿酸的紫外吸收谱有明显重叠部分。利用光谱数据,通过式(4)、(5)计算即可得到BSA与栎瘿酸结合过程中的相关参数,结果汇总于表4。从表中可以看出BSA与栎瘿酸之间作用的平均距离为4.134 nm,同时说明二者之间确实发生了非辐射能量转移。

图4 BSA荧光发射光谱与栎瘿酸吸收光谱

表4 BSA与栎瘿酸的结合距离信息
3.6 结合位置取代实验 BSA分子上有两个结合位点(Site Ⅰ和Site Ⅱ),而华法林和布洛芬分别是这两个结合位点的特异性标志物[16-17]。因此,通过选用华法林和布洛芬作为不同结合位点的竞争剂,可获得栎瘿酸的结合位点的相关信息。当不存在、以及及分别存在竞争剂华法林、布洛芬的情况下,栎瘿酸与BSA结合常数及结合位点数的变化情况汇总于表5。由表5可知,在Site Ⅱ位点被布洛芬所占据时,栎瘿酸的结合位点数n以及结合常数Ka只有微弱的减少,说明药物与标志物之间不存在明显的直接竞争作用;而在Site Ⅰ位点被标志物布洛芬占据后,栎瘿酸的结合位点数Ka以及结合常数n均明显降低,表明栎瘿酸与华法林之间发生直接竞争作用,即栎瘿酸与BSA作用的结合位点为Site Ⅰ位点。

表5 不同竞争剂存在下BSA与栎瘿酸的结合位点数及结合常数
3.7 BSA与栎瘿酸识别过程的构象变化-同步荧光光谱光谱分析
图5展示了BSA在与栎瘿酸结合过程中当Δλ=60nm和Δλ=15nm的同步荧光光谱。从图中可以看出,伴随着加入的栎瘿酸浓度的增加,BSA在Δλ=60nm和Δλ=15nm时的同步荧光强度均发生了明显改变,说明BSA分子中的酪氨酸、色氨酸残基均参与了荧光猝灭过程,其中对色氨酸的猝灭效果更为明显。同时我们注意到,伴随着栎瘿酸浓度的增加,Δλ=15 nm时的同步荧光光谱的最大发射峰位并未发生明显的改变,而当Δλ=60 nm的同步荧光光谱则显示出轻微蓝移现象,说明在BSA与栎瘿酸的结合过程中,蛋白中酪氨酸残基所处的微环境微环境没有明显的改变,而色氨酸残基所处的微环境微环境疏水性略微增强。

图5 BSA与栎瘿酸相互作用的同步荧光发射光谱.A: Δλ=60nm,B: Δλ=15nmC (Roburic acid,a-g):0×10-6、5×10-6、10×10-6、15×10-6、20×10-6、25×10-6、35 ×10-6 mol/L.
3.8 BSA与栎瘿酸识别过程的构象变化—红边激发位移(REES)分析 红边激发位移是指当溶剂介质存在缓慢舒张作用时,色氨酸中吲哚环与临近偶极子的电子结合作用即可引起色氨酸电子跃迁能分配的一种现象,是一种监测荧光发色基团微环境改变的方法。当蛋白质受到激发光照射时,若蛋白质中色氨酸残基所处微环境是流动的,则其在发射荧光之前就已经出现了缓慢舒张作用,此时色氨酸残基产生的荧光光谱的发射波长不发生变化。如果色氨酸残基处在受限环境当中,色氨酸中处于激发态的吲哚环将会产生缓慢舒张作用,并且激发波长不同,其发射波长也不同[18-19]。
在实验中可以发现,在266 nm的激发波长下,BSA荧光发射光谱的最大发射波长位于346 nm,所以选取326(FL)和366(FR)这两个等波长点进行双波长处理。由图6可见,在相同激发波长下,BSA的FL/FR值伴随着栎瘿酸浓度的增大而上升,说明伴随着BSA与栎瘿酸反应的进行,荧光发射光谱发生蓝移[18],这也从另一方面验证“3.1”中得到的结果,即说明BSA结构的疏水性伴随着反应的进行而有所增加。

图6 栎瘿酸对BSA红边激发荧光位移的影响,C(栎瘿酸a→e):0×10-6、5×10-6、15×10-6、20×10-6、25×10-6 mol/L
当栎瘿酸浓度分别为0×10-6、5×10-6、15×10-6mol/L时,随着激发波长的逐渐增大,BSA的FL/FR值缓慢降低,产生了Rees现象,说明在上述情况下,BSA中色氨酸残基的运动受到限制。然而,随着体系中栎瘿酸浓度的扩大,当栎瘿酸浓度分别为20×10-6、25×10-6mol/L时,BSA的FL/FR值不再随着激发波长的增大而明显降低,即不再产生Rees现象,说明伴随着栎瘿酸浓度的升高,由于BSA构象的改变,分子中色氨酸残基处于了相对流动的微环境当中。
4 结论
本研究设计一种全面表征传统藏药中有效成分与功能蛋白相互作用与识别过程的实验方法。本研究以藏药秦艽中有效成分栎瘿酸以及运载蛋白为例,在不同温度下利用本方法进行了实验,结果显示:栎瘿酸与BSA二者之间发生的结合作用引起了BSA内源荧光猝灭,造成的猝灭现象为形成了不发荧光络合物的静态猝灭过程。通过测量可获得二者在不同温度下结合常数、结合位点数以及结合过程中相关热力学参数,并得知二者相互结合是以氢键和范德华力为主要作用力的自发、放热反应过程。同时,二者结合过程中发生了非辐射能量转移,且栎瘿酸结合于BSA分子中的Site Ⅱ位点,平均结合距离为4.134 nm。另外,在二者识别过程中,BSA结构的疏水性有轻微的增加,而且伴随着栎瘿酸浓度的增加,BSA中色氨酸所处微环境疏水性有了轻微增加,微环境流动性逐步增强。

