茶氨酸生物转化体系研究
李依韦,朱思琪,宋美慧,代玉坤
(内蒙古民族大学 生命科学与食品学院,内蒙古 通辽028043)
茶氨酸最初是在茶叶中分离出来的一种非蛋白质氨基酸,其方向均为左旋,又称为“L-茶氨酸”[1].它不但可以作为添加剂,而且还具备多种生理功能[2].它能够直接对中枢神经产生影响,从而调节人的情绪,影响学习和记忆能力、注意力等,还具有抗肿瘤降血压等作用[3].近年来,茶氨酸在医疗保健方面的开发更是值得期待,很有可能成为新型安全的天然药品或保健品,其市场发展潜力很大[4].
化学合成法生产茶氨酸成本低,但是纯化较难,副产物多,安全性无法保证,不适合在食品和医药上应用[5].植物组织培养法获得茶氨酸对环境条件要求严格且周期长、产率低,不利于产业化生产[6].而微生物转化法克服了以上2种方法的弊端,是相对合适也是最具有发展前景的方法.这种方法是用γ-谷氨酰转肽酶(γ-GT)和谷氨酰胺合成酶生产茶氨酸,其中,用γ-GT合成茶氨酸的方法最为简单有效.γ-GT是普遍存在于微生物和哺乳动物体内的一个不对称的二聚体酶,为转氨酶的一种.
地衣芽孢杆菌是一种革兰氏阳性菌,繁殖能力快,形成的芽孢多.具有丰富的酶系且产酶量高、耐热、安全性高[7].本研究利用地衣芽孢杆菌发酵产γ-GT,再根据该酶催化γ-谷氨酰基对硝基苯胺的γ-谷氨酰基转移到双甘氨肽生成对硝基苯胺,来确定γ-GT酶活力.该高活性的酶能将底物谷氨酰胺中的γ-谷氨酰基转移到另一底物乙胺盐酸盐上,发酵转化最终获得茶氨酸.
1 材料与方法
1.1 试验菌种 地衣芽孢杆菌(内蒙古民族大学生命科学与食品学院微生物生物技术实验室保存).
1.2 试验方法
1.2.1 绘制地衣芽孢杆菌生长曲线 活化好的地衣芽孢杆菌37℃、180 r∙min-1振荡培养.紫外分光光度计每隔2 h在660 nm处测吸光度,建立生长曲线(图1).
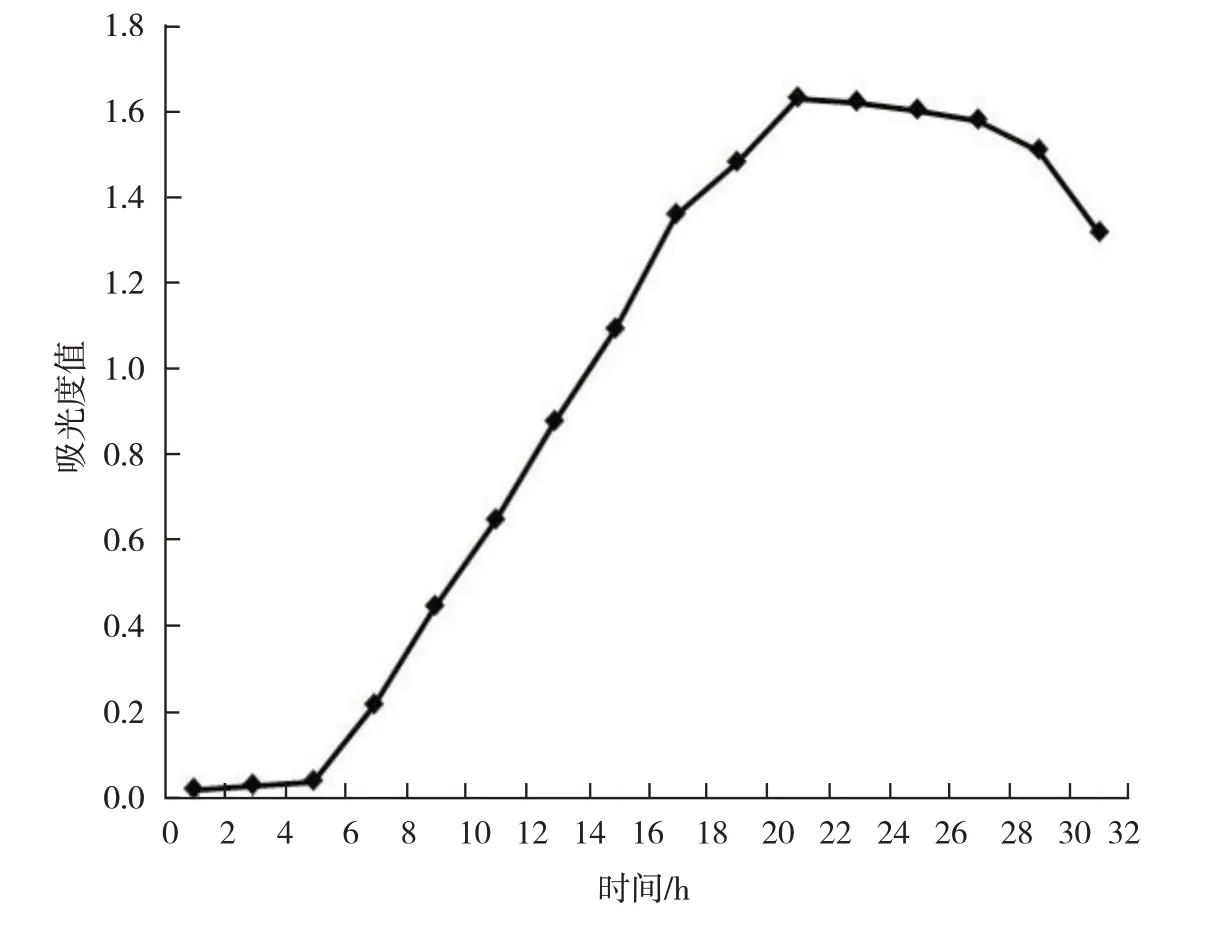
图1 地衣芽孢杆菌生长曲线Fig.1 The growth curve of Bacillus licheniformis
1.2.2 紫外分光光度计法制作茶氨酸标准曲线配制100 μg∙mL-1的茶氨酸标准液.从100 μg∙mL-1的标准溶液中分别取出1.00、1.25、1.50、1.75、2.00、2.25、2.50 mL,将上述取出的溶液再各加4 mL无菌水、0.5 mL的2%茚三酮溶液、0.5 mL的pH 8.0磷酸缓冲溶液,100℃水浴反应15 min冷却至室温,超纯水定容至10 mL,此时溶液浓度为10.0、12.5、15.0、17.5、20.0、22.5、25.0 μg∙mL-1.在570 nm处测各浓度的吸光度,建立标准曲线(图2).线性回归方程为y=58.716x-0.546,R2=0.999 3,趋势线可靠性高,可以作为茶氨酸测定标准.
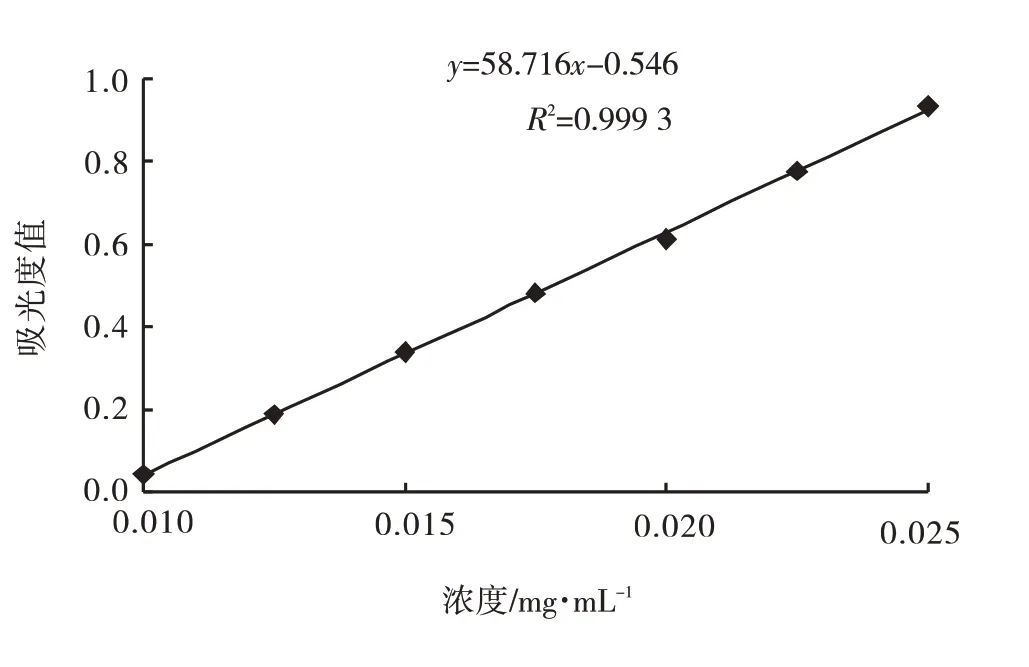
图2 茶氨酸标准曲线Fig.2 The standard curve of theanine
1.2.3筛选发酵液中产γ-GT最佳条件以温度、pH值、接种量、装液量为因素,按照表1设计正交试验筛选发酵液中产γ-GT最佳条件,发酵时间均为24 h.取1 mL发酵液,5 000 r∙min-1离心15 min,弃上清液,加3 mL无菌水悬浮菌体,混匀稀释10倍.取1 mL稀释液,分别加入0.4 mL γ-谷氨酰基对硝基苯胺、0.4 mL双甘肽、1.2 mL Tris-HCL.37℃水浴30 min,405 nm处测对硝基苯胺吸光度.根据γ-GT(U∙mL-1)=D×103×(A1-A2)×Vt/(e×VS×d)计算γ-GT酶活力大小[8-9],式中,D为稀释倍数,A1为样品吸光度值,A2为空白对照吸光度值,Vt为反应总体积,e为摩尔吸光度值(6.22×10-3mol∙L-1∙cm-2),VS为酶液体积,d为比色皿光位(1 cm).
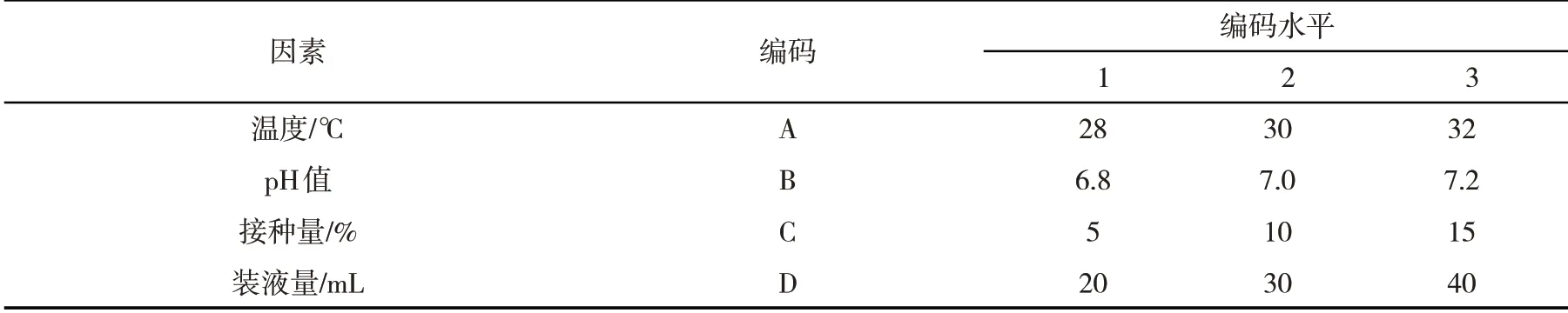
表1 正交试验因素水平编码Tab.1 Orthogonal experimental factor level coding
1.2.4 筛选转化液中产茶氨酸最佳条件以pH值、谷氨酰胺、乙胺盐酸盐、发酵液量为因素,按照表2设计正交试验筛选转化液中产茶氨酸的最佳条件[10].取1 mL转化培养液,5 000 r∙min-1离心10 min.取上清液,同时加入4 mL水、0.5 mL 2%茚三酮溶液、0.5 mL pH 8.0磷酸缓冲溶液.100℃水浴反应15 min后冷却至室温,分别定容至10 mL.在570 nm处测茶氨酸吸光度.根据茶氨酸标准曲线计算出茶氨酸的产量.
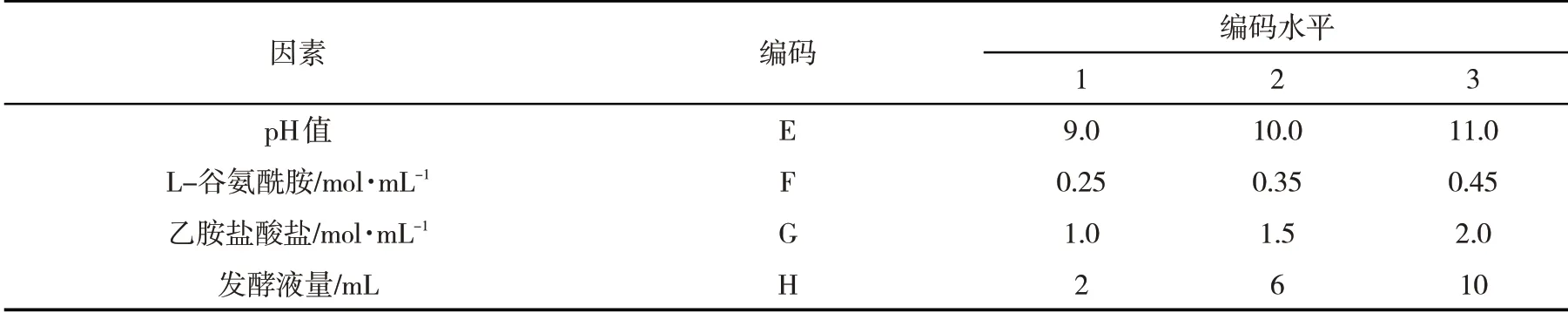
表2 正交试验因素水平编码Tab.2 Orthogonal experimental factor level coding
2 结果与分析
2.1 发酵液中γ-GT酶活力根据极差Rj=maxKˉij-minKˉij的大小,可以对影响因素排列.Rj越大表明该因素的水平变化对结果影响越大.影响γ-GT酶活力因素排序为:温度>接种量>pH>装液量,分别为温度28℃、接种量10%、pH 7.0、装液量30 mL,此时γ-GT酶活力为4.18 U∙mL-1(表3).
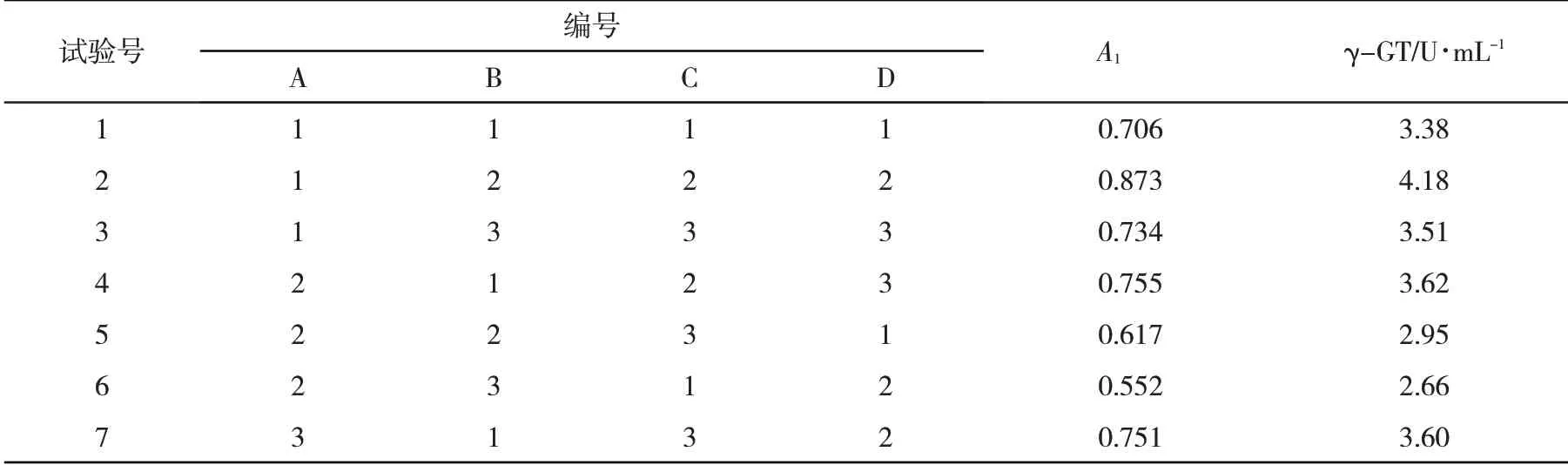
表3 正交试验设计与结果Tab.3 Design and results of orthogonal experiments
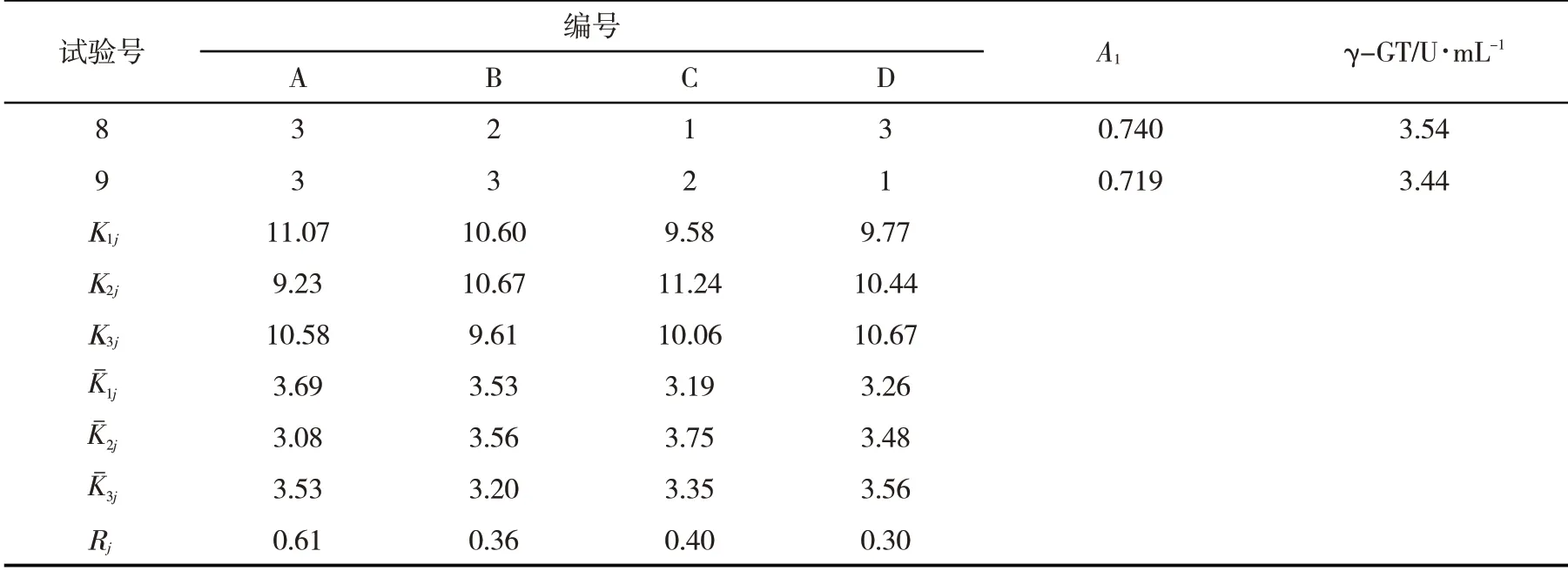
续表3
2.2 转化液中茶氨酸含量根据表4中Rj的大小,可以得到影响因素排序为:乙胺盐酸盐>发酵液量>L-谷氨酰胺>pH,最佳组合为乙胺盐酸盐2.0 mol∙L-1、发酵液量10 mL、L-谷氨酰胺0.45 mol∙L-1、pH 9.0,根据表4和图2中测定的吸光度值计算茶氨酸量,转化液中茶氨酸的量最大值为0.82 mg∙mL-1.图2茶氨酸计算公式:y=58.716x-0.546.
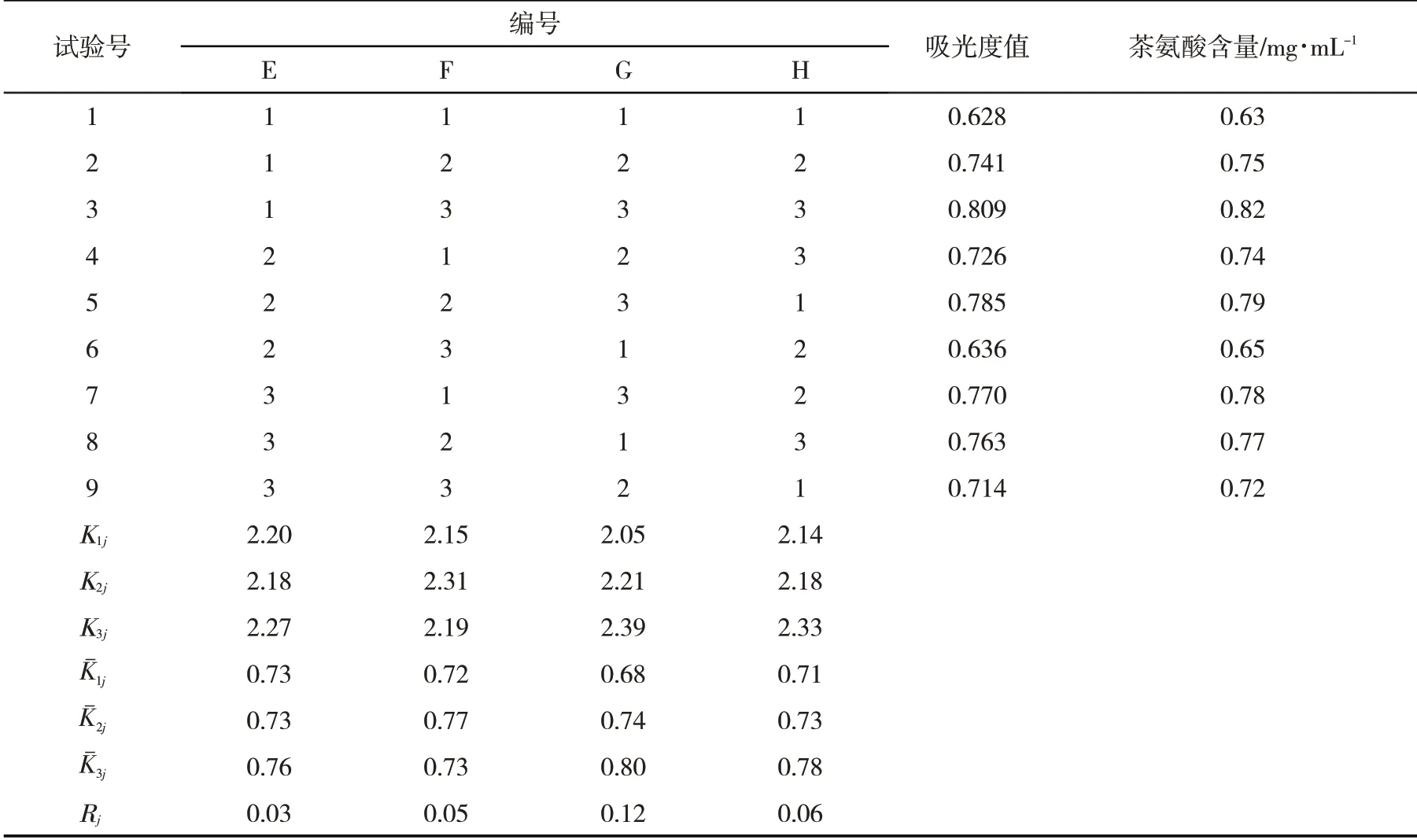
表4 正交试验设计与结果Tab.4 Design and results of orthogonal experiments
3 结论
采用正交试验法筛选合适的产酶和生产茶氨酸的条件,方法简单明了且结果可靠.研究得到地衣芽孢杆菌产γ-GT酶活力最高时的体系为温度28℃、接种量10%、pH 7.0、装液量30 mL,此时γ-GT酶活力为4.18 U∙mL-1;茶氨酸最佳转化体系为乙胺盐酸盐2.0 mol∙L-1、发酵液量10 mL、L-谷氨酰胺0.45 mol∙L-1、pH 9.0,此时测得茶氨酸含量为0.82 mg∙mL-1.

