肠道菌群在2型糖尿病中的作用机制及中药的调控作用
周子钧,纪越,李俊辰,宋逸飞,任桐
(1.天津中医药大学第一附属医院肾病科,天津 300382; 2.国家中医针灸临床医学研究中心,天津 300382)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种由于胰岛素分泌不足或胰岛素抵抗而引起的慢性代谢性疾病。研究表明,预计2045年T2DM将影响全球6.93亿人[1]。现代医学认为T2DM发病与氧化应激、胰高血糖素分泌异常、炎症反应等因素密切相关,但具体机制尚未完全明确[2]。随着对肠道菌群与T2DM关系研究的深入,近年来发现肠道菌群在T2DM的发病中也起重要作用[3]。在中医学中,糖尿病被认为是“消渴”病,“消渴”是一种由于先天不足、饮食失节、情志失调、劳倦内伤等导致的以多饮、多尿、乏力、消瘦或尿糖高为主要症状的病症,其临床症状与糖尿病相似,病机多为阴津亏损、燥热偏盛,故临床上对糖尿病的治疗大多以消渴论治。其中中药治疗T2DM的疗效较好,同时具备毒副作用小、兼治并发症的优点,在临床上发挥着重要作用[4]。由于中药大多以口服剂型为主,肠道菌群在这些药物发挥药效的过程中起重要作用[5],然而肠道菌群在T2DM发病中的作用及中药与肠道菌群之间的调节机制尚未完全明确。现就常见的肠道菌群及其代谢产物在T2DM发病过程中的作用以及中药调节肠道菌群治疗T2DM的具体机制进行综述。
1 肠道菌群与T2DM的关系
人类肠道中共生着大量微生物,数量可达1014个,组成极其复杂的微生态系统,并保持一种相对平衡状态,维持机体的正常生理功能[6]。近年来发现肠道菌群通过短链脂肪酸(short chain fatty acid,SCFA)代谢、胆汁酸代谢、支链氨基酸(branched chain amino acid,BCAA)代谢、脂多糖分泌等途径在T2DM的发生发展中发挥重要作用,见图1。研究表明,肠道菌群平衡失调可能导致T2DM的发生发展[7-8],其中T2DM患者肠道菌群α、β多样性均显著降低,菌群丰度明显减少[9]。动物模型中,与正常组相比,T2DM组大鼠肠道中Bacteroidetes和Alistipes菌群数量均下调,而Firmicutes和Blautia菌群数量上调,Firmicutes/Bacteroidetes明显升高[10]。但也有实验得出相反的结果,与正常组相比,T2DM组大鼠肠道中Firmicutes菌群数量减少,Bacteroidetes菌群丰度增加[11]。这可能与单个菌群的多个作用及菌群之间的相互作用有关,如Bacteroidetes菌群是革兰阴性菌,数量增多会刺激脂多糖的分泌,进而加剧胰岛素抵抗[12],但同时该菌群也包含SCFA产生菌(如Prevotella菌群),其数量增多会刺激SCFA的分泌,缓解胰岛素抵抗[13]。由此可见,肠道菌群通过多靶点、多途径对T2DM进行调控。此外,菌群衍生代谢物(如丙酸咪唑、琥珀酸和对甲酚)也与宿主胰岛素抵抗相关,进而影响T2DM的发生发展[14-15]。Deferribacteres菌群与铁代谢有关[16],铁代谢异常可导致T2DM的发生[17]。以上证据表明,肠道菌群与T2DM密切相关,具体作用机制分为以下几点。
1.1肠道菌群通过SCFA代谢影响T2DM SCFA是肠道菌群发酵食物产生的一种代谢产物,主要包含乙酸、丙酸和丁酸,其中丁酸是肠上皮细胞的主要能源之一,对细胞的生长分化起重要作用,主要由Firmicutes菌群产生;乙酸是胆固醇和脂肪酸合成的前体,而丙酸则是糖异生的底物,两者主要由Bacteroidetes菌群产生[18-19]。SCFA在人体发挥重要的生理功能,如调节肠道菌群、维持酸性环境、提供能量以及维持肠黏膜屏障完整性等,其中丁酸盐可抑制炎症反应,乙酸盐和丙酸盐可影响糖代谢[20],所以SCFA常被认为是预防和治疗T2DM的营养靶点[15]。Wang等[21]研究表明,调节肠道菌群有助于SCFA的转化,而SCFA特别是丁酸盐,可显著抑制肿瘤坏死因子-α和白细胞介素-6等促炎因子的分泌,进而改善胰岛素抵抗。近年来有学者指出,紊乱的肠道菌群与营养物质相互作用生成过多的乙酸盐,通过脑-肠轴持续刺激胰岛素分泌,最终导致胰岛素抵抗[22]。此外,SCFA还可通过调节胃肠道激素分泌,改善胰岛素敏感性,最终降低血糖。酪酪肽具有提高胰岛素敏感性和改善胰岛细胞功能的作用,而胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)可促进胰岛素分泌、胰岛β细胞修复再生。SCFA与G蛋白偶联受体(G protein-coupled receptor,GPR)41和GPR43结合可促使肠内分泌酪酪肽和GLP-1,进而刺激胰岛素分泌[23-24];同时SCFA与GPR41和GPR43的结合也可抑制核因子κB在宿主免疫细胞中的激活,减轻炎症反应,进而保护胰岛β细胞[18]。但有学者认为,SCFA刺激酪酪肽和GLP-1的分泌可能与GPR41和GPR43无关,在离体实验中,GPR43特异性激动剂对GLP-1和酪酪肽输出无显著影响,而GPR41特异性拮抗剂也未降低由乙酸和丁酸刺激的GLP-1或酪酪肽分泌[25]。但肠道菌群紊乱会严重影响SCFA的生成,进而影响T2DM的发生发展[26]。
1.2肠道菌群通过胆汁酸代谢影响T2DM 胆汁酸是人体胆固醇代谢、脂质消化和其他调节途径的重要组成部分,在肝脏中胆汁酸与甘氨酸结合,于回肠处再摄取后到达肠-肝循环,以梭状芽孢杆菌为主的部分菌群在胆盐水解酶和7α脱羟酶的作用下,将初级胆汁酸转化为次级胆汁酸,激活法尼醇X受体和GPR5等关键核受体[27]。其中,初级胆汁酸主要激活法尼醇X受体,次级胆汁酸主要激活GPR5,两者均在维持糖代谢稳态、改善胰岛素抵抗过程中发挥重要作用[28]。胆汁酸和法尼醇X受体通过小异二聚体伴侣级联抑制肝糖异生途径中磷酸烯醇丙酮酸羧激酶、葡萄糖6磷酸酶和果糖1,6-二磷酸酶的活性,进而抑制糖异生,改善葡萄糖稳态,缓解T2DM[29];次级胆汁酸与GPR5结合,促进GLP-1的分泌,上调胰岛素分泌,缓解胰岛素抵抗[30]。然而,有研究表明,长期直接刺激法尼醇X受体也会减少胆汁酸池的容量,从而导致机体能量消耗的减少和胰岛素抵抗的增强,反而诱发肥胖和糖尿病[31]。因此,维持胆汁酸代谢平衡对改善T2DM十分关键,而肠道菌群作为胆汁酸代谢中的重要一环,其平衡也至关重要。但肠道菌群对胆汁酸的调节不是单向的,如牛黄胆酸等初级胆汁酸也能向肠道细菌提供归巢信号,促进孢子萌发,使其可能以休眠和无毒的形式存在,并有利于抗生素和毒素引起的菌群失调的恢复[32]。总之,肠道菌群紊乱,胆汁酸代谢平衡亦会随之紊乱,反之亦然,最终影响正常的能量代谢,加剧T2DM进程。
1.3肠道菌群通过BCAA代谢影响T2DM BCAA是指α碳上含有侧链的氨基酸,包括亮氨酸、异亮氨酸和缬氨酸,是人体内重要的营养代谢信号分子,而BCAA的合成与肠道菌群密切相关,Prevotellacopri和Bacteroidesvulgatus菌群是合成BCAA的主要菌群,经Prevotellacopri喂养3周正常小鼠血清中BCAA水平明显升高[33]。多项研究认为,BCAA及其代谢产物与胰岛素抵抗密切相关[34-35],高剂量的BCAA膳食可增加胰岛素抵抗的发生风险,并可加速T2DM的发展[36]。然而目前BCAA诱导胰岛素抵抗的机制仍存在争议,有学者认为哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是BCAA和胰岛素之间的中心信号[37],BCAA和胰岛素均可激活mTOR,被激活的mTOR激活核糖体蛋白S6激酶1,核糖体蛋白S6激酶1通过磷酸化S6调控信使RNA的翻译启动[38],而过度激活的核糖体蛋白S6激酶1和mTOR可负向调节蛋白激酶B,诱导胰岛素底物受体1丝氨酸磷酸化,抑制胰岛素底物受体1与胰岛素受体之间的作用,从而发生胰岛素抵抗[39]。有实验证实,BCAA虽然对mTOR的生物活性有影响,但对糖尿病患者的代谢无明显改变[40],表明BCAA并非通过mTOR导致胰岛素抵抗。此外,有研究表明BCAA可通过磷脂酰肌醇-3-激酶/蛋白激酶B途径负性调控Krüppel样因子15,进而影响糖脂代谢[41-42]。表明肠道菌群所调控的BCAA代谢在T2DM的发生发展中起重要作用。
1.4肠道菌群通过脂多糖影响T2DM 脂多糖又称内毒素,是肠道菌群中革兰阴性菌细胞壁的组成成分,是体内重要的炎症刺激物。T2DM被认为是一种慢性炎症状态,各种促炎因子在T2DM的发病中发挥重要作用,肠道菌群紊乱会产生大量的脂多糖,脂多糖与免疫细胞表面的Toll样受体4结合,激活下游髓样分化因子88和核因子κB等炎症信号通路,促进促炎因子(如肿瘤坏死因子-α、白细胞介素-1和白细胞介素-6)的分泌,进而诱导加重胰岛素抵抗[43-47]。同时,异常的菌群(如Desulfovibrio菌群)也会导致肠壁通透性改变,促使脂多糖进入血循环,形成内毒素血症,加剧炎症反应和胰岛素抵抗[48]。此外,关于T2DM与炎症反应的研究指出,长期高水平的脂多糖持续刺激可能使中性粒细胞和单核细胞产生耐受性,在受到刺激时不能分泌足够的促炎因子,进而影响机体的免疫应答,表明脂多糖对T2DM的进程有重要作用,因此改善肠道菌群,调控脂多糖分泌对T2DM的治疗至关重要[49-50]。
2 中药在治疗T2DM中对肠道菌群的调节
肠道菌群紊乱与T2DM的发生发展密切相关,因此,调节肠道菌群,恢复菌群稳态作为T2DM的新型治疗方法备受关注,主要包括粪便移植、益生菌、减重手术和抗生素等。此外,中药治疗T2DM的疗效较好,且具有毒副作用小、辅助降糖和同时治疗并发症等优点[4]。中医学中将糖尿病归于“消渴”,其病机多为阴虚燥热,并根据不同的证型采取不同的中药进行治疗,但具体作用机制尚不明确[51]。中药大多以口服剂型为主,肠道菌群在这些药物发挥药效的过程起重要作用,见图2。研究中药与肠道菌群相互作用的机制,可以更加合理且有效地使用中药,同时为中医药治疗T2DM的临床应用提供数据支持。
2.1中药单体治疗T2DM中对肠道菌群的调节 青钱柳是我国一种特有的药食同源珍稀植物,具有改善血糖的作用。青钱柳多糖干预后,糖尿病大鼠肠道菌群中Spirochaetes和Proteobacteria菌群丰度明显降低,而Ruminococcaceae、Eubacteriaceae和Lachnospiraceae菌群丰度显著增高,其中Ruminococcaceae和Lachnospiraceae菌群被证明与SCFA的产生密切相关,具备分泌SCFA的能力;健康人体粪便样本的体外培养中同样观察到青钱柳多糖可增加SCFA产生菌的菌群丰度,表明青钱柳多糖通过改善T2DM患者的肠道菌群促进SCFA的分泌,进而缓解T2DM[52]。
黄精在临床上也常用来治疗T2DM,其中黄精总皂苷和黄精总多糖是中药黄精的主要活性成分,在动物实验中黄精总皂苷和黄精总多糖的干预均增加了糖尿病大鼠肠道菌群中Firmicutes菌群数量,减少了Bacteroidetes和Proteobacteria菌群数量,其中Bacteroidetes和Proteobacteria菌群数量与脂多糖的分泌呈正相关,表明黄精总皂苷和黄精总多糖能选择性地促进肠道菌群中一些有益细菌的生长,抑制脂多糖的分泌,进而改善胰岛素抵抗[53]。其中黄精多糖还可通过调节SCFA产生菌(如Bifidobacterium、Streptococcus和Blautia菌群),调节肠道菌群多样性,促进SCFA分泌,改善糖脂代谢紊乱[13]。
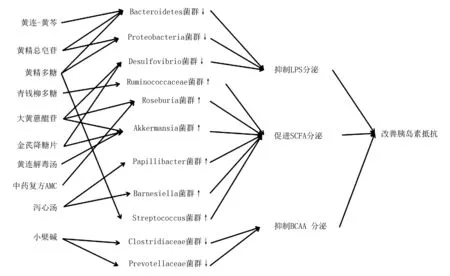
LPS:脂多糖;SCFA:短链脂肪酸;BCAA:支链氨基酸;T2DM:2型糖尿病;中药复方AMC包含8味中药(知母、苦瓜、黄连、丹参、红曲米、芦荟、五味子、干姜)
大黄蒽醌苷是传统中药大黄的生物活性成分之一,在治疗T2DM、调节肠道菌群中也有较好的疗效,实验表明大黄蒽醌苷能上调Lactobacillus、Roseburia和Akkermansia菌群丰度,进而促进SCFA的分泌,激活GLP-1/cAMP信号途径,改善胰岛素抵抗,此外大黄蒽醌苷还可降低Desulfovibrio菌群数量,减少脂多糖的分泌,保护肠道完整性,从而抑制慢性炎症反应,改善T2DM[48]。
小檗碱是黄连的主要有效成分,近年来已被证实在T2DM的治疗中有较好的疗效。以往研究认为,小檗碱通过下调Firmicutes菌群丰度,上调Bacteroidetes菌群丰度,进而抑制脂多糖分泌,促进SCFA分泌,改善糖脂代谢[54]。近年研究指出,小檗碱还可能通过抑制BCAA的生成缓解胰岛素抵抗,与T2DM组小鼠相比,小檗碱组小鼠体内BCAA产生菌(如Streptococcaceae、Clostridiaceae和Prevotellaceae)菌群丰度明显减少,血清BCAA显著降低[55]。
2.2中药复方治疗T2DM中对肠道菌群的调节 黄芩-黄连是临床常用于治疗T2DM的药物。一项对T2DM小鼠的实验研究发现,糖尿病组与黄芩-黄连干预组肠道菌群中Bacteroidetes和Firmicutes比例比较差异有统计学意义,指出黄芩-黄连可能通过调节肠道菌群抑制脂多糖分泌,进而抑制Toll样受体4/髓样分化因子88信号通路,减轻炎症反应,缓解胰岛素抵抗[56]。实验证实,经过黄芩-黄连治疗的T2DM大鼠肠道菌群中SCFA产生菌Bacteroidales S24-7 group_norank,[Eubacterium]nodatum group,Parasutterella,Prevotellaceae UCG-001,Ruminiclostridium,Ruminiclostridium 9菌群数量显著增加,表明黄芩-黄连通过调节肠道菌群增加SCFA的分泌,进而改善胰岛素抵抗[57]。
黄连解毒汤在临床上常用来治疗T2DM,黄连解毒汤通过上调Parabacteroides Blautia和Akkermansia菌群丰度,调节肠道菌群结构,促进SCFA分泌,明显改善T2DM大鼠的高血糖和炎症反应[58]。
泻心汤出自张仲景的《金匮要略》,常用来治疗脾胃系统疾病,临床也常用于治疗T2DM,有研究指出,经泻心汤治疗T2DM大鼠肠道菌群中SCFA产生的Alloprevotella、Barnesiella、[Eubacterium] Ventriosum、Lachnospiraceae UCG-001、Papillibacter菌群丰度明显增加,而Adlercreutzia和Blautia菌群丰度则降低,表明泻心汤通过调节肠道菌群上调SCFA的分泌,同时增加肠道完整性,抑制炎症反应,进而改善胰岛素抵抗[59];Blautia菌群是一种产生乙酸的菌群,被认为可改善T2DM,但在该实验中菌群丰度减少,可能是与相同功能的菌群竞争抑制所致[59]。
金芪降糖片是临床治疗T2DM的中成药,但具体机制尚未完全明确,有研究指出,低剂量的金芪降糖片通过上调Akkermansia菌群丰度促进SCFA特别是丁酸的分泌,维持肠黏膜完整,抑制炎症反应,同时降低Desulfovibrio菌群数量,减少脂多糖的分泌,并抑制炎症反应,改善胰岛素抵抗[60]。
中药复方AMC(知母、苦瓜、黄连、丹参、红曲米、芦荟、五味子和干姜)治疗T2DM的实验显示,与二甲双胍相比,AMC对T2DM的治疗效果更好[5]。其中AMC通过改变肠道菌群结构,增加SCFA产生菌(Blautia、Faecalibacterium、Roseburia等)的菌群丰度,改善T2DM患者的血脂、血糖代谢和胰岛素抵抗,进而缓解T2DM[5]。
3 小 结
肠道菌群通过SCFA代谢、胆汁酸代谢、BCAA代谢、脂多糖分泌等途径与T2DM的发生密切相关,调节肠道菌群能明显改善胰岛素抵抗,缓解T2DM,这为T2DM的防治提供了新思路、新靶点。中医药作为我国传统医学,对T2DM的治疗效果显著,中药大多以口服为主,对肠道菌群的调节在治疗疾病中发挥着重要作用。中药通过调节肠道菌群改善T2DM患者体内菌群结构、促进有益菌群丰度增加,进而缓解T2DM。但由于目前技术的局限性,仍有许多机制尚未完全明确,深入研究肠道菌群在中药治疗T2DM过程中的作用机制,将为中药的临床使用提供分子生物学支持,为中医药现代化提供理论基础。

