黄茶多糖的分离纯化及其抗氧化活性研究
张倩
(1.广东药科大学药学院,广东 广州 510006;2.广东省先导化合物发现与新药研发工程技术中心,广东 广州 510006)
黄茶是我国六大茶类之一[1],属轻发酵茶类,因其独特的“闷黄”工艺而知名。黄茶中富含多种营养成分,比如茶多糖、茶多酚、甲基黄嘌呤类、氨基酸类和挥发性成分等[2-3],近年来由于其具有抗氧化、抗肿瘤、降血糖、降血脂和护肝等丰富的保健疗效[4-11],逐渐引起了人们的关注。
对黄茶的研究主要集中在其加工工艺优化和挥发性成分上[12-15],对其保健功效的研究主要包括降脂、抗癌、抗氧化等。肖力争[16]通过建立糖尿病大鼠模型并给予黄茶君山银针,观察相关指标证明其可调节糖脂代谢。赵欣[17]通过反转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR) 检查Bax、Bcl-2 基因表达情况及 4′,6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI) 染色分析,得出黄茶对HT-29结肠癌细胞有较强的诱导凋亡的能力[17]。邓潇潇等[18]通过动物模型分析,研究表明一定浓度的黄茶对胃损伤有预防的效果。Andlauer W等[19]采用快速电流筛选法和化学发光法[测定铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)及DPPH·的清除作用]对黄茶的抗氧化活性进行研究,结果显示黄茶提取物对体外氧化损伤具有较强的保护作用。Xu等[20]的研究发现黄茶的水提物和醇提物均具有较好的抗氧化效果。
黄茶中的多糖是一类重要的生物活性物质,近年来,大量研究报道植物多糖可作为一种天然抗氧化剂来代替人工合成抗氧化剂,其通过清除体内过量自由基以达到抗氧化的目的[21]。全吉淑等[22]研究发现茶多糖对ROO·、O2-·、·OH及H2O2均有清除作用。史敏等[23]对茶多糖通过抗氧化而延缓衰老的机制进行了综述,总结出茶多糖可通过清除活性自由基、抑制脂质过氧化、激活抗氧化防御系统和调节机体免疫功能达到延缓老化目的。
目前对黄茶多糖成分的提取分离和生物活性的研究相对较少。本文主要研究了黄茶多糖的提取工艺,并用常规抗氧化体系方法研究了黄茶多糖半纯品体外清除 DPPH·、ABTS+·和羟自由基(·OH)的活性以及总还原力能力,以期为黄茶的药理活性研究以及开发利用提供一定的物质基础。
1 材料与方法
1.1 材料与试剂
黄茶(广东大叶青):广东省农业科学院;二乙胺基乙基纤维素 52(diethylaminoethyl cellulose52,DEAE-52):美国通用电气医疗公司;DPPH、ABTS、L-抗坏血酸、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、三氟乙酸(trifluoroacetic acid,TFA):上海阿拉丁生化科技股份有限公司。其他相关试剂均为国产分析纯。
1.2 仪器与设备
LXJ-IIB型离心机:上海安亭科学仪器厂;HL-2B恒流泵和BS-100自动部分收集器:上海沪西分析仪器厂有限公司;JA5003N电子天平:上海菁海仪器有限公司;EYELAN-1100型旋转蒸发仪:日本东京理化器械株式会社;FD-2型冷冻干燥机:北京博医康实验仪器有限公司;1260高效液相色谱仪:安捷伦科技有限公司。
1.3 方法
1.3.1 黄茶粗多糖的提取
取黄茶15 kg,加去离子水浸泡约12 h后于80℃下提取 3 次,3 h/次,其中料液比约为 1∶10(g/mL)。3 次提取后合并提取液,进行减压浓缩以减少溶剂体积,并将浓缩液进行离心过滤(3 500 r/min,10 min),弃沉淀,取上清液,加入乙醇,不断搅拌至乙醇浓度为70%,室温(25±2)℃放置48 h,离心过滤后的沉淀物为黄茶70%乙醇醇沉部位的粗多糖P70。
1.3.2 黄茶粗多糖P70除蛋白
采用Sevag法除蛋白[24]。取一部分粗多糖P70用去离子水溶解后配制成水溶液和Sevag试剂(三氯甲烷∶正丁醇 =4∶1,体积比)按 5∶1 的体积比混合振摇,静置分层。取上层清液,下层离心取上清液后与上层合并,再重复上述操作3次至下层蛋白质絮状物全部去除或近似全部去除。上清液经减压过滤后,于流动水中用截留分子量为1 000 Da的透析袋透析48 h,然后进行旋转蒸发浓缩以减少溶剂体积再进行冷冻干燥,得脱蛋白后粗多糖P70的冻干粉末,命名为YT70。
1.3.3 黄茶粗多糖YT70的糖含量测定
葡萄糖标准曲线的制备:精密称定10mg葡萄糖标准品,以去离子水为溶剂,将其定容到100mL容量瓶。分别移取 0.2、0.4、0.6、0.8、1.0mL 于容量瓶中,用去离子水配至2.0mL,加入6%苯酚溶液1.0mL,摇匀后加入浓硫酸5.0mL,充分摇均。将其置于室温(25±2)℃下30min,使其充分反应后,于紫外可见分光光度仪在490nm处测定葡萄糖标准品的吸光度值。
样品溶液的制备:精密称取冻干粉末YT70约5 mg,以去离子水为溶剂,将其定容到100 mL容量瓶。移取0.5 mL多糖溶液,用去离子水配至2.0 mL,加入6%苯酚溶液1.0 mL,混匀,加入5.0 mL浓硫酸,充分摇均。将其置于室温(25±2)℃下30 min,使其充分反应后,于紫外可见分光光度仪在490 nm处测定其吸光度值,并由所绘制的标准曲线计算YT70的糖含量。
1.3.4 黄茶粗多糖YT70的分离纯化
将所得黄茶粗多糖YT70用阴离子交换柱进行分离。阴离子交换柱的填料选用DEAE-52,层析柱选用Ø2.5 cm×40 cm规格。称取500 mg黄茶粗多糖YT70样品溶于10mL去离子水中,于10000r/min下离心10 min,取上清液上样,依次用 0、0.05、0.2 mol/L 的 NaCl溶液洗脱,用苯酚-硫酸法[25]将洗脱液显色后,于紫外可见分光光度计在490 nm的波长下检测其吸光度值,并绘制洗脱曲线,根据吸光度值收集洗脱液。将收集到的洗脱液通过减压浓缩后,使用截留分子量为3 500 Da的透析袋于流动水中透析24 h,再通过旋转蒸发减少溶剂的体积后进行冷冻干燥,得纯化后黄茶多糖的冻干粉末,命名为YT70-1。
1.3.5 单糖组成分析
样品的制备:精密称取黄茶多糖冻干粉末YT70-1约5 mg,加入2 mol/L的TFA溶液2 mL后封口于120℃油浴反应6 h,随后旋转蒸发减压浓缩至干,再加甲醇约3 mL使干燥物溶解后继续旋转蒸干,重复上述操作3次后加1 mL去离子水溶解,取0.1 mL溶液于4 mL的试管中加入PMP-甲醇溶液200 μL及0.3 mol/L的氢氧化钠溶液200 μL,在70℃下水浴反应30 min,冷却至室温(25±2)℃后加入 210 μL 0.3 mol/L的氯化氢溶液,用1 mL的氯仿萃取,振荡均匀后10 000 r/min离心5 min。离心后取上层清液,重复操作3次。最后用0.45 μm的滤膜过滤,用于高效液相色谱(high performance liquid chromatography,HPLC)检测。
混合标准单糖PMP衍生化:取9种标准单糖,包括甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸,分别用去离子水配成2 mmol/L溶液,分别取50 μL混合于离心管,加PMP甲醇溶液200 μL和0.3 mol/L的氢氧化钠溶液200 μL,70℃水浴反应30 min,冷却至室温(25±2)℃后加210 μL 0.3 mol/L氯化氢溶液中和,用1 mL氯仿萃取,振荡均匀后10 000 r/min离心5 min。离心后取上层,重复操作3次。最后0.45 μm滤膜过滤,用于HPLC检测。
色谱条件:色谱柱为AgilentZORBAXEclipseXDBC18(Ø4.6 mm×250 mm,5 μm);流动相为 0.1 mol/L 磷酸盐缓冲液-乙腈(体积比 83∶17);流速为 1 mL/min;进样量为20 μL;检测波长为250 nm。
1.3.6 黄茶多糖YT70-1的纯度分析
采用高效液相凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测试多糖样品的均一性。称取YT70-15 mg溶于1 mL的超纯水中,用0.45 μm微孔滤膜过滤后进样。色谱条件为高效液相色谱仪Waters2695,色谱柱:TSK-GELG-3000PWXL凝胶柱串联,检测器:Waters2414示差检测器,流动相:0.02mmol/LKH2PO4溶液,进样量:10μL,流速:0.5mL/min。
1.4 黄茶多糖的抗氧化活性测定
1.4.1 黄茶多糖对DPPH·的清除效果
DPPH溶液(0.1 mmol/L)的制备:称取0.003 9 g DPPH,以无水乙醇为溶剂,定容至10 mL,将定容液稀释10倍即得,避光保存于0~4°C。
DPPH自由基的清除效果测定方法参考文献[26]的方法,根据实际做一些修改。称取一定量的YT70-1,将其配制成不同浓度梯度的多糖溶液(0.156 25、0.312 5、0.625、1.25、5、10、20 mg/mL),移取 20 μL 于 96 孔板中,加入 200 μL DPPH 溶液(0.1 mmol/L)。充分摇匀,于黑暗处放置30 min,在517 nm处测定吸光值A1。多糖溶液用去离子水代替,其他条件和操作不变,在517 nm处测定吸光值A2。DPPH溶液用无水乙醇代替,其他条件和操作不变,在517 nm处测定吸光值A3。以VC为阳性对照[27]。每个浓度梯度平行操作3次。清除效果根据以下公式计算。

式中:A1为多糖溶液+DPPH·工作液吸光度值;A2为去离子水+DPPH工作液吸光度值;A3为多糖溶液+去离子水吸光度值。
1.4.2 测定黄茶多糖对ABTS+·的清除效果
ABTS母液的制备(21mmol/L):称取0.1152gABTS,以去离子水为溶剂,移至10mL容量瓶中并定容。
过硫酸钾溶液的制备(7.35 mmol/L):称取过硫酸钾0.019 9 g,以去离子水为溶剂,定容到10 mL容量瓶中。
ABTS储备液的制备:各取5 mL ABTS母液和过硫酸钾溶液,混匀后加入5 mL去离子水,摇匀,并避光放置12 h(仅限第2天使用)。
ABTS+·的清除效果测定方法参考文献[28]的方法,并根据实际情况做了一些修改。用去离子水将ABTS储备液稀释成ABTS工作液(现配现用,734 nm处测得的吸光度为0.7±0.02),置于30°C平衡30 min。称取一定量的YT70-1,将其配制成不同浓度的多糖溶液(0.156 25、0.312 5、0.625、1.25、2.5、5、10、20 mg/mL)。向96孔板中加入20 μL多糖溶液及200 μL ABTS工作液。混匀后避光放置20 min,于734 nm处测定吸光度A4。以去离子水分别代替多糖溶液、ABTS工作液,重复上述操作,于734 nm处测定吸光值分别为A5、A6,以VC为阳性对照。每个浓度梯度平行操作3次。清除效果根据以下公式计算。

式中:A4为多糖溶液+ABTS工作液吸光度;A5为去离子水+ABTS工作液吸光度;A6为多糖溶液+去离子水吸光度。
1.4.3 测定黄茶多糖对羟自由基的清除效果
称取一定量的YT70-1,将其配制成不同浓度的多糖溶液(0.15625、0.3125、0.625、1.25、2.5、5、10、20mg/mL),各取2 mL于具塞试管,分别加入6 mmol/L FeSO4溶液2 mL和6mmol/L水杨酸-乙醇溶液2 mL,用8.8 mmol/L H2O2溶液1 mL启动反应,37℃水浴条件下反应30 min后于510 nm处测定吸光度。以VC为阳性对照。每个浓度梯度平行操作3次。清除效果根据以下公式计算。

式中:A7为样品吸光度值;A8为以蒸馏水代替样品的对照吸光度值;A9为以去离子水代替样品和H2O2的吸光度值。
1.4.4 测定黄茶多糖的总还原力试验
取磷酸缓冲液(pH6.6)与1.0%铁氰化钾溶液各2.5 mL,充分混匀后,分别加入1.0 mL不同浓度的多糖溶液(0.156 25、0.312 5、0.625、1.25、2.5、5、10、20 mg/mL),混匀,50℃水浴加热20 min。随后加入蒸馏水2.0 mL与 0.1%FeCl3溶液 2.0 mL,混匀后室温(25±2)℃静置10 min,700 nm处测定其吸光度。以去离子水代替多糖溶液作为空白对照,以VC为阳性对照。每个浓度梯度平行操作3次。
2 结果与分析
2.1 提纯结果
2.1.1 黄茶多糖的提取
采用热水浸提、70%乙醇沉淀的方法得到黄茶70部位的粗多糖P70,采用Sevag法脱蛋白、透析及冻干后得37.169 g的黄茶粗多糖YT70。
2.1.2 黄茶多糖的糖含量测定
以浓度为横坐标、吸光度为纵坐标绘制标准曲线,得到A=4.521 4C-0.010 9(其中A为吸光度,C为浓度),R2=0.999 1的回归方程,如图1所示。根据葡萄糖溶液标准曲线,计算所得黄茶粗多糖YT70的糖含量为43.3%。

图1 葡萄糖标准曲线Fig.1 Standard cure of glucose
2.1.3 黄茶多糖的洗脱曲线
YT70的DEAE-52柱层析洗脱曲线见图2。
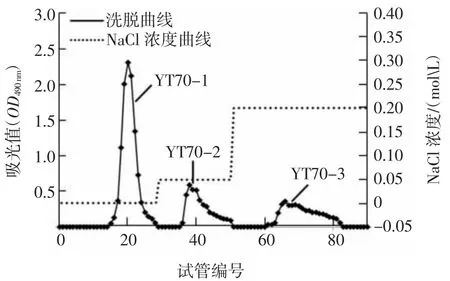
图2 YT70的DEAE-52柱层析洗脱曲线Fig.2 Elution profile of YT70 on DEAE-52
由图2可知,黄茶粗多糖YT70经DEAE-52柱分离得到3个组分,将其命名为YT70-1、YT70-2、YT70-3,分别是用水、0.05 mol/L和0.2 mol/L的氯化钠溶液洗脱得到。其中YT70-1吸光度值高,且峰型很窄,表示其糖含量及纯度较高。而YT70-2和YT70-3的吸光度值偏低,峰型宽,有明显拖尾现象,表明它们的糖含量不高且杂质偏多。故收集YT70-1,进行浓缩、透析并冻干。
2.1.4 单糖组成分析
将混合单糖标准品溶液以及多糖样品溶液进行液相分析。单糖组成分析结果见图3。

图3 标准混合单糖的HPLC分析图谱和YT70-1的HPLC分析图谱Fig.3 HPLC analysis of the mixture of standard monosaccharide and HPLC analysis of the monosaccharide of YT70-1
如图3A和图3B所示,与混合单糖标准品的HPLC分析图谱作对照,可知YT70-1的单糖组成包括甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖及岩藻糖8种糖,相对含量分别为20.35%、11.71%、3.17%、20.99%、17.54%、7.62%、15.90%、2.71%。其中,葡萄糖和甘露糖的含量比较高,而葡萄糖醛酸和岩藻糖的含量很少。
2.1.5 黄茶多糖YT70-1的纯度验证
YT70-1的HPGPC色谱图见图4。

图4 YT70-1的HPGPC色谱图Fig.4 HPGPC analysis of YT70-1
如图4所示,YT70-1的HPGPC图谱呈现为单一对称峰,但是仍有一些残存杂质。表明YT70-1为半纯多糖,略带杂质。
2.2 抗氧化测定结果
2.2.1 黄茶多糖对DPPH·的清除效果
YT70-1对DPPH·的清除能力见图5。

图5 YT70-1对DPPH·的清除能力Fig.5 The scavenging effects of YT70-1 on DPPH·
从图5可以看出,随着浓度的增加,黄茶多糖YT70-1对DPPH·的清除率逐渐增大。当YT70-1的浓度达到20 mg/mL时,对DPPH·的清除率为48.7%。虽然明显不及VC的(IC50为0.063 22 mg/mL)的清除能力,但仍然表明YT70-1具有一定的抗氧化作用。
2.2.2 黄茶多糖对ABTS+·的清除效果
YT70-1对ABTS+·的清除能力见图6。

图6 YT70-1对ABTS+自由基的清除能力Fig.6 The scavenging effects of YT70-1 on ABTS+·
由图6可知,随着浓度的增加,YT70-1对ABTS+·清除率逐渐增大。当浓度在5 mg/mL~10 mg/mL时,YT70-1对ABTS+·的清除率为60%~80%,之后随浓度增加,清除效果变化不大,趋于稳定。以样品的浓度对ABTS+·清除率作图并进行线性拟合后计算得到阳性对照药VC的IC50为0.050 52 mg/mL,YT70-1的IC50为3.87 mg/mL。YT70-1呈现出良好的ABTS+·清除能力。
2.2.3 黄茶多糖对羟自由基(·OH)的清除效果
YT70-1对OH自由基的清除能力见图7。

图7 YT70-1对OH自由基的清除能力Fig.7 The scavenging effects of YT70-1 on·OH
由图7可知,YT70-1清除OH自由基的能力随着浓度的增加而增强。当YT70-1的浓度达到20 mg/mL时,对·OH的清除率为39.67%。阳性对照VC对·OH的清除率可达到96.33%。因此YT70-1表现出了对OH自由基的清除活性。
2.2.4 黄茶多糖的总还原力
YT70-1的总还原力见图8。

图8 YT70-1的总还原力Fig.8 Reducing power of YT70-1
如图8所示,随着浓度的增加,黄茶多糖YT70-1的还原力逐渐增强。当YT70-1的浓度达到20 mg/mL时,OD700nm为0.415,虽然明显不及阳性对照VC(2.64)的还原力(吸光度越大表示还原能力越强),但仍然表明黄茶多糖具有一定的抗氧化作用。
3 结论
黄茶经水提醇沉除蛋白后得到黄茶的粗多糖成分YT70,其糖含量为43.3%,再经DEAE-52柱层析分离纯化得到黄茶多糖YT70-1,其主要由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖及岩藻糖等单糖组成,随后运用一系列多糖抗氧化化学检测方法测定分析了黄茶多糖YT70-1的体外抗氧化活性。结果表明,YT70-1具有一定的体外抗氧化活性,体外能够清除DPPH·、ABTS+·和·OH,清除能力随多糖浓度的增大而增加,其中相较DPPH·和·OH,YT70-1对ABTS+·的清除能力更强,效果更好。

