对羟基苯甲酸丙酯对食蚊鱼(Gambusia affinis)鳃和表皮K+流速的影响
闫小雨,曾鸿鹄,2,3,4,宋晓红,2,3,*,梁延鹏,2,3,4,黎昕,刘志锐,黄思齐,邓鸿彬
1. 桂林理工大学环境科学与工程学院,桂林 541000 2. 广西环境污染控制理论与技术重点实验室,桂林 541000 3. 岩溶地区水污染控制与用水安全保障协同创新中心,桂林 541000 4. 广西环境污染控制理论与技术重点实验室科教结合科技创新基地,桂林 541000
对羟基苯甲酸酯是对羟基苯甲酸与烷基形成的一种脂类化合物[1],作为防腐剂被广泛使用于食品、化妆品和药品中[2-3]。在众多对羟基苯甲酸酯化合物中,对羟基苯甲酸丙酯(propylparaben, PrP)在环境中的检出频率和含量较高,地表水、污泥、沉积物和土壤中均有检出[4-5]。PrP的大量使用导致其广泛存在于鱼类、无脊椎动物、海草、海洋大藻类、红树林等动植物体内[6],在海洋食物网中有生物累积和放大作用[7]。此外,PrP在鱼类的早期发育阶段通过诱导氧化应激、DNA双链断裂、细胞凋亡以及改变脂肪酸代谢等途径引起机体毒性[8],并具有与双酚类物质相似的雌激素效应[9]。
鱼类的鳃和皮肤是重要防御组织,当鱼体暴露于受污染的水体时,某些污染物例如内分泌干扰物会通过鱼鳃和表皮组织进入鱼体[10-11],从而破坏鱼鳃细胞和鱼体肾脏细胞等细胞的离子平衡[12]。Baldissera等[13]研究发现,银鲶鱼(Clariasbatrachus)在受到豚鼠气单胞菌(Aeromonascaviae)毒害作用时,鱼体肾脏细胞内K+稳态会被破坏最终导致鱼体肾脏功能受损;Hung等[14]通过测量斑马鱼(Daniorerio)细胞内Ca2+流速变化,证实了污染物顺铂对斑马鱼细胞离子稳态的损害。K+是动植物的必需元素,其稳态对维持细胞各项功能正常运转具有重要作用[15],人体血细胞内K+含量过高或过低都会引起器官衰竭等病症[16]。细胞内高K+低Na+的环境是保持细胞离子平衡和新陈代谢的重要基础,K+稳态变化可有效指示污染物的毒害作用,目前关于PrP对鱼体内K+平衡影响的研究还未见报道。

食蚊鱼(Gambusiaaffinis)分布于我国华南地区的淡水水体中,体型小、容易捕捞且易于在实验室饲养,因此被广泛应用于环境毒理学研究。本文以食蚊鱼作为模式生物,通过急性毒性实验研究了不同浓度PrP暴露下食蚊鱼的半致死浓度(LC50),采用非损伤微测技术检测鱼体表皮和鱼鳃的K+流速,分别研究了不同浓度PrP瞬时暴露和96 h暴露后鱼体表皮和鱼鳃的K+流速变化,探讨PrP暴露对鱼体表皮和鱼鳃细胞K+通道的影响机制,为PrP的毒性评估和环境监测提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验动物
食蚊鱼购自广西荔浦青山水产养殖场,在水生生物养殖系统中适应7 d。实验用水连续曝气24 h以上,水温为24.5℃±0.5℃,pH为7.5±0.1,溶解氧为(5.9±0.5) mg·L-1,保持14 h∶10 h的光暗条件,每天定时投喂2次丰年虫虫卵。挑选健康活泼、大小均一的个体作为实验用鱼,平均体质量为(0.18±0.04) g,平均体长为(2.7±0.2) cm。
1.2 实验方法
1.2.1 食蚊鱼急性毒性实验
采用半静态法研究PrP对食蚊鱼的急性毒性效应,通过预实验获得96 h无死亡最高浓度(5 mg·L-1)和24 h全部死亡最低浓度(11 mg·L-1),作为正式实验的浓度区间。采用等对数间距法设置8个浓度组,PrP的浓度分别为5.0、5.6、6.3、7.1、7.9、8.9、10和11 mg·L-1,并设空白对照组和二甲基亚砜(DMSO)对照组。按实验所需配制母液,实验前每次取1 mL母液加入1 L水中,DMSO终浓度为1‰。分别将8条实验用鱼置于配有不同浓度PrP溶液的烧杯中,每个烧杯3 L PrP溶液,每个浓度组设3个平行。每24 h更换1/2 PrP溶液,测定溶解氧和pH,记录24、48、72和96 h每个烧杯中食蚊鱼的死亡情况。当鱼失去平衡、腹部向上,用玻璃棒触碰无反应,鱼鳃无闭合则判定鱼体死亡。实验所用试剂均为分析纯,购自Sigma-Aldrich化学制品有限公司(St.Louis, MO, USA)。
1.2.2 K+流速的测定方法
采用非损伤微测系统(NMT100/200 Series,北京旭月公司,中国)以非损伤性扫描离子选择微电极测定鱼体表皮和鱼鳃中K+的含量。基于Nernst方程和Fick’s第一扩散定律计算K+流速,能够获得非常细微的信号,流速能够达到10~12 pmol·(cm2·s)-1,离子流计算结果为正值时表示K+流出细胞(外排),计算结果为负值时表示K+流入细胞(内流)。
离子选择微电极使用之前需要校正,校准结果如下:校准液1(1 mmol·L-1K+)电压为-22.47 mV,校准液2(0.25 mmol·L-1K+)电压为-56.26 mV,测试液(0.5 mmol·L-1K+)电压为-39.89 mV,在测试过程中测试液电压波动在±10 mV之内,则满足校准要求。在靠近目标物的2个位置之间移动微电极,由电脑驱动的液压机械手来控制其移动距离和频率,将目标物放置于装有测试液的7.5 cm一次性无菌培养皿中,在室温下(26~28 ℃)检测离子流速。
1.2.3 PrP瞬时暴露食蚊鱼K+的流速测定
将实验室适应后的食蚊鱼在体式显微镜下迅速解剖取出鱼体的单边鱼鳃组织,将鱼鳃放入装有测试液的培养皿中,平衡10 min,鱼鳃测试液成分为CaCl2(0.1 mmol·L-1)、MgCl2·6H2O(0.98 mmol·L-1)、MgSO4(0.81 mmol·L-1)、KCl(0.5 mmol·L-1)、NaCl(149.4 mmol·L-1)、D-半乳糖(5 mmol·L-1)、丙酮酸钠(5 mmol·L-1),平衡完成后将培养皿放置于显微镜下,利用机械手使传感器距离鱼鳃鳃丝1 μm,选择测试模式X-30检测鱼鳃的K+流速。每个鱼鳃样品检测时间为30 min,在检测第10分钟时加入PrP暴露液。PrP暴露液浓度由急性毒性实验得到的96 h-LC50确定,浓度选择如下:低浓度LC50/10 (0.9 mg·L-1),中浓度LC50/5 (1.8 mg·L-1),高浓度LC50/2 (4.6 mg·L-1)。每个浓度组测定5条鱼。
鱼体表皮的测试过程与鱼鳃一致,鱼体表皮的测试液成分为NaCl(151 mmol·L-1)、CaCl2(0.25 mmol·L-1)、MgSO4(0.2 mmol·L-1)、KCl(0.5 mmol·L-1),在上机测试前先用0.4 mg·L-1间氨基苯甲酸乙酯甲磺酸盐(MS-222)将鱼体麻醉20 min,确保鱼体在测试过程中处于麻醉状态以不影响测试结果,鱼鳃和鱼体表皮的检测过程如图1所示,鱼体表皮测试部位为鱼体背鳍往后5 mm。

图1 鱼鳃和鱼体表皮K+流速的测试过程 (左:鱼鳃,右:鱼体表皮;玻璃针为传感器尖端)Fig. 1 The process of K+ flow velocity test in the fish gills and epidermis (left: fish gills, right: fish epidermis; the glass needle is the sensor tip)
1.2.4 PrP 96 h暴露食蚊鱼K+的流速测定
分别将5条食蚊鱼暴露于96 h-LC50/10 (0.9 mg·L-1)、96 h-LC50/5 (1.8 mg·L-1)和96 h-LC50/2 (4.6 mg·L-1)3种不同浓度PrP溶液中96 h,并设空白对照组。用NMT系统检测K+流速的过程同1.2.3,每个样品检测20 min,每测完1条鱼鱼体表皮后,立即解剖鱼鳃,再检测鱼鳃细胞的K+流速。
1.2.5 数据处理
实验结果采用平均值±标准误差(Mean±S.E)表示,采用单因素方差分析,以Tukey检验法进行两两比较,以P>0.05、P<0.01表示差异不显著。安全浓度按Turubell氏公式求出,计算公式为SC=0.3×48 h-LC50/(24 h-LC50/48 h-LC50)[20]。
2 结果(Results)
2.1 PrP对食蚊鱼的急性毒性效应
PrP对食蚊鱼的急性毒性实验结果如图2所示,空白组的食蚊鱼与实验开始时相比无明显变化,低浓度组的食蚊鱼的活泼性和存活率与对照组基本相似,随着浓度的增高,食蚊鱼出现中毒现象,表现为反应迟缓、游速减慢、身体逐渐失去平衡、腹部朝上。食蚊鱼的死亡率随着暴露浓度的升高而升高,随着暴露时间的延长而升高,浓度升高至11 mg·L-1时,烧杯内食蚊鱼全部死亡。PrP暴露后,食蚊鱼的24 h-LC50、48 h-LC50、72 h-LC50和96 h-LC50分别为9.70、9.63、9.45和为9.14 mg·L-1,安全浓度为2.85 mg·L-1。本实验中,24 h-LC50>48 h-LC50>72h-LC50>96 h-LC50,说明随着实验时间的延长,PrP对食蚊鱼的毒性效应提高且呈一定的时间-剂量效应,PrP的浓度与食蚊鱼反应之间的关系属于“S”型曲线关系。
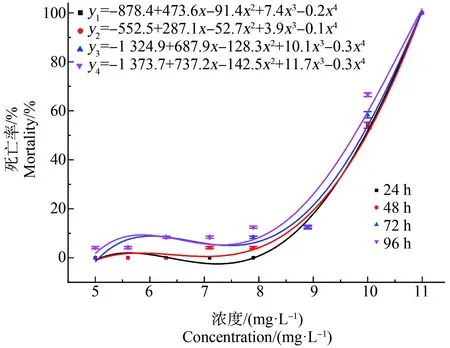
图2 对羟基苯甲酸丙脂(PrP)暴露对食蚊鱼死亡率的影响Fig. 2 Effects of propylparaben (PrP) exposure on the mortality of mosquito fish
2.2 PrP瞬时暴露后食蚊鱼K+的流速变化
在图3和表1中,鱼鳃中的K+主要处于外排状态,其中0.9 mg·L-1PrP暴露前后K+流速差别不显著(P>0.05),90%的K+流速处于-25~100 pmol·(cm2·s)-1之间(图3(a));1.8 mg·L-1PrP暴露前后K+流速差别显著(P<0.01),暴露前鱼鳃中的K+流速主要处于0~200 pmol·(cm2·s)-1之间,暴露后90%的K+流速处于0~700 pmol·(cm2·s)-1之间,PrP暴露后K+外排量增大,波动幅度增大(图3(b));4.6 mg·L-1PrP暴露前后K+流速差别显著(P<0.01),暴露前鱼鳃中的K+通量主要处于-25~200 pmol·(cm2·s)-1之间,暴露后90%的K+通量处于250~1 000 pmol·(cm2·s)-1之间(图3(c))。图3(d)中暴露前各浓度组间无显著差别(P>0.05),暴露后低浓度组与空白对照组无显著差别(P>0.05),高、中、低3个浓度组间差别显著(P<0.01),随着PrP暴露浓度的增加,鱼鳃中的K+流速波动幅度增大,K+外排量增加,呈现剂量效应;加药后10 min,4.6 mg·L-1暴露组K+外排量分别是0.9 mg·L-1和1.8 mg·L-1暴露组K+外排量的14.03倍和2.10倍,1.8 mg·L-1暴露组K+外排量是0.9 mg·L-1暴露组K+外排量的6.64倍;加药后20 min,4.6 mg·L-1暴露组K+外排量分别是0.9 mg·L-1和1.8 mg·L-1暴露组K+外排量的18.61倍和2.52倍,1.8 mg·L-1暴露组K+外排量是0.9 mg·L-1暴露组K+外排量的7.37倍。加药后第14分钟时,4.6 mg·L-1暴露组K+外排量分别是0.9 mg·L-1和1.8 mg·L-1暴露组K+外排量的21.3倍和2.7倍,1.8 mg·L-1暴露组K+外排量是0.9 mg·L-1暴露组K+外排量的8.2倍,14 min后各浓度组间K+流速差距不再增长趋于稳定。

表1 不同PrP暴露方式对食蚊鱼K+流速的影响Table 1 Influence of different PrP treatment methods on the K+ flow velocity of mosquito fish
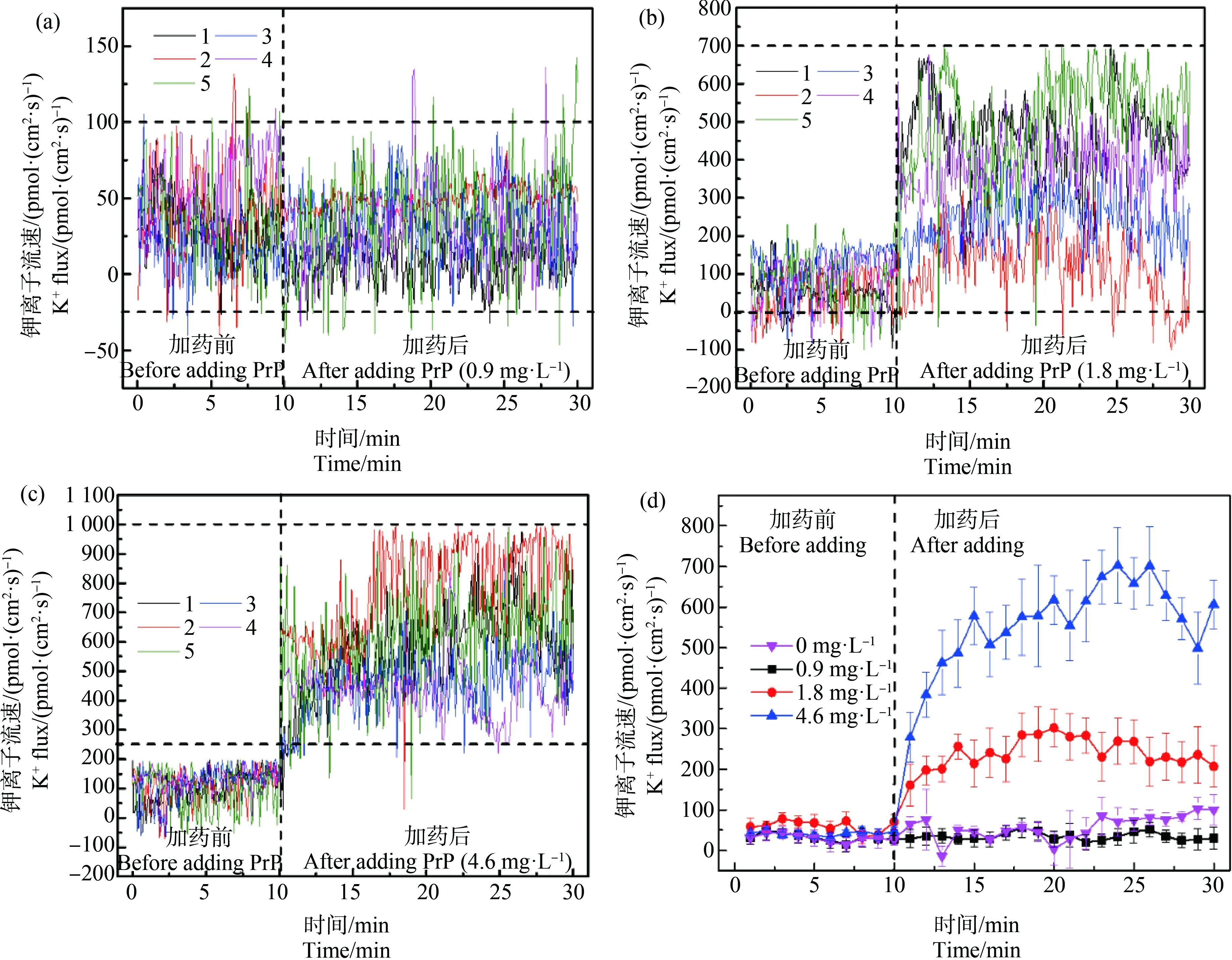
图3 PrP瞬时暴露后食蚊鱼鱼鳃K+的流速变化注:(a)、(b)和(c)分别表示不同浓度PrP (0.9、1.8和4.6 mg·L-1)瞬时暴露下鱼鳃K+流速的波动情况,图中不同颜色的折线分别表示5条 鱼鱼鳃的K+流速情况,(d)中每条折线表示不同PrP暴露组中5条鱼鱼鳃的K+流速的平均值±标准误差 (Mean ±S.E);下同。Fig. 3 Changes of K+ flow velocity in the gills of mosquito fish after PrP instantaneous exposureNote: (a), (b) and (c) respectively represent the fluctuation of the gill K+ velocity under the instantaneous exposure of different concentrations of PrP (0.9, 1.8, 4.6 mg·L-1); the polylines with different colors in the figure represent the gills K+ flow velocity of 5 fishes, and each polyline in (d) represents the average values (Mean±SEM) of the K+ flow velocity in 5 fish gills after exposed to different PrP groups; the same as follow.
在图4和表1中,鱼体表皮的K+主要处于内流状态,其中0.9 mg·L-1PrP暴露前后鱼体表皮K+流动情况差别不显著(P>0.05),90%的K+流速处于区间-400~200 pmol·(cm2·s)-1(图4(a));1.8 mg·L-1PrP暴露前后差别显著(P<0.01),暴露前鱼体表皮K+流速区间为-300~100 pmol·(cm2·s)-1,暴露后流速区间为-600~200 pmol·(cm2·s)-1,暴露后K+内流量和外排量均增加,波动较大(图4(b));4.6 mg·L-1PrP暴露前后差别显著(P<0.01),暴露前鱼体表皮K+流速区间为-400~100 pmol·(cm2·s)-1,暴露后流速区间为-600~200 pmol·(cm2·s)-1,K+内流量增大幅度大于增加的K+外排量,波动区间范围增广(图4(c))。图4(d)中低浓度组与空白对照组无显著差别(P>0.05),1.8 mg·L-1和4.6 mg·L-1处理组K+流速差异不显著(P>0.05),但均与0.9 mg·L-1处理组差异显著(P<0.01),加药后10 min,4.6 mg·L-1暴露组K+内流量是0.9 mg·L-1暴露组K+内流量的5.45倍,1.8 mg·L-1暴露组K+内流量是0.9 mg·L-1暴露组K+内流量的4.59倍;加药后20 min,4.6 mg·L-1暴露组K+内流量是0.9 mg·L-1暴露组K+内流量的4.35倍,1.8 mg·L-1暴露组K+内流量是0.9 mg·L-1暴露组K+内流量的3.73倍。

图4 PrP瞬时暴露后食蚊鱼鱼体表皮K+的流速变化Fig. 4 Changes of K+ flow velocity in fish epidermis of mosquito fish after PrP instantaneous exposure
2.3 PrP 96 h暴露后食蚊鱼K+的流速变化
在图5和表1中,PrP 96 h暴露后食蚊鱼鱼鳃的K+主要处于外排状态,空白组K+流速主要处于-25~100 pmol·(cm2·s)-1之间(图5(a));0.9 mg·L-1PrP暴露条件下90%的K+流速处于区间-25~400 pmol·(cm2·s)-1(图5(b));1.8 mg·L-1PrP暴露条件下,90%的K+流速处于区间0~500 pmol·(cm2·s)-1(图5(c));4.6 mg·L-1PrP暴露条件下,90%的K+流速处于区间-100~500 pmol·(cm2·s)-1(图5(d))。在图5(e)中各浓度组间K+流速差别显著(P<0.01),K+外排量随着暴露浓度的增大而增大,测定前10 min时4.6 mg·L-1暴露组K+外排量分别是空白对照组和1.8 mg·L-1暴露组K+外排量的9.70倍和1.21倍,1.8 mg·L-1暴露组K+外排量分别是空白对照组和0.9 mg·L-1暴露组K+外排量的8.03倍和1.93倍,0.9 mg·L-1暴露组K+外排量是空白对照组K+外排量的4.17倍;测定10 min至20 min时4.6 mg·L-1暴露组K+外排量分别是空白对照组和1.8 mg·L-1暴露组K+外排量的10.81倍和1.37倍,1.8 mg·L-1暴露组K+外排量分别是空白对照组和0.9 mg·L-1暴露组K+外排量的7.87倍和3.31倍,0.9 mg·L-1暴露组K+外排量是空白对照组K+外排量的2.38倍。
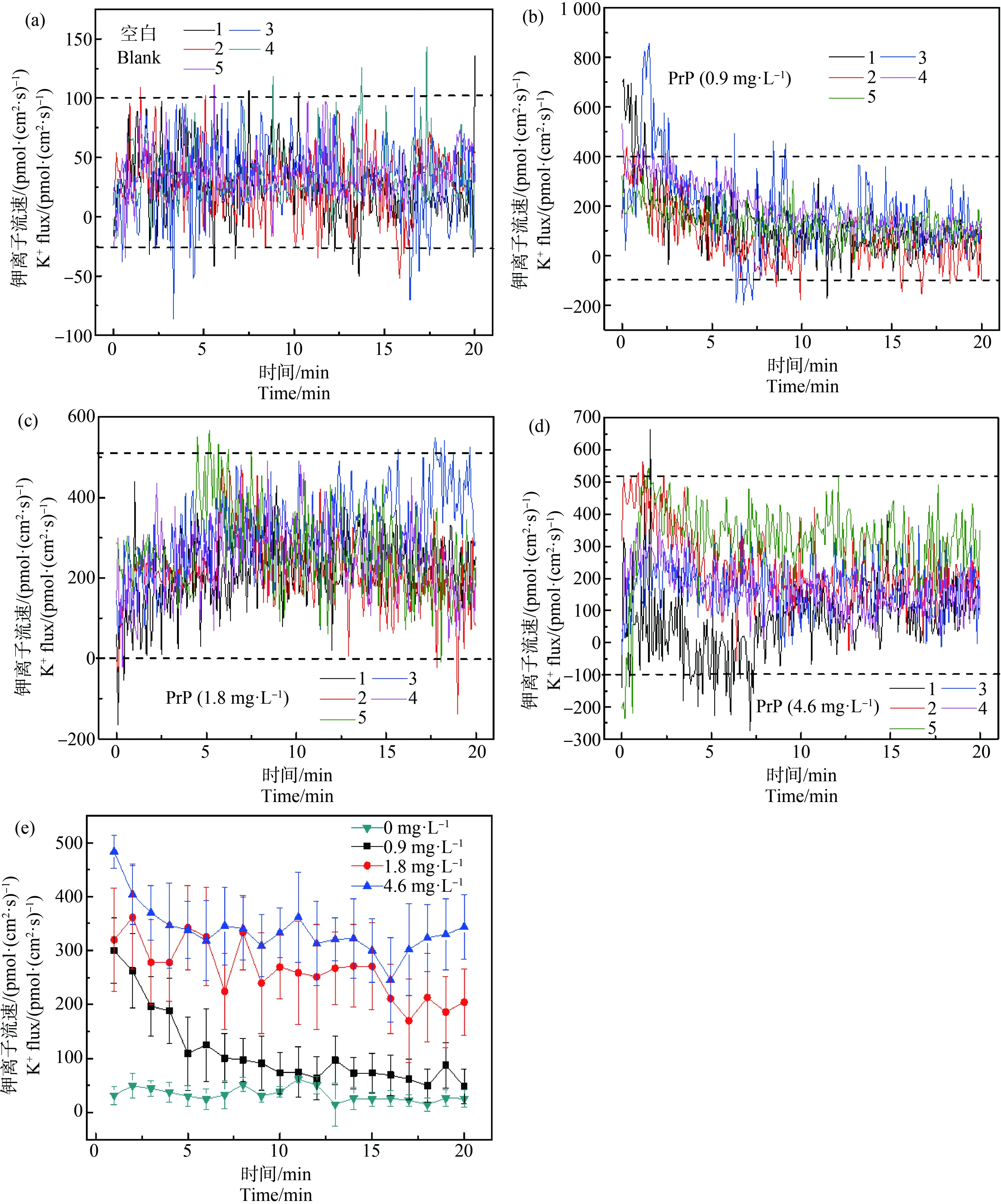
图5 PrP暴露96 h后鱼鳃K+的流速变化注:(a)、(b)、(c)和(d)分别表示空白对照组和不同浓度PrP (0.9、1.8和4.6 mg·L-1)暴露96 h后鱼鳃K+流速的波动情况,图中不同颜色的折线分别 表示5条鱼鱼鳃的K+流速情况,(e)中每条折线表示空白对照组和不同PrP暴露组中5条鱼鱼鳃的K+流速的平均值±标准误差(Mean±S.E);下同。Fig. 5 Changes of K+ flow velocity in the gills of mosquito fish after PrP 96 h exposureNote: (a), (b), (c) and (d) respectively represent the fluctuation of the gill K+ flow velocity under the 96 h exposure of different PrP concentrations (0, 0.9, 1.8, 4.6 mg·L-1); the polylines with different colors in the figure represent the gills K+ flow velocity of 5 fishes, and each polyline in (e) represents the average values (Mean±SEM) of the K+ flow velocity in 5 fish gills after exposed to different PrP groups; the same as follow.
在图6和表1中,PrP 96 h暴露后食蚊鱼鱼体表皮的K+主要处于内流状态。空白组K+流速主要处于-200~150 pmol·(cm2·s)-1之间(图6(a));0.9 mg·L-1PrP暴露组中,90%的K+流速处于区间-450~100 pmol·(cm2·s)-1(图6(b));1.8 mg·L-1PrP暴露组中,90%的K+流速处于区间-500~150 pmol·(cm2·s)-1(图6(c));4.6 mg·L-1PrP暴露组中,90%的K+流速处于区间-650~250 pmol·(cm2·s)-1(图6(d))。图6(e)中空白对照组和0.9 mg·L-1PrP暴露组K+流速无显著差异(P>0.05),其余各组间K+流速差异显著(P<0.01),K+流速跟暴露浓度出现正相关性,测定前10 min时4.6 mg·L-1暴露组分别是空白对照组和1.8 mg·L-1暴露组K+外排量的6.50倍和1.27倍,1.8 mg·L-1暴露组K+外排量分别是空白对照组和0.9 mg·L-1暴露组K+外排量的5.11倍和5.03倍;测定10 min至20 min时4.6 mg·L-1暴露组分别是空白对照组和1.8 mg·L-1暴露组K+外排量的7.94倍和1.13倍,1.8 mg·L-1暴露组K+外排量分别是空白对照组和0.9 mg·L-1暴露组K+外排量的7.03倍和7.38倍。
3 讨论(Discussion)
3.1 PrP对食蚊鱼的急性毒性效应
PrP的96 h-LC50为9.14 mg·L-1,表现为中等毒性。这与Dobbins等[21]的研究结果类似,大型溞(Daphniamagna) PrP的96 h-LC50范围在4.0~24.6 mg·L-1,黑头软口鲦(Pimephalespromelas) PrP的96 h-LC50为3.3~160.0 mg·L-1。Terasaki等[22]的研究表明,PrP对大多数水生生物都具有急性毒性效应。PrP具有亲脂性,Ding等[23]推测这种毒性效应与水辛醇分配系数有关,该衍生物越疏水毒性效应越强,由此可见,PrP对水生生物的毒性与其亲脂性有关,相对于其他对羟基苯甲酸酯类物质,PrP对水生生物类具有较强的毒性。
3.2 不同浓度PrP暴露对鱼鳃K+流速的影响
钠钾泵是Na+和K+之间进行交换的一种蛋白质载体,通过磷酸化和去磷酸化的过程发生构象的变化,导致与Na+、K+的亲和力不同,使细胞外的Na+浓度高于细胞内,细胞内K+浓度高于细胞外,每消耗一个ATP分子,逆电化学梯度泵出3个Na+和泵入2个K+。通常情况下K+的流入量和流出量是平衡的,K+的流入量增多会出现低钾血症,钾的流出量增多会出现高钾血症[24]。钠钾泵保持膜内高钾,膜外高钠的不均匀离子分布,以维持细胞内正外负的静息电位以保证细胞正常的生理活动,细胞内外K+浓度变化会导致这种离子平衡机制被破坏从而影响细胞的正常生理活动[25]。
Knudsen和Jensen[26]研究发现,鲤鱼(Cyprinuscarpio)在受到亚硝酸盐的胁迫时K+会从红细胞和骨骼肌组织中快速外排,导致细胞体积缩小,在该种环境下长期暴露最终会引发细胞衰亡。Härdig等[27]发现,造纸厂废水暴露会影响鱼类血液系统,破坏血红细胞内多种离子平衡,K+会从细胞中高速流失到细胞外造成细胞外高钾血症。本研究中,鱼鳃中的K+在PrP瞬时暴露和96 h暴露后都处于外排状态,实验结果与这些报道一致。Mardones等[19]发现,鱼鳃细胞暴露于有害鞭毛藻毒素后,藻毒素与载体蛋白相结合通过细胞膜的卵磷脂层产生脂质过氧化反应,使K+高速流出。PrP的辛醇水分配系数为3.04,具有亲脂性[28],可与细胞膜内载体蛋白相结合,通过卵磷脂层进入细胞内并最终破坏细胞膜内钠钾泵的功能。本研究中鱼鳃对PrP暴露反应敏感,可能是由于PrP进入细胞内产生脂质过氧化反应并破坏钠钾泵转运的功能,将细胞膜溶解使K+快速排出,具体机制还需进一步探究
PrP瞬时暴露实验中,鱼鳃高、中、低浓度组间K+流速差异显著,具有剂量效应,K+外排量随着PrP浓度的升高和暴露时间的延长增大;96 h PrP暴露后各实验组鱼鳃K+流速差异显著,呈现剂量效应。Flores-Lopes和Thomaz[29]的研究表明,鱼鳃有很大的外部接触面,对水环境的化学和物理变化特别敏感,流域水质恶化,水中的污染物会引起鱼鳃病变,所以鱼鳃可做为环境监测的工具。本研究中无论PrP瞬时暴露还是96 h暴露,鱼鳃的K+流速变化都呈现出显著的剂量效应,说明鳃细胞对环境中PrP的变化较为敏锐,可有效的指示水环境中的对羟基苯甲酸酯类污染物。
鱼鳃瞬时暴露和96 h暴露后K+流速差异显著,暴露方式不同对鱼鳃K+流速有一定影响。低浓度组中,鱼鳃K+流速瞬时暴露后与暴露前无显著差异,96 h暴露时低浓度组与空白组有显著差异,说明鱼鳃短时间接触低浓度PrP可能不会引起机体钠钾泵损伤,长期接触低浓度PrP会造成鱼鳃钠钾泵功能一定程度的受损。Mardones等[19]研究藻毒素对鱼鳃细胞系(RTgill-W1)的细胞膜离子转运过程的影响时发现,在加入藻毒素的后10 min内鱼鳃细胞有明显的刺激反应,但随着检测的进行,H+和K+流速变化会趋于一个稳定值;Lin等[17]也发现在加入G蛋白偶联受体5 min内,斑马鱼细胞Ca2+流速有明显的刺激反应,随着检测的进行Ca2+的流速变化亦趋于稳定。本研究中,PrP 96 h暴露实验中各浓度组K+流速在测定过程中相对稳定,瞬时暴露实验中各浓度组K+流速在测定过程中先急速升高后趋于稳定,鱼鳃在加入PrP后5 min内具有一定的应激性反应,随着测试时间的延长,应激性逐渐减弱;并且,鱼鳃在适应环境的过程中产生一定的防御机制,缓解了PrP暴露所引起的损伤。
3.3 不同浓度PrP暴露对鱼体K+流速的影响
鱼体表皮细胞暴露于PrP后,K+内流明显且波动范围大,这与Horng等[30]的研究结果一致,鱼体皮肤内层细胞在受到盐胁迫时会向外排出K+,但鱼体表皮细胞会吸收K+,可能是由于鱼体表面的角质形成细胞会主动摄取K+,平衡鱼鳃和皮肤内层细胞对K+的外排。本实验中,K+内流可能是因为鱼体表皮通过角质形成细胞的途径摄取K+,鱼体皮肤内层细胞排出的K+需要角质形成细胞从外界大量摄入K+来平衡,说明PrP对鱼体表皮细胞造成了一定的影响,导致钠钾泵功能紊乱。
PrP瞬时暴露实验中,1.8 mg·L-1和4.6 mg·L-1处理组鱼体表皮K+流速差异不显著,与0.9 mg·L-1处理组差异显著,说明PrP浓度变化对鱼体表皮K+流速有影响,钠钾泵转运功能具有ATP依赖性和饱和性,所以PrP浓度达到一定阈值后,钠钾泵对K+的转运达到最大值,PrP的浓度继续增大对K+内流速度变化影响不大。96 h PrP暴露后鱼体表皮K+流速除空白对照组和0.9 mg·L-1PrP暴露组K+流速无显著差异外,其余各组间K+流速差异显著,说明低浓度PrP没有引起鱼体表皮细胞损伤。
比较鱼体表皮瞬时暴露和96 h暴露的结果发现,低浓度组差异不显著,中浓度组和高浓度组差异显著,此外,低浓度组瞬时暴露前后差异不显著,96 h暴露前后差异亦不显著,说明低浓度组PrP短时间暴露和长期暴露都不会引起鱼体表皮K+流速的异常,可能是由于鱼体表皮具有较好的防御机制,低浓度PrP暴露对鱼体表皮细胞的钠钾泵功能无明显干扰。中高浓度组在瞬时暴露时鱼体表皮K+流速与对照组无显著差别,在96 h暴露后却与对照组差别显著,说明暴露方式不同,PrP对鱼体的损伤程度也不同。
在本实验中,PrP暴露后鱼鳃细胞和鱼体表皮细胞的钠钾泵功能都受到了一定程度的损伤,不能维持细胞内K+的正常转运过程,鱼鳃细胞均向外排出K+,鱼体表皮细胞向内吸收K+,呈现一定的剂量效应,PrP对K+流速的影响与暴露时间、暴露方式有关。相比较而言,鱼体表皮细胞抵抗PrP损伤的能力更强,鱼鳃细胞对PrP引起的损伤更敏感,具有一定的指示作用。

