环境污染物干扰鱼类体色的研究及其生态毒理学意义
杨莉,王力军,金映虹,侯宇,张春暖,张纪亮,,*
1. 河南科技大学动物科技学院,洛阳 471000 2. 海南师范大学热带岛屿生态学教育部重点实验室,海口 571158
鱼类是水生态系统中的重要组成部分。水环境污染对鱼类生长、发育以及繁殖产生的不利影响,引起了国内外学者的关注。最近,污染物对鱼类体色的影响也开始引起关注。鱼类体色具有多种功能,如伪装、威慑、物种识别、温度调节和求偶等,对其生存与成功繁殖至关重要[1]。在所有脊椎动物中,鱼类体色调控最为复杂,涉及的体色相关基因也最为丰富[2]。目前,鱼类中至少发现了6种不同的色素细胞,包括黑色素细胞、黄色素细胞、红色素细胞、虹彩细胞、蓝色素细胞和白色素细胞。加上鱼类体色还对污染物非常敏感,使其成为了一种具有巨大应用前景的污染监测生物指示物[3-5]。因此,污染物干扰鱼类体色的相关研究是一个值得挖掘的新方向。
目前,已经发现多种污染物能够干扰鱼类的体色(表1)。内分泌干扰物(雌激素、有机锡和双酚A)和对辛基苯酚均能够引起鱼类颜色强度的改变[6-12]。某些农药,如杀虫剂二氯二苯三氯乙烷(dichlorodiphenyltrichloroethane, DDT)、杀虫剂甲基对硫磷、除草剂阿特拉津和久效磷等,都在不同程度上影响鱼类体色。研究发现,DDT和阿特拉津能够减少孔雀鱼(Poeciliareticulata)体表橙色斑点的面积,降低体色的亮度;甲基对硫磷能够降低阿马里洛鱼(Girardinichthysmultiradiatus)鳍和体表颜色强度[13-15]。久效磷对孔雀鱼不同色素细胞均产生干扰作用,表现为色素颗粒显著减少、分散与溶解,黑色素细胞和黄色素细胞退化、数量减少,虹彩细胞胞膜溶解以及反射小板减少、板层变薄且间隙变得不规则甚至闭合[16]。高浓度氯氰菊酯长期暴露会增加鲤鱼(Cyprinuscarpio)的色素沉着[17]。硝酸盐能够对鱼类皮肤造成严重的组织学损伤,表皮和真皮会出现不同程度的坏死脱落,且伴随黑色素细胞和粘液细胞的分散和减少[18]。硫酸锌暴露导致印度囊鳃鲶(Heteropneustesfossilis)身体出现明显的色素沉着障碍,并伴随粘液分泌增多[19]。金属化合物三氧化二砷会引起斑马鱼(Daniorerio)皮肤粘液渗出、身体褪色[20]。虹鳟(Salmogairdneri)长期暴露于防污剂美托咪啶,颜色变浅,色素细胞发生聚集反应[21];在酸暴露下,虹鳟体色减褪[22]。Kaur和Dua[23]将淡水鱼翠鳢(Channapunctatus)暴露于废水中,发现鳞片破损、松动、脱落和钙质结构紊乱,色素细胞出现异常分散现象,色素颗粒明显减少和分散。在暹罗斗鱼(Bettasplendens)色素细胞的研究中,发现甲基汞、亚砷酸盐、威百亩(甲基二硫代氨基甲酸钠)和百草枯能够引起色素细胞聚集;杀虫脒和磷酸盐导致不同程度的色素细胞分散[24]。
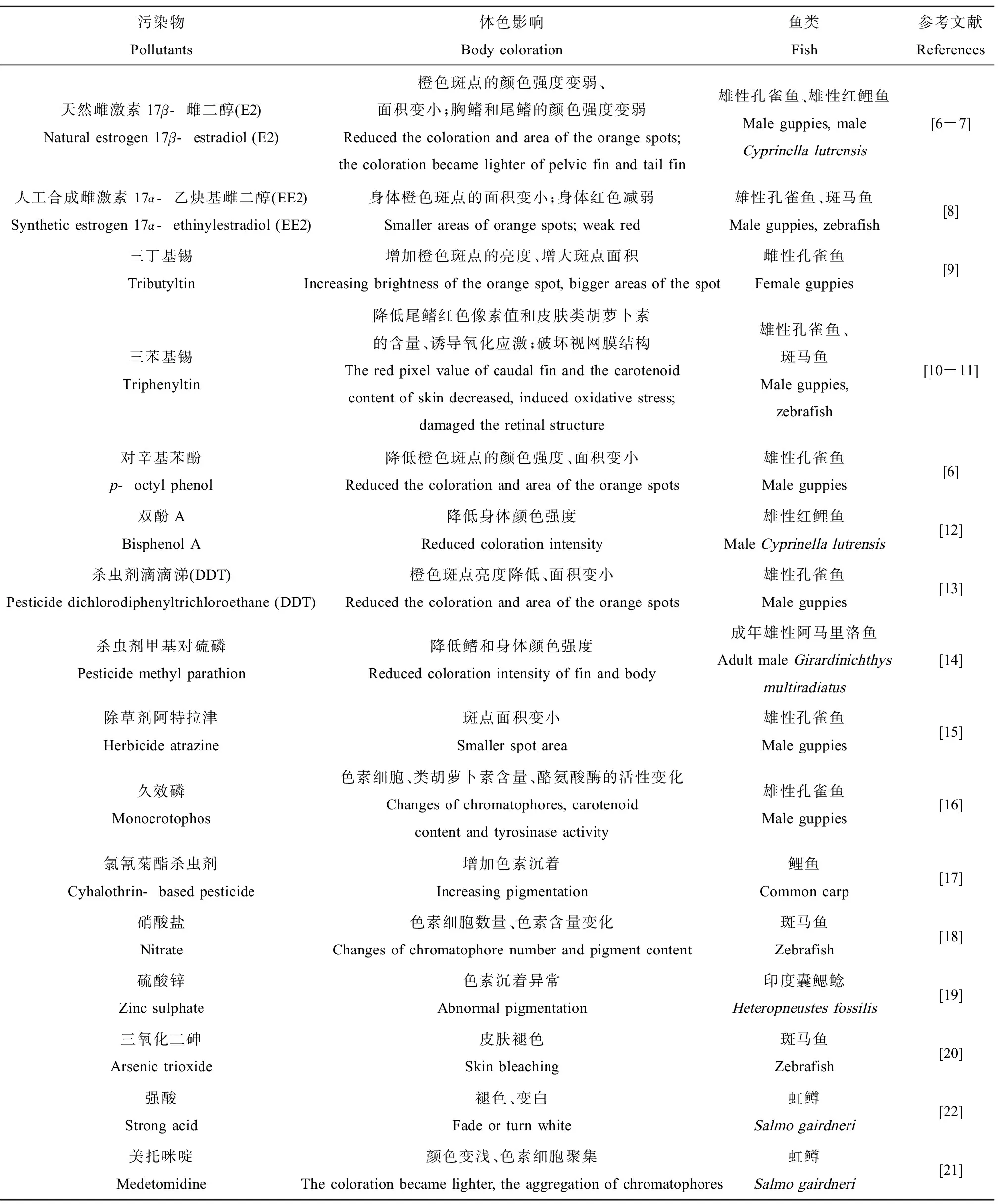
表1 污染物对鱼类体色的影响Table 1 The effects of pollutants on body coloration in fish
尽管大量研究已经证实污染物能够干扰鱼类体色,但对其潜在生理与分子机制的研究却较少。研究表明,有些污染物(双酚A、雌二醇和类黄酮等)可以调节核受体的转录活性,进而可能影响色素细胞分化和发育等过程[25-26]。另外,化学物质(重金属、芳香烃等)还可以与色素细胞的复杂分子机制相互作用。因此,在环境监测中,色素细胞被用作细胞传感器[24]。鱼类皮肤色素的合成、代谢及转运和色素细胞活动等过程都可能存在污染物的作用靶点。鉴于鱼类体色形成的分子机制较复杂,因此,对鱼类体色形成的分子基础进行系统总结,不仅有助于探究污染物干扰体色的可能靶点和毒理学机制,而且将促进体色相关生物标志物的开发及其在环境监测中的应用。
1 鱼类皮肤中主要色素的合成、代谢及转运(The synthesis, metabolism and transport of main pigments in fish skin)
鱼类拥有多种色素,储存在特定的色素细胞中,是体色呈现多样性的重要组织学基础。目前,研究较多的色素细胞主要为黑色素细胞、黄色素细胞、红色素细胞和虹彩细胞[2]。黑色素储存于黑色素细胞;呈现红色/橙色的类胡萝卜素和呈现黄色的蝶啶储存于黄色素细胞和红色素细胞;虹彩细胞不含色素,通过透明嘌呤晶体反射小板形成衍射光栅,呈现不同光泽。
1.1 黑色素
黑色素对鱼类体色表型产生重要影响,黑色素的生成被破坏会导致色素沉着度降低,甚至会引起白化病[27]。酪氨酸酶(tyrosinase, Tyr)是黑色素(鱼类仅有真黑色素)合成的关键限速酶,酪氨酸在Tyr催化下,经由多巴(dihydroxyphenylalanine, Dopa)、多巴醌和吲哚醌等形式,合成真黑色素;该过程需要Tyr、多巴色素异构酶(dopachrome tautomerase, Dct)、酪氨酸酶相关蛋白1(tyrosinase related protein 1, Tyrp1)等酪氨酸酶家族成员以及银蛋白(Silv,也称Pmel17)的参与。另外,3种黑素体转运蛋白(Oca2、Aim1和Slc24a5)对黑色素的合成也至关重要[28],如图1(a)所示。
1.2 类胡萝卜素
与其他色素不同,类胡萝卜素不能在脊椎动物体内合成,使其成为体内有限的资源[29]。脊椎动物主要通过食物摄取类胡萝卜素,转运至体表色素细胞。目前,已经发现多个基因参与类胡萝卜素的摄取(Sr-bi、Cd36)、结合与沉积(Star1、Mln64、Star4、Star5、Apod、Plin、Gsta2)以及降解(Bco2、Bcmo1)[30],如图1(b)所示。
1.3 蝶啶
蝶啶不仅与黄色体色有关,其合成中间产物四氢生物蝶呤还可作为酪氨酸合成的辅助因子调控黑色素合成[31]。蝶啶合成包括3个分途径:鸟嘌呤(guanosine triphosphate, GTP)环化水解酶I(GTP cyclohydrolase 1, Gch1)、6-丙酮酰四氢喋呤合成酶(6-pyruvoyltetrahydropterin synthase, Pts)和墨蝶呤还原酶(sepiapterin reductase, Spr)以GTP为底物,从头合成四氢生物蝶呤;四氢生物蝶呤的再生,涉及蝶呤-4-氨基甲酰胺脱水酶(pterin-4-alpha-carbinolamine dehydratase, Pcbd)和二氢蝶啶还原酶(dihydropteridine reductase, Dhpr);墨喋呤及衍生物的合成,主要涉及Spr和黄嘌呤氧化酶/黄嘌呤脱氢酶(xanthine oxidase, Xod/xanthine dehydrogenase, Xdh)[31],如图1(c)所示。另外,Gch1还参与黑色素细胞和黄色素细胞分化;Pcbd复合物的转录靶标是酪氨酸酶启动子,影响黑色素细胞分化[31-32]。
1.4 晶体反射小板(GTP与水结晶形成)
GTP除了作为蝶啶合成中的重要底物外,还是虹彩细胞晶体反射小板的主要组成成分,而Xod/Xdh也是嘌呤分解代谢的关键限速酶[33],如图1(d)所示。虹彩细胞通过嘌呤核苷磷酸化酶(purine nucleoside phosphorylase 4a, Pnp4a)把鸟嘌呤核苷转化为GTP,Slc23l参与GTP的运输[34-35]。另外,嘌呤合成酶(Gart、Paics、Ppat、Pfas、Atic和Adsl等)[35-36]以及嘌呤代谢相关基因(Ada2、Prtfdc1和Slc2a9)[37]均可能影响GTP的水平。
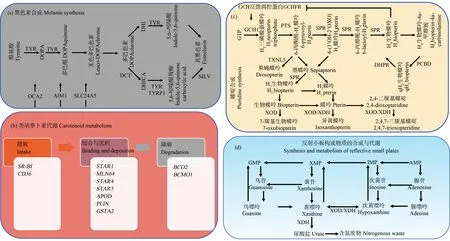
图1 鱼类色素细胞色素或呈色物质合成与代谢过程Fig. 1 The synthesis and metabolism of pigments or colored substances in fish
2 鱼类色素细胞的发育与迁移(The development and migration of fish chromatophores)
除视网膜上皮,色素细胞均源于与外周神经系统背根神经节相关的神经嵴细胞[38]。色素细胞模式形成包括细胞模式的发育(如增殖、分化、迁移以及死亡)以及色素的合成与表达[39]。深刻认识色素细胞模式形成有关基因,对研究鱼类体色形成的分子机制,特别是体表斑纹图案形成,具有重要意义[40-42]。神经嵴细胞向色素细胞的分化由一系列细胞内和细胞外信号分子共同调控[43]。
目前,鱼类色素细胞迁移与分化的研究主要以斑马鱼为研究对象。斑马鱼神经嵴细胞依靠Erbb3b增殖,有一部分胚后祖细胞衍生物在Tuba813a作用下迁移到皮下组织,产生成鱼模式的色素细胞(图2)。该祖细胞具有分化为3种色素细胞的潜能,且大部分色素细胞都来源于胚后祖细胞;集落刺激因子1受体a (colony stimulating factor 1 receptor a, Csf1ra)决定黄色素细胞的命运;小眼畸形相关转录因子a (microphthalmia-associated transcription factor a, Mitfa)决定黑色素细胞的命运,干细胞因子受体a (stem cell factor receptor a, Kita)促进成鱼黑色素细胞前体的分化、存活;白细胞受体酪氨酸激酶(leukocyte receptor tyrosine kinase, Ltk)促进虹彩细胞的分化和存活[44]。此外,部分色素细胞直接来源于迁移的神经嵴细胞,如胚胎或者早期幼鱼黑色素细胞会持续到成鱼阶段,且颜色与新分化的黑色素细胞相比偏棕色;幼鱼黄色素细胞命运的决定依靠Csf1r,同时Pax7促进黄色素细胞的发育,前期会失去色素,进入隐蔽期,而在成鱼期,依靠Csf1ra重新获得色素(图2)。色素细胞沿着背根神经节、横隔膜、纵隔膜迁移到真皮,并按照一定的顺序排列[44-45]。另外,Pcdh10、Igsf11和Erbb等能促进色素细胞或前体细胞的迁移[46-48]。色素细胞前体和色素细胞会因各种因子(Bcl、Gu和Ednrb等)而增殖,并可能依赖这些因子而存活[48]。随着分子生物学技术以及组学技术的发展,已经筛选出大量与色素细胞发育与迁移相关的基因(表2),有待于进一步的研究。
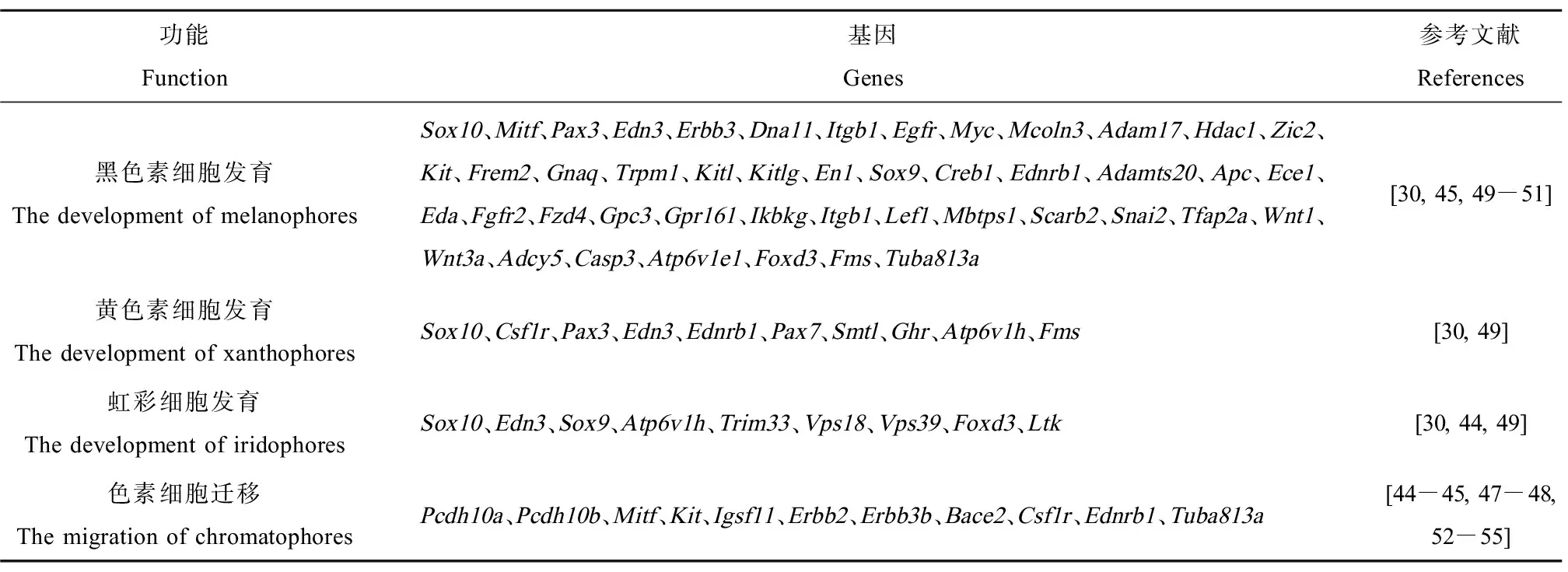
表2 色素细胞发育和迁移相关基因Table 2 The genes related to the development and migration of chromatophores
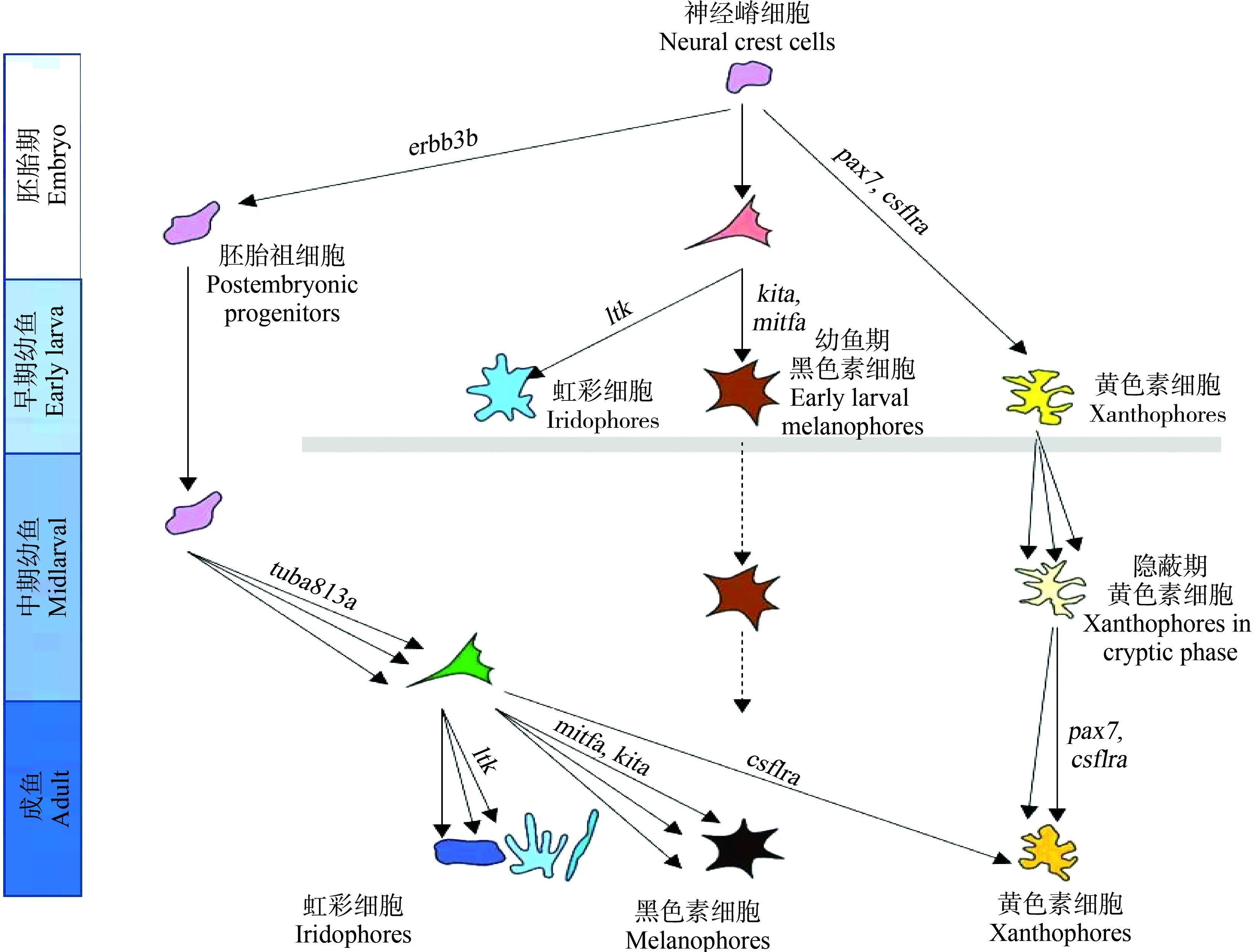
图2 斑马鱼色素细胞的迁移与分化(仿Patterson和Parichy[44])Fig. 2 The migration and differentiation of chromatophores in zebrafish (Imitating Patterson and Parichy[44])
3 鱼类体色调控机制(The regulatory mechanisms of body coloration in fish)
3.1 神经调控-黑素皮质素系统
鱼类可通过生理体色变化和形态体色变化2种方式对体色进行调控。生理体色变化基于色素体在色素细胞内的聚集或分散,一般由短期的环境因素刺激(包括光照、温度等)引起,通过交感神经系统和内分泌系统共同调控[56]。已经证实,在光照刺激下,去甲肾上腺素和黑色素聚集素(melanin-concentrating hormone, Mch)可诱导色素体聚集[57-59]。Mch不仅聚集色素体,而且抑制α-促黑细胞刺激素(α-melanocyte stimulating hormone,α-Msh)的分散活性,甚至抑制α-Msh的释放,阻止黑色素体的分散。形态体色变化是由色素和色素细胞的组成、数量和形态等共同决定的,由长期刺激诱导,如长期的光照等[33]。研究表明,鱼类在长期适应浅色或深色背景的过程中,机体可以通过减少或增加色素细胞的数量等改变体色[60-61]。在长期刺激过程中,黑色素细胞对Mch的敏感性降低;α-Msh的调节作用似乎占主导地位,α-Msh不仅参与黑色素体的扩散,而且参与黑色素细胞的发育[59]。
鱼类黑素皮质素系统不仅调控色素的分散或聚集;还通过调控色素合成,参与形态学体色变化[2](图3)。黑素皮质素1受体(melanocortin 1 receptor, Mc1r)以及其激动剂α-Msh和内源拮抗剂刺鼠信号蛋白(agouti signaling protein, Asip)是体色调控的主要因子[62]。α-Msh在垂体中合成,通过与皮肤黑色素细胞、黄色素细胞以及虹彩细胞等色素细胞膜上Mc1r结合而激活色素细胞扩散以及色素的合成[63];而Asip则主要参与背腹体色模式的调控[64]。在黑色素细胞中,激活的Mc1r不仅可以通过环磷酸腺苷(cAMP)通路介导色素的扩散,而且可以影响黑色素合成相关基因(Tyr、Tyrp1)的表达,产生更多的黑色素。黄色素细胞中色素扩散和黑色素相似。在虹彩细胞中,目前确定了cAMP对色素分散的促进作用[63]。
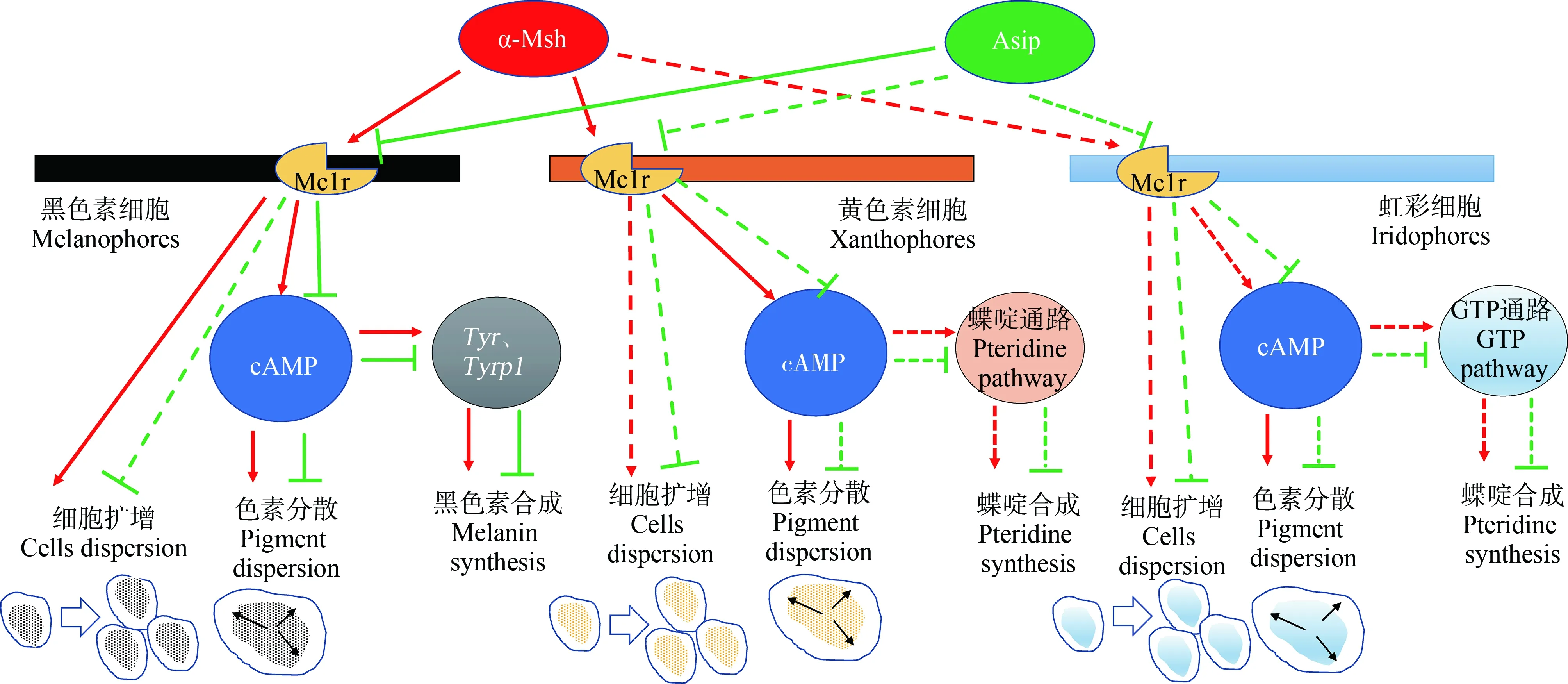
图3 鱼类黑素皮质素系统对体色的调控机制注:↑代表诱导或刺激;┬代表抑制;虚线代表未确定。Fig. 3 The regulation mechanism of melanocortin system on body coloration in fishNote: ↑ stands for inducing or stimulating; ┬ stands for inhibition; the dotted line represents uncertainty.
3.2 “类胡萝卜素权衡”假说
除在体色中具有重要作用外,类胡萝卜素在抗氧化系统中也起重要作用[65]。然而,类胡萝卜素不能在脊椎动物体内合成,只能通过摄食获得,使其在体内成为一种有限的资源。研究发现,类胡萝卜素优先参与抗氧化作用中,只有多余的类胡萝卜素才用于装饰体色[66]。因此,在脊椎动物机体内,存在通过竞争类胡萝卜素来实现抗氧化系统和装饰体色之间的分配权衡[65]。“类胡萝卜素权衡”假说得到了2类实验的支持:一类是,类胡萝卜素补充剂能增加着色、免疫以及抗氧化能力;另一类是,通过胁迫诱导的氧化应激,导致类胡萝卜素的重新分配和减少类胡萝卜素色素的着色。
3.3 光传导和视觉系统
在视网膜光传导中,视蛋白作为光感受器发挥重要作用,是光传导的基础。视蛋白的激活分别导致下游转导蛋白(G-protein transducin)和磷酸二酯酶(phosphodiesterase)的活化,随后伴随着胞质信使环磷酸鸟苷(cGMP)的减少和感光细胞的激活,从而对光刺激作出反应,如视网膜接受光刺激后调节α-Msh的分泌[67]。此外,除视网膜外,某些脊椎动物皮肤可以直接转换光信号,作为体色变化反应的一部分[68-71]。目前,在多种体色改变的鱼类皮肤中,已经发现了视蛋白转录产物[72-73]。研究表明,鱼类的体表色素细胞可以感光,这也提示皮肤光感受器在体色变化的调控中具有一定的作用[70]。目前,研究认为维生素A衍生的发色团与视蛋白结合,可能是鱼类皮肤光传导的基础[67]。
视觉缺陷会干扰黑色素细胞分化所需的内分泌信号通路[2]。营养不足和环境刺激都会导致眼睛视网膜缺陷。如,饲料中脂肪酸二十二碳六烯酸、二十碳五烯酸和维生素A的比例不足会干扰鱼类视网膜中视紫红质的合成[74-75],这种缺陷能够影响从视网膜到中枢神经系统的信号传输,而这种信号是诱导垂体产生Msh所必需的[76]。另外,视觉缺陷的鱼类无法适应背景。在背景适应过程中,鱼类根据环境光线水平调整皮肤中色素的分布,而视网膜到下丘脑的直接投射是鱼类背景适应中信号输入的基础[77]。所以,视觉系统与神经系统之间的联系是鱼类体色变化调控的重要机制之一(图4)。
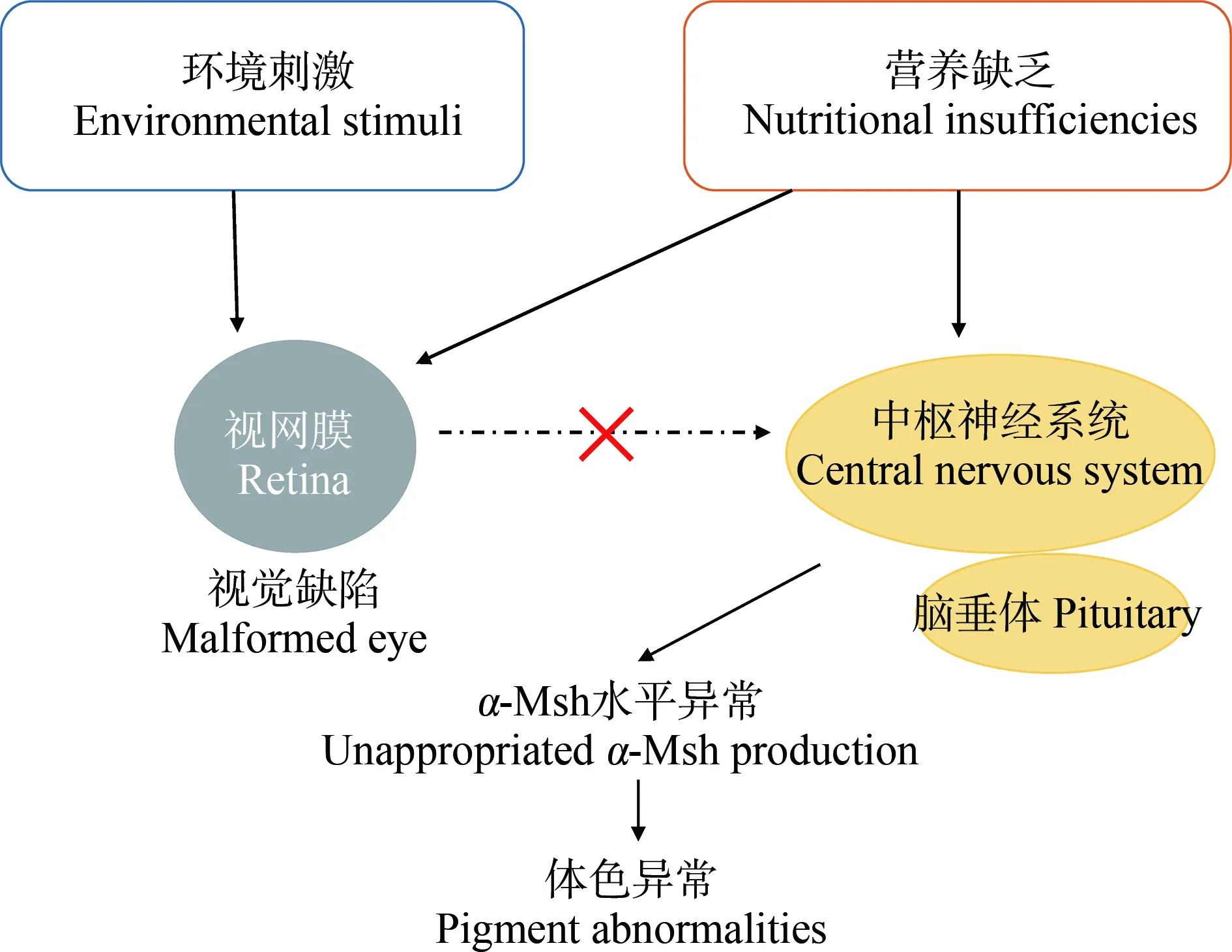
图4 视觉缺陷诱导鱼类体色异常机制图Fig. 4 Schematic of the malpigmentation based on visual defects
鱼类体色调控机制是维持鱼类正常体色的前提,同时也是研究污染物对鱼类体色毒理学机制的重要切入点。已经有研究表明,有机污染物(多氯联苯、全氟烷氧烷和双酚A等)能影响机体神经和内分泌系统、氧化应激和视网膜结构,这些变化均可能会干扰体色的调控[78]。相关研究亟待进一步的开展与完善。
4 污染物干扰鱼类体色的机制研究(Research on the mechanisms of pollutants interfering with fish body coloration)
根据目前的研究,污染物干扰鱼类体色的机制主要包括干扰神经和内分泌系统、影响色素合成或代谢、诱导氧化应激、影响视网膜结构与功能以及干扰色素细胞的分化、迁移与发育等。
环境内分泌干扰物可能主要通过干扰性激素水平影响体色,如17β-雌二醇(17β-estradiol, E2)、17α-乙炔基雌二醇(17α-ethinylestradiol, EE2)均能抑制孔雀鱼与斑马鱼第二性特征,即交配体色,且这种影响似乎是不可逆的[6-8,79]。另外,金属离子镉污染也能够诱导睾酮水平增加,增强体色,促进鱼类的成功繁殖[80-81]。DDT同系物对非洲蟾蜍(Xenopustropicalis)和芦苇蛙(Hyperoliusargus)内分泌系统产生负面影响,导致个体皮肤颜色的变化[82]。砷暴露会干扰鱼类神经系统的分泌活动,影响色素细胞的结构和数量[83]。
污染物能够干扰脊椎动物色素的合成或代谢。目前,在这方面的研究主要集中在黑色素和类胡萝卜素。污染物能够直接影响黑色素合成途径,既可以促进黑色素的合成[84-85],也可以抑制黑色素的合成[86]。甲基汞能够通过竞争性阻止铜辅助因子的结合来抑制酪氨酸酶的活性,从而导致黑色素的合成减少[87]。除草剂诱导机体内谷胱甘肽减少,而循环中的谷胱甘肽能够抑制真黑色素的合成[4]。酸胁迫下,虹鳟体色较浅甚至变白、透明,主要通过抑制多巴色素氧化脱羧作用,抑制5,6-二羟基吲哚的合成,从而合成更少的黑色素,同时还能够诱导黑色素合成相关酶的失活[22]。金属污染(铅和镉等)能够促进黑色素和类胡萝卜素体色相关基因的表达[81,88]。基于类胡萝卜素的体色不仅受重金属的影响,而且受有机污染物的影响。有机磷杀虫剂甲基对硫磷可以影响类胡萝卜素的沉积,对胚胎期的阿马里洛鱼产生长期影响,甚至持续到成鱼期[14]。
在我们的研究中,环境水平的三苯基锡(triphenyltin, TPT)抑制雄性孔雀鱼的交配体色,并因此降低雄性求偶过程中的性吸引力[10]。一般认为睾酮水平的增加与雄鱼交配体色的形成有关。有意思的是,TPT暴露后,虽然睾酮水平增加,雄性孔雀鱼的体色却表现出褪色,这提示TPT对体色的影响可能涉及其他机制。我们还发现TPT诱导了雄性孔雀鱼产生氧化应激。根据“类胡萝卜素权衡”假说,可以推断,相对于装饰体色,TPT暴露的雄性孔雀鱼可能优先考虑氧化应激补偿,进而导致皮肤中类胡萝卜素含量的降低,体色减褪(图5)。
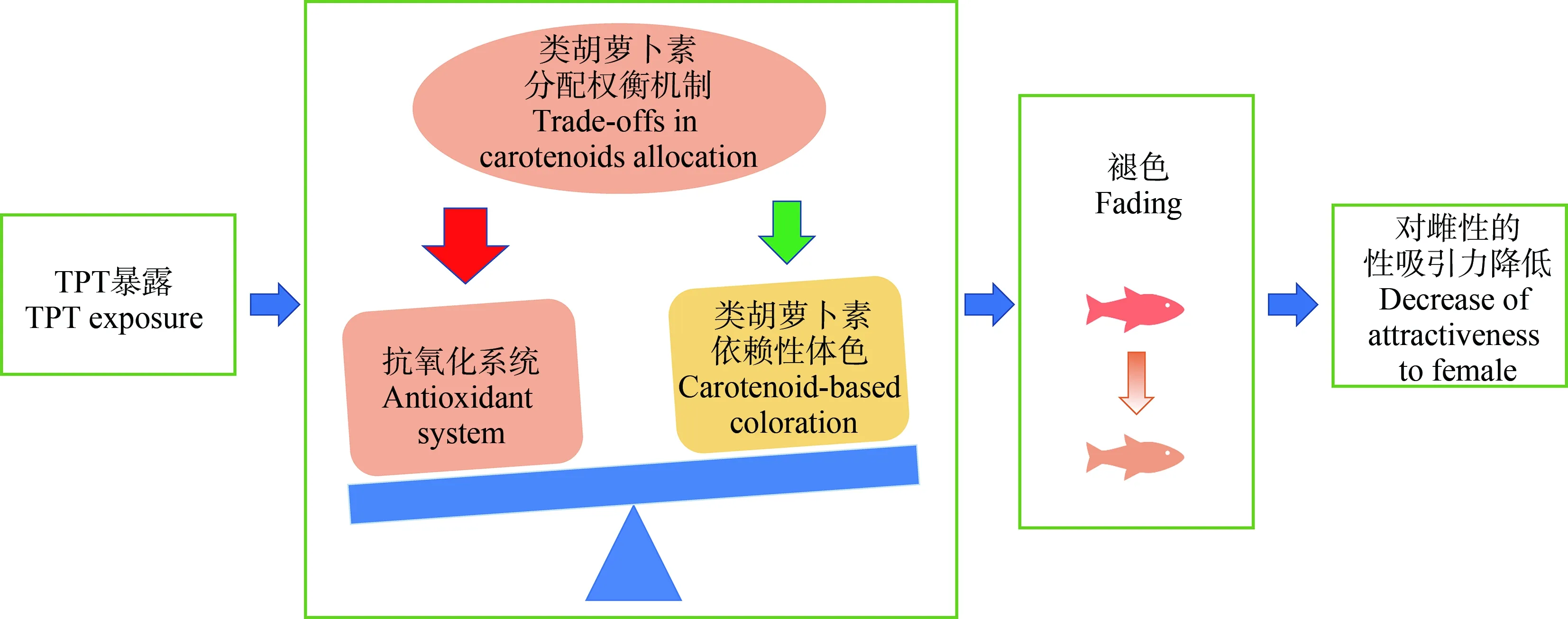
图5 三苯基锡(TPT)干扰鱼类体色的“类胡萝卜素权衡”机制(仿Zhang等[10])Fig. 5 Fish exposed to triphenyltin (TPT) change their body coloration through the “carotenoid trade-off” hypothesis (Imitating Zhang et al[10])
另外,研究表明,TPT和双酚S能够破坏鱼类视网膜结构,可能影响视网膜的光传导,进而导致体色改变[11,89]。在胚胎发育期,TPT能够引起非洲爪蟾胚胎黑色素的部分或完全丧失,降低黑色素细胞的正常树突延伸,并破坏黑色素细胞的正常迁移[90];TPT能够干扰斑马鱼幼鱼黑色素分布,正常幼鱼黑色素聚集成点状斑,覆盖背部小面积区域,而TPT暴露的幼鱼黑色素则广泛分布于背部[11]。
5 小结与展望(Summary and prospects)
污染物可通过影响发育、生理、行为、繁殖成功和生存,对鱼类产生有害的影响,并可能最终影响鱼类种群数量。通过物种间相互作用(猎物-捕食等),污染物可能会造成严重的生态危害[91]。目前,污染物对鱼类体色分子机制的研究亟需深入开展,促进鱼类体色基础生物学的发展以及相关生物标志物的开发。在鱼类体色形成的分子基础研究上,利用基因组学和蛋白组学技术,我们可以借助表型/化学反应数据在一定程度上推断污染物作用于鱼类体色形成的靶点和毒理学机制。
污染物对鱼类的影响均能够通过体色的变化进行直观地观察和预测,这依赖于鱼类体色较高的可塑性以及对外界环境的高敏感性。目前,鱼类抗氧化酶、乙酰胆碱和卵黄蛋白原等作为水环境污染的早期预警生物标志物被广泛关注。然而对鱼类体色相关分子标志物的研究尚处于起步阶段。有研究者曾提出鱼类黑色素细胞可作为快速、可靠的水中重金属污染物的生物标志物,鳞片作为水污染的指示物[23,83]。鱼类包含脊椎动物中最多的色素细胞,体色涉及的基因数量在脊椎动物中也最为丰富,然而我们对鱼类体色涉及的分子机制认识还远远不够。因此,亟需深入研究鱼类体色的分子基础,有助于从庞大的体色相关基因库中筛选具有应用前景的生物标志物,促进其在环境监测中的应用。
在将来的研究中,还需研究和建立代表性鱼类的颜色基准,发展鱼类体色检测技术。另外,体色相关生物标志物的开发,不仅要以生理、发育等指标的变化为依据,而且还要从体色形成的分子层面探究相关基因或通路表达的变化,同时还需考虑多物种性和生物指标的多样性,这样才能使结果更具全面性、有效性和综合性。随着分子生物学与图像视频技术等不断发展,将促进鱼类体色及相关分子标志物在水环境污染监测中的应用。

