可德兰多糖-阿魏酸接枝共聚物的制备工艺优化
王紫薇,蔡吴丹,闫景坤
(江苏大学食品与生物工程学院,江苏镇江 212013)
可德兰多糖是一种由微生物发酵产生的胞外多糖[1],在食品领域可用作稳定剂、增稠剂等[2],但由于其刚性的三螺旋结构使其不溶于冷水[3],进而限制了其在食品工业中的应用。可德兰多糖分子内和分子间氢键的相互作用是其不溶于水的主要原因,但是可德兰多糖分子链上又存在大量的羟基[4],可通过对羟基进行化学修饰,来获得具有独特理化性质和生物活性的可德兰多糖衍生物。目前,可德兰多糖的化学改性方法主要包括羧甲基化[5]、氧化[6]、硫酸化[7,8]、磷酸化、阳离子化等。
近年来,多糖-酚酸接枝共聚的方法因其具备不仅能结合酚酸类化合物和多糖的优点,还可以赋予接枝共聚物新的功能与特性的特点而备受关注。目前,用于制备接枝共聚物的方法主要包括:碳二亚胺化学交联法、酶催化接枝法、电化学法和自由基介导接枝法[9]。其中,自由基介导接枝法因具有经济、环保、安全以及可避免酚酸在反应过程中的降解和氧化等优点[10],已成功用于许多多糖-酚酸接枝共聚物的制备,如菊粉-没食子酸[11]、壳聚糖-咖啡酸[12]、壳聚糖-阿魏酸[13]、普鲁兰-阿魏酸[14]等。
因此,为了改善可德兰多糖的理化特性,拓宽其在食品工业中的应用范围。本文采用自由基介导的接枝方法制备可德兰多糖-阿魏酸(FA)接枝共聚物。通过单因素试验,研究FA 添加量、H2O2浓度、Vc添加量及反应时间对可德兰多糖-FA 接枝共聚物接枝率和得率的影响;在此基础上,采用L9(34)正交试验设计优化可德兰多糖-FA 接枝共聚物制备的工艺参数,确定最佳制备工艺条件和最高接枝率。此外,通过紫外光谱和红外光谱对可德兰多糖-FA 接枝共聚物进行定性分析。
1 材料与方法
1.1 材料与试剂
可德兰多糖购于日本Wako Pure 化学公司;FA、福林酚试剂(Folin-Ciocalteu)购于美国Sigma 公司;过氧化氢(H2O2)购于上海阿拉丁试剂有限公司;维生素C(Vc)、无水Na2CO3、NaOH 等购于国药集团化学试剂有限公司;超纯水,实验室自制。
TE-124 型电子天平,赛多利斯科学仪器(北京)有限公司;BS-124S 型分析天平,赛多利斯科学仪器(北京)有限公司;PHS-3C pH 计,上海理达仪器厂;真空冷冻干燥机,宁波新芝生物科技股份有限公司;台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;Nexus670 红外光谱仪,美国Nicolet 仪器公司;UV-1601 紫外可见分光光度计,北京瑞利分析仪器公司。
1.2 试验方法
1.2.1 可德兰多糖溶液的制备
可德兰多糖溶液的制备参照Li 等[15]的碱溶酸中和处理的方法,并稍作修改。将2 g 可德兰多糖溶解在200 mL 1.0 mol 的NaOH 溶液中,在室温条件下磁力搅拌6 h,直至可德兰多糖完全溶解,然后用等体积的1.0 mol HCl 溶液将溶液调至中性,放置4℃冰箱过夜,使其充分水化,备用。
1.2.2 可德兰多糖-FA 接枝共聚物的制备
可德兰多糖-FA 接枝共聚物的制备参照Liu 等[16]的方法,并稍作修改。准确量取25 mL 5 mg/mL 水化完全的可德兰多糖溶液于三颈瓶中,分别加入不同质量的Vc 和FA,在氮气保护下先磁力搅拌30 min,然后逐滴加入1 mL 不同浓度的H2O2溶液,在氮气保护下反应不同的时间。反应结束后,用4 倍体积95%乙醇沉淀,放入4℃冰箱中静置过夜,8000 r/min 离心10 min,收集沉淀,用去离子水复溶、蒸馏水透析(分子截留量:6~8 ku)48 h,冻干,即得接枝共聚物固体。接枝共聚物的得率按式1 计算:

其中,m1为可德兰多糖的添加量,mg;m2为FA 的添加量,mg;M为冻干后接枝共聚物的质量,mg。
1.2.3 接枝率的测定
根据Folin-Ciocalteu 法测定可德兰多糖-FA 接枝共聚物的接枝率[17]。准确配制0.1 mg/mL 的样品溶液15 mL,取4 mL 样品溶液于试管中,加入1 mL 0.2 M Folin-Ciocalteu 试剂,充分混匀,3 min 后,加入3 mL 2%的Na2CO3溶液,间断性振摇2 h。在4000 r/min 的条件下离心8 min,于760 nm 下测定样品溶液的吸光值,每个样品重复测三次。在相同条件下,制作FA的标准曲线,制得标准曲线的回归方程为y=0.0257x+0.0082(R2=0.9991)。接枝率按式2 计算得到。

其中,m1为可德兰多糖-FA 接枝共聚物中FA 的质量;m2为接枝共聚物的质量。
1.2.4 单因素试验
1.2.4.1 FA 的添加量
保持Vc 的加入量(50 mg)、H2O2浓度(5 mol/L)以及可德兰多糖溶液的浓度与体积(25 mL,5 mg/mL)不变,根据FA 与可德兰多糖的质量比,添加不同质量的FA(100、150、200、250、300 mg),在氮气保护的条件下反应8 h 后,得到五种不同的混合溶液,分别经过醇沉、离心、复溶、透析、冻干,得到不同FA 添加量的可德兰多糖-FA 接枝共聚物。计算接枝共聚物的得率,并采用Folin-Ciocalteu 法测定接枝共聚物的接枝率。
1.2.4.2 Vc 的添加量
保持FA 的加入量(200 mg)、H2O2浓度(5 mol/L)和可德兰多糖溶液的体积与浓度(25 mL,5 mg/mL)不变,加入不同质量的Vc(30、40、50、60、70 mg),在氮气保护的条件下反应8 h 后,得到五种不同的混合溶液,分别经过醇沉、离心、复溶、透析、冻干,得到不同Vc 添加量的可德兰多糖-FA 接枝共聚物。计算接枝共聚物的得率,并采用Folin-Ciocalteu 法测定接枝共聚物的接枝率。
1.2.4.3 H2O2的浓度
保持FA 的加入量(200 mg)、Vc 的加入量(50 mg)以及可德兰多糖溶液的体积与浓度(25 mL,5 mg/mL)不变,添加不同浓度的H2O2溶液(1、3、5、7、9 mol/L),在氮气保护的条件下反应8 h 后,得到五种不同的混合溶液,分别经过醇沉、离心、复溶、透析、冻干,得到不同H2O2添加量的可德兰多糖-FA 接枝共聚物。计算接枝共聚物的得率,并采用Folin-Ciocalteu 法测定接枝共聚物的接枝率。
1.2.4.4 反应时间
保持FA 的加入量(200 mg)、Vc 的加入量(50 mg)、H2O2浓度(5 mol/L)以及可德兰多糖溶液的体积与浓度(25 mL,5 mg/mL)不变,在氮气保护的条件下,经过不同的反应时间(1、4、8、12、16 h),得到五种不同的混合溶液,分别经过醇沉、离心、复溶、透析、冻干,得到不同反应时间的可德兰多糖-FA接枝共聚物。计算接枝共聚物的得率,并采用Folin-Ciocalteu 法测定接枝共聚物的接枝率。
1.2.5 正交试验设计
根据单因素试验的结果,可初步确定每组单因素中的最优条件。为了得到更高接枝率的可德兰多糖-FA 接枝共聚物,以接枝率为指标,选取每组单因素中最佳水平附近的点,进行L9(34)正交试验,对可德兰多糖-FA 接枝共聚物的制备工艺进行优化。
1.2.6 紫外光谱分析
准确称取制得的接枝共聚物溶于去离子水中,配制0.1 mg/mL 的可德兰多糖-FA接枝共聚物的水溶液,将可德兰多糖溶于1 mol/L 的NaOH 溶液中,配制0.1 mg/mL 的可德兰多糖溶液,同时用无水乙醇配制0.01 mg/mL 的FA 溶液,在200~400 nm 波长范围内进行紫外扫描分析。
1.2.7 FT-IR 分析
处理前后的可德兰多糖以及阿魏酸的FT-IR 通过Nicolet 670 FT-IR 光谱仪进行测定。称取1 mg 可德兰多糖样品、FA 和可德兰多糖-FA 接枝共聚物,样品与溴化钾按照质量比1:100 进行混合,压片,在500~4000 cm-1的波长范围内扫描,分辨率为4 °/min。
1.2.8 水溶性的测定
可德兰多糖-阿魏酸接枝共聚物水溶性的测定参照Bai[18]的方法。准确称取100 mg 可德兰多糖-阿魏酸接枝共聚物固体溶解于5 mL 去离子水中,在室温下搅拌12 h,然后在转速为8000 g 的条件下离心10 min,除去未溶解的可德兰多糖-阿魏酸接枝共聚物固体,将上清液在105℃下烘干至恒重,按式(1.3)计算可德兰多糖-阿魏酸接枝共聚物的水溶性。

其中,m 为上清液中可德兰多糖-阿魏酸接枝共聚物的质量;M 为初始可德兰多糖-阿魏酸接枝共聚物固体的质量。
1.3 统计分析
每个试验重复三次,采用Excel、SPSS和OriginPro 8.5 软件对试验数据进行分析处理。
2 结果与分析
2.1 可德兰多糖-FA 接枝共聚物的形成机理
在多糖-酚酸接枝共聚物的制备方法中,Vc/H2O2氧化还原对因具有经济环保、价格低廉等优点而被广泛使用[10,19]。在本研究中,利用Vc/H2O2氧化还原对,在氮气保护下,通过自由基介导的方式,将FA 成功接枝到可德兰多糖上,其合成机理如图1 所示[20]。Vc与H2O2在室温下反应生成Asc·-和·OH。然后,生成的这些自由基(Asc·-和·OH)攻击可德兰多糖羟基中的氢原子,从而在可德兰多糖链中形成大分子自由基。最后,FA 分子通过共价键的方式与可德兰多糖大分子自由基形成可德兰多糖-FA 接枝共聚物。
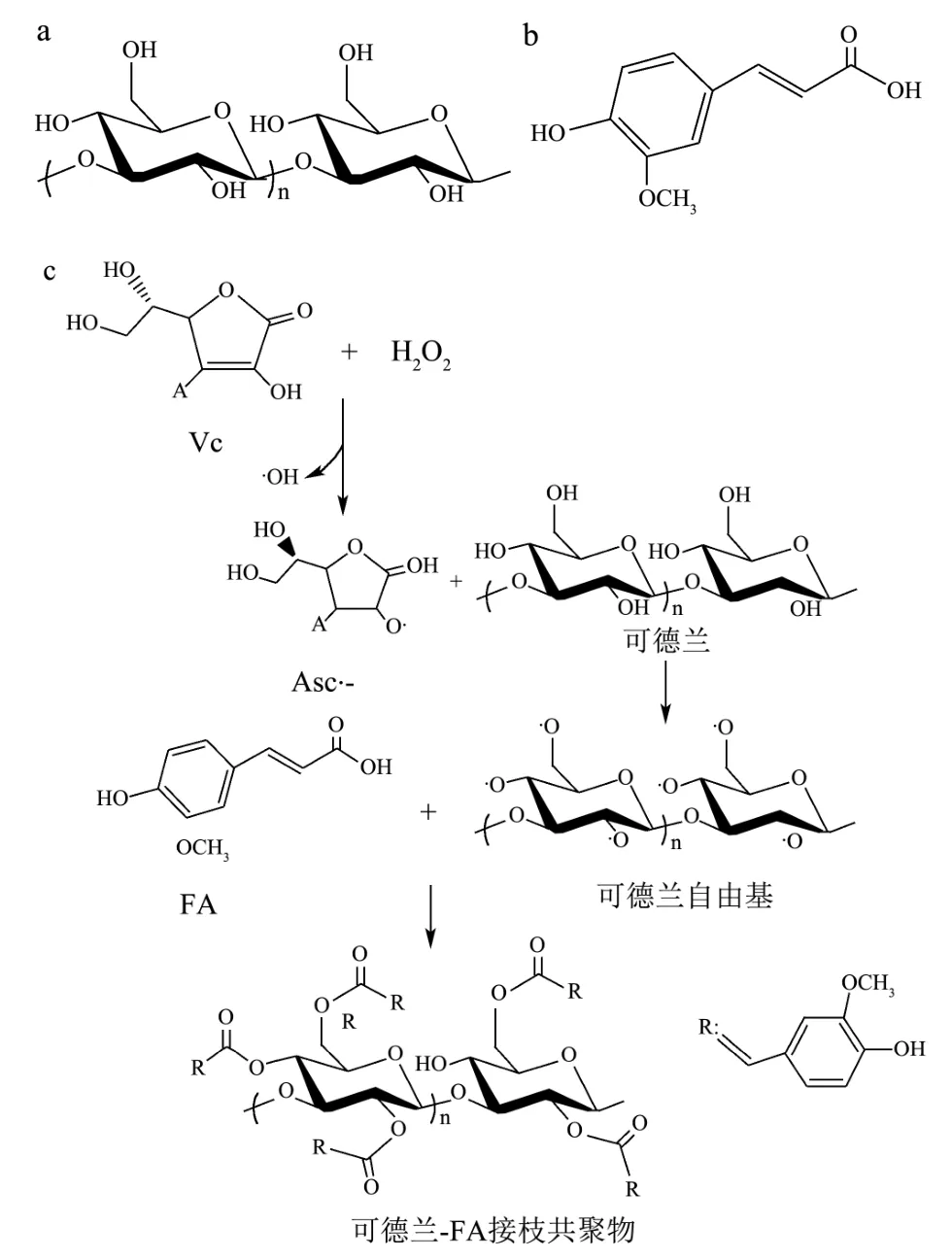
图1 可德兰多糖-FA 接枝共聚物的合成机理 Fig.1 Synthesis mechanism of FA-grafted curdlan conjugates
2.2 单因素试验分析
2.2.1 FA 添加量的影响
由图2 可知,在其他条件保持一定的情况下,接枝共聚物的接枝率随着FA 添加量的增加而增加,从11.78 mg FA/g 增加到58.87 mg FA/g。这可能是由于随着FA 添加量的增加,大量的FA 单体分子在可德兰多糖主链附近聚集,与可德兰多糖发生反应的FA 增多而提高接枝率[21]。当FA 添加量大于200 mg 时,可德兰多糖-FA 接枝共聚物的接枝率呈现出下降的趋势。在较高的添加量下,接枝率不但没有增加,反而逐渐降低。这可能是由于FA 分子在反应体系中达到了饱和,或者是由于FA 添加量的逐渐增加,使反应达到了动态的化学平衡[22]。由此可见,FA 添加量的进一步增加对接枝率没有产生促进作用。同时,随着FA添加量的增加,得率逐渐减少。因此,选取FA 添加量为200 mg 作为最佳的反应量。
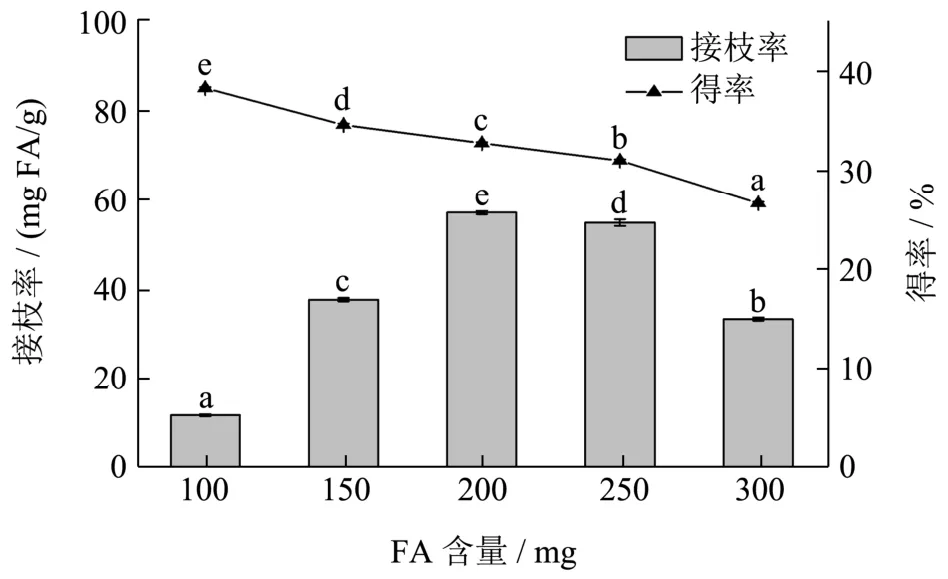
图2 FA 添加量对可德兰多糖-FA 接枝共聚物的接枝率和得率的影响 Fig.2 Effect of FA amount on grafting rate and yield of FA-grafted curdlan conjugates
2.2.2 Vc 添加量的影响
由图3 可知,在其他条件不变的情况下,可德兰多糖-FA 接枝共聚物的接枝率随着Vc 添加量的增加,呈现先增加后减小的趋势,在50 mg 时,接枝率达到最大,为56.03 mg FA/g。接枝共聚物的得率随着Vc添加量的增加,也呈现先增加后减小的趋势,在50 mg时,接枝共聚物的得率最大为56.03 mg FA/g。因此,选取Vc 添加量为50 mg 进行正交优化试验。

图3 Vc 添加量对可德兰多糖-FA 接枝共聚物的接枝率和得率的影响 Fig.3 Effect of Vc amount on grafting rate and yield of FA-grafted curdlan conjugates
2.2.3 H2O2浓度的影响
由图4 可知,H2O2的浓度对接枝共聚物的接枝率和得率均有影响。随着H2O2浓度的增加,接枝共聚物的接枝率呈现先增大后减小的趋势,在浓度为5 mol/L 时,接枝率达到最大,为78.87 mg FA/g。然而,当H2O2的浓度大于5 mol/L 时,接枝率会骤然下降,这可能是因为过量的·OH 存在,会通过氧化阻碍接枝反应,或者降解可德兰多糖的分子链[23],从而降低了接枝共聚物的接枝率。此外,接枝共聚物的得率也呈现先缓慢增加后减小的趋势。因此,选取H2O2浓度为5 mol/L 作为最佳条件进行正交优化试验。
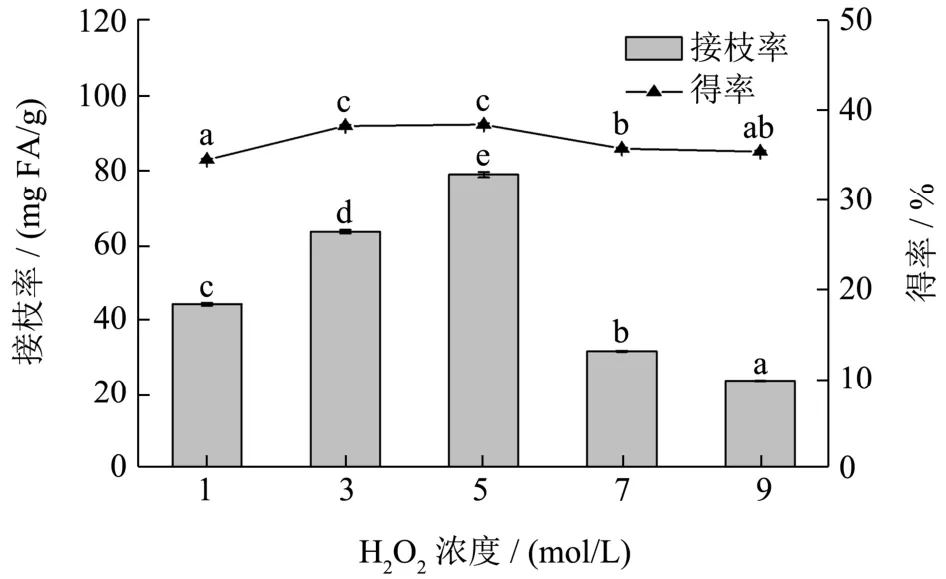
图4 H2O2浓度对可德兰多糖-FA 接枝共聚物的接枝率和得率的影响 Fig.4 Effect of H2O2 concentration on grafting rate and yield of FA-grafted curdlan conjugates
2.2.4 反应时间的影响
由图5 可知,接枝共聚物的接枝率和得率随着反应时间的延长,均呈现先增大后减小的趋势,当反应时间为12 h 时,接枝率和得率均达到最大,分别为90.87 mg FA/g 和34.67%。这说明反应时间适当的延长,有助于增加接枝共聚物的合成量,但反应时间过长,可能会加速反应物或接枝产物的降解,从而使得接枝率和得率都呈现下降趋势[24]。Liu 等[25]曾报道制备壳聚糖-没食子酸接枝共聚物的最佳反应时间为12 h,这与本研究结果相类似。因此,选择12 h 为最佳的反应时间。
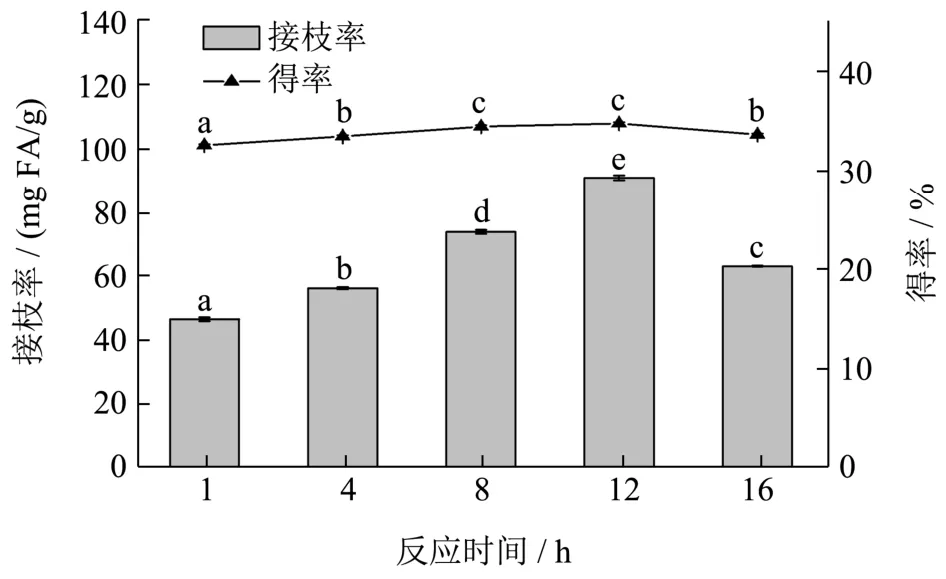
图5 反应时间对可德兰多糖-FA 接枝共聚物的接枝率和得率的影响 Fig.5 Effect of reaction time on grafting rate and yield of FA-grafted curdlan conjugates
2.3 正交试验结果分析
以单因素试验选取的FA添加量、Vc添加量、H2O2浓度和反应时间(分别以A、B、C、D 表示)四个因素为自变量,以接枝率为指标,进行四因素三水平正交试验。正交试验因素水平表见表1。

表1 因素水平表 Table 1 Factor level table
表2 为试验结果以及极差分析。由表2 中的极差分析可知,对可德兰多糖-FA 接枝共聚物的接枝率影响因素从大到小的顺序依次为FA 添加量、Vc 添加量、反应时间、H2O2浓度。根据表2 中接枝率平均数据分析可得接枝率最高的因素组合为A3B2C2D2,即FA 添加量为250 mg、Vc 添加量为50 mg、H2O2浓度为5 mol/L、反应时间为12 h。采用最优组合A3B2C2D2,进行三次验证试验,得到可德兰多糖-FA 接枝共聚物的接枝率为98.62 mg FA/g,得率为40.84%,高于正交表中的最高值(96.85 mg FA/g),因此选择最优组合,制备可德兰多糖-FA 接枝共聚物。

表2 正交试验与结果 Table 2 Orthogonal experiment and results
2.4 光谱分析
图6 和图7 分别为可德兰多糖、FA 和可德兰多糖-FA 接枝共聚物的紫外光谱和红外光谱图。从图6 可以看出,与原始可德兰多糖相比,可德兰多糖-FA 接枝共聚物分别在295 nm 和312 nm 处出现了与FA 相似的特征吸收峰,这说明FA 成功接枝到可德兰多糖链上,这与Woranuch 等[26]的研究结果相一致。从图7也可以看出,FA 在1517 cm-1有特征吸收峰[27],而原始可德兰则没有,与可德兰多糖的光谱图相比,可德兰多糖-FA 接枝共聚物的光谱图(图7c)在1514 cm-1处而出现了一个新的特征吸收峰,归属于FA 的C=C芳环的振动,这与紫外光谱的分析结果相一致,进一步说明FA 共价接枝到可德兰多糖链上。

图6 可德兰多糖、FA 和可德兰多糖-FA 接枝共聚物的紫外光谱 Fig.6 UV spectra of cotlan polysaccharide,FA and FA-grafted curdlan copolymer

图7 可德兰多糖、FA 和可德兰多糖-FA 接枝共聚物的红外光谱 Fig.7 Infrared spectra of curdlan,FA and FA-grafted curdlan copolymer
2.5 水溶性分析
图8 为可德兰多糖及其接枝共聚物的水溶性变化情况。从图中可以看出,经碱溶酸中和处理的可德兰多糖在常温下表现出一定的水溶性,其水溶性为14.30%。而经过接枝反应后,接枝共聚物表现出很好的水溶性,为92.5%,这一结果表明,接枝反应可以大大的改善可德兰多糖的溶解性。
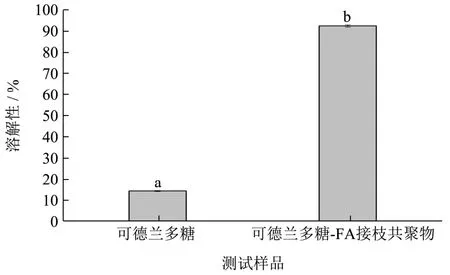
图8 可德兰多糖及其接枝共聚物样品水溶性分析图 Fig.8 Water solubility analysis diagram of the samples of curdlan polysaccharide and its graft copolymer
3 结论
3.1 通过Vc/H2O2氧化还原体系,在氮气保护下,能够成功地将FA 分子接枝到可德兰多糖的分子链上,形成可德兰多糖-FA 接枝共聚物。
3.2 单因素试验研究表明,FA 添加量为200 mg,Vc添加量为50 mg,H2O2浓度为5 mol/L,反应时间为12 h 时,可德兰多糖-FA 接枝共聚物的接枝率达到最高为90.87 mg FA/g,此时,接枝共聚物的得率为40.84%。
3.3 正交试验设计结果表明,可德兰多糖-FA 接枝共聚物制备的最佳工艺条件为:FA 添加量250 mg,Vc添加量50 mg,H2O2浓度5 mol/L,反应时间12 h,此时,可德兰多糖-FA 接枝共聚物的接枝率为98.62 mg FA/g。
3.4 紫外光谱和红外光谱分析表明,FA 共价接枝到可德兰多糖分子链上,并且经溶解性分析,知接枝共聚反应可提高多糖的水溶性。

