6龄黏虫幼虫受球孢白僵菌侵染后生长发育及体内成瘤反应的变化
李平 江幸福 孟令贺 程云霞 张蕾 翟保平


摘要 為探讨黏虫被球孢白僵菌侵染后生长发育情况及其体内的免疫反应,设置孢子浓度为104、5×104、105、5×105、106个/mL及5×106个/mL的球孢白僵菌菌液注射黏虫6龄初幼虫,研究球孢白僵菌对黏虫校正死亡率、羽化率、蛹重等生长发育指标的影响以及成瘤反应的浓度依赖效应。结果表明,6龄幼虫的校正死亡率随菌液浓度升高而逐渐增加。蛹重随菌液浓度增加而下降,但仅在106、5×106个/mL浓度处理时蛹重显著低于对照。同时,在孢子浓度为5×105、106、5×106个/mL时羽化率较对照显著降低,雌雄成虫寿命也显著缩短,而6龄幼虫至成虫羽化的发育历期在105、5×105、106、5×106个/mL浓度处理时较对照显著延长。此外,白僵菌侵染诱发黏虫免疫成瘤反应,并且具有明显的时间和浓度效应。注射84 h内,黏虫体内成瘤的数量随注射时间延长而递增,其后不再增加;同时,成瘤数量随着菌液浓度升高而增加,至106个/mL浓度时不再显著上升。该结果为揭示黏虫抵抗真菌侵染的免疫防御机制以及所产生的免疫代价提供了科学依据。
关键词 黏虫; 白僵菌; 生长发育; 成瘤
中图分类号: S 433.4
文献标识码: A
DOI: 10.16688/j.zwbh.2020560
Changes in the development and nodule formation of the 6th-instar
Mythimna separata larvae after infection by Beauveria bassiana
LI Ping1,2, JIANG Xingfu2, MENG Linghe2, CHENG Yunxia2, ZHANG Lei2*, ZHAI Baoping1*
(1. College of Plant Protection,Key Laboratory of Integrated Management of Crop Disease and Pests,Ministry of
Education,Nanjing Agricultural University,Nanjing 210095, China; 2. State Key Laboratory for Biology of Plant
Disease and Insect Pests,Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing 100193,China)
Abstract
In order to explore the effects of Beauveria bassiana on the growth and development of Mythimna separata and its induction of immune response, the spore concentration was set to 104, 5×104, 105, 5×105, 106 and 5×106 spores/mL, respectively. The 6th-instar larvae of M.separata were injected with Beauveria bassiana spore suspensions to study the effects of B.bassiana on the growth and developmental indicators such as corrected mortality, emergence rate, pupa weight, and the injection concentration-dependent effect of nodule formation. The results showed that the corrected mortality of the 6th-instar larvae increased with increasing injection concentration. Pupa weight decreased with increasing injection concentration, but decreased significantly at the concentrations of 106 and 5×106 spores/mL. At the same time, the emergency rate decreased significantly with the increase of treatment concentration only under the concentration of 5×105, 106, 5×106 spores/mL. The life spans of male and female adults were also significantly shortened. The developmental duration from the 6th-instar larvae to emergency was significantly longer than that of the control at the concentration of 105 spores/mL and above. In addition, infection by B.bassiana induced immune responses of M.separata with significant time and concentration effects. Within 84 h after injection, the number of nodules increased with time, but did not increase significantly thereafter. In addition, the number of nodules increased with increasing fungal liquid concentration, but the number of nodules did not increase significantly when the concentration reached 106 spores/mL. The results provide a scientific basis for revealing the immune defense mechanism of M.separata against fungal infection and immune cost.
Key words
Mythimna separata; Beauveria bassiana; development; nodule formation
病原真菌进入昆虫体内会受到寄主免疫系統的识别和抵抗[1-2]。昆虫的免疫系统是一个完整地存在于开放血淋巴系统的防御体系,通常由血浆中抗菌肽、溶菌酶、酚氧化酶等活性因子参与的体液免疫系统以及多种功能的血细胞参与的细胞免疫系统组成[3-4]。其中昆虫的细胞免疫主要依赖血细胞对外来抗原或异物的吞噬、集结和包囊作用,所以昆虫体内血细胞的数量、微聚成瘤等反应可作为判断昆虫免疫力的主要指标[5-7]。细菌、病毒和真菌都可以有效诱导昆虫免疫反应,而注射孢子或分生孢子是实验室研究中真菌感染昆虫的常用手段[8],例如Shamakhi通过注射球孢白僵菌Beauveria bassiana证实了在不同温度胁迫条件下二化螟Chilo suppressalis免疫系统的调节主要发生在短时间内[9];注射转录因子MaSom1缺失的蝗绿僵菌孢子后,蝗虫的免疫反应显著增强,体壁内侧成瘤数增加[10];黑腹果蝇Drosophila melanogaster免疫的性别二态性并不完全表现在表皮防御方面,注射接种和表面喷雾接种球孢白僵菌时雄虫的防御均强于雌虫[11]。研究发现,寄生物可能对宿主的生活史进化、性选择和种群动态产生影响,而昆虫免疫系统的维持和免疫反应的完成需要消耗大量的能量,所以宿主往往会做出适应与权衡,利用繁殖的资源以防止寄生物的感染及其随后的增殖[12]。在免疫系统上能量的投入会导致昆虫在免疫胁迫下生存的整体健康状况下降,体现为昆虫生长发育受损、繁殖能力的下降、存活率降低、寿命缩短,甚至第二性征发育受到抑制[13-16]。
球孢白僵菌 Beauveria bassiana具有容易培养、致病力强、广谱以及对温血动物和植物无害的特点,是目前世界上研究和应用最多的虫生真菌之一[17]。可寄生15个目149个科的700多种昆虫及蜱螨类,是田间及野外最常见的致病真菌,同时被认为是防治蛾类的最佳选择[18-19]。球孢白僵菌已经广泛运用于烟粉虱Bemisia tabaci、亚洲玉米螟Ostrinia furnacalis等农林害虫的防治[20-21]。研究病原真菌与害虫的互作关系对昆虫病原真菌的田间实际应用有重要意义。目前关于白僵菌诱导昆虫细胞免疫的研究多是关于血淋巴中血细胞数量、类型变化及包囊作用,研究发现甜菜夜蛾Spodoptera exigua幼虫、葱蝇Delia antiqua成虫、亚洲玉米螟幼虫对球孢白僵菌孢子的侵入均产生强烈的细胞防御,血细胞能够一定程度上抑制菌丝增殖[22-24]。
黏虫Mythimna separata是一种典型的远距离迁飞害虫,可取食玉米、小麦、水稻等多种禾谷类粮食作物,还可为害棉花与蔬菜等经济作物,其飞行能力强、发生范围广、为害世代多,每年在我国南北地区有4~5次大范围的往返迁飞为害,给农业生产造成重大损失,除新疆外,其他地区均发现黏虫为害[25-26]。近年来,随着气候变化以及种植结构的改变,黏虫适应能力更强,在我国的发生为害呈现出新的特点[27]。目前有关白僵菌防治黏虫的研究报道较少,防御机制的研究多针对黏虫体内相关保护酶的变化,如黏虫3龄幼虫被球孢白僵菌Bb314侵染初期,可通过增强保护酶和解毒酶的活性来维持虫体的正常生理功能[28]。关于白僵菌诱发的黏虫体内细胞免疫反应以及侵染对黏虫后续生长发育影响的相关研究鲜见报道。
本试验以白僵菌这种田间主要生防菌作为免疫诱导物,用不同浓度的菌液注射黏虫确保其受到不同强度的免疫刺激,探究对其后续生长发育和体内成瘤反应的影响,旨在更全面地了解真菌诱导的昆虫免疫反应机制以及昆虫免疫防御代价,为研制高效的真菌杀虫剂、指导白僵菌的应用提供一定的理论依据。
1 材料与方法
1.1 供试虫源及菌株
试验用黏虫采自吉林省四平市公主岭市田间,在实验室内繁殖饲养多代。幼虫用新鲜玉米苗饲养,培养箱温度设置为(24±1)℃,相对湿度设置为70%左右,光周期L∥D=14 h∥10 h,密度设置为10头/瓶(9 cm×13 cm)。
试验所用球孢白僵菌GZGY-1-3由中国农业科学院植物保护研究所蔬菜害虫研究组提供。用SDA 培养基对菌株进行活化。在(25±2)℃下培养7~10 d后用0.05%吐温-80无菌水冲洗平板获取孢子,过滤离心再悬浮进行清洗,最终获取新鲜孢子悬浮液。用血球计数法(25×16个方格)测定孢子浓度。最终配制成浓度为104、5×104、105、5×105、106、5×106、107个/mL及108个/mL的孢子悬浮液,用于注射接种。对照组注射含0.05% 吐温-80的无菌水。
孢子悬浮液浓度=(80个方格内总孢子数/80)×4×106×悬浮液稀释倍数。
1.2 试验方法
1.2.1 注射法接种球孢白僵菌
选择6龄蜕皮后24 h内的幼虫进行注射。在注射之前,将幼虫在冰上放置30 min麻醉,并使用70%乙醇对穿刺部位周围的表皮进行消毒。使用5 μL的注射器(30号针头)(Hamilton,瑞士)吸取1 μL新鲜配制的孢子悬浮液通过幼虫第3腹足与腹部的连接处表皮注射入幼虫体内,注射过程中要避免刺破中肠。选取出血量很少且生命体征明显的幼虫进行后续观察。对照组注射1 μL含0.05%吐温-80的无菌水。
1.2.2 不同浓度球孢白僵菌免疫诱导对黏虫生长发育的影响
6龄幼虫经不同浓度球孢白僵菌注射处理后,继续在10头/瓶的密度条件下采用新鲜玉米苗饲喂,每30头为一组,3个重复,每天观察记录幼虫死亡日期。幼虫老熟时,加入含水量10%左右的土壤供其化蛹,并记录成虫羽化日期及死亡日期,幼虫化蛹3 d后用万分之一天平(METTLER TOLEDO、美国)称量蛹重。计算幼虫死亡率、校正死亡率(成功化蛹前感染死亡数与6龄初处理数对比)、羽化率以及LC50。
校正死亡率=(处理死亡率-对照死亡率)/(1-对照死亡率)×100%;
羽化率=羽化数/成功化蛹数×100%。
1.2.3 成瘤的计数方法
首先将幼虫放在冰面上30 min進行麻醉,然后用解剖剪将幼虫腹部表皮从头到尾剪开,使用昆虫针展开固定在黑色蜡盘上,用PBS缓冲液轻轻洗涤内表面几次,去除可能被误认为结节的污染物。检查消化道表面有无结节,之后取出丢弃。用体视镜(Olympus,日本)观察拍摄幼虫内表面结瘤数。由于个体产生的结瘤大小存在明显的差异,根据Zhang等[29]的解剖计数方法对瘤的大小进行测量时,每30 μm长作为一个单位IN(indexed nodule),不足30 μm记为一个IN。数据结果记录为IN/头。
1.2.4 成瘤反应的时间动态的测定
根据注射不同浓度球孢白僵菌后黏虫的校正死亡率,选取106个/mL球孢白僵菌孢子悬浮液对幼虫进行注射侵染,分别在注射后0、6、12、24、48、72、84、96 h时进行解剖观察其成瘤反应。每组11头幼虫。
1.2.5 不同浓度球孢白僵菌免疫诱导下的成瘤反应
取1 μL不同浓度(104、5×104、105、5×105、106、5×106个/mL)孢子悬浮液注射幼虫,幼虫处理方法和注射方法同前。根据1.2.4时间动态试验结果,选取成瘤不再增加的时间对处理过的幼虫进行解剖拍照,计算成瘤数量。对照组注射相同体积的含0.05%吐温-80的无菌水。每组10头幼虫。
1.3 数据处理与分析
试验所得数据应用统计软件SPSS 24.0进行方差分析。对于死亡率和羽化率等涉及百分率的数据先进行平方根反正弦转换。采用单因素方差分析(ANOVA)和LSD检验比较不同浓度组别间的差异显著性(P<0.05),所有数据采用平均值±标准误(mean±SE)表示。
2 结果与分析
2.1 球孢白僵菌侵染对黏虫生长发育的影响
根据预试验结果,注射吐温-80后黏虫死亡率与不做任何处理的相比不存在显著差异(|t|1,2=0500,P=0.667),故后续试验不再设置空白对照,均以注射吐温-80的处理作为对照组。由表1可以看出注射不同浓度球孢白僵菌孢子悬浮液对6龄黏虫的死亡率及校正死亡率具有显著影响(F8,18=477.983,P<0001;F7,16=111.125,P<0.001),表现为随着注射浓度的增加,处理后黏虫幼虫死亡率与校正死亡率均随之增加。但在104~105个/mL相对较低的浓度下,黏虫幼虫的校正死亡率没有显著差异(P>0.05),当孢子悬浮液浓度达到106个/mL时黏虫幼虫的校正死亡率相比低浓度处理显著增加(P<0001)。107个/mL处理下校正死亡率达到7407%。最高浓度(108个/mL)下幼虫全部死亡,根据校正死亡率得到毒力回归方程y=-1.050+0876x (χ2=155.180,df=6,P<0.001),计算出LC50=8.03×106个/mL。由于107个/mL及108个/mL浓度下幼虫死亡率过高,后续生长发育指标的测定不再设置此浓度。选择104、5×104、105、5×105、106个/mL及5×106个/mL作为后续生长发育及成瘤反应试验的浓度。
球孢白僵菌注射处理对黏虫化蛹后的蛹重有显著影响(F6,505=5.986,P<0.001,图1)。但仅在高浓度,106个/mL及5×106个/mL下表现出显著的抑制效应,蛹重减少至311.31 mg和300.63 mg,显著低于注射吐温-80的对照组32911 mg(P<005),但这两个浓度之间不存在显著差异(P>005)。而相对较低浓度的真菌侵染并不影响黏虫蛹的发育,体现在104~5×105个/mL浓度处理的黏虫蛹重与对照以及各组之间均无显著差异(P>0.05)。
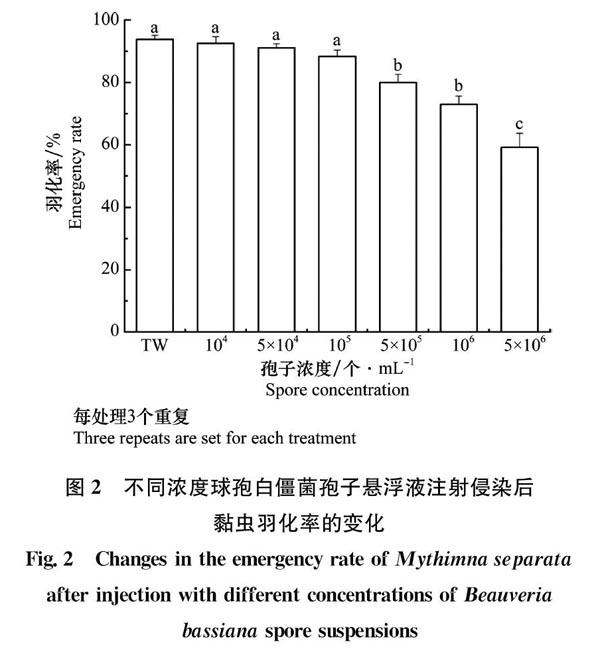
球孢白僵菌侵染对黏虫的羽化也具有显著抑制作用(F6,14=23.406,P<0.001),随着菌液浓度的升高黏虫的羽化率表现出明显下降的趋势(图2)。对照组以及104~105个/mL浓度处理之间均无显著差异(P>0.05),而5×105~5×106个/mL处理黏虫羽化率较对照组及其他低浓度处理显著降低(P<0.05),其中最高浓度5×106个/mL处理的羽化率由对照组最高93.83%降至59.07%,降低了1/3左右。
不同浓度球孢白僵菌侵染后6龄幼虫至成虫羽化的发育历期有显著差异(F6,423=46.524,P<0001,图3)。黏虫6龄幼虫至成虫羽化的发育历期随浓度的升高而逐渐延长,105~5×106个/mL处理的发育历期较对照组均显著延长(P<0.05),其中5×106个/mL处理的历期最长,达19.98 d,较对照组(18.07 d)延长近2 d。106个/mL与5×106个/mL两个高浓度处理的历期无显著差异(P>005),但较低浓度处理均显著延长(P<0.05)。
球孢白僵菌侵染对黏虫雌、雄成虫的寿命均有显著影响(雌F6,124=6.253,P<0.001;雄F6,124=2862,P=0.012)(图4)。孢子悬浮液浓度的提高显著抑制了成虫的正常发育,缩短了成虫的
寿命。5×105~5×106个/mL浓度处理后雌、雄虫的寿命均显著低于对照组(P<0.05),其中最高浓
度(5×106个/mL)的处理组,雌虫寿命8.09 d,较对照缩短近1/3;而雄虫的寿命为11 d较对照组缩短近1/4。
2.2 成瘤反应的时间动态及形态变化
选取对黏虫生长发育有显著抑制作用但致死率不是太高的106个/mL孢子悬浮液注射黏虫。
图5为黏虫体内结瘤形态随时间推移发生的变化。注射后6 h黏虫体内形成小黑点状结瘤,数量少,多附着在叶状脂肪体边缘,边界清晰(图5a),且体积通常不超过2 IN。随着时间延长,结瘤数量逐渐增多,且体积变大,多在2~3 IN,并且开始出现以团状结瘤为中心,外围褐色散点分布的较大的结瘤团(图5b)。将结瘤团放大观察,可以看到褐色的结瘤被白色透明状的胶质层包裹,周围散布的小型结瘤呈卫星状环绕(图5c)。随后出现凝聚成团的结瘤,但边缘不规则且颜色较中间部分浅淡(图5d)。72 h时在黏虫气孔附近出现大量散点状结瘤团,且边缘模糊颜色呈黄褐色,胶质团出现不规则的形状且相互连接(图5e)。84 h后小型的结瘤几乎消失,而这些散点结瘤凝聚成大的团状黑瘤散布在气管周围(图5f),且形态不再变化,趋于稳定。
图6可看出,随时间增加黏虫体内成瘤数量随之递增。注射后即刻解剖(0 h)作为对照,结瘤数量仅有6.18 IN/头,此时黏虫体内还未发生强烈的细胞免疫,其免疫响应需要一定的时间,在注射6 h后黏虫体内结瘤数量增加为32.64 IN/头。在6~12 h时间段内黏虫成瘤数量显著提升(F7,80=151942,P<0.001),随后放缓。在注射后24 h至84 h内的几个时间节点,黏虫体内的结瘤数量显著增加。而在处理84 h后黏虫体内的结瘤数量不再大幅增加,趋于平稳,与96 h的数量无显著差异(P>0.05)。
2.3 不同浓度球孢白僵菌侵染后黏虫成瘤反应的变化
根据前面成瘤反应时间动态的结果,选择在注射处理后84 h进行解剖,观察测量不同浓度间黏虫体内结瘤数量的差异。可以看出,随着菌液浓度的升高,黏虫体内结瘤数量随之增加(F6,63=133988,P<0.001,图7)。其中,注射浓度5×104~106个/mL时,结瘤数随着注射浓度的增加而显著上升,但至106个/mL浓度后不再显著增长(P>0.05)。
3 讨论
昆虫在受到外界寄生物侵染时,会迅速产生免疫反应来做出响应,在昆虫对真菌感染的免疫防御中,细胞免疫中的包囊作用和形成结瘤并黑化的过程常体现为昆虫的免疫防御反应。昆虫主要是通过在自身和寄生物之间形成物理屏障来限制入侵生物造成损害[30-32]。成瘤反应也被证实广泛存在于昆虫中,对昆虫的生存具有重要的意义,同时常被用于昆虫免疫能力的评估。在进行细胞免疫相关试验时通常通过注射接种直接刺激血腔诱导成瘤反應,这样可以在确保试虫受到感染的同时对虫体内的感染物定量[33-34]。为了便于解剖和观察黏虫受到真菌侵染后血腔内的细胞免疫现象,本试验选取黏虫6龄幼虫作为试验对象并以结瘤数量作为指标,试验证明了球孢白僵菌侵染会诱导黏虫体内的成瘤反应,且无论注射的孢子悬浮液浓度高还是低,黏虫体内都会产生免疫反应来抵御外来病原物的侵染。昆虫种类不同或同一物种内的血细胞数量不同,结瘤的数量上限也不同[35],这种限制体现在结瘤反应的时间进程和注射真菌孢子数量对总结瘤数量的影响。黏虫体内的结瘤数量在注射球孢白僵菌孢子后开始增加,到84 h时数量稳定,不再增长,且在注射浓度达到106个/mL时黏虫体内产生的结瘤数量也不再显著增加。同时,在104~5×106个/mL浓度范围内感染强度越大结瘤数量越多,幼虫死亡率也越高,幸存个体的生长发育也受到影响。这说明成瘤反应所代表的黏虫体内免疫反应是其生存必需的,并且这种免疫防御的维持需要生物成本,体现在对黏虫的生长发育的抑制上。
研究表明,昆虫的免疫防御在消耗自身能量的同时往往会造成进化过程中表现出生存适合度下降[36]。烟草天蛾Manduca sexta被寄生蜂寄生后或者注射灭活的细菌后血细胞的数量均会减少且取食行为受到显著抑制[37],东亚飞蝗 Locusta migratoria manilensis 受到侵染后,其取食量、蝻期近似消化率及食物转化率也都出现显著变化[38],熊蜂Bombus terrestris在注入脂多糖(LPS)后其整个种群的存活率下降[39]。本试验对黏虫6龄幼虫注射不同浓度的球孢白僵菌孢子悬浮液,来探究6龄黏虫生长发育对注射真菌的浓度响应。结果表明,随着免疫胁迫强度的增加,黏虫的各项生长指标表现出明显的抑制效应,包括死亡率的升高、羽化率的降低、蛹重的降低、发育历期的延长,成虫寿命的缩短。首先黏虫幼虫死亡率随注射孢子的浓度升高而增加,但在105个/mL后才显著增加,而各个浓度处理下黏虫体内都发生成瘤反应,这是由于黏虫在受到外界病原物入侵时其免疫防御系统有一定的抵抗力,大多数幼虫可以从相对较弱的感染(104、5×104个/mL)中恢复,表现为死亡率较低、蛹重、发育历期、羽化均不受影响。蛹期是昆虫变态的重要时期,免疫反应的过度消耗可能使其无法正常完成这一转化,表现在蛹重、羽化率及发育速度受到影响。注射白僵菌对黏虫蛹重及发育历期的抑制效应与草地贪夜蛾注射细菌后蛹重减少及发育速度降低的结果相一致[29],但这种现象也仅在相对高浓度处理下出现。强的感染(106个/mL以及5×106个/mL)会导致各项生存指标受到抑制,107个/mL浓度处理后黏虫死亡率达50%以上,108个/mL处理后全部死亡,由此推断,虽然强烈的感染刺激下能够诱导产生结瘤并激活其他免疫功能,但这些功能不足以克服和恢复昆虫机体所受的损伤与能源消耗,这与野外受感染昆虫免疫研究的结果一致[40]。
以结瘤反应为代表的细胞免疫证实了黏虫对白僵菌侵染具有一定的免疫防御能力,但昆虫的免疫防御机制十分复杂,仅以结瘤反应作为衡量标准可能不足以完全解释昆虫体内复杂的免疫活动,不少研究会配合体外暴露接种的方式来共同评估昆虫的免疫能力[41-42]。考虑到田间实际应用中多在低龄幼虫期通过喷施菌液来进行防治,本试验采用注射方法避开了昆虫的体壁防御,需进一步完善使其对田间的防治起到直接的指导作用。
综上所述,球孢白僵菌可以有效诱导黏虫体内免疫反应且病原物的侵染对于黏虫的生长发育造成了一定的影响,但由于昆虫免疫防御系统的运作与物质能源的分配,诱发这种生存水平上的抑制效应需要有足够量的病原物的刺激。本文为研究黏虫对真菌感染的免疫防御和免疫代价提供了科学依据。
参考文献
[1] LEMAITRE B, HOFFMANN J. The host defense of Drosophila melanogaster [J]. Annual Review of Immunology, 2007, 25: 697-743.
[2] BOGU M I, KEDRAA E, BANIA J, et al. Different defense strategies of Dendrolimus pini, Galleria mellonella, and Calliphora vicina against fungal infection [J]. Journal of Insect Physiology, 2007, 53(9): 909-922.
[3] SIVA-JOTHY M T, MORET Y, ROLFF J. Insect immunity: An evolutionary ecology perspective [J]. Advances in Insect Physiology, 2005, 32(5): 1-48.
[4] 李志强, 陈国生, 王茂先, 等.昆虫体液免疫的分子生物学[J].生命的化学, 2003, 23(5): 348-351.
[5] 张忠, 叶恭银, 胡萃.两种金小蜂毒液对菜粉蝶蛹血细胞延展、存活及包囊作用的影响[J].昆虫学报, 2004, 47(5): 551-561.
[6] SCHMID M R, BROCKMANN A, PIRK C W W, et al. Adult honeybees (Apis mellifera L.) abandon hemocytic, but not phenoloxidase-based immunity [J]. Journal of Insect Physiology, 2008, 54(2): 439-444.
[7] PARK Y, KIM Y, STANLEY D. Cellular immunosene scence in adult male crickets, Gryllus assimilis [J]. Archives of Insect Biochemistry & Physiology, 2011, 76(4): 185-194.
[8] 杨晓峰, 周小霞, 郑小莉.真菌诱导的昆虫免疫反應研究进展[J].贵州农业科学,2008(5):73-76.
[9] SHAMAKHI L, ZIBAE A, KARIMI-MALATI A, et al. Effect of thermal stress on the immune responses of Chilo suppressalis walker (Lepidoptera: Crambidae) to Beauveria bassiana [J]. Journal of Thermal Biology, 2019, 84: 136-145.
[10]DU Yanru, JIN Kai, XIA Yuxian. Involvement of MaSom1, a downstream transcriptional factor of cAMP/PKA pathway, in conidial yield, stress tolerances, and virulence in Metarhizium acridum[J]. Applied Microbiology & Biotechnology, 2018, 102(13): 5611-5623.
[11]PARVIN S, MORIA C, JOHN V, et al. Sexual dimorphism in Drosophila melanogaster survival of Beauveria bassiana infection depends on core immune signaling [J/OL]. Scientific Reports, 2018, 8(1):12501. DOI: 10.1038/s41598-018-30527-1.
[12]SHELDON B C, VERHULST S. Ecological immunology: costly parasite defences and trade-offs in evolutionary ecology [J]. Trends in Ecology & Evolution, 1996, 11(8): 317 - 321.
[13]JACOT A, SCHEUBER H, KURTZ J. Juvenile immune status affects the expression of a sexually selected trait in field crickets [J].Journal of Experiment Biology, 2005, 18(4): 1060-1068.
[14]LUONG L T, POLAK M. Costs of resistance in the Drosophila-Macrocheles system: a negative genetic correlation between ectoparasite resistance and reproduction [J]. Evolution, 2007, 61(6): 1391-1402.
[15]TSCHIRREN B, SIITARI H, SALADIN V, et al. Transgenerational immunity in a bird-ectoparasite system: Do maternally transferred antibodies affect parasite fecundity or the offsprings susceptibility to fleas? [J]. IBIS, 2008, 151(1): 160-170.
[16]BASCUNN-GARCA A P, LARA C, CRDOBA-AGUILAR A. Immune investment impairs growth, female reproduction and survival in the house cricket, Acheta domesticus [J]. Journal of Insect Physiology, 2010, 56(2): 204-211.
[17]李荣森, 罗绍彬.微生物防治害虫[M].北京: 科技出版社, 1983: 27-45.
[18]李增智.中国虫生真菌的研究与应用[M].北京: 学术期刊出版社, 1988: 241.
[19]KHACHATOURIANS G G. Production and use of biological pest control agents [J]. Trends Biotechnology, 1986, 4(5): 120-124.
[20]POPRAWSKI T J, JONES W J. Host plant effects on activity of the mitosporic fungi Beauveria bassiana, and Paecilomyces fumosoroseus, against two populations of Bemisia whiteflies (Homoptera: Aleyrodidae) [J]. Mycopathologia, 2001, 151(1): 11-20.
[21]黃少华, 张宝鑫, 李敦松, 等.珠江三角洲甜玉米螟害防治试验初报[J].广东农业科学, 2004(1): 44-46.
[22]HUNG S Y, BOUCIAS D G. Influence of Beauveria bassiana, on the cellular defense response of the beet armyworm, Spodoptera exigua [J].Journal of Invertebrate Pathology, 1992, 60(92): 152-158.
[23]张慧, 吴圣勇, 王帅宇, 等.葱蝇成虫防御类酶和血细胞对球孢白僵菌的防御作用[J].中国生物防治学报, 2017, 33(2): 198-205.
[24]陶淑霞, 李玉, 刘家富, 等.球孢白僵菌对亚洲玉米螟幼虫血细胞数量和包囊作用的影响[J]. 植物保护学报, 2011, 38(6): 527-531.
[25]李光博, 王恆祥, 胡文绣.黏虫季节性迁飞为害假说及标记回收试验[J].植物保护学报, 1964, 3(2): 101-110.
[26]国家科委全国重大自然灾害综合研究组.中国重大自然灾害及减灾对策分论[M].北京: 科学出版社, 1993: 549-602.
[27]江幸福, 张蕾, 程云霞, 等.我国黏虫发生危害新特点及趋势分析[J].应用昆虫学报, 2014, 51(6): 1444-1449.
[28]张琛, 陈思博, 吴晨源, 等.粘虫高毒力白僵菌菌株筛选及其感菌后虫体内保护酶活性的变化[J].核农学报,2020,34(12):2701-2707.
[29]ZHANG Lei, RINGBAUER J A, GOODMAN C L, et al. Prostaglandin-mediated recovery from bacteremia delays larval development in fall armyworm, Spodoptera frugiperda [J/OL]. Archives of Insect Biochemistry and Physiology, 2018, 97(4): e21444. DOI:10.1002/arch.21444.
[30]GILLESPIE J P, BURNETT C, CHARNLEY A K. The immune response of the desert locust Schistocerca gregaria during mycosis of the entomopathogenic fungus, Metarhizium anisopliae var. acridum [J]. Journal of Insect Physiology, 2000, 46(4): 429-437.
[31]SUGUMARAN M. Unified mechanism for sclerotization of insect cuticle [J]. Advances in Insect Physiology, 1998, 27, 229-334.
[32]OUEDRAOGO R M, CUSSON M, GOETTEL M S, et al. Inhibition of fungal growth in thermoregulating locusts, Locusta migratoria, infected by the fungus Metarhizium anisopliae var. acridum [J]. Journal of Invertebrate Pathology, 2003, 82(2): 103-109.
[33]STANLEY D. Prostaglandins and other eicosanoids in insects: Biological significance [J]. Annual Review of Entomology, 2006, 51: 25-44.
[34]STANLEY D, KIM Y. Eicosanoid signaling in insects: From discovery to plant protection [J]. Critical Reviews in Plant Science, 2014, 33: 20-63.
[35]HOWARD R W, MILLER J S, STANLEY D. The influence of bacterial species and intensity of infections on nodule formation in insects [J]. Journal of Insect Physiology, 1998, 44(2): 157-164.
[36]蒋红波, 王进军.昆虫免疫防御系統的限制因素[J].现代生物医学进展, 2006(2): 86-90.
[37]ADAMO S A. Parasitic suppression of feeding in the tobacco hornworm, Manduca sexta: parallels with feeding depression after an immune challeng [J]. Archives of Insect Biochemistry & Physiology, 2005, 60(4):185-197.
[38]涂雄兵, 李志红, 牙森·沙力, 等. 绿僵菌侵染后东亚飞蝗营养生理参数变化研究[J]. 应用昆虫学报, 2011, 48(4): 896-901.
[39]MORET Y, SCHMID-HEMPEL P. Survival for immunity: the price of immune system activation for bumblebee workers [J]. Science, 2000, 290(5494): 1166 -1168.
[40]TUNAZ H, STANLEY D. An immunological axis of biocontrol: Infections in field-trapped insects [J]. Naturwissenschaften, 2009, 96(9): 115-119.
[41]ZHANG Junjie, JIANG Hui, DU Yanru, et al. Members of chitin synthase family in Metarhizium acridum differentially affect fungal growth, stress tolerances, cell wall integrity and virulence [J/OL]. PLoS Pathogens, 2019, 15(8):e1007964. DOI: 10.1371/journal.ppat.1007964.
[42]HUANG Wei, SHANG Yanfang, CHEN Peilin, et al. MrpacC regulates sporulation, insect cuticle penetration and immune evasion in Metarhizium robertsii [J]. Environmental Microbiology, 2015, 17(4):994-1008.
(责任编辑:杨明丽)

