消胆胺通过激活肝内FXR信号靶向改善非酒精性脂肪性肝炎的机制分析
孙奕凡 臧淑妃* 杨传玉 汪丽红
非酒精性脂肪性肝炎(NASH)是单纯性脂肪肝(NAFLD)进展为肝硬化的限速步骤[1-2]。基于我国庞大的NAFLD人群和较高的NASH发生率,对NASH患者进行及时有效的干预具有重要意义。胆汁酸(BA)是由肝细胞以胆固醇为原料合成并分泌的具有两性结构的分子[3-4],胆汁酸代谢异常与NASH的进展关系密切[5]。消胆胺(CHY)作为胆汁酸螯合剂,临床上用于降低胆固醇,基础实验中用于去除实验动物体内的内源性胆汁酸[4,6],但其对代谢的影响尚不清楚。而法尼醇X受体(FXR)作为胆汁酸代谢关键分子,激活后可改善NASH炎症和纤维化[7]。本研究拟采用课题组前期建立的ApoE-/-小鼠NASH模型予以CHY干预,观察其对FXR的影响以及防治NASH的作用,并探讨其可能机制。
1 材料与方法
1.1 造模及分组 40只SPF级6周龄雄性ApoE-/-小鼠平均分为4组,对照(LFD)组给予低脂饮食(LFD,货号98121701,品牌Research Diet,美国)喂养,NASH模型(HFHC)组给予高脂高胆固醇饮食(HFHC,货号D12079B,品牌Research Diet,美国)喂养,CHY对照(LFD+CHY)组给予低脂饮食+2%CHY(货号C4650,美国Sigma)喂养,CHY干预(HFHC+CHY)组给予高脂高胆固醇饮食+2%CHY喂养,连续喂养12周。
1.2 实验方法 (1)血液学指标检测:小鼠喂养12周后,采用戊巴比妥钠麻醉,心脏取血800~900 μL后,颈椎脱位法处死,立即无菌获取肝脏、肠道,液氮速冻并置于-80 ℃备用。血液置于1.5 mL离心管静置2 h后,以3000 r/min离心15 min,取上清,使用日立7180全自动生化分析仪测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)、胆固醇(TC)等指标水平。(2)荧光定量RT-PCR:取肠道及肝脏组织约50 mg,采用TRIZOL/氯仿抽提法提取总RNA,抽提的RNA纯度、浓度均到达质控要求(浓度至少200 ng/μL,纯度1.9~2.0)后,使用罗氏逆转录试剂盒(批号:32460620,品牌:Roche,德国)cDNA第一链合成系统逆转录合成cDNA,以20 μL反应体系使用SYBR Green mix(批号:04913914001,品牌:Roche,德国)荧光定量,进行PCR扩增,通过2-ΔΔCT计算mRNA表达的相对水平。(3)油红O染色:新鲜肝脏冰冻切片,厚度10 μm,10%多聚甲醛固定40 min,PBS清洗3次,每次10 min,再经60%异丙醇漂洗30 s;采用新鲜现配6∶4油红O染色液染色15~20 min,60%异丙醇清洗3次,每次10 s,蒸馏水清洗10 s,苏木素复染核5 min,流水冲洗10 s,甘油明胶封片,光镜下观察拍照。(4)Western Blot:采用RIPA裂解法提取总蛋白,使用酶标仪采用BCA法测定所提蛋白的浓度,之后根据蛋白浓度及上样量,添加5X蛋白上样缓冲液,99 ℃加热10 min使蛋白变性,根据所测蛋白分子量配胶,40 ng蛋白量上样,上层胶80 V 30 min+下层胶120 V 2 h电泳,10%牛奶封闭1 h后一抗4 ℃孵育过夜,TBST清洗3次,每次10 min,二抗室温孵育1 h,TBST清洗3次,每次10 min,应用化学发光成像系统进行图像采集、分析。
1.3 统计学方法 采用SPSS 25.0统计软件。计量资料以(±s)表示,组间均数比较采用ANOVA单因素方差分析;组间两两比较,方差齐者采用LSD或SNK法,方差不齐者采用Tamhane或Dunnett法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠的体质量、肝重及各项血清学生化指标比较 见图1。HFHC和LFD连续喂养12周后,HFHC组体重、肝体重比以及血清ALT、AST、TG、TC水平均明显高于LFD组(P<0.05);与HFHC组相比,CHY+HFHC组小鼠的体重、肝体重比以及血清ALT、AST、TG、TC水平均显著降低(P<0.05)。
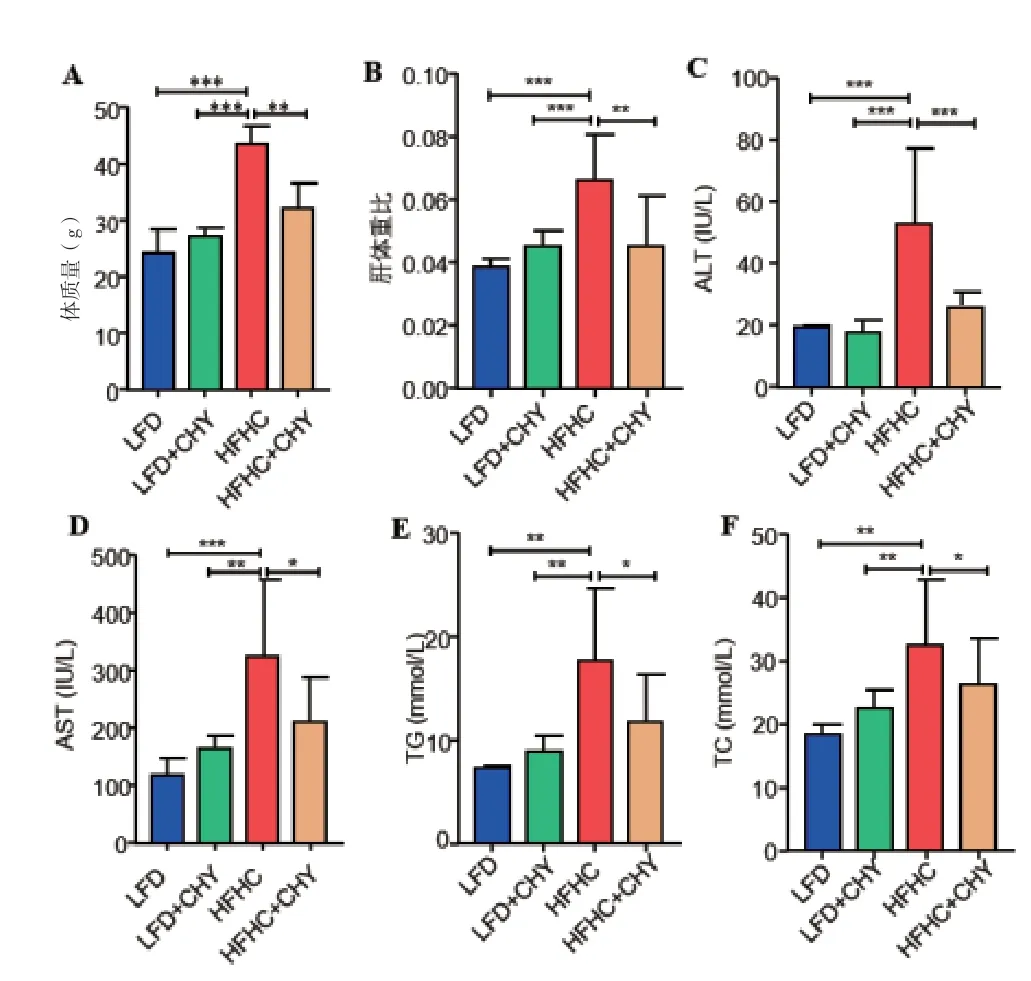
图1 A. 四组小鼠体质量比较;B. 四组小鼠肝体重比较;C. 四组小鼠的血清ALT水平比较;D. 四组小鼠的血清AST水平比较;E. 四组小鼠的血清TG水平比较;F.四组小鼠的血清TC水平比较;***P<0.001;**P<0.01,*P<0.05
2.2 各组小鼠的肝组织病理学结果 油红O染色结果显示,LFD组小鼠无明显脂肪变,HFHC组小鼠出现明显脂肪变;予以CHY干预后,LFD+CHY组和HFHC+CHY组的油红O染色面积、密度、染色程度均较对照组明显降低,说明CHY干预能够明显减轻肝内形成。见图2。
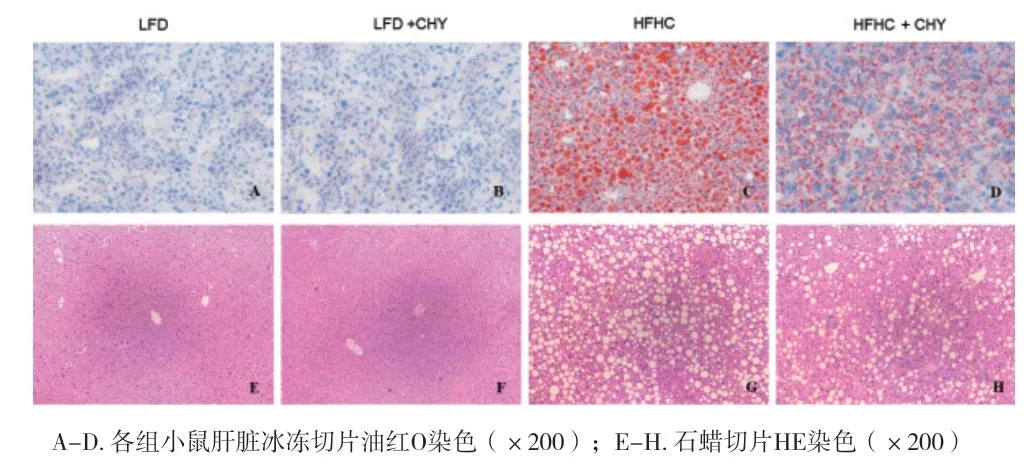
图2 各组小鼠的肝组织病理学结果
2.3 各组小鼠肝脏内炎症因子表达水平比较 与 HFHC组比较,HFHC+CHY组小鼠的肝内KC活化标志分子CD68(P<0.001)、F4/80(P<0.001)和炎症相关 分 子TNF-α(P<0.01)、MCP-1(P<0.001)、TLR4(P<0.05)的mRNA水平均显著下降,见图3 A-B。肝组织匀浆ELISA结果显示,HFHC+CHY组小鼠肝内TNF-α(P<0.01)、IL-1β(P<0.001)的表达水平均明显下降,见图3C。小鼠肝脏组织行IHC CD68与F4/80染色,结果显示HFHC+CHY干预组的CD68和F4/80阳性灶明显减少,说明CHY可改善HFHC诱导的KC活化,见图4-5。

图3 A-B. 各组小鼠肝内CD68、F4/80、TNF-α、MCP-1及TLR4的mRNA水平比较;C. 各组小鼠肝脏炎症因子TNF-α、IL-1β 水平比较
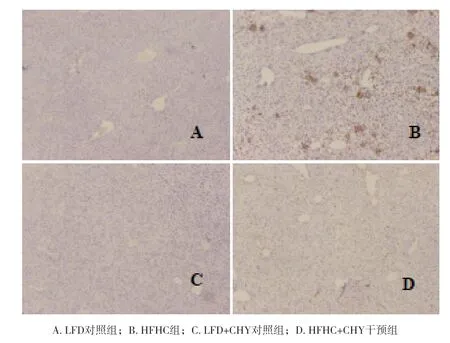
图4 各组小鼠肝脏组织CD68免疫组化结果(DAB×200)
2.4 各组小鼠肝脏内FXR及SHP mRNA信号分子表达水平比较 与LFD对照组比较,NASH模型组小鼠肝内FXR(P<0.001)、SHP(P<0.001)的表达均显著下调,经CHY干预后,FXR(P<0.01)、SHP(P<0.01)的表达均显著上调,见图6。Western blot实验结果显示,NASH模型组小鼠的肝内FXR信号受损,FXR、SHP分子蛋白的表达显著下降,经CHY干预后发生明显上调,见图7。

图5 各组小鼠肝脏组织F4/80免疫组化结果(DAB×200)

图6 各组小鼠肝脏FXR及相关分子SHP mRNA 的表达
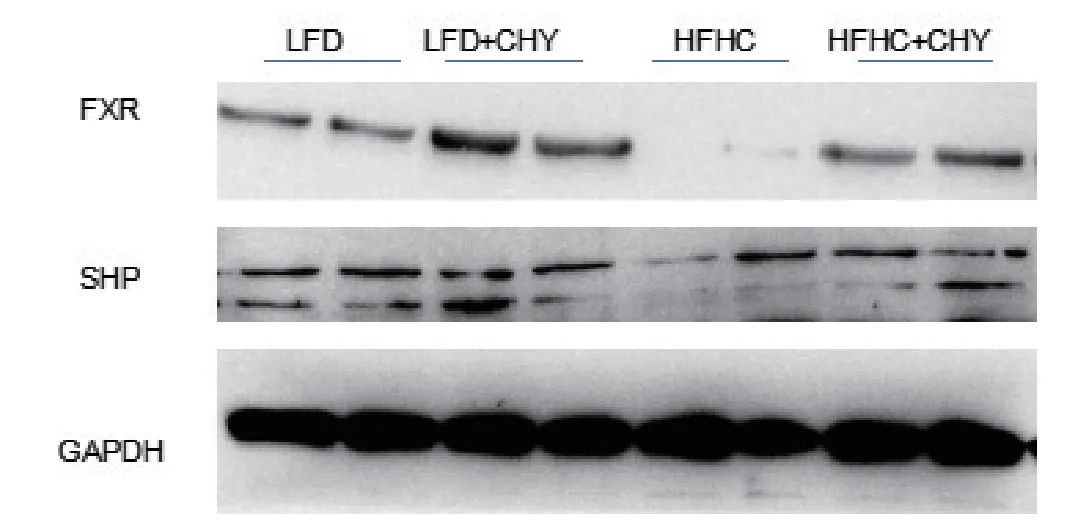
图7 各组小鼠肝内FXR及SHP蛋白的表达水平
3 讨论
近年来,肠道菌群被认为是NASH“多重打击”中的一个重要环节[8]。饮食、药物、内源性激素等原因导致的菌群失调破坏肠道屏障功能,产生过度的内毒素和PAMPs[9]通过通透性增加的肠道屏障,经门静脉循环到达肝脏,激活肝内炎症的级联反应,可造成长期慢性的肝脏炎症损伤。有证据显示,NASH动物模型经CHY干预治疗可明显改变肠道微生物的菌群结构,减少肠源性内毒素和毒性代谢产物的产生与吸收,修复肠道屏障功能,恢复肠道的通透性,从而达到改善NAFLD/NASH的作用。胆汁酸作为肠道菌群代谢物的一种,具有体内FXR等受体的天然配体,其介导的生物学信号,尤其是FXR信号,可以通过抑制CYP7A1、CYP8B1两种胆汁酸合成酶的表达,从而负反馈调控胆汁酸的合成,在NASH的发展中起重要作用[10]。研究表明,敲除FXR可以破坏机体的糖脂代谢,促进肝脏的脂肪变性及炎症的进展,应用外源性FXR抑制或激动剂、或是消除内源性胆汁酸均可显著改善NAFLD的进展[11]。本研究试图验证CHY干预与FXR信号表达的关系,并探究其与HFHC诱导的NASH是否相关。
本研究发现,HFHC诱导12周的ApoE-/-小鼠出现明显的肝脏脂肪性变与炎症表现,转氨酶、血脂等血清学指标和CD68、F4/80、TNF-α等炎症因子水平表达均明显升高,且与肝脏组织病理学表现一致。经CHY干预后,HFHC模型小鼠的各项炎症指标均明显改善,病理学结果亦证明CHY干预能够减轻肝脏炎症。CD68与F4/80是Kupffer细胞的标志物,而Kupffer细胞募集和活化在NAFLD炎症的发生、发展中起着十分重要的作用[7,12],提示CHY对炎症的改善作用可能与其对Kupffer细胞活化的抑制有关。另外,NASH模型小鼠出现肝内FXR信号相关分子的显著下调,包括FXR、SHP。经CHY干预后,NASH模型小鼠的FXR信号抑制状态得到明显改善,可能是CHY通过激活胆汁酸代谢过程中的FXR信号,减轻KC细胞的活化,抑制了NASH的发生发展。
综上,本研究证实CHY对NASH具有防治作用,为将CHY作为防治NASH的潜在药物提供了实验依据。

