miR-193a-3p通过LGR4/ATF4信号的上调促进成骨细胞分化
马伟杰,白金喜,李江平,王 斌 (.广州市南沙区中医医院外二科,广东 广州 546;.佛山市三水区人民医院创伤骨科,广东 佛山 5800)
骨重塑主要受成骨细胞代谢和破骨细胞代谢之间的平衡控制[1]。成骨细胞是指在调节产后骨形成中起重要作用的成骨细胞。破骨细胞是骨基质中溶解无机成分的吸收细胞。成骨细胞通过产生骨基质蛋白和碱性磷酸酶(ALP)促进骨形成,诱导骨基质矿化。成骨细胞分化是由各种生长因子和激素触发的,这些因子和激素有助于骨骼发育和改善骨骼发育[2]。因此,试图改善成骨细胞分化是一种潜在的、有前途的治疗骨损伤和骨丢失策略,如防治骨质疏松症或骨折。
microRNA(miRNA)是成骨细胞分化的关键调节剂。据报道,miRNAs参与了各种生物反应,包括细胞增殖、凋亡和分化[3]。miRNAs在成骨细胞分化和骨形成中起着重要的协调作用。然而,miRNAs在成骨细胞分化中的精确调控网络仍不清楚。有研究在成骨细胞分化的诱导过程中,miR-193a-3p的表达发生了改变影响成骨细胞分化过程,诱导mRNA的降解和翻译抑制[4]。
LGR4又称G蛋白偶联受体48,是G蛋白偶联受体的成员[5],在各种生理功能中起着至关重要的作用。越来越多的研究表明,LGR4在调节骨形成和重塑中起着重要作用。研究表明,LGR4促进成骨细胞分化同时抑制破骨细胞分化[6]。因此,LGR4是骨形成的关键调节因子,是改善骨疾病的一个有用的靶点。
近年来,miR-193a-3p由于其在各种生物过程中的重要作用而得到了广泛的研究。 先前的一项研究报道,在诱导成骨细胞分化过程中,miR-193a-3p的表达发生了改变[7]。 然而,miR-193a-3p在成骨细胞分化过程中的作用靶点和调控机制尚不清楚。本研究旨在探讨miR-193a-3p在调节成骨细胞分化中的确切靶点及其机制。
研究方案按照1964年赫尔辛斯基宣言有关规定,经由佛山市三水区人民医院和广州市南沙区中医医院伦理委员会审查通过。选取两院2019年7月~2021年1月收治的骨质疏松患者20例。现报告如下。
1 材料与方法
1.1细胞培养和成骨细胞分化:骨髓间充质干细胞细胞模型(hBMSCs)由髂前上棘骨穿刺术取骨质疏松患者骨髓组织,在DMEM-F12(Gibco,美国)中培养,添加10%胎牛血清(TaKaRa,中国),2 mm L -谷氨酰胺和1%青霉素-链霉素混合。293T细胞由中国科学院干细胞库(上海)提供,在DMEM(Gibco,美国)中培养,补充10%FBS和1%青霉素-链霉素混合物。 细胞维持37℃时,含有5%CO2和95%的空气。为了诱导成骨细胞分化,将BMSCs培养在含有100 nm地塞米松、10 mMb-甘油磷酸和50 mM抗坏血酸的成骨分化培养基中。每2天更新一次。
1.2细胞转染:Agomi R-193a-3p、antagomi R-193a-3p及其阴性对照从基因公司(TaKaRa,中国)购买,并根据制造商的协议,使用Lipofectamine RNAiMAX转染试剂(赛默飞公司,美国)转染细胞。LGR4和ATF4 shRNA Lentiviral颗粒(赛默飞公司,美国)按照Manu-facturer的指示转化为细胞。
1.3RNA提取与实时定量聚合酶链反应(RT-qPCR):总RNA的提取使用TRIZOL试剂(铎洋生物有限公司,广州)遵循制造商的协议。为了检测miRNA,使用TaqMan微RNA反向转录试剂盒(TaKaRa,中国)进行cDNA合成,并使用TaqMan微RNA检测试剂盒(TaKaRa,中国)进行RT-qP CR进行cDNA扩增。对于mRNA的检测,使用M-MLV反转录酶(TaKaRa,中国)进行逆转录,并使用Power SYBR Green PCR Master Mix(铎洋生物有限公司,广州)进行cDNA的扩增。以GAPDH为内参,进行mRNA表达正常化。比较用2-ΔΔCT方法对数据进行分析,并将其表示为与对照相比的变化。
1.4ALP活性的测定:用ALP测定试剂盒(伯乐公司,美国)测定活性。细胞被俘获后,用裂解缓冲液溶解。离心后收集上清液,然后转移到96孔板中。然后,将上清液与对硝基苯磷酸酯(PNPP)和反应缓冲液在37°C下孵育10 min,最后使用酶标仪在570 nm下测试了吸光度值(OD值)。
1.5基质矿化的检测:采用茜素红(ARS)(伯乐公司,美国)染色法测定基质矿化。细胞用PBS洗涤,然后,用4%甲醛固定细胞1 h,室温下用40 mM ARS溶解(伯乐公司,美国)孵育15 min。用蒸馏水洗涤细胞,除去未结合的染料分子,在37℃下溶解10%十六烷基吡啶氯化铵30 min,检测540 nm处的OD值。
1.6双荧光素酶报告试验:用PCR扩增含有miR-193a-3p结合序列的小鼠LGR4 3′-UTR,并将其插入pmirGLO报告载体(Promega,美国)。结合区域突变在LRG43′-UTR是产生的一种快速改变定向突变试剂盒(Stratagene,美国)。用LipofectamineRNAiMAX转染试剂(伯乐公司,美国)将构建的pmirGLO-LGR4 3′-UTR载体与AgomiR-193a-3p共转染293T细胞。在孵育48 h后,用双荧光素酶报告检测系统(Promega,美国)测量荧光素酶活性。用光度计检测荧光素酶活性,将萤火虫荧光素酶活性标准化为Renilla荧光素酶活性。

2 结果
2.1miR-193a-3p在成骨细胞分化过程中表达下调:为了探讨miR-193a-3p在成骨细胞分化中的潜在作用,我们研究了miR-193a-3p在成骨细胞分化过程中的表达变化。培养BMSCs诱导成骨细胞分化,在第1天、第7天和第14天测定miR-193a-3p的表达水平。结果表明,miR-193a-3p的表达水平在成骨细胞分化过程中,以时间依赖性的方式显著下调(见图1)。结果表明,miR-193a-3p可能在成骨细胞分化中起重要作用。

图1 miR-193a-3p在成骨细胞分化过程中的表达水平
2.2miR-193a-3p调节骨髓间充质干细胞的成骨细胞分化:为了研究miR-193a-3p是否调节成骨细胞的分化,我们分别通过转染AgomiR-193a-3p和AntagomiR-193a-3p在BMSCs中进行了过表达实验。我们发现转染AgomiR-193a-3p的BMSCs水平上调,而转染AntagomiR-193a-3p的BMSCs水平下调。见图2。

图2 转染AgomiR-193a-3p和AntagomiR-193a-3p在BMSCs中过表达
为了研究miR-193a-3p的精确生物学功能,我们检测了miR-193a-3p对ALP活性和基质矿化的影响。结果表明,miR-193a-3p的过表达下调了BMSCs的ALP活性,抑制了BMSCs的基质矿化。见图3。
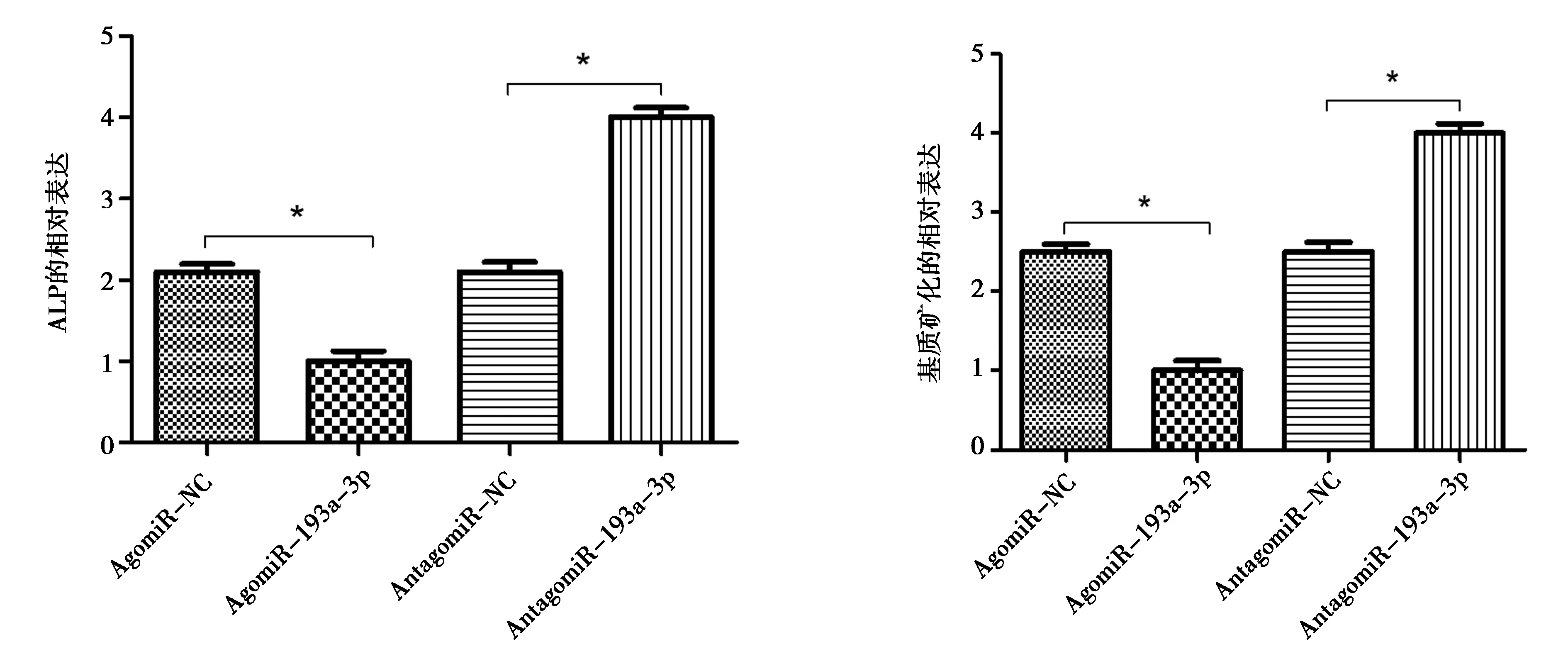
图3 miR-193a-3p对ALP活性和基质矿化的影响
评估miR-193a-3p对成骨细胞标记基因Runx2表达的调节作用。结果表明,miR-193a-3p的过表达则下调Runx2的表达。见图4。

图4 miR-193a-3p的过表达时Runx2的表达
2.3确定LGR4为miR-193a-3p的靶基因:为了阐明miR-193a-3p调控成骨细胞分化的潜在机制,我们利用生物信息学分析方法寻找了miR-193a-3p的候选靶基因。我们发现LGR4是骨形成的关键调节因子,被预测为miR-193a-3p的潜在靶基因。LGR4mRNA的3′-UTR对miR-193a-3p具有保守的结合位点。见图5。
为了验证miR-193a-3p是否直接针对LGR4,我们构建了含有野生型(WT)或突变型(MT)结合位点的LGR4 3′-UTR的荧光素酶记者。荧光素酶报告试验表明,miR-193a-3p的过表达显著降低了含有WT结合位点的LGR4 3′-UTR荧光素酶报告者的荧光素酶活性。然而,miR-193a-3p的过表达对含有miR-193a-3pMT结合位点的LGR43′-UTR荧光素酶没有明显影响。见图6。

图6 荧光素酶报告试验miR-193a-3p的过表达对WT、MT结合位点的LGR43′-UTR
检测miR-193a-3p对LGR4表达的调节作用。发现miR-193a-3p的过表达显著下调LGR4的表达。见图7。
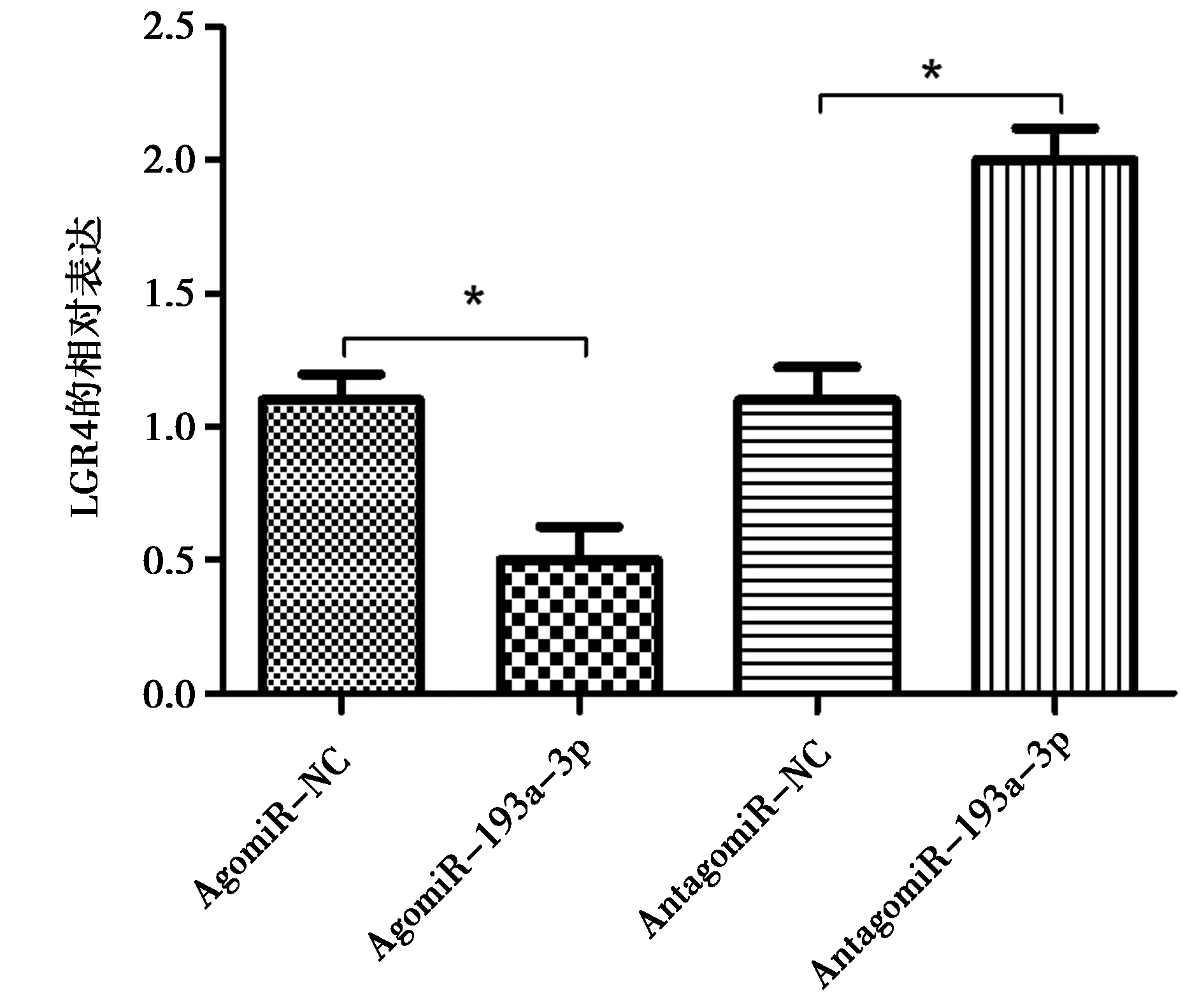
图7 检测miR-193a-3p对LGR4表达的调节作用
综上所述,这些结果表明miR-193a-3p直接与LGR4 3′-UTR结合,并负调控LGR4的表达。
2.4miR-193a-3p通过LGR4调节ATF4的表达:为了进一步研究miR-193a-3p在调节成骨细胞分化中的分子基础,我们检测了miR-193a-3p对调节骨信息的LRG4下游靶点ATF4表达的调节作用。结果显示miR-193a-3p的过表达显著降低了ATF4的表达,而miR-193a-3p的抑制促进了ATF4的表达。见图8。

图8 miR-193a-3p对调节骨信息的LRG4下游靶点ATF4表达的调节作用
3 讨论
miR-193a-3p是一种重要的调节成骨细胞分化的因子,据报道,miR-193a-3p在各种细胞过程中起着重要作用[8]。miR-193a-3p参与各种细胞的细胞分化。miR-193a-3p被报道用于调节髓系前体的分化,在急性髓系白血病中起着重要作用[9]。然而,miR-193a-3p是否参与成骨细胞分化尚不清楚。在本研究中,我们发现miR-193a-3p在诱导成骨细胞分化过程中明显下调。miR-193a-3p是人脂肪源干细胞[10]成骨细胞分化过程中下调的miRNAs之一。重要的是,我们发现抑制miR-193a-3p促进了BMSCs的成骨细胞分化,而miR-193a-3p的过度表达则抑制了BMSCs的成骨细胞分化,表明miR-193a-3p在成骨细胞分化中起着重要作用。最近的一项研究报告miR-193a-3p通过靶向高迁移率组蛋白1抑制BMSCs成骨细胞分化[11],提示miR-193a-3p在调节成骨细胞分化具有明显的机制性。以上支持miR-193a-3p通过调节成骨细胞分化在骨形成中的重要作用。LGR4已成为骨形成的重要调节因子。 LGR4基因敲除小鼠成骨细胞分化受损。LGR4的表达受骨形态基因蛋白2的调控,该蛋白能诱导成骨细胞在体外中的分化。研究表明,LGR4通过环磷酸腺苷/蛋白激酶A通路激活ATF4的表达,促进成骨细胞分化和骨形成[4]。LGR4介导的Wnt/b-catenin信号通路也有助于促进成骨细胞的分化。LGR4已被鉴定为R-海绵蛋白2的受体,通过激活Wnt/b-catenin信号通路促进成骨细胞分化[12]。阻断LGR4可阻碍干细胞分化,并干扰Wnt/β-catenin信号。除了调节成骨细胞的差异,LGR4还调节破骨细胞的分化。研究表明,LGR4结合RANKL在体外和体内抑制破骨细胞分化[13]。下调LGR4参与诱导RAW264.7细胞分化,通过调节成骨细胞分化和破骨细胞分化来重塑。在本研究中,我们确定LGR4为miR-193a-3p的靶基因。我们发现抑制miR-193a-3p上调LGR4表达,这有助于促进成骨细胞分化。此外,我们还阐明了miR-193a-3p抑制诱导的成骨细胞分化与ATF4表达的上调有关,证实了LGR4/ATF4信号在成骨细胞分化中的重要性。ATF4是通过诱导骨钙素、骨唾液蛋白和胶原的表达来调节成骨细胞分化的关键转录因子,有助于骨形成[14]。 因此,我们的研究提示了调节LGR4/ATF4信号的潜在靶点,并强调了miR-193a-3p/LGR4/ATF4轴在调节成骨细胞分化中的重要作用。总之,我们的结果表明,抑制miR-193a-3p通过上调LGR4/ATF4信号促进BMSCs成骨细胞分化,靶向miR-193a-3p激活LGR4/ATF4信号可能是改善骨形成和防止骨质疏松等骨疾病中一种有用的方法。

