不同OCT分型糖尿病性黄斑水肿对玻璃体腔注射康柏西普的疗效差异及相关因素分析
白阳 孟娜娜 贡亦清 周晓敏 赵治
糖尿病视网膜病变(diabetic retinopathy,DR)是发达国家致盲和导致视觉损害的主要原因之一[1]。其中,糖尿病性黄斑水肿(diabetic macular edema,DME)是DR患者视力下降的主要原因[2]。糖尿病患者的血-视网膜屏障一旦被破环,视网膜毛细血管渗透性增加,局部视网膜增厚和水肿,累及黄斑区,即形成DME[3]。近几年玻璃体腔注射抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物已成为目前临床上治疗DME的一线治疗方案,能显著改善黄斑区视网膜的水肿程度,提高视力[4]。但是,不同研究结果都提示DME对抗VEGF治疗的应答情况个体差异较大,比如Protocol I研究的结果显示约52%的患者在接受抗VEGF治疗2年后视力改善在2行以下,同时约40%的患者有持续的视网膜水肿,而Protocol T研究结果也显示约32%~66%的患者连续6次注射玻璃体腔行抗VEGF治疗后依然存在黄斑区的水肿[5,6]。因此,寻找与抗VEGF应答反应相关的生物学标志,揭示不同应答反应的背后机制成为DME治疗的研究热点。基于相干光层析成像术(optical coherence tomography,OCT)的DME形态分型[7]在临床上被用来指导抗VEGF治疗,Otani[8]最早根据OCT的形态学特征将DME分为:海绵状视网膜水肿型(sponge-like swelling,SLS),黄斑囊样水肿型(cystoid macular edema,CME)和浆液性视网膜脱离型(serous retinal detachment,SRD)。本研究旨在回顾不同OCT分型的DME接受玻璃体腔内注射康柏西普的疗效差异,并分析DME患者接受抗 VEGF治疗应答良好的相关因素,以期为临床治疗提供参考。
资料与方法
一、患者资料
回顾性病例研究。分析2018年8月至2020年8月在江苏大学附属人民医院眼科就诊的DME患者。纳入标准:(1)符合DME的临床诊断标准;(2)以往6个月未接受过任何的抗VEGF药物玻璃体腔注射的治疗;(3)愿意接受3+PRN的抗VEGF治疗方案并能接受规律的随访。排除标准:(1)屈光间质混浊影响眼底观察者;(2)以往曾经接受过任何的视网膜激光治疗的患者;(3)伴有年龄相关性黄斑变性,视网膜静脉阻塞等其他也能够导致黄斑水肿的眼底疾病者;(4)术前患有影响视功能的视神经及其他视网膜病变。
采集患者年龄、性别、身高、体重、糖尿病病程、空腹血糖、糖化血红蛋白(HbAlc)、胰岛素使用情况、收缩压和舒张压等全身指标;所有患眼均行视力、眼压、裂隙灯显微镜等眼科常规检查以及散瞳后眼底彩色照相和OCT检查。
二、治疗方法
所有患者均签署知情同意书,手术均由同一医师完成,手术步骤如下:患眼自术前3 d起局部使用盐酸左氧氟沙星(日本参天制药)滴眼液点眼,4次/d。患者取平仰卧位,采用倍诺喜滴眼液(日本参天制药)表面麻醉,注射前5%聚维酮碘浸泡消毒结膜囊,时间约60 s,然后生理盐水冲洗结膜囊。于颞上方角巩缘后3.5~4 mm处垂直进针,向玻璃体腔注入康柏西普(成都康弘药业)0.5 mg,术毕棉签压迫止血片刻,涂氧氟沙星凝胶(沈阳兴齐制药)后包术眼。采取3+PRN的治疗方案,规律随访6个月。
三、观察指标
观察指标主要包括患眼的最佳矫正视力(best-corrected visual acuity,BCVA)和OCT指标。其中BCVA 检查由同一位经验丰富的验光师采用国际标准视力表进行检查,结果转换为最小分辨角对数(logMAR) 视力进行分析。应答分级参照以往研究[9]对抗VEGF治疗后的黄斑区OCT形态改变进行分析。
OCT检查采用德国海德堡公司的OCT仪(Heidelberg HRA+OCT Spectralis, Germany, HRA2型号)进行采用快速扫描,行6 mm×6 mm黄斑区的快速连续立体扫描,扫描方式选择垂直方向的线性扫描,水平方向从左到右,垂直方向从下到上进行扫描。所有 OCT 检查均由同一位经验丰富的技师完成。OCT观察指标包括黄斑中心厚度(central foveal thickness,CFT)、玻璃体黄斑界面状态、视网膜椭圆体带完整性(ellipsoid zone,EZ) 及视网膜外界膜完整性(external limiting membrane,ELM)。以黄斑中心凹为中心,测量患眼视网膜神经上皮层内界膜至视网膜色素上皮(retinal pigment epithelium,RPE)层强反光带内侧的距离,以此作为CFT。玻璃体黄斑界面状态根据OCT形态提示记录玻璃体黄斑牵拉(vitreous macular traction,VMT)和黄斑前膜(epiretinal membrane,ERM)的比例。EZ和ELM的完整性参照黄斑中心凹水平扫描线1 mm范围内EZ和ELM的连续性,分别记录为完整或不完整。所有OCT图像结果均由两名有经验的眼科医师独立进行判断和测量,出现结果不一致或相差较多时由第三名高年资的医师进行判断,所有定量测量重复测量3次,取平均值。
参照文献[10]的标准并结合OCT检查结果,将DME分为弥漫增厚型(diffuse retinal thickening,DRT)、黄斑囊样水肿型(CME)和浆液性视网膜脱离型(SRD)。见图1。

四、统计学分析方法
结 果
一、患者一般情况
最终入组61例(78只眼)纳入本研究。其中,男性25例(40只眼),女性36例(38只眼)。年龄31~79岁,平均年龄(63.4±10.5)岁。3组间在DME病程,CFT以及ELM和EZ的完整性上差异有统计学意义,而在性别、基线BCVA、年龄、HbA1c、SBP、胰岛素使用比例以及玻璃体黄斑界面状态上无明显差异(表1)。
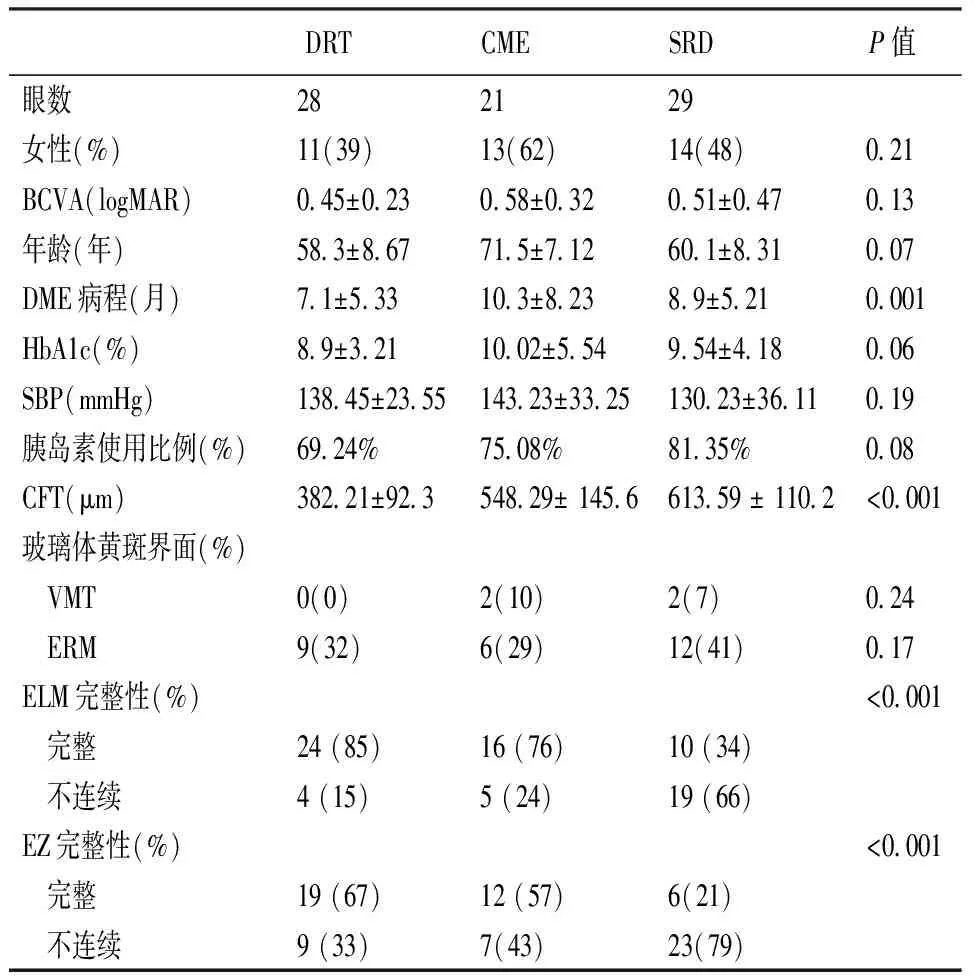
表1 不同DME分型基线时的一般资料和眼部参数比较
二、不同DME分型接受3+PRN康柏西普眼内注射6个月后视力和OCT特征比较
不同DME分型接受了3+PRN康柏西普眼内注射6个月后3组间CFT下降值分别为(130.21±89.03)、(227.58±131.64)和(263.58±98.02)μm,差异有统计学意义(P=0.001),SRD型下降最多。而3组间BCVA(logMAR)改变值分别为0.27±0.21,0.18±0.23,0.14±0.12,差异有统计学意义(P=0.02)。而3组间在随访6个月中的累计眼内注射次数分别是3.3±1.2,4.5±1.3,4.9±1.7,差异也具有统计学意义(P=0.03)。DRT型BCVA改善最大,累计注射次数最少。第6个月时3组间的CFT和EZ,ELM完整性之间的差异也具有统计学意义,DRT的CFT更少,EZ和ELM的完整性更好(表2)。
三、不同DME分型接受3+PRN康柏西普眼内注射6个月后应答情况比较
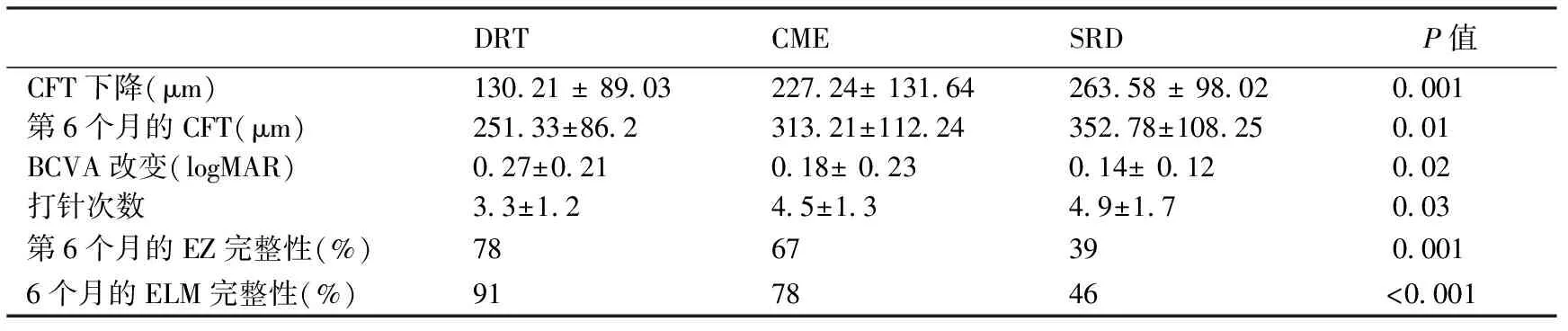
表2 不同DME分型接受3+PRN康柏西普眼内注射6个月后视力和OCT特征比较
依据抗VEGF应答分级标准,不同DME分型接受3+PRN康柏西普眼内注射6个月后应答情况存在明显差异,DRT型患者中应答良好的比例为15/28(53.57%),CME型患者中应答良好的比例为5/21(23.81%),而SRD型患者中应答良好的比例为7/29(24.14%)。3组患者之间在抗VEGF治疗的应答良好的比例上有显著差异(P=0.01),DRT型应答最好(表3)。

表3 不同DME分型接受3+PRN康柏西普眼内注射6个月后应答情况的比较
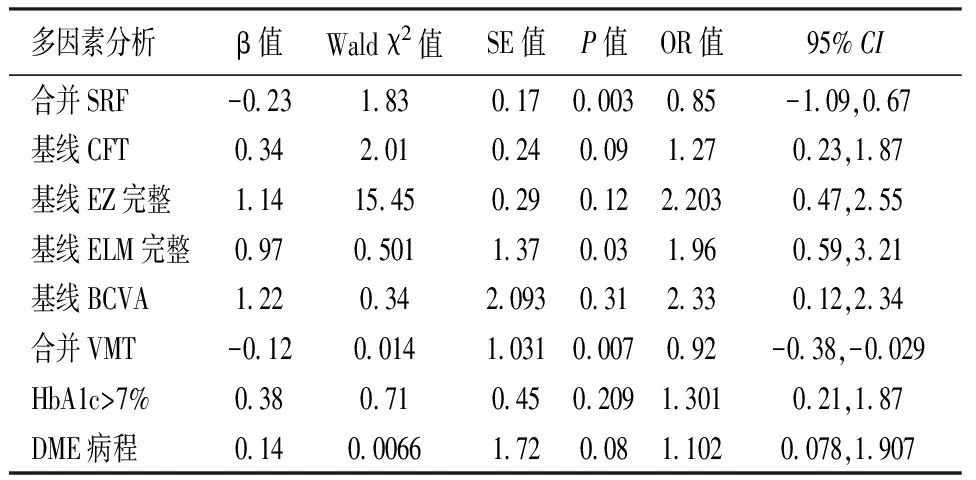
表4 DME对抗VEGF治疗应答良好的多因素logistic回归分析
四、DME对抗VEGF治疗应答良好的多因素Logistic回归分析
将合并SRF和VMT,DME病程,HbA1c>7%,基线CFT,EZ和ELM 完整性以及基线BCVA作为自变量,与应答良好(因变量)作多因素logistic回归分析。结果显示合并SRF(OR=0.85,P=0.003)和VMT(OR=0.92,P=0.007)以及基线ELM不完整(OR=1.96,P=0.03)是DME对抗VEGF治疗应答良好的危险因素(表4)。
讨 论
有研究认为高达73%的DR患者的视力损害是由DME造成的[11]。所以治疗DME是阻止DR患者视力下降的重要环节。不同的DME分型或形态学特征都曾用于临床指导DME的治疗[2,7,12]。本研究结果提示DRT型DME对抗VEGF治疗的应答优于CME和SRD型DME,合并SRF和VMT以及不完整的ELM是DME抗VEGF应答良好的危险因素。
Arf等的研究[13]结果认为与DRT型相比,CME型病程更长,BCVA更差,CFT更大,因此DRT型可能早于CME型的发生。同时,DRT型的ELM和EZ完整性也优于CME型。但是SRD型属于DME早期还是更晚期的形态学改变一直有争论[14,15],我们的结果提示SRD病程比DRT型更久,同时ELM和EZ的完整性更差。
不同OCT分型的DME对抗VEGF治疗的应答情况,各个研究[16-18]结论不一,普遍认为DRT型应答较好,但是CME和SRD型对抗VEGF治疗的应答情况比较复杂。其中SRD型DME接受抗VEGF治疗的结论比较有分歧:有研究认为此型DME对抗VEGF治疗应答较差,而对激素的应答可能更好[16,18];另有研究[18-20]认为伴有SRF的DME抗VEGF治疗应答良好。糖尿病患者长期的高血糖导致眼部视网膜血管内皮细胞和周细胞的丢失,微血管瘤的形成和血视网膜屏障的破坏,这些病理改变导致视网膜缺血和血管的高渗透性,血管内的液体和脂质等成分积聚在视网膜各层,导致DME[21,22]。经证实[23]DME患者眼内的VEGF水平明显高于没有DME的DR患者,同时,其他的一些炎症因子如白细胞介素-6(interleukin,IL-6、IL-8和单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)-1等也被发现在DME患者眼中高表达[24,25]。目前关于DME对抗VEGF治疗应答个体差异较大的一个较为普遍的被接受的观点就是DME患者眼内的VEGF家族和多种炎症因子表达的比例存在个体差异。本研究结果显示在6个月的随访期中,DRT型患者中应答良好的比例最高(15/28),显著优于CME和SRD型(P=0.01),这与以往的研究[26,27]结果类似。同时,DRT型DME接受抗VEGF的次数最少,BCVA提升也最明显,这些结果都提示我们DRT型对抗VEGF应答反应良好,可能与其眼内的VEGF高表达而炎症因子表达不显著有关[28]。
不同亚型的DME发病机制存在差异也可能是导致不同的应答反应的原因,比如DRT型中Müller细胞对视网膜内液体的转运功能受损,而CME型Müller细胞液化坏死及相关炎症因子高表达,SRD型则被认为与ELM功能受损和脉络膜毛细血管的高渗透性有关[29,30]。同时,有研究[31]证实在DRT型和SRD型DME患者的房水中分别检测出VEGF和IL-6的浓度与相应的CFT密切相关,提示不同形态学特征的DME可能与不同的细胞因子高表达相关。SRD型与IL-6等炎症因子高表达相关,因此单纯抗VEGF治疗应答欠佳。Müller细胞是一种特殊的大胶质细胞,通过控制细胞间离子、水和碳酸氢盐的运输来调节血-视网膜屏障的紧密性。由于毛细血管损伤而缺血和炎症反应,改变了Müller细胞的钾离子通道导致细胞内积液,所以在中心凹处视网膜的外丛状层出现了海绵样水肿;而如果视网膜水肿继续存在,Müller细胞和邻近的神经细胞出现液化坏死,深层毛细血管网缺失明显的区域也容易聚集液性囊腔,并导致视网膜囊性形成[32]。而糖皮质激素还可以通过抑制炎症因子减轻Müller细胞的肿胀,减少其液化和坏死,故治疗CME型DME使用糖皮质激素可能比抗VEGF更有效[33]。
以往的研究大多关注DME接受抗VEGF治疗后与BCVA相关的因素,认为与BCVA恢复良好的相关因素主要包括椭圆体带的完整性和视网膜内层结构的完整性以及抗VEGF治疗早期的黄斑水肿下降程度等[34,35]。本研究着眼于DME接受抗VEGF治疗后的应答反应,结果显示合并SRF和VMT以及基线ELM不完整是DME对抗VEGF治疗应答良好的危险因素。合并SRF即为SRD型,应答不佳的原因上文已分析。而是否合并VMT是多个OCT下DME分型标准考量的因素之一[8,36],也是行玻璃体切割术的指征之一,因此黄斑区玻璃体后脱离不完全导致的玻璃体黄斑牵拉是临床上比较常见的抗VEGF应答不佳的原因之一。而ELM被视作第三个外层血视网膜屏障,ELM的破坏与SRF的形成密切相关,因此ELM不完整的DME对抗VEGF治疗应答欠佳[37]。
本临床研究存在一定的局限性。首先,随访时间较短,仅为6个月,而DME抗VEGF治疗长期随访会出现反复发作和应答下降的可能,因此需要更长期的随访资料来支持我们的研究结论;其次,我们的样本量偏小;最后,我们未对OCT里的高反射点等指标进行比较,也未利用血流OCT对于视网膜的血流信号等进行定量测量。对于这部分的影像学参数在不同分型DME抗VEGF治疗过程中的变化和相关分析,在今后的研究中我们会进一步完善。
综上所述,本研究对比3种不同的OCT分型的DME在接受抗VEGF治疗3+PRN后随访6个月的视力和解剖学变化,发现3组患者之间在抗VEGF治疗的应答良好上有显著差异,DRT型应答最好。不同DME分型接受了3+PRN抗VEGF治疗6个月后 CFT下降值,BCVA改变值和累计眼内注射次数差异有统计学意义。合并SRF和VMT以及基线ELM不完整是DME对抗VEGF治疗应答良好的危险因素。我们需要进一步扩大样本量,延长随访期,并且增加观测的影像学指标,以期找出更好的DME抗VEGF治疗的应答预测指标。

