植物生物反应器表达系统研究进展
许惠滨 王福祥

摘 要:由于成本低廉、易于规模化生产、可减少污染哺乳动物病原的风险且能对表达蛋白进行翻译后修饰等优点,植物正逐渐成为一种重要的重组蛋白生产平台,而以转基因植物作为工业与化工产品生产的天然生物反应器也越来越受关注。植物生物反应器主要有稳定表达系统和瞬时表达系统,概述了这两种不同的表达系统的优缺点及其研究进展,并阐述了植物生物反应器的发展趋势,以期为植物生物反应器的发展和应用奠定理论基础。
关键词:植物;重组蛋白;生物反应器;表达系统
中图分类号:S 31 文献标志码:A 文章编号:0253-2301(2021)09-0076-06
DOI: 10.13651/j.cnki.fjnykj.2021.09.013
Research Progress of Plant Bioreactor Expression Systems
XU Hui bin 1, WANG Fu xiang2,3
(1.Marine and Agricultural Biotechnology Laboratory, College of Geography and Oceanography,
Minjiang University, Fuzhou, Fujian 350002, China; 2.National Rice Engineering Laboratory of China,
Rice Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China;
3.College of Agriculture, Fujian Agricultral and Forestry University, Fuzhou, Fujian 350002, China)
Abstract: Plants are emerging as a promising platform for recombinant protein production due to time and cost efficiency, scalability, lack of harboured mammalian pathogens and possession of the machinery for eukaryotic post translational protein modification.Transgenic plants are gaining increasing attention from the industry as a natural bioreactor for the production of industrial and chemical products. Plant bioreactor mainly consists of stable expression system and transient expression system. Here, we overview the advantages and disadvantages of different expression systems and their research progress, and the development trend of plant bioreactor was also described. In order to lay a theoretical foundation for the development and application of plant bioreactor.
Key words: Rlant; Recombinant protein; Bioreactor; Expression system
得益于近年來系统生物学和分子生物学等多方面技术的发展,合成生物学的研究对象正逐步过渡到更为复杂的多细胞体系。植物拥有丰富的内膜系统和细胞器、高度特化的生物合成基因簇、精细的代谢调控网络,为开展相关研究提供了理想的模式体系。植物生物反应器是指通过基因工程途径,以常见的农作物作为“化学工厂”,生产具有高经济附加值的医用蛋白、工农业用酶、特殊碳水化合物、生物可降解塑料、脂类及其他一些次生代谢产物等生物制剂的方法[1] ,在过去的几十年里,它已发展成为生产有用重组蛋白的重要平台。Fisher等首次引入分子农业或“生物制药”的概念来描述“植物中重组蛋白的产生”[2-3] 。早期,该领域的研究对象主要是重组大分子,如血液蛋白、疫苗和抗体,目前也涉及化妆品原料和医疗治疗方面[4] 。
表达/生产系统的选择不仅取决于研究者自身的需求,还取决于生产目标生物制剂的最终目的和功能。传统的基于大肠杆菌、酵母、昆虫或哺乳动物细胞系统的生物制药大规模生产平台已经建立并不断完善。复杂的治疗性蛋白质必须经过适当的折叠或加工以达到所需的生物活性,这需要在酵母或哺乳动物细胞系统中而不是原核生物中产生,然而哺乳动物细胞培养中最令人担忧的是扩大规模的高运营成本和动物传播病毒或病毒粒子的潜在污染[5] 。鉴于这些问题,植物生物反应器是生产特定重组蛋白的一个很好的选择。因为它具有很多优势:首先,植物只需要光、水和土壤等温室条件就能生产蛋白质,相比细菌、昆虫细胞和哺乳动物培养系统所需的生物反应器便宜;其次,与传统生产系统不同,人畜共患病病原体无法感染植物,因此不会成为分子农业衍生产品的污染物来源;再次,通过将密码子优化、细胞器特异性启动子的加入、N聚糖的人源化和瞬时转染系统等技术进一步提高了分子农业的优势,产量超过1 mg·g-1的新鲜植物重量;最后,植物瞬时转染系统也提高了生产速度,在转染成株后数日内即可收获,而不是在数月内获得稳定表达[6-7] 。植物作为最廉价的“工厂”,具有广阔的应用前景。如何最大限度提高植物源蛋白表达量是当前研究的重点和难点。为了更好地应用植物生物反应器生产有用重组蛋白,本文对影响外源蛋白表达效率的几种表达系统进行概述,以期促进植物生物反应器的推广和应用。
1 植物表达系统
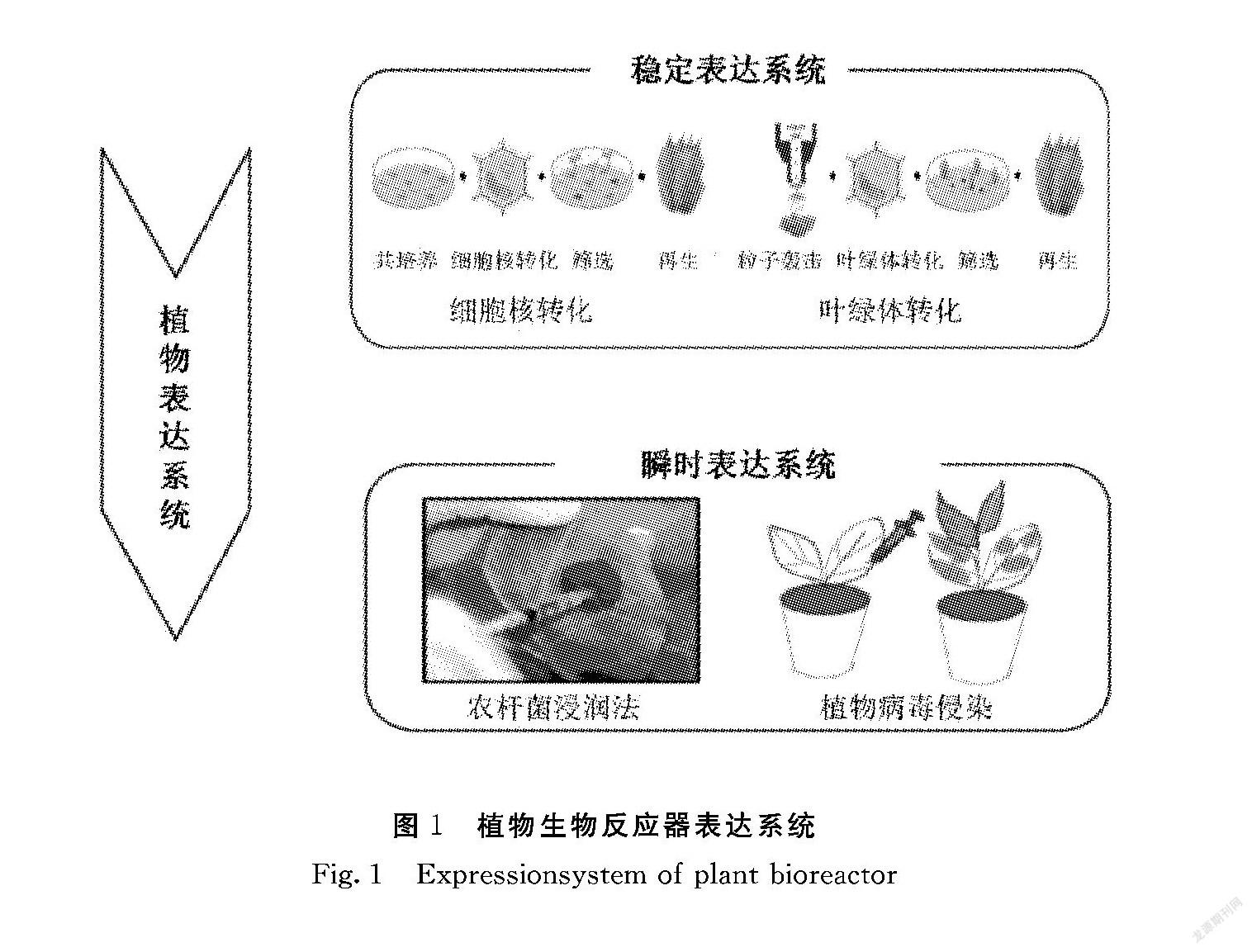
植物中有多种表达系统,归纳起来主要有两大类,既稳定表达系统和瞬时表达系统(图1)[4] ,每种系统都有优缺点(表1),而利用哪种系统取决于使用整株植物或最小加工形式的应用程序。稳定表达系统可以进一步细分为农杆菌介导转化或基因枪轰击使细胞核或叶绿体稳定转化的技术,以及悬浮细胞培养技术;而瞬时表达可以通过植物病毒或农杆菌渗透实现[8-9] 。在早期的研究阶段,稳定表达系统被广泛应用,然而近年来瞬时表达系统已成为首选。
2 稳定表达系统
稳定表达系统是将外源目的基因导入植物细胞中,使其在植物基因组中稳定地整合,并诱导长成新的植株,同时,在植物生长过程中表达目标基因,将目标性状传给子代,成为表达目标蛋白的品系,目标蛋白的表达持久、稳定。
2.1 农杆菌或基因枪介导转化
农杆菌或基因枪介导转化的稳定表达系统是利用稳定遗传转化方法表达和生产重组蛋白质,其优点是操作简便、独特的糖基化模式、来自动物传播污染物的低风险和廉价的存储成本[5,10-11] 。目前已报道了成功利用该系统在烟草、水稻、马铃薯、番茄和莴苣等多种植物中生产有价值的重组蛋白[12-16] 。通过细胞核转化(nuclear transformation)和叶绿体体转化(plastid transformation)两种方法均可获得稳定的重组蛋白转基因植物。
2.1.1 细胞核转化 细胞核转化是应用最早的植物转化体系,它将目的基因随机插入并整合到植物染色体的核基因组中,再经抗性筛选获得表达外源蛋白的植株。由于外源基因整合到核基因组上,使其在植物体内能够稳定表达。细胞核转化已经在许多植物中应用和报道,其不足之处有3个方面:外源蛋白在植物中表达量偏低;为了获得稳定遗传的纯合子需要经过多代筛选,费时费力;转基因植物后代筛选过程中花粉可能会给环境带来基因污染,因此,其种植环境和管理要求严格[17] 。
2.1.2 叶绿体转化 叶绿体转化是将外源基因经同源重组的方式定点整合到叶绿体基因组中。每个植物细胞中含有10~100个叶绿体,每个叶绿体中又含有10~100个质体基因组,因此,外源基因在每个叶绿体中会有100~10000 个拷贝,这样通过叶绿体转化就能够高效表达外源蛋白[18-20] ;它还具有稳定性强[21] 以及由于母性遗传,大多数作物都有开放栽培的可能性。其存在的问题是插入了外源基因的叶绿体基因组只占较少一部分,易形成异质体,而异质体不稳定,须通过去除野生型叶绿体基因组拷贝得到同质体方可稳定遗传。此外,叶绿体中所表达的蛋白不能进行翻译后加工修饰,因此,此系统仅适于表达结构简单的蛋白,如抗菌、抗病毒的亚基疫苗和生长素等[22] 。在叶绿体中开发新的治疗性蛋白质,以满足某些代谢或遗传疾病的紧急医疗需求,在食用植物细胞中表达高水平蛋白质的能力,将冻干细胞在环境温度下储存数月/年而不会失去治疗效果,预示着推进这种低成本、无冷链的传递系统,以降低蛋白质药物的成本,并使急需蛋白质药物的人群能够消费得起。
2.2 悬浮细胞培养
农杆菌转化形成的植株或愈伤组织可以在液体培养基中繁殖,进而产生稳定的悬浮细胞系进行扩大生产。自从首次报道在烟草细胞悬浮培养中生产白蛋白以来,开启了利用各种植物源细胞悬浮培养产生多种药用蛋白的研究[23-24] ,可以制备悬浮细胞的植物种类从烟草扩大到胡萝卜、苜蓿、番茄、大豆、水稻和红花等植物[25] 。這种系统有几个优点,包括生长迅速;提高了重组蛋白生产的连续性;在可控的发酵罐中培养能够避免受到生物或非生物的胁迫,降低了转录后沉默的发生[4,25] 。但是以该系统生产的产品需要经过复杂的下游纯化过程和低温无菌存储运输,其成本相对较高,无法发挥出植物生物反应器的优越性 [6] 。
3 瞬时表达系统
瞬时表达系统是将编码目的基因序列插入病毒基因组中,基于植物病毒对植物的感染,以病毒作为载体将重组病毒接种到植物叶片上,使得目的基因随病毒在植物体内进行复制、转录、翻译和装配,在转基因植物或细胞中产生多拷贝重组蛋白基因[26-27] 。宿主细胞在导入表达载体后不经选择培养,载体DNA随细胞分裂而丢失,目的蛋白的表达时限短暂。20世纪90年代后期,瞬时表达系统主要用于检测载体或目的蛋白在完整或病毒感染的植物中是否表达以及确定重组蛋白的功能[4] 。
转基因植物通常用于获得重组蛋白或者定位蛋白质,但是转基因植株的产生需要大量的时间,表达蛋白的产量也相对较低。而以植物病毒为载体的瞬时表达系统不需要稳定遗传转化,从病毒侵染到高量表达仅仅需要7~ 14 d[28] 。这种表达系统是应用植物病毒在植物中复制、转录和传播,其技术具有简单、快速和产量高等优点[29] ,被广泛接受并用于生产大量重组蛋白。该系统的缺点是技术条件要求高,如质粒的纯度、转染的效率等,而且由于瞬时转染中外源基因进入受体细胞后,存在于游离的载体上,不与基因组染色体相整合,当细胞复制后,诱导的性状消失,使得瞬时转染得到的蛋白质产物保存时间较短,只能持续数天到2周。
3.1 病毒表达载体
常用的植物病毒载体包括烟草花叶病毒(Tobacco mosaic virus,TMV)、花椰菜花叶病毒(Cauliflower mosaic virus,CMV)、豇豆花叶病毒( Cowpea mosaic virus,CPMV)、马铃薯X病毒(Potato X virus,PVX)等。其中,来源于TMV的病毒载体30B具有表达量高的优点,利用该载体在植物瞬时表达GFP,表达量达到总可溶性蛋白的4.8%[30] 。目前,CPMV表达载体已经广泛使用于动物保护性疫苗生产[11] 。
3.2 侵染技术
先前,植物瞬时表达主要有两种方法:一种是通过电击或PEG渗透进行原生质体转化[31] ;另一种是粒子轰击植物表皮细胞或叶片,也称为基因枪法[32-33] 。由于原生质体培养耗时长、成功率低,而基因枪法需要专用的基因枪配套设备,因此,这两种方法均难以广泛应用。与上述两种方法相比,农杆菌介导的瞬时转化具有成本低、操作简单、成功率高等优点,可应用于基因表达检测、基因沉默、亚细胞定位、蛋白质相互作用分析、抑制剂功能鉴定等[34] 。根癌农杆菌作为植物遗传转化的常用工具,主要采用牙签接种法[35] 、注射法[36] 、高压喷射法[37] 和真空渗透法[38] 。这些方法已成功应用于许多植物组织,如拟南芥叶片[39] ;百合花和金鱼草的花瓣;半夏的叶、叶柄和愈伤组织[40] ;生菜和番茄的叶子和果实;苹果、梨、桃子、草莓和橙子的果实[34] 。此外,还有烟草、马铃薯、芥菜、苜蓿、黑眼豆和水稻等,烟草作为受体材料,因其适合培养且能够被多种病毒侵染,故被人们所青睐;而选用马铃薯和西红柿主要是方便进行动物饲喂试验[11] 。
4 展望
地球上所有的生命形式都依赖于光合作用,这是植物将光能转换成化学能的过程。当我们通过DNA重组技术将某一代谢通路引入植物中时,我们就可以将植物转化为一个高效的工厂,而且这个工厂使用结束后还可以转化为肥料,因此,植物是一种理想的生物反应器,也是一个可以生物降解的工厂[41] 。基于植物的表達系统是生产具有药用价值的重组蛋白的强大、可扩展和成本效益高的平台。在分子农业这一总称下,以植物为基础生产药用蛋白是通过在植物或植物细胞中的瞬时表达和稳定转化获得的,具有广阔的应用前景。那么选用哪一种植物作为宿主,选择哪一种表达系统和侵染技术进行蛋白的表达与生产,以及如何解决规模化生产的问题等,还有待进一步研究。这些问题的解决,为植物生物反应器的发展和应用奠定扎实的研究基础,将为外源重组蛋白质的生产和应用开辟更广阔的道路。
植物中有多种表达系统,而每种系统都有其各自的优缺点,在此已经简单介绍了各个系统的一些应用案例。今后,利用植物生产有用重组蛋白的需求将不断扩大,而生产有用重组蛋白的经济可行性将决定生产企业的生存能力。不同的表达系统重组蛋白的表达效率不同,在本文讨论的生产系统中,瞬时表达系统最常被不同的公司采用,目前已有16种安全环保的可上市产品通过室内或室外试验[42] 。以生物反应器为基础的细胞培养系统可以快速扩大规模,并且不含哺乳动物病原体,已经被传统的以发酵为基础的公司所采用。尽管如此,关于植物生物反应器的应用情况仍然存在障碍,研究人员仍需努力通过将各个领域的技术的融合与发展,进而不断拓宽植物生物反应器的应用市场。
参考文献:
[1]杨晶,杜林娜,王法微,等.新型植物生物反应器研究进展[J].2018(5):104-109.
[2]FISCHER R,LIAO YC,HOFFMANN K,et al.Molecular farming of recombinant antibodies in plants[J].Biological Chemistry,1999,380(7-8):825-839.
[3]FISCHER R,DROSSARD J,COMMANDEUR U,et al.Towards molecular farming in the future: Moving from diagnostic protein and antibody production in microbes to plants[J].Biotechnol Appl Biochem,1999,30(2):101-108.
[4]MOON KB, PARK JS, PARK Y, et al.Development of Systems for the Production of Plant DerivedBiopharmaceuticals[J].Plants,2019,9(1):30.
[5]MA J,DRAKE P,CHRISTOU P.The production of recombinant pharmaceutical proteins in plants[J].Nat Rev Genet,2003,4(10):794-805.
[6]刘蓉蓉.转基因植物生产疫苗和药物的研发进展[J].生物技术通报,2017, 33(9):17-22.
[7]CHARLES A.Plant made vaccines and therapeutics:from′Edible Vaccines′ to Ebola therapeutics[J].Plant Biotechnology Journal,2015,13:1013-1016.
[8]FISCHER R, SCHILLBERG S.Molecular Farming:Plant Made Pharmaceuticals and Technical Proteins[M].John Wiley & Sons: Hoboken, NJ, USA, 2004.
[9]STOGER E, MA JK, FISCHER R,et al.Sowing the seeds of success: Pharmaceutical proteins from plants[J].Curr Opin Biotechnol,2005,16(2):167-173.
[10]XU J F, DOLAN MC, MEDRANO G, et al.Green factory: Plants as bioproduction platforms for recombinant proteins[J].Biotechnol Adv,2012, 30(5):1171-1184.
[11]楊丽萍.植物瞬时表达系统的研究进展[J].现代农业研究,2019(5):51-52.
[12]FLOSS DM, MOCKEY M, ZANELLO G, et al.Expression and immunogenicity of the mycobacterial Ag85B/ESAT6 antigens produced in transgenic plants by elastin like peptide fusion strategy[J].J Biomed Biotechnol, 2010, 274346.
[13]TOKUHARA D, LAVAREZ B, MEJIMA M,et al.Rice based oral antibody fragment prophylaxis and therapy against rotavirus infection[J].J Clin Investig, 2013, 123(9):3829-3838.
[14]THANAVALA Y, MAHONEY M, PAL S,et al.Immunogenicity in humans of an edible vaccine for hepatitis B[J].Proc Natl Acad Sci USA,2005,102(9):3378-3382.
[15]CHEN Y H,WANG A X, ZHAO L X,et al.Expression of thymosin α1 concatemerin transgenic tomato (solanum lycopersicum) fruits[J].Biotechnol Appl Biochem,2009, 52(4):303-312.
[16]MOHEBODINI M, JALALI JAVARAN M, ALIZADEH H,et al.Agrobacterium mediated transformation of lettuce (lactuca sativa L.) to express lgG binding protein A and human pro insulin as a fusion protein[J].J Hortic Sci Biotechnol, 2014, 89:719-725.
[17]陈金梅,姜路壹,洪治.植物生物反应器制药的现状及展望[J].生物技术通报,2015, 31(10):1-7.
[18]CARDI T, LENZI P, MALIGA P.Chloroplasts as expression platforms for plant produced vaccines[J].Expert Rev Vaccines, 2010, 9(8):893-911.
[19]RUHLMAN T, VERMA D, SAMSON N, et al.The role of heterologous chloroplast sequence elements in transgene integration and expression[J].Plant Physiol, 2010, 152(4): 2088-2104.
[20]OEY M, LOHSE M, KREIKEMEYER B, et al.Exhaustion of the chloroplast protein synthesis capacity by massive expression of a highly stable protein antibiotic[J].Plant J, 2009, 57(3):436-445.
[21]AHMAD N, MICHOUX F, LOSSL AG,et al.Challenges and perspectives in commercializing plastid transformation technology[J].J Exp Bot, 2016, 67(21):5945-5960.
[22]SIJMONS PC, DEKKER BM, SCHRAMMEIJER B, et al.Production of correctly processed human serum albumin in transgenic plants[J].Biotechnology (N Y), 1990, 8(3):217-221.
[23]HUANG TK, MCDONALD KA.Bioreactor engineering for recombinant protein production in plant cell suspension cultures[J].Biochem Eng J,2009, 45:168-184.
[24]YANO A, MAEDA F, TAKEKOSHI M.Transgenic tobacco cells producing thehuman monoclonal antibody to hepatitis B virus surface antigen[J].J Med Virol, 2004, 73(2):208-215.
[25]GIRARD L S, FABIS M J, BASTIN M, et al.Expression of a human anti rabies virusmonoclonal antibody in tobacco cell culture[J].Biochem Biophys Res Commun,2006, 345(2):602-607.
[26]KUMAR G, KARTHIK L, RAO K V B.Plant vaccines: An overview[J].Microbial Bioprospecting for Sustainable Development ,2018, 35(3):249-263.
[27]郝宇娉,陸琳,杨志红.转基因植物疫苗的研究进展[J].核农学报,2020, 34(12) : 2708-2724.
[28]HEFERON K L.Plant virus expression vectors set the stage as production platforms for biopharmaceutical proteins[J].Virology, 2012, 433(1):1-6.
[29]CHEN Q, LAI H F, HURTADO J,et al.Agroinfltration as an efective and scalable strategy of gene delivery for production of pharmaceutical proteins[J].Adv Tech Biol Med, 2013,1(1):103.
[30]杨丽萍, 金太成, 徐洪伟, 等.植物中瞬时表达外源基因的新型侵染技术[J].遗传, 2013, 35(1):111-117.
[31]SHEEN J.Signal transduction in maize and arabidopsis mesophyll protoplasts[J].Plant Physiol, 2001, 127(4):1466- 1475.
[32]SESSA G, BORELLO U, MORELLI G, et al.A transient assay for rapid functional analysis of transcription factors in arabidopsis[J].Plant Mol Biol Report,1998, 16:191.
[33]SCHWEIZERP J, ABDERHALDEN O, DUDLER R.A transient assay system for the functional assessment of defense related genes in wheat[J].Mol Plant Microbe Interact, 1999, 12:647-654.
[34]ZHAO WT, WEI JH, LIU XD, et al.Main methods and application progress of plant instantaneous expression technology[J].Biotechnol Commun, 2013:294-300.
[35]LU R, MALCUIT I, MOFFETT P, et al.High throughput virus induced gene silencing implicates heat shock protein 90 in plant disease resistance[J].EMBO J, 2003, 22(21):5690- 5699.
[36]FU DQ, ZHU BZ, ZHU HL, et al.Virus induced gene silencing in tomato fruit[J].Plant J, 2005, 43(2):299-308.
[37]LIU Y L, SCHIFF M, DINESH KUMAR S P.Virus induced gene silencing in tomato[J].Plant J, 2002, 31(6):777-786.
[38]EKENGREN SK, LIU Y L, SCHIFF M, et al.Two mapk cascades, NPR1, and TGA transcription factors play a role in pto mediated disease resistance in tomato[J].Plant J, 2003,36(6):905-917.
[39]CLOUGH SJ, BENT AF.Floral dip: a simplified method for Agrobacterium mediated transformation of arabidopsis thaliana[J].Plant J, 1998, 16(6):735-743.
[40]JIA Y F, MA Y K, GUO Y L, et al.Research on the transient express of gus gene by Agrobacterium tumefaciens in pinellia ternata breit[J].Acta Agric Boreali Sin, 2007(4):42- 45.
[41]YOSHIDA K, SHINMYO A.Transgene expression systems in plant, a naturalbioreactor[J].J Biosci Bioeng, 2000, 90(4):353-362.
[42]MCCORMICK A A, REDDY S, REINL S J,et al.Plant produced idiotype vaccines for the treatment of non hodgkin′s lymphoma: safety and immunogenicity in a phase I clinical study[J].Proc Natl Acad Sci USA,2008,105(29):10131-10136.
(责任编辑:柯文辉)

