14 种凉味剂的热解动力学分析研究
王紫燕,汤建国,毛娟芳,袁大林,郑绪东,雷萍,李志强,任达兵,易伦朝,韩敬美*
1 云南中烟工业有限责任公司技术中心,昆明市五华区红锦路367号 650231;2 昆明理工大学,昆明市呈贡区景明南路727号 650500
凉味剂是烟草行业的一类重要添加剂,其热释放特性对卷烟制品,特别是对加热卷烟制品吸食品质具有决定性的影响[1]。凉味剂的释放速率由其热力学特性(挥发性)和动力学特性(抽吸时主流烟气的传质阻力)两个因素决定。由于各种凉味剂挥发性和抗传质阻力不同,其在卷烟加热过程中的热解反应不同[2],明确其热稳定性对后续的应用研究至关重要。热解动力学是研究生物质热化学转化机理的重要方法[3],热解动力学参数会影响反应物的选择及反应过程的操作条件[4],因此,样品热解动力学分析有助于设计和控制样品热分解过程[5]。在热解动力学计算过程中,非模型法和模型法相结合可以弥补两种方法单独使用时的不足,得到样品的动力学三参数[6-7]。
目前,热解动力学已广泛应用于烟草材料[8]、添加剂[9]和卷烟纸[10]的热裂解行为研究,但鲜见对凉味剂的热解行为研究。本研究采用非等温热重法和两种动力学拟合方法(KAS 法和Coats-Redfern 法)对14 种凉味剂做了热解动力学分析,直观描述凉味剂热解过程,分析其热稳定性及反应频率,以期为凉味剂选择和配方设计提供参考。
1 材料与方法
1.1 材料与仪器
材料:椒样薄荷油、薄荷素油、DL-薄荷醇、N-(乙氧羰基甲基)-对烷-3-甲酰胺(WS-5,≥98.0%,上海西园生物技术有限公司);N-(4-甲氧基苯基)-对薄荷基-3-羧酰胺(WS-12,≥99.0%,上海麦克林生化科技有限公司);N-乙基-对薄荷基-3-甲酰胺(WS-3)、N, 2, 3-三甲基-2-异丙基丁酰胺(WS-23,≥99%,上海阿达玛斯试剂有限公司);乳酸薄荷酯(≥98.0%,上海西园生物技术有限公司);异薄荷酮、异胡薄荷醇[≥98.0%,阿法埃沙(中国)化学有限公司];L-薄荷酮(≥98.0%,上海源叶生物科技有限公司);乙酸薄荷酯(≥98.0%,上海鼎芬化学科技有限公司);琥珀酸单薄荷酯[≥98.0%,梯希爱(上海)化成工业发展有限公司];薄荷酮甘油缩酮(≥98.0%,上海泰坦科技股份有限公司);乙醇(色谱纯,默克股份有限公司)。
仪器:TG/DSC1 型热重/差热综合热分析仪(瑞士Mettler Toledo 公司)。
1.2 热重分析
采用非等温方法进行凉味剂的热解试验。在常压空气气氛中,热天平保护气为高纯氮气,每次称取17 mg 样品置于70 μL 的氧化铝坩埚底部,再将其置于热重分析仪天平托盘上,根据设定速率对样品进行加热。对不同升温速率的试验过程重复进行3 次。热重分析仪控制温度范围为30 ~500℃,加热速率为2.5、5、10、20 和30℃/min,空气流速为50 mL/min。
1.3 动力学拟合方法
1.3.1 Kissinger-Akahira-Sunose(KAS)拟合法
KAS 法是一种常用的基于热重分析计算动力学参数的非模型拟合法。根据热分解动力学理论,热分解过程可由下列动力学方程表示[11]:

式中:α—样品在t 时刻的转化率,%;A—指前因子,min-1;E—表观活化能,kJ/mol;R—气体常数,8.314 J/(mol·K);T—热分解过程中的温度,K;f(α)—热分解反应机理函数微分形式。
在程序升温过程中,热分解过程为线性升温,则对特定的升温速率(β)有:

将公式(2)代入到公式(1)可得非等温热分解过程的动力学方程[12]:

使用此方法至少需要3 条以上非等温热重曲线,以此获得样品最大失重温度(T)与加热速率(β)的对应关系。对试验所得到的数据进行处理,以1/T为横坐标,ln(β/T2)为纵坐标,获得两者的线性关系,可得斜率为-E/R,进而得到样品表观活化能(E),再根据截距ln(AR/E)可得指前因子(A)。
1.3.2 Coats-Redfern 拟合法
应用Coats-Redfern 法[13-15]有:

由于2RT/E<<1,则等式(5)可化简为:
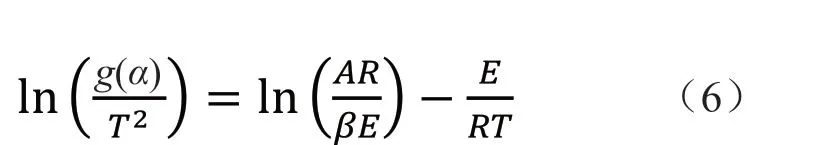

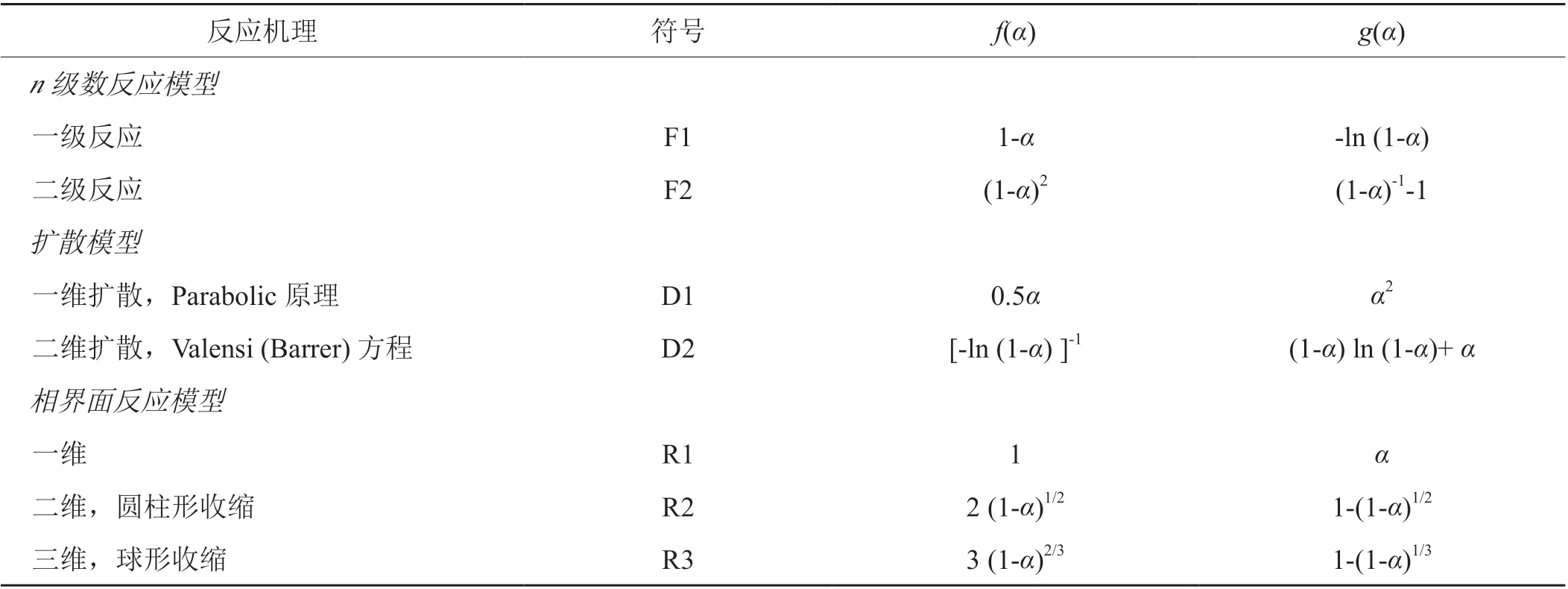
表1 常用的反应机理函数表达式[16-18]Tab. 1 Commonly used expression of reaction mechanism function
2 结果与讨论
2.1 热解特性分析
通过对14 种凉味剂不同升温速率下的热重曲线分析发现,所有凉味剂的TG 曲线图和DTG 曲线图相似。因此,本节以DL-薄荷醇为例进行说明。从图1DL-薄荷醇的TG 曲线(A)和DTG 曲线(B)可以看出:在约55℃以前,DL-薄荷醇质量变化很小,这可能是因为物质内部架构重排失水所致,随着热解温度的不断升高,DL-薄荷醇的热分解经过一个明显的失重阶段,当其热解完全后,DL-薄荷醇质量便不再发生变化。此外,随着升温速率的增加,TG 曲线向高温端靠近,同时,DTG 曲线上热失重速率的峰值温度呈上升趋势,但其变化的幅度小于升温速率的变化。这可能是因为升温速率越大,引起的温度差就越大,使得样品达到相同反应温度经历的时间越短,热滞后现象显著;另一方面,升温速率的增加,也加快了样品与氧气的反应速率,导致样品最大失重速率增加[19-20]。

图1 DL-薄荷醇在不同升温速率下的TG 曲线(A)与DTG 曲线(B)Fig. 1 TG curve (A) and DTG curve (B) of DL- menthol at different heating rates
图2 为DL-薄荷醇在10℃/min 升温速率下的热解特性曲线。在图中DTG 曲线上,过峰值点A 与TG 曲线作垂线交于点B,再过该点作TG 曲线的切线,该切线与初始失重平行线交与点C,点C 对应的温度为样品热解温度T1,随着热解的进行,样品失重速率达到最大(A 点),此时对应的温度为最大失重速率温度T2,当样品热解完全时,失重速率接近于0(D点),此时对应的温度为热解完全温度T3[21]。所有凉味剂的TG 曲线图与DTG 曲线图中的热解温度、最大失重速率温度和热解完全温度依照上述方法整理如表2所示。从表2中可以看出,随着升温速率的增大,三个温度点均呈不同程度的增加,但最大失重速率温度与失重速率为0 的温度点相差不大,这主要是由于升温速率的增加使得样品中易挥发成分快速析出,加快了与氧气的反应速率,导致样品最大失重速率增加,又因为样品成分较简单,在样品失重速率达到最大不久后便热解完全所致。在不同升温速率下,异薄荷酮开始热解温度最低,为32.63℃,WS-12 开始热解温度最高,为264.25℃;L-薄荷酮最大失重速率温度最低,为127.83℃,WS-12 最高为374.81℃;异薄荷酮热解完全的温度最低,为136.29℃,WS-12 最高,为396.38℃。
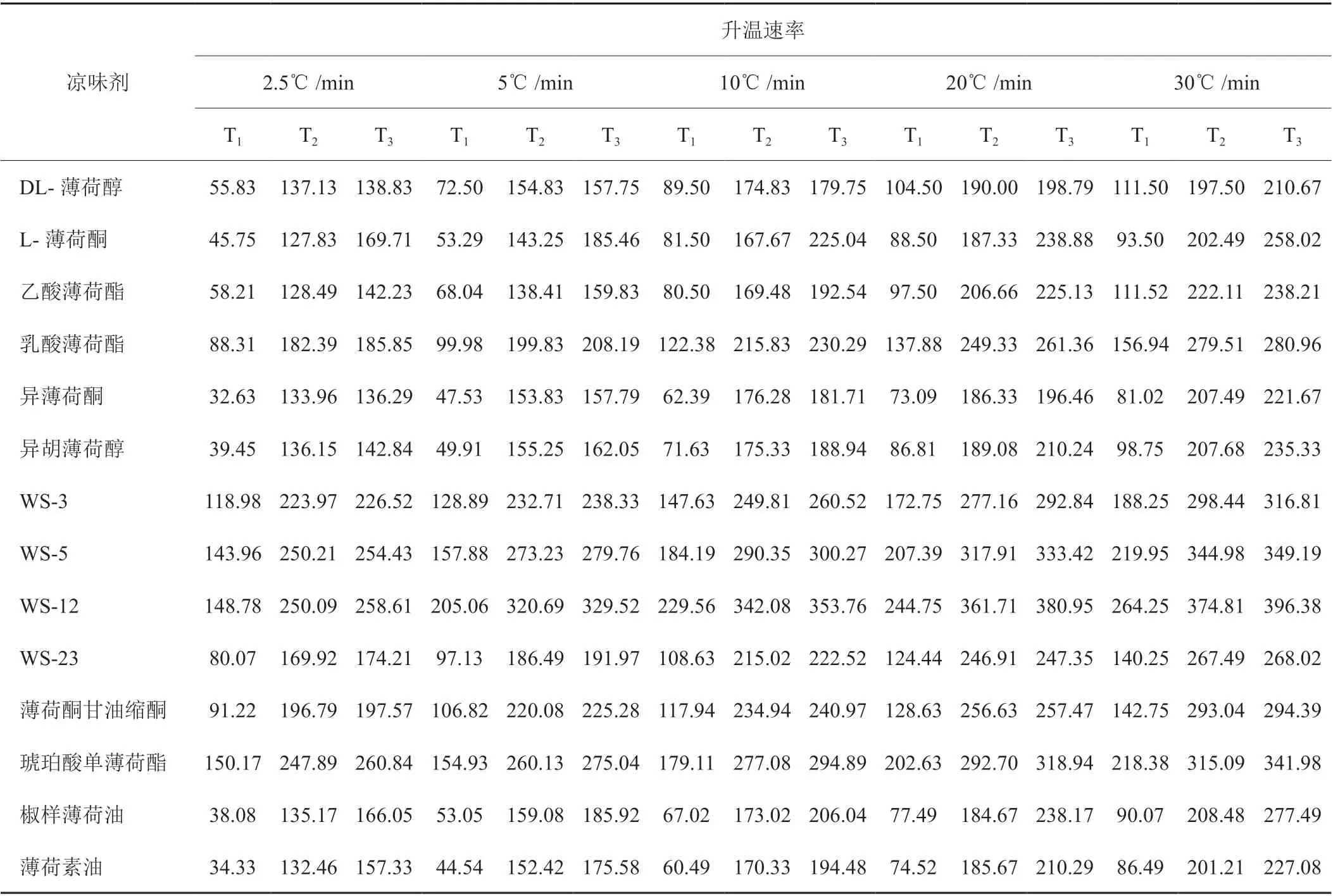
表2 14 种凉味剂在5 种升温速率下的热解温度(T1)、最大失重速率温度(T2)和热解完全温度(T3)Tab. 2 Pyrolysis temperature (T1), maximum weight loss rate temperature (T2) and pyrolysis complete temperature (T3) of 14 kinds of cooling agents at 5 heating rates

图2 DL-薄荷醇在10℃/min 升温速率下的燃烧特性曲线Fig. 2 Thermal decomposition characteristic curve of DL-menthol at a heating rate of 10℃/min
2.2 动力学分析
2.2.1 Kissinger-Akahira-Sunose(KAS)拟合法


由拟合曲线的斜率可得到各种凉味剂不同转化率α下的活化能E的分布结果如图4 所示。由图4 可知,在空气氛围下,凉味剂热解反应活化能E随转化率α的增加而增加,所有样品活化能在48.08 ~86.26 kJ/mol 之间。其中: WS-3、WS-5 和琥珀酸单薄荷酯活化能达73.47 kJ/mol 及以上,其余凉味剂活化能在48.08 ~64.74 kJ/mol 之间,具体结果如表3 所示。

表3 使用KAS 模型得到的凉味剂的活化能(E)和可决系数(r2)Tab. 3 The activation energy (E) and linear correlation coefficient (r2) of the cooling agents obtained by using the KAS model

图3 DL-薄荷醇以KAS 法的拟合结果Fig.3 Fitting results of DL-menthol by KAS method
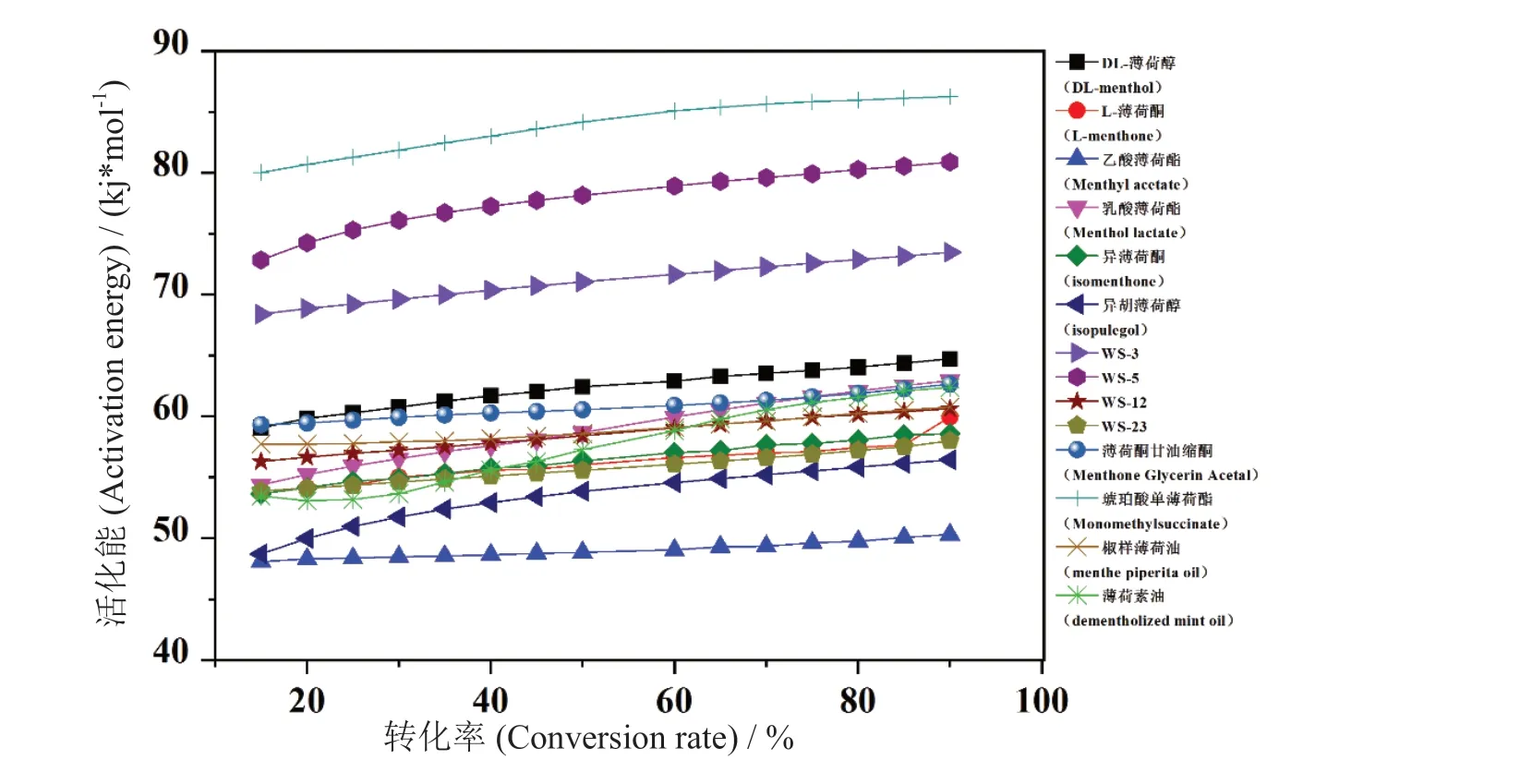
图4 14 种凉味剂热分析过程中活化能E 与转化率α 的关系Fig. 4 Relationship between activation energy E and conversion α during thermal analysis of 14 kinds of cooling agents
2.2.2 Coats-Redfern 拟合法
由上述的TG/DTG 分析可知,加热速率对样品的热解行为有显著影响。较高加热速率产生的热滞后将导致用于动力学模型的温度数据变高,由此得到的反应速率也较高[22]。因此,为了最小化热滞后效应,通过10℃/min 的升温速率下的热解数据来确定g(α)[23]。
为了得到合适的动力学反应模型来描述凉味剂的热分解过程,依据方程(6)拟合的最高可决系数来确定最合适的反应模型。由样品的转化率和反应机理函数g(α)得到14 种凉味剂不同阶段的不同反应模型函数的拟合曲线和可决系数,通过它们的拟合曲线和可决系数发现,所有凉味剂线性拟合曲线均与DL-薄荷醇(图5)相似,且可决系数大于等于0.9993。再依据14 种凉味剂DTG 曲线的主要失重峰选择样品温度范围,进一步根据Coats-Redfern 法计算得到各凉味剂的平均活化能和指前因子等参数(表4)。其中,异薄荷酮和薄荷素油含有两种反应模型,分别为一维扩散模型(D1)和一维相界面反应模型(R1),两种模型下的可决系数均为1.000,活化能分别为43.37与20.15 kJ/mol 和34.04 与15.51 kJ/mol。

图5 基于不同的反应模型函数g(α)采用Coats-Redfern拟合方法获得DL-薄荷醇的拟合曲线和可决系数(r2)Fig. 5 The fitting curves and correlation coefficients (r2) of DLmenthol obtained by Coats-Redfern fitting method based on different reaction model functions g(α)
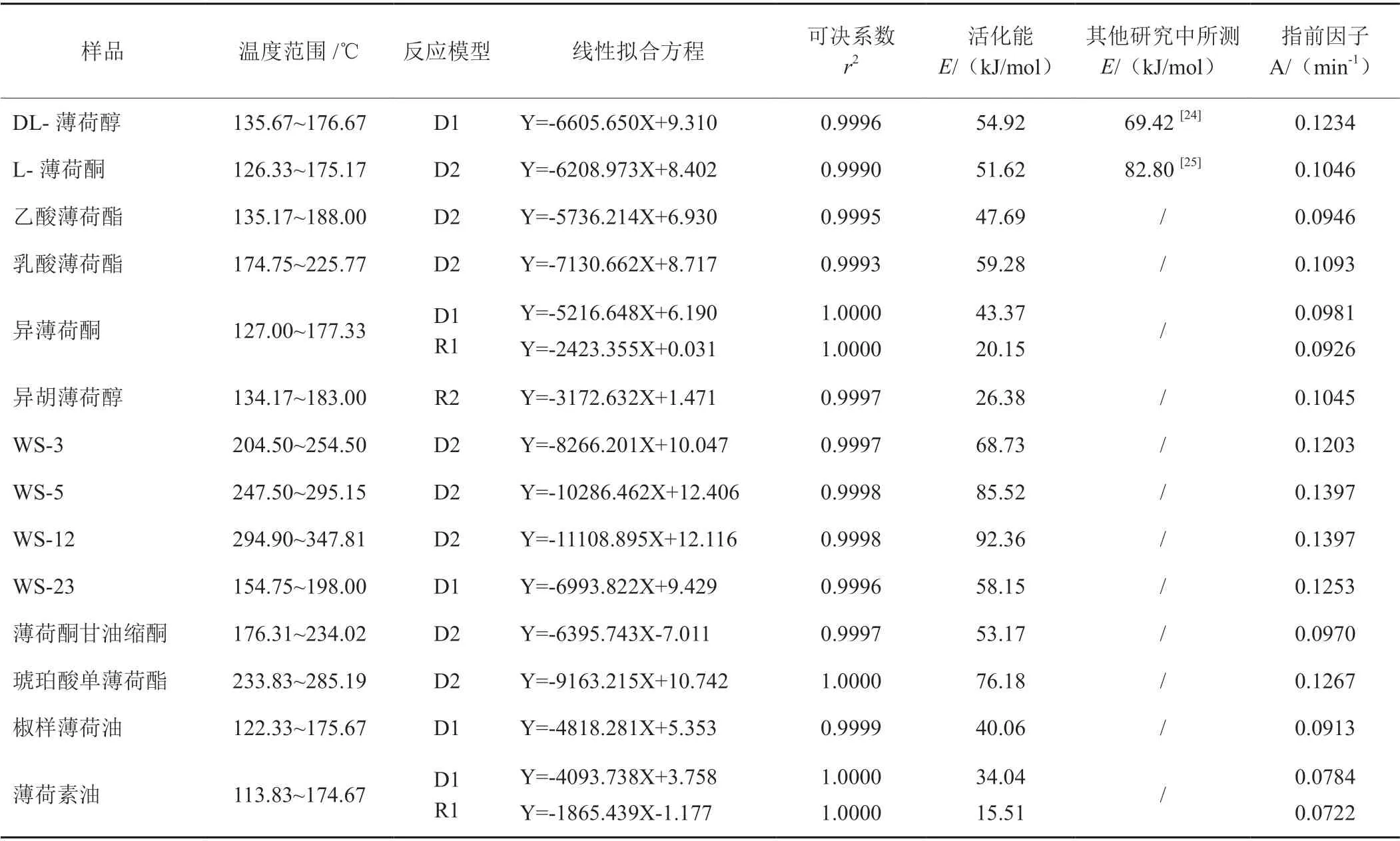
表4 采用Coats-Redfern 拟合方法获得的凉味剂热解过程动力学三参量Tab. 4 The kinetic parameters of the pyrolysis process of cooling agents obtained by Coats-Redfern fitting method

续表3
3 结论与讨论
文章通过非等温热重法和两种动力学拟合方法(KAS 法和Coats-Redfern 法)对14 种凉味剂热解动力学进行分析。结果表明:(1)随升温速率的增加,不同凉味剂的TG 曲线向高温端靠近,DTG 曲线上热失重速率峰值温度呈上升趋势,且其变化幅度小于升温速率变化幅度。(2)Kissinger-Akahira-Sunose(KAS)法得到凉味剂的热解活化能E 随转化率α的增大而增大,热解反应活化能E 范围在48.08 ~86.26 kJ/mol 之间。(3)异薄荷酮、薄荷素油、异胡薄荷醇、椒样薄荷油活化能在15.51 ~43.37 kJ/mol 之间,DL-薄荷醇、WS-23、L 薄荷酮、乙酸薄荷酯、乳酸薄荷酯、WS-3、薄荷酮甘油缩酮、琥珀酸单薄荷酯活化能在47.69 ~76.18 kJ/mol 之间,WS-5、WS-12 活化能在85.52 ~92.36 kJ/mol 之间。(4)所有凉味剂的反应模型主要为D1:g(α)=α2、D2:g(α)= (1-α)ln(1-α)+α、R1:g(α)=α、R2:g(α)=1-(1-α)1/2;指前因子在0.0722~0.1397 min-1之间。
目前,传统卷烟、加热卷烟及电子烟均不同程度的添加有凉味剂。但每种烟草制品加热机制及温度存在一定差异,传统卷烟燃烧温度通常为600 ~900℃,加热卷烟通过特殊热源能将烟草材料加热至300℃以上,电子烟通过电池提供的电能,将烟弹中含有的雾化剂、添加剂及烟碱液等在270℃以下雾化成蒸汽。通过凉味剂的热解动力学分析发现,WS-5、WS-12 和琥珀酸单薄荷酯活化能较大,反应速率较慢,失重温度区间较长,且其热解完全温度达285.19 ~347.81℃,大于电子烟液雾化成蒸汽的温度,无法使凉味剂得到充分利用,从节约成本而言,不适用于电子烟;薄荷素油、异薄荷酮和异胡薄荷醇活化能较小,反应速率较快,失重温度区间较短,使得加热温度还未达到卷烟燃烧温度凉味剂便会热解完全,无法达到降低卷烟刺激性、增强卷烟清新口感的目的,不适用于传统卷烟;WS-12 活化能较大,反应较困难,且热解温度较高,不适用于加热卷烟,若能通过其他方法降低其活化能或延长加热时间,可适当添加。其余凉味剂单从其热解特性而言,均可用于这三类卷烟。

